Биосенсор с металлическими наночастицами
Иллюстрации
Показать всеГруппа изобретений относится к области биотехнологии, в частности к области биосенсоров с металлическими наночастицами в качестве системы передачи сигнала. Биосенсор для визуального детектирования аналита включает распознающую молекулу, способную распознавать целевой аналит, иммобилизованную на теплочувствительной поверхности, и металлическую наночастицу, характеризующуюся полосой поверхностного плазмонного резонанса, функционализированную второй распознающей молекулой, способной распознавать целевой аналит или другие распознающие молекулы. При этом аналит визуально детектируют по изменению цвета в областях подложки, где присутствует аналит, возникающему под действием тепла, выделяемого металлическими наночастицами при облучении их внешним источником света с длиной волны в диапазоне от 380 нм до 1100 нм. Также раскрыты способы детектирования аналита и применение биосенсора для анализа различных объектов. Группа изобретений обеспечивает возможность анализа множества образцов в рамках одного анализа с пределом чувствительности порядка пикограммов. 7 н. и 10 з.п. ф-лы, 8 ил., 5 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к области биотехнологии, в частности, к области биосенсоров, в частности, к области биосенсоров с металлическими наночастицами в качестве системы передачи сигнала.
УРОВЕНЬ ТЕХНИКИ
В последние годы биосенсоры рассматривают как альтернативу обычным способам анализа в различных областях. Биосенсор представляет собой аналитическое устройство, состоящее из двух основных элементов: биорецептора (биодатчика: антитела, ДНК-зонда или клетки и т.д.), предназначенного для специфического детектирования некоторого вещества, с использованием преимущества специфичности биомолекулярных взаимодействий, и преобразователя или сенсора, способного интерпретировать реакцию биологического распознавания рецептором и "преобразовывать" ее в количественно измеримый оптический или электрический сигнал. Наиболее выдающимися свойствами данных устройств, которые делают их весьма привлекательными вариантами аналитических средств, являются их специфичность, высокая чувствительность, чувствительность, обеспечивающая меньшее время анализа, возможность включения их в интегрированные системы, простота автоматизации, возможность работы в реальном времени, гибкость в применении и низкая цена.
Прогресс в области биосенсоров основан на накопленном в течение многих лет опыте изучения способности к распознаванию и свойств различных биомолекул. В качестве распознающих элементов применяются многие биологические средства от самых простых, таких как ферменты или антитела, до более сложных продуктов генной инженерии. С другой стороны, недавние достижения в области микроэлектроники, нанотехнологии и уникальные свойства специфических материалов стали ключевыми для таких устройств.
Несмотря на это, современные способы сенсорного детектирования не всегда способны удовлетворить требованиям надежности и скорости. Время, необходимое для осуществления анализа, и чувствительность данной методики являются наиболее существенными ограничениями. Хотя разработка данных устройств была преимущественно сфокусирована на области клинической диагностики, интерес к ним в других областях применения, включая экологическую, агропродовольственную, химическую, фармацевтическую и военную области, на сегодняшний день все возрастает.
В настоящем изобретении предложен новый биосенсор, основанный на способности металлических наночастиц преобразовывать свет в тепло.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Первый аспект настоящего изобретения относится к биосенсору для визуального детектирования аналита, включающему:
a. Распознающую молекулу (осуществляющую захват биомолекулу), способную распознавать целевой аналит;
b. Подложку с теплочувствительной поверхностью, на которой указанная распознающая молекула из этапа a) иммобилизована или иммобилизуется;
c. Внешний источник света;
d. Вторую распознающую молекулу (детектирующую биомолекулу), способную распознавать целевой аналит; и
e. Металлическую наночастицу, характеризующуюся полосой поверхностного плазмонного резонанса;
при этом аналит визуально детектируют по изменению цвета в областях подложки, где присутствует аналит, которое происходит под действием тепла, выделяемого металлическими наночастицами при облучении их внешним источником света.
В предпочтительном варианте реализации первого аспекта настоящего изобретения биосенсор для визуального детектирования аналита включает:
a. Распознающую молекулу (осуществляющую захват биомолекулу), способную распознавать целевой аналит, иммобилизованную на подложке с теплочувствительной поверхностью;
b. Внешний источник света; и
с. Вторую распознающую молекулу (детектирующую биомолекулу), способную распознавать целевой аналит, связанную с поверхностью металлической наночастицы, характеризущейся полосой поверхностного плазмонного резонанса;
при этом аналит визуально детектируют по изменению цвета в областях подложки, где присутствует аналит, которое происходит под действием тепла, выделяемого металлическими наночастицами при облучении их внешним источником света.
Второй аспект настоящего изобретения относится к биосенсору для визуального детектирования аналита, включающему:
a. Распознающую молекулу (осуществляющую захват биомолекулу), способную распознавать целевой аналит;
b. Подложку с теплочувствительной поверхностью;
c. Внешний источник света;
d. Вторую распознающую молекулу (детектирующую биомолекулу), способную распознавать целевой аналит, возможно связанную с молекулой-меткой; и
e. Металлические наночастицы, характеризующиеся полосой поверхностного плазмонного резонанса, функционализированные биомолекулами, специфично распознающими детектирующую биомолекулу или молекулу-метку, которой модифицирована детектирующая биомолекула;
при этом аналит визуально детектируют по изменению цвета в областях подложки, где присутствует аналит, которое происходит под действием тепла, выделяемого металлическими наночастицами при облучении их внешним источником света.
Третий аспект настоящего изобретения относится к биосенсору для визуального детектирования аналита, определенному во втором аспекте настоящего изобретения, включающему:
a. Распознающую молекулу (осуществляющую захват биомолекулу), способную распознавать целевой аналит;
b. Подложку с теплочувствительной поверхностью;
c. Внешний источник света;
d. Вторую распознающую молекулу (детектирующую биомолекулу), способную распознавать целевой аналит, связанную с одной или несколькими молекулами биотина; и
e. Металлические наночастицы, характеризующиеся полосой поверхностного плазмонного резонанса, функционализированные молекулами стрептавидина, молекулами авидина или тому подобными молекулами, специфично распознающими молекулы биотина;
при этом аналит визуально детектируют по изменению цвета в областях подложки, где присутствует аналит, которое происходит под действием тепла, выделяемого металлическими наночастицами при облучении их внешним источником света.
Четвертый аспект настоящего изобретения относится к биосенсору для визуального детектирования аналита, определенному во втором аспекте настоящего изобретения, включающему:
a. Распознающую молекулу (осуществляющую захват биомолекулу), способную распознавать целевой аналит;
b. Подложку с теплочувствительной поверхностью;
c. Внешний источник света;
d. Вторую распознающую молекулу, при этом указанная молекула представляет собой антитело (детектирующее антитело), способную распознавать целевой аналит; и
e. Металлические наночастицы, характеризующиеся полосой поверхностного плазмонного резонанса, функционализированные антителами к Fc, которые связываются с детектирующим антителом;
при этом аналит визуально детектируют по изменению цвета в областях подложки, где присутствует аналит, которое происходит под действием тепла, выделяемого металлическими наночастицами при облучении их внешним источником света.
В частном варианте реализации любого из аспектов настоящего изобретения распознающие молекулы (осуществляющие захват и детектирующие биомолекулы) выбраны из перечня, состоящего из антител, пептидов, ферментов, полисахаридов, нуклеиновых кислот (ДНК, РНК), аптамеров или пептидо-нуклеиновых кислот (ПНК), предпочтительно из молекул ДНК и антител.
В другом варианте реализации любого из аспектов настоящего изобретения внешний источник света представляет собой лазер, при этом длина волны указанного лазера равна длине волны максимума полосы поверхностного плазмонного резонанса металлической наночастицы.
В другом варианте реализации любого из указанных двух аспектов настоящего изобретения металлическую наночастицу выбирают из перечня, состоящего из:
a. Наночастиц золота;
b. Наночастиц серебра; или
c. Наночастиц меди.
Указанная металлическая наночастица предпочтительно представляет собой треугольную золотую нанопризму.
В другом варианте реализации любого из указанных двух аспектов настоящего изобретения поверхность подложки содержит теплочувствительную бумагу, или целлюлозную мембрану, нитроцеллюлозную мембрану или ацетатцеллюлозную мембрану. Предпочтительно теплочувствительная бумага прикреплена ко второй подложке, выбранной из перечня, состоящего из подложек из стекла, кремния, керамики, полистирола, целлюлозной мембраны, нитроцеллюлозной мембраны или ацетатцеллюлозной мембраны.
Пятый аспект настоящего изобретения относится к применению биосенсора согласно первому аспекту настоящего изобретения для визуального детектирования аналита, которое включает:
а. Добавление образца, в котором присутствует детектируемый аналит, к подложке с иммобилизованной на ней распознающей аналит молекулой (осуществляющей захват биомолекулой);
b. Инкубацию подложки из этапа а) с металлическими наночастицами, функционализированными второй распознающей аналит молекулой (детектирующей биомолекулой); и
c. Возможно размещение подложки на теплочувствительной поверхности, если указанная подложка еще не содержит указанную поверхность; и
d. Облучение подложки из этапа b) или с) внешним источником света.
Шестой аспект настоящего изобретения относится к применению биосенсора для визуального детектирования аналита, описанного во втором аспекте настоящего изобретения, для детектирования аналита, которое включает:
a. Добавление образца, в котором присутствует детектируемый аналит, к подложке с иммобилизованной на ней распознающей аналит молекулой (осуществляющей захват биомолекулой);
b. Инкубацию подложки из этапа а) со второй распознающей аналит молекулой (детектирующей биомолекулой), возможно снабженной меткой;
c. Инкубацию подложки из этапа b) с металлическими наночастицами, функционализированными биомолекулой, специфично распознающей детектирующую биомолекулу или метку, которой модифицирована детектирующая биомолекула; и
d. Возможно, размещение подложки на теплочувствительной поверхности, если указанная подложка еще не содержит указанную поверхность; и
e. Облучение подложки из этапа с) или d) внешним источником света.
Предпочтительный вариант реализации шестого аспекта настоящего изобретения относится к применению биосенсора для детектирования аналита, которое включает:
a. Добавление образца, в котором присутствует детектируемый аналит, к подложке с иммобилизованной на ней распознающей аналит молекулой (осуществляющей захват биомолекулой);
b. Инкубацию подложки из этапа а) со второй распознающей аналит молекулой (детектирующей биомолекулой), меченой по меньшей мере одной молекулой биотина;
c. Инкубацию подложки из этапа b) с металлическими наночастицами, функционализированными стрептавидином; и
d. Возможно размещение подложки на теплочувствительной поверхности, если указанная подложка еще не содержит указанную поверхность; и
e. Облучение подложки из этапа с) или d) внешним источником света.
Другой предпочтительный вариант реализации шестого аспекта настоящего изобретения относится к применению биосенсора для детектирования аналита, которое включает:
a. Добавление образца, в котором присутствует детектируемый аналит, к подложке с иммобилизованной на ней распознающей аналит молекулой (осуществляющей захват биомолекулой);
b. Инкубацию подложки из этапа а) со второй распознающей молекулой (детектирующей биомолекулой), которая представляет собой антитело;
c. Инкубацию подложки из этапа b) с металлическими наночастицами, функционализированными антителом к Fc; и
d. Возможно, размещение подложки на теплочувствительной поверхности, если указанная подложка еще не содержит указанную поверхность; и
e. Облучение подложки из этапа с) или d) внешним источником света.
Седьмой аспект настоящего изобретения относится к применению биосенсора, описанного в первом аспекте настоящего изобретения, для детектирования аналита, которое включает:
a. Добавление к образцу, в котором присутствует детектируемый аналит, металлических наночастиц, функционализированных второй распознающей аналит молекулой (детектирующей биомолекулой);
b. Выделение аналита, связанного с наночастицами, из образца из этапа а), предпочтительно посредством процесса центрифугирования;
c. Добавление экстракта из этапа b к подложке с иммобилизованной на ней распознающей аналит молекулой (осуществляющей захват биомолекулой);
d. Возможно размещение подложки на теплочувствительной поверхности, если указанная подложка еще не содержит указанную поверхность; и
e. Облучение подложки из этапа с) или d) внешним источником света.
Восьмой аспект настоящего изобретения относится к применению биосенсора согласно любому из предшествующих аспектов или вариантов реализации для детектирования примесей, лекарственных средств, патогенных микроорганизмов, пищевых компонентов, пестицидов, токсичных соединений или в анализе биохимического потребления кислорода.
КРАТКОЕ ОПИСАНИЕ ФИГУР
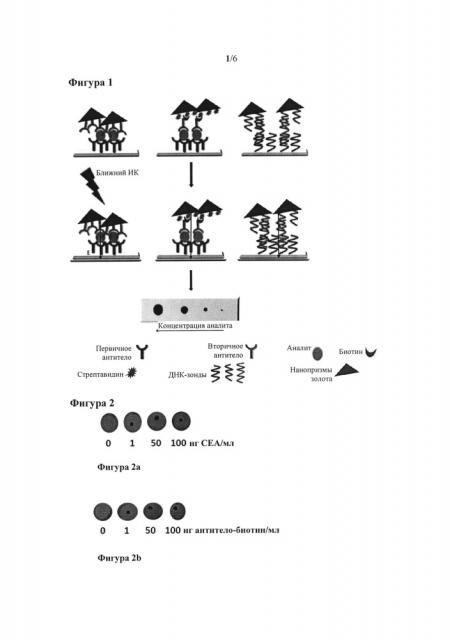
На фигуре 1 показана схема системы распознавания согласно настоящему изобретению.
Фигура 2: на фигуре 2а показано распознавание РЭА+антитело к РЭА 3С6-нанопризмы. На фигуре 2b показано распознавание антитело к РЭА 3С6-биотин+стрептавидин-нанопризмы.
Фигура 3: на фигуре 3а показано распознавание антитело к РЭА 3С1+РЭА+антитело к РЭА 3С6-нанопризмы. На фигуре 3b показано распознавание антитело к РЭА 3С1+РЭА+антитело к РЭА 3С6-биотин+стрептавидин-нанопризмы.
На фигуре 4 показано распознавание антитело к РЭА 3С1+РЭА+антитело к РЭА 3С6-наночастицы золота.
На фигуре 5 показано распознавание антитело к РЭА 3С1+РЭА+антитело к РЭА 3С6-нанопризмы золота с различными длительностями облучения и различными расстояниями между поверхностью и лазером. На фигуре 5а показано облучение в течение времени, равного 10 секундам, при большем расстоянии. На фигуре 5b показано облучение в течение времени, равного 2 секундам, при меньшем расстоянии.
На фигуре 6 показано распознавание антитело к РЭА 3С1+РЭА+антитело к РЭА 3С6-нанопризмы (в буфере ФБР и в образцах плазмы крови).
На фигуре 7 показано распознавание антитело к РЭА 3С1+РЭА+антитело к РЭА 3С6-нанопризмы золота в образцах плазмы крови и детектирование посредством инфракрасной камеры.
На фигуре 8 показаны схемы трех конструкций биосенсора, описанного в примере 5.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к биосенсору, включающему (i) распознающую молекулу (осуществляющую захват биомолекулу), способную распознавать целевой аналит; (ii) подложку с теплочувствительной поверхностью; (iii) внешний источник света; (iv) вторую распознающую молекулу (детектирующую биомолекулу), способную распознавать целевой аналит, и (v) металлическую наночастицу, характеризующуюся полосой поверхностного плазмонного резонанса, при этом указанный аналит визуально детектируют по изменению цвета в областях подложки, где присутствует аналит, которое происходит под действием тепла, выделяемого металлическими наночастицами при облучении их внешним источником света.
В биосенсоре согласно настоящему изобретению используется способность металлических наночастиц преобразовывать свет в тепло в качестве системы передачи сигнала. Основанием для применения данной системы в качестве отличительного признака в биосенсорах служит наличие полосы поглощения поверхностного плазмонного резонанса. Данные полосы поглощения возникают, когда частота света, воздействующего на наночастицу, находится в резонансе с частотой коллективных колебаний электронов в полосе проводимости частицы, что вызывает возбуждение. Данное явление известно как "локализованный поверхностный плазмонный резонанс" (ЛППР). Положение в спектре резонансной полосы сильно зависит от формы, размера и структуры частиц (полые или твердые), а также от диэлектрической среды, в которой находится частица. При ЛППР наблюдают высокие молярные коэффициенты экстинкции (~3×1011 М-1 см-1) с эффективностью, эквивалентной 106 молекулам флуорофора, и значительным усилением локального электрического поля вблизи наночастицы.
Металлические наночастицы, такие как наночастицы золота, серебра или меди, обладают эффектом поверхностного плазмонного резонанса. При облучении внешним источником света высокой интенсивности с подходящей частотой, таким как лазер, данные частицы способны высвобождать часть поглощенной энергии в виде тепла, вызывая локальное повышение температуры вблизи их поверхностей.
Такое контролируемое выделение тепла лежит в основе новой разработанной системы детекции. Выделенное тепло вызывает различимое изменение на теплочувствительной поверхности, выбранной подходящим образом. В этом смысле авторы настоящего изобретения обнаружили, что, неожиданно, предел детектирования составляет порядка пикограмм для экспериментов, проводимых с применением изменения цвета в областях подложки, где присутствует аналит, обеспечиваемого металлическими наночастицами при облучении их внешнем источником света в качестве средства детектирования. Соответственно, в примере 4 настоящего изобретения проиллюстрировано, как был получен предел детектирования с применением визуального детектирования согласно настоящему изобретению, причем указанный предел был меньшего порядка и, следовательно, обеспечивал большую чувствительность, по сравнению с таковыми, полученными в экспериментах, осуществленных с применением в качестве средства детектирования инфракрасной камеры. Этот неожиданный результат привел к разработке биосенсора, обладающего следующими свойствами: (i) высокой чувствительностью, (ii) высокой селективностью или специфичностью, благодаря чему указанный биосенсор взаимодействует исключительно с целевым аналитом, но не с другими аналитами, обладающими сходными свойствами; (iii) высокой надежностью, что исклбчает проблемы с шумом в системе передачи, связанных с исследуемым образцом; (iv) низкой стоимостью получения; (v) коротким временем проведения анализа, что позволяет при необходимости быстро провести анализ; (vi) необязательностью предварительной обработкой образца, что позволяет при необходимости сэкономить время, материалы и реагенты; (vii) простотой обращения, благодаря чему для применения биосенсора не требуется квалифицированный персонал; (viii) возможностью осуществления анализов в реальном времени, и (ix) портативностью, что обеспечивает возможность осуществления анализа in situ.
Соответственно, первый аспект настоящего изобретения относится к биосенсору для визуального детектирования аналита, включающему:
a. Распознающую молекулу (осуществляющую захват биомолекулу), способную распознавать целевой аналит;
b. Подложку с теплочувствительной поверхностью, на которой иммобилизована распознающая молекула (осуществляющая захват биомолекула) из этапа а);
c. Внешний источник света;
d. Вторую распознающую молекулу (детектирующую биомолекулу), способную распознавать целевой аналит; и
e. Металлическую наночастицу, характеризующуюся полосой поверхностного плазмонного резонанса;
при этом аналит визуально детектируют по изменению цвета в областях подложки, где присутствует аналит, которое происходит под действием тепла, выделяемого металлическими наночастицами при облучении их внешним источником света.
Следует подчеркнуть тот факт, что в контексте настоящего изобретения под визуальным детектированием понимают любое детектирование, которое можно осуществить невооруженным глазом без необходимости применения любого типа устройства для детектирования, такого как инфракрасная камера.
Соответственно, в предпочтительном варианте реализации первого аспекта настоящего изобретения биосенсор для визуального детектирования аналита включает:
a. Распознающую молекулу (осуществляющую захват биомолекулу), способную распознавать целевой аналит;
b. Подложку с теплочувствительной поверхностью, на которой иммобилизована распознающая молекула (осуществляющая захват биомолекула) из этапа а);
c. Внешний источник света;
d. Вторую распознающую молекулу (детектирующую биомолекулу), способную распознавать целевой аналит; и
e. Металлическую наночастицу, характеризующуюся полосой поверхностного плазмонного резонанса;
при этом биосенсор не включает никаких типов устройств, способных обнаружить преобразование света в тепло металлическими наночастицами, облученными внешним источником света.
В другом предпочтительном варианте реализации первого аспекта настоящего изобретения биосенсор включает:
a. Распознающую молекулу (осуществляющую захват биомолекулу), способную распознавать целевой аналит, иммобилизованную на подложке с теплочувствительной поверхностью;
b. Внешний источник света; и
c. Вторую распознающую молекулу (детектирующую биомолекулу), способную распознавать целевой аналит, связанную с поверхностью металлической наночастицы, характеризующейся полосой поверхностного плазмонного резонанса;
при этом аналит визуально детектируют по изменению цвета в областях подложки, где присутствует аналит, которое происходит под действием тепла, выделяемого металлическими наночастицами при облучении их внешним источником света.
В контексте настоящего изобретения под внешним источником света понимают любой источник электромагнитного излучения с длиной волны в диапазоне от 380 нм до 1100 нм, способный вызывать возбуждение полосы ЛППР металлических частиц на основе золота, серебра, меди или любого из их сплавов или состояний окисления, предпочтительно в ближнем инфракрасном диапазоне (между 750 и 1100 нм), так как поглощения энергии примесными биомолекулами, присутствующими в образце, которые поглощают в видимом диапазоне спектра (гемоглобин и т.д.), не происходит в данном диапазоне энергий. Указанный внешний источник света может представлять собой источник монохроматического или полихроматического света, предпочтительно источник монохроматического света.
В контексте настоящего изобретения под металлической наночастицей, характеризующейся полосой поверхностного плазмонного резонанса, понимают любой моно- или поликристаллический кластер частиц металлов в любом из состояний окисления, или любой из их сплавов, все геометрические размеры которого находятся в диапазоне от 1 до 1000 нм, предпочтительно между 1 и 200 нм. В предпочтительном варианте реализации настоящего изобретения указанные частицы металлов представляют собой атомы благородных металлов. В более предпочтительном варианте реализации настоящего изобретения указанные частицы металлов представляют собой атомы золота, серебра или меди. В еще более предпочтительном варианте реализации настоящего изобретения они представляют собой цилиндрические или треугольные частицы золота или серебра.
В контексте настоящего изобретения под распознающей молекулой или осуществляющей захват биомолекулой понимают любую молекулу, способную специфично распознавать конкретный аналит за счет любого типа химического или биологического взаимодействия.
В контексте настоящего изобретения под второй распознающей молекулой или детектирующей биомолекулой понимают любую молекулу, способную специфично распознавать конкретный аналит с помощью любого типа химического или биологического взаимодействия.
Молекулы, применяемые в качестве элементов распознавания в биосенсорах согласно настоящему изобретению, должны обладать достаточной селективной аффинностью распознавания конкретного аналита в присутствии других соединений, а также должны быть стабильны во времени и должны сохранять свою структуру, а также биологическую активность после иммобилизации на подложке и на поверхности наночастиц.
Антитела, пептиды, ферменты, белки, полисахариды, нуклеиновые кислоты (ДНК), аптамеры или пептидо-нуклеиновые кислоты (ПНК) можно применять в качестве распознающих молекул в разработанной системе.
В большинстве случаев наиболее широко применяемые биорецепторы представляют собой нуклеиновые кислоты, антитела или фрагменты антител, при этом антитела или фрагменты антител позволили разработать наибольшее количество методик, полезных для диагностики. Основанием для этого является способность иммунной системы вырабатывать практически неограниченное количество антител с различными селективностями и высокой аффинностью к соответствующему антигену. На сегодняшний день могут быть получены моноклональные антитела или фрагменты антител практически из любой молекулы, независимо от ее размера. С другой стороны, одним из преимуществ антител является гомогенность структуры данных белков, которая не зависит от их специфичности. Это позволяет стандартизировать способы, связанные с их применением в качестве иммунохимических реагентов, такие как их сохранение или иммобилизация на поверхности преобразователя. Фрагменты антител (Fab или одноцепочечный фрагмент Fv), сохраняющие структуру и способность распознавать антиген, а также рекомбинантные антитела, такие как моноклональные антитела или миниантитела второго поколения, можно получить в качестве распознающих молекул, применяя методики молекулярной биологии.
С другой стороны, аптамеры представляют собой молекулы, которыми в некоторых приложениях можно заменять антитела благодаря их малому размеру и низкой иммуногенности. Аптамеры представляют собой одноцепочечные нуклеиновые кислоты, обладающие вполне определенными трехмерными формами, позволяющими им связываться с целевой молекулой способом, аналогичным антителам. В аптамерах соединены оптимальные свойства малых молекул (низкая иммуногенность, высокая проникающая способность и т.д.) и антител (высокая специфичность и аффинность и химическая стабильность). Другое преимущество по сравнению с моноклональными антителами состоит в том, что их синтезируют химическим путем, а не экспрессируют биологическим путем.
С помощью нуклеиновых кислот можно обнаружить вариации в отдельном основании в комплементарной последовательности ДНК. Их можно применять в процессах секвенирования генов, анализе экспрессии генов и для детектирования мутаций и изменений в ДНК, связанных с определенными заболеваниями, поскольку можно синтетическим путем сконструировать последовательности нуклеотидов, соответствующие структуре ранее детектированных генов. На сегодняшний день вместо них все чаще применяют нити ПНК, так как последние обладают большей биологической стабильностью (по отношению к разрушению различными ферментами) и химической стабильностью (более устойчивы к изменениям рН или ионной силы). Более того, поскольку, в отличие от ДНК, они не содержат ни единиц 2'-дезокси-D-рибозы, ни фосфодиэфирных связей, ПНК обладают нейтральной структурой, которая вызывает меньшее электростатическое отталкивание в процессе гибридизации, образует более прочные связи; а также обладает низким неспецифическим поглощением.
Распознающий элемент (осуществляющая захват биомолекула) указанного сенсора, как правило, будет иммобилизован на подложке с теплочувствительной поверхностью путем физического удерживания внутри матрицы (захвата), физической адсорбции на матрице посредством ионных или гидрофобных взаимодействий, или путем связывания ковалентной связью.
В этом смысле, в контексте настоящего изобретения под подложкой с теплочувствительной поверхностью понимают любую поверхность, способную претерпевать структурное изменение при нагреве, в результате чего появляется изображение. В предпочтительном варианте в качестве теплочувствительной поверхности будут применять термобумагу, которая благодаря своей теплочувствительности обеспечивает генерацию сигнала после воздействия повышенной температуры. Термобумагой считают любую бумагу, содержащую термочувствительный слой, в состав которого входит краситель, сенсибилизатор и проявитель цвета (независимо от химических компонентов, из которых они получены), способные взаимодействовать друг с другом, что приводит к появлению изображения после воздействия на термочувствительный слой подвергнут воздействию повышенной температуры. В другом предпочтительном варианте реализации в качестве теплочувствительной поверхности будут применять любой высокотехнологичный полимер, который, после воздействия внешнего стимула, такого как изменение температуры, отреагирует изменением своих свойств, таким как: сворачивание, изгиб, изменение цвета, изменение состояния, люминесценция и т.д. Типы термочувствительных полимеров включают: PNIPAM, поли-N-изопропилакриламид, поли-N-винилпиперидин или поли-N-винилкапролактам.
В одном варианте реализации настоящего изобретения подложка с теплочувствительной поверхностью указанной системы включает по меньшей мере одну теплочувствительную подложку, на которой происходит молекулярное распознавание, такую как мембрана, выполненная из целлюлозы или ее производных (нитрата целлюлозы, ацетата целлюлозы и т.д.), или теплочувствительная бумага.
В другом варианте реализации настоящего изобретения подложка с теплочувствительной поверхностью указанной системы содержит две подложки. На первой подложке будет иммобилизована осуществляющая захват биомолекула, и при этом указанная подложка представляет собой мембрану, полученную из целлюлозы или ее производных (нитрата целлюлозы, ацетата целлюлозы и т.д.) или из других материалов, таких как полистирол, керамика, кремний или стекло. Вторая подложка, состоящая из теплочувствительной поверхности, которая обеспечивает генерацию сигнала после воздействия повышенной температуры, будет прикреплена к указанной первой подложке.
Второй аспект настоящего изобретения относится к биосенсору для визуального детектирования аналита, включающему:
a. Распознающую молекулу (осуществляющую захват биомолекулу), способную распознавать целевой аналит;
b. Подложку с теплочувствительной поверхностью;
c. Внешний источник света;
d. Вторую распознающую молекулу (детектирующую биомолекулу), способную распознавать целевой аналит, возможно связанную с молекулой-меткой; и
e. Металлические наночастицы, характеризующиеся полосой поверхностного плазмонного резонанса, функционализированные биомолекулами, специфично распознающими детектирующую биомолекулу или метку, которой модифицирована детектирующая биомолекула;
при этом аналит визуально детектируют по изменению цвета в областях подложки, где присутствует аналит, под действием тепла, выделяемого металлическими наночастицами, при облучении их внешним источником света. Снова стоит отметить, что под визуальным детектированием понимают любое детектирование, которое можно осуществить невооруженным глазом без необходимости применения устройства какого-либо для детектирования, такого как инфракрасная камера. Соответственно, биосенсор согласно второму аспекту настоящего изобретения не включает устройство любого типа, способное обнаружить преобразование света в тепло металлическими наночастицами, облученными внешним источником света.
В контексте настоящего изобретения под молекулами-метками понимают такие молекулы, которые распознаются за счет аффинности во взаимодействиях типа лиганд-белок или по молекулярному узнаванию при гибридизации нитей нуклеиновых кислот. В первом случае очевидно, что детектирующая биомолекула модифицирована антигеном, гормоном, витамином полигистидиновой меткой или доменами лектина, среди прочего. Соответственно, очевидно, наночастицы (НЧ) функционализованы антителами, аптамерами, рецепторами, связывающими белками, трикарбоновыми кислотами, модифицированными двухвалентными ионами металлов, или сахарами, способными специфично взаимодействовать с соответствующей меткой детектирующей биомолекулы. Во втором случае очевидно, что как детектирующая биомолекула, так и НЧ золота функционализованы комплементарными встречающимися в природе нитями нуклеиновых кислот (дезоксирибонуклеиновой кислоты или ДНК, рибонуклеиновой кислоты или РНК), или комплементарными искусственными нитями нуклеиновых кислот (пептидо-нуклеиновой кислоты или ПНК, морфолинов и т.д.), или комплементарными комбинациями нитей (ДНК-ДНК, ПНК-ДНК, ДНК-ПНК, ПНК-ПНК и т.д.).
Третий аспект настоящего изобретения относится к биосенсору для визуального детектирования, описанного во втором аспекте настоящего изобретения, включающему:
a. Распознающую молекулу (осуществляющую захват биомолекулу), способную распознавать целевой аналит;
b. Подложку с теплочувствительной поверхностью;
c. Внешний источник света;
d. Вторую распознающую молекулу (детектирующую биомолекулу), способную распознавать целевой аналит, связанную с одной или несколькими молекулами биотина; и
e. Металлические наночастицы, характеризующиеся полосой поверхностного плазмонного резонанса, функционализированные молекулами стрептавидина, молекулами авидина или тому подобными молекулами, специфично распознающими молекулы биотина;
при этом аналит визуально детектируют по изменению цвета в областях подложки, где присутствует аналит, которое происходит под действием тепла, выделяемого металлическими наночастицами при облучении их внешним источником света.
Четвертый аспект настоящего изобретения относится к биосенсору для визуального детектирования, описанного во втором аспекте настоящего изобретения, включающему:
a. Распознающую молекулу (осуществляющую захват биомолекулу), способную распознавать целевой аналит;
b. Подложку с теплочувствительной поверхностью;
c. Внешний источник света;
d. Вторую распознающую молекулу (детектирующее антитело), способную распознавать целевой аналит; и
e. Металлические наночастицы, характеризующиеся полосой поверхностного плазмонного резонанса, функционализированные антителами к Fc или к IgG, которые связываются с детектирующим антителом;
при этом аналит визуально детектируют по изменению цвета в областях подложки, где присутствует аналит, которое происходит под действием тепла, выделяемого металлическими наночастицами при облучении их внешним источником света.
Предложенное устройство представляет собой систему распознавания типа "сэндвич" между "распознающей" молекулой, осуществляющей захват биомолекулой (которая представляет собой либо белок, такой как антитело, либо ДНК-зонд, либо ПНК-зонд и т.д.), иммобилизованной на подложке, на которой происходит распознавание аналита, и второй детектирующей молекулой, детектирующей биомолекулой (вторым антителом или комплементарным ДНК-зондом), связанной с поверхностью металлической наночастицы, либо непосредственно, либо опосредованно с помощью считывающего (reader) белка и/или метки. Функционализация подложек и наночастиц соответствующими распознающими молекулами позволяет детектировать множество аналитов, следуя одной и той же стратегии.
Кроме того, второй, третий и четвертый аспекты настоящего изобретения, в частности, относятся к универсальной системе детектирования. В действительности, в третьем аспекте настоящего изобретения показано, как с помощью меченых биотином детектирующих биомолекул и функционализации металлических наночастиц стрептавидином можно применять одни и те же наночастицы, конъюгированные с данным белком, для распознавания различных аналитов на основе взаимодействия авидин-биотин, что позволяет избежать необходимости получения отдельного конъюгата наночастица-детектирующая биомолекула для каждого конкретного аналита. Другим примером будет четвертый аспект настоящего изобретения, в котором в системе детектирования, основанной на функционализации металлических наночастиц антителом к Fc, способным распознавать Fc-область любого другого антитела, можно применять одни и те же наночастицы для распознавания различных аналитов, при условии, что детектирующая биомолекула в данной системе представляет собой антитело.
Соответственно, устройство согласно настоящему изобретению обеспечивает возможность анализа множества образцов в рамках одного анализа с пр