Способ диагностики смешанных хронических рецидивирующих инфекций глаза методом пцр
Иллюстрации
Показать всеИзобретение относится к биохимии. Описан способ ПЦР диагностики смешанных хронических рецидивирующих инфекций глаз. Суть заявляемого способа состоит в одновременном скрининге инфекций глаз вирусной и бактериальной этиологии в нескольких биологических образцах. Конкретно в слезе или соскобе с конъюнктивы и в слюне, крови, моче. Заявляемый способ позволяет оптимизировать лечение смешанных хронических рецидивирующих инфекций переднего сегмента глаза, в частности кератитов и кератоувеитов, что повышает эффективность лечения смешанных хронических рецидивирующих инфекций глаз. 1 з.п. ф-лы, 5 табл., 1 пр.
Реферат
Изобретение относится к ПЦР (полимеразно-цепная реакция) диагностике смешанных хронических рецидивирующих инфекций глаз. Сущность заявляемого способа состоит в одновременном скрининге инфекций глаз вирусной и бактериальной этиологии в нескольких биологических образцах, а именно в слезе или соскобе с конъюнктивы и в слюне, крови, моче. Заявляемый способ позволяет оптимизировать лечение смешанных хронических рецидивирующих инфекций переднего сегмента глаза, в частности, кератитов и кератоувеитов, что повышает эффективность лечения смешанных хронических рецидивирующих инфекций глаз.
В середине прошлого века началось активное изучение свойств вируса простого герпеса (ВПГ), открыты другие представители семейства Herpesviridae - вирус варицелла-зостер (ВВЗ), цитомегаловирус (ЦМВ), вирус Эпштейна-Барр (ВЭБ) [1, 2, 3]. Последние десятилетия характеризуются значимыми достижениями в области клиники, диагностики и терапии герпетических инфекций глаз. Изучены свойства уже известных герпес вирусов и открыты новые: герпес вирусы человека 6, 7 и 8 типов (ГВЧ-6, ГВЧ-7, ГВЧ-8). [4].
Доминирующей формой поражения глаз при офтальмогерпесе является герпетический кератит (ГК) [1, 3]. Развиваются новые лабораторные технологии - полимеразная цепная реакция (ПЦР) и ее вариант ПЦР в реальном времени (РТ-ПЦР) для количественного определения вирусов [5-7]. Применение ПЦР при ГК началось сравнительно недавно, тем не менее, эта методика представляется перспективной [8-11].
Из RU 2234097 известно определение наличия ДНК ВПЧ-8 при заболевании глаз.
Из RU 2481581 известно определение 5-ти инфекций ВПЧ 1, 2, 6, 7 и ВЭБ в донорской роговице.
В уровне техники не выявлено сведений относительно роли хронических инфекций, вызываемых хламидиями, микоплазмами и уреаплазмами в развитии и течении герпетического кератита. Однако как показали наши исследования, указанные бактериальные инфекции являются фактором, провоцирующим хронические заболевания глаз смешанной этиологии.
Из RU 2621863 известен набор для определения ДНК Chlamydia trachomatis в моче.
Из RU 2271003 известно определение ДНК Chlamydia trachomatis, Mycoplasma hominis, Ureaplasma urealyticum при обследовании детей на наличие урогенитальных инфекций в образце, представляющем смесь мочи, слюны, крови и слезного отделяемого.
Из WO 2008146306 известно определение ДНК Chlamydia trachomatis, Mycoplasma, Ureaplasma и ЦМВ, ВПЧ 1 и 2 при кератите. Данный способ выбран в качестве ближайшего аналога. В известном способе определяют ДНК видов Mycoplasma и Ureaplasma, отличных от hominis и urealyticum, соответственно. Кроме того, не определяют ДНК ВПЧ 6, ВПЧ 7, ВВЗ и ВЭБ, а также определение проводят только в одном образце.
Техническим результатом заявленного изобретения является оптимизация лечения хронических инфекций переднего сегмента глаза. Повышение эффективности лечения хронических инфекций переднего сегмента глаза, в частности, кератитов и кератоувеитов.
Данный технический результат является очень важным, поскольку бессистемное и необоснованное назначение препаратов не только не облегчает состояние пациента, но и ухудшает средне и долгосрочную перспективу течения хронических заболеваний глаз, приводя к развитию антибиотико-устойчивых форм бактериальной составляющей смешанной инфекции, а также дальнейшему снижению местного и общего иммунного ответа организма пациента. Проблема адекватного назначения лекарственных средств при хронических смешанных инфекциях стоит очень остро. В уровне техники не обнаружено способов быстрого, точного определения состава инфекционных агентов, участвующих в развитии инфекционных хронических заболеваний глаз смешанной этиологии. Проведенное нами исследование выявило наиболее часто встречающихся инфекционных агентов, участвующих в развитии инфекционных хронических заболеваний глаз смешанной этиологии за счет выявления клинических особенностей течения ГК на современном этапе, совершенствования клинико-диагностических алгоритмов. Что позволяет разрабатывать оптимальные схемы терапии ГК.
Примеры
Под наблюдением находилось 83 пациента (33 мужчины и 50 женщин в возрасте 10-82 лет) с диагнозом «герпетический кератит (кератоувеит)» в разных стадиях течения процесса (в активной стадии и в стадии ремиссии), а также 25 здоровых добровольцев без клинических признаков воспалительной патологии глаз и жалоб. Исследование проводилось на клинических базах филиала №1 ГКБ им СП. Боткина Департамента Здравоохранения г. Москвы (Офтальмологический центр), ФГАУ МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова и офтальмологического отделения ООО «Герпетический центр» за период с 2013 по 2017 гг.
Критериями включения в исследование являлись: жалобы и симптомы, типичные для герпетического кератита (кератоувеита), обусловленного вирусом ВПГ; в ремиссии - помутнения роговицы в совокупности с характерными анамнестическими данными. Критериями исключения были возраст пациентов (младше 10-ти лет) и клинические проявления Herpes Zoster Ophthalmicus (HZO) с поражением одноименного дерматома.
Всем пациентам проводилось стандартное офтальмологическое обследование, включающее определение максимально корригированной остроты зрения (МКОЗ), пневмотонометрию, биомикроскопию с использованием витальных красителей, офтальмоскопию при относительной прозрачности оптических сред. Лабораторная диагностика включала исследование биологических жидкостей (слезы или соскоба с конъюнктивы, а также исследование слюны, крови и мочи) методом одномоментного скриннинга 10 инфекционных патогенов с применением методик РеалТайм-ПЦР (РТ-ПЦР) и качественной ПЦР. С помощью методики РТ-ПЦР в биологических образцах определяли количество ДНК пяти герпес-вирусов (ВПГ 1 и 2 типа, ЦМВ, ВЭБ, ГВЧ-6); методом ПЦР (с флуоресцентной детекцией результатов по конечной точке (формат "Flash") в качественной модификации) проводился поиск ДНК ВВЗ и ДНК ГВЧ-7 типа. Детекция ДНК Chlamydia trachomatis, Mycoplasma hominis, Ureaplasma urealyticum проводилась только в двух образцах (слезе и моче) методом ПЦР с флуоресцентной детекцией результатов по конечной точке (формат "Flash") в качественной модификации (комплекты реагентов предоставлены ООО «ДНК-технология», Россия). Все лабораторные исследования проводили в лаборатории ООО «Герпетический центр» г. Москвы.
Системная противовирусная терапия включала назначение селективных аналогов нуклеозидов (АН) в суточных дозах от 1 до 3 г в зависимости от стадии кератита и результатов лабораторного исследования. Местная противовирусная терапия включала: ганцикловир в виде глазного геля 0,15% («Зирган», производитель - Сантен) 3-5 раз в день в комбинации с препаратом Офтальмоферон®, капли глазные (в 1 мл содержится не менее 10000 ME рекомбинантного интерферона альфа-2b), от 4 до 10 раз в день, кратность инсталляций в день зависела от стадии кератита. Местная терапия при активных жалобах также включала инсталляции нестероидных противовоспалительных препаратов.
Статистическая обработка результатов проводилась при помощи пакета SPSS Statistics 23. Анализ корреляций проводили с использованием критерия τ-Кендалла, для сравнения средних величин применяли непараметрический критерий знаковых рангов Вилкоксона для связанных выборок, для проверки последовательностей на случайность использовали одновыборочные критерии - χ-квадрат и биномиальный. Результаты считались статистически достоверными при p ≤0,05.
Результаты и обсуждение. Средний срок наличия жалоб к моменту обращения составил 104±33 дня. Все пациенты к моменту обращения получали местную терапию препаратов разных фармакологических групп в нерациональных комбинациях.
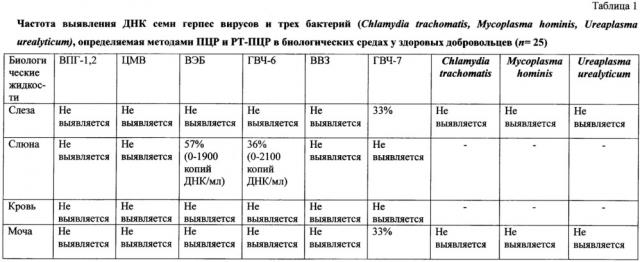
Практика поиска фрагментов ДНК герпес вирусов методом ПЦР общепринята при диагностике инфекционных заболеваний, поскольку этот факт свидетельствует об активной продукции вирусов в организме [0]. При наличии активных жалоб ДНК герпес вирусов в разных биологических жидкостях определялась в 100% наблюдений, из них у 47% пациентов выявлена моноинфекция и у 53% - микст-инфекция. В 45% наблюдений ДНК герпес вирусов выявлялась в нескольких средах одновременно (например, в слезе и моче), в 55% - только в одной среде (к примеру, только в крови). Результаты всех лабораторных исследований проанализированы ниже.
*при уровне значимости ≤0,05 (для критериев χ-квадрат и биномиального)
* при уровне значимости ≤0,05 (для критериев %-квадрат и биномиального)
*при уровне значимости ≤0,05 (для критериев χ-квадрат и биномиального)
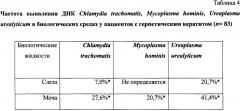
При сравнении частот выявления ДНК трех герпес вирусов (ВПГ 1 и 2; ВВЗ, ЦМВ) и ДНК трех бактерий (Chlamydia trachomatis, Mycoplasma hominis, Ureaplasma urealyticum) стало понятно, что их выявление в любом биологическом секрете вне зависимости от их количества при наличии клинической картины воспаления роговицы свидетельствует о значимой роли этих инфекционных патогенов в развитии кератита, поскольку настоящим исследованием показано, что у здоровых добровольцев эти патогены не выявляются ни в одной из биологических жидкостей (см. Таблицы 1-4). Выявление ДНК ВЭБ, ГВЧ-6 и ГВЧ-7 не может однозначно подтвердить диагноз инфекционного кератита смешанной этиологии, поскольку данные вирусы с аналогичной частотой определяются и у здоровых.
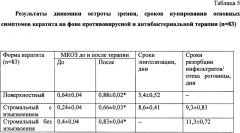
При сочетании манифестной клинической картины кератита и выявлении ДНК ВПГ 1 и 2; ВВЗ, ЦМВ и/или Chlamydia trachomatis, Mycoplasma hominis, Ureaplasma urealyticum назначалась системная противовирусная терапия в виде аналогов нуклеозидов в повышенных дозах (сроком, не менее 1 месяца в сочетании с местным противовирусным лечением), а также системная антибактериальная терапия (антибиотики с активностью в отношении хламидий, микоплазм, уреаплазм). Результаты динамики остроты зрения, сроков эпителизации и сроков резорбции воспалительных инфильтратов приведены в Таблице 5.
*разница достоверна при уровне значимости <0,05
Как видно из выше представленного, отсутствие ДНК в одном образце может являться ложноотрицательным результатом, т.е. способ определения только по одному образцу является недостоверным и может привести к назначению неправильного лечения.
Метод одномоментного скриннинга 10 инфекционных агентов в слезе, слюне, крови и моче с помощью методов ПЦР и РТ-ПЦР при инфекционном кератите смешанной этиологии (в том числе и герпетическом), может быть использован в клинической практике для подтверждения природы воспаления роговицы, определения дозировки, длительности и эффективности применения местной и системной противовирусной терапии.
Одновременное определение в нескольких биологических образцах Chlamydia trachomatis, Mycoplasma hominis, Ureaplasma urealyticum и ВПЧ 1 и 2, ВПЧ 6, ВПЧ 7, ВВЗ, ЦМВ, ВЭБ является наиболее оптимальным и целесообразным для назначения адекватного лечения смешанных хронических рецидивирующих инфекций глаз.
С уверенностью можно сказать, что заявляемый способ не только является новым, но обладает изобретательским уровнем, так как из известного уровня техники специалист не мог бы предположить, что одновременное определение именно 10 указанных выше инфекционных агентов в 4 образцах является наиболее целесообразным при необходимости лечения смешанных хронических рецидивирующих инфекций глаз.
Литература
1. Майчук Ю.Ф. Вирусные заболевания глаз. М.: Медицина; 1981.
2. Неизвестная эпидемия: Герпес. Под ред. Хахалина Л.Н. Смоленск: «Фармаграфикс»;с 997: 62-74.
3. Каспаров А.А. Офтальмогерпес. М.: Медицина; 1994.
4. Krug LT, Тео CG, Tanaka-Taya К, Inoue N. Newly Identified Human Herpesviruses: HHV-6, HHV-7, and HHV-8. In: Fong IW, eds. New and Evolving Infections of the 21st Century, New York, NY: Springer; 2007:195-276.
5. Долгов B.B., Ракова Н.Г., Колупаев B.E. Иммуноферментный анализ в клинико-диагностических лабораториях. М.-Тверь: Триада; 2007.
6. ПЦР "в реальном времени". Под ред. Д.В. Ребрикова. М.: БИНОМ. Лаборатория знаний; 2009.
7. Караджас Н.В. Современные аспекты герпесвирусной инфекции. Эпидемиология, клиника, диагностика, лечение и профилактика. М.: Спецкнига; 2012.
8. Чернакова Г.М., Клещева Е.А., Семенова Т.Б. Герпесвирусы в офтальмологии. Вестник офтальмологии. 2014; 130(4): 127-131.
9. Al-Dujaili LJ, Clerkin РР, Clement С, McFerrin НЕ, Bhattacharjee PS, Varnell ED, Kaufman HE, Hill JM. Ocular herpes simplex virus: how are latency, reactivation, recurrent disease and therapy interrelated? Future microbiology. 2011; 6(8):877-907. doi: 10.2217/FMB.11.73.
10. Миронкова E.A., Демкин B.B., Слепова O.C., Садохина Т.С., Макаров П.В., Кугушева А.Э. Диагностика и роль ВГЧ-6 инфекции при кератопластике высокого риска. Российский офтальмологический журнал. 2012; 5(3): 30-34. 11. Fukuda M., Deai T., Hibino T., Higaki S., Hayashi K., Shimomura Y. Quantitative analysis of herpes simplex virus genome in tears from patients with herpetic keratitis. Cornea; 2003; 22(7 Suppl) : S55-60.
12. Каспарова Ел.А., Каспаров А.А., Марченко H.P., Пур-Акбариан Нияз А., Макарова M.А., Бородина H.В., Смиренная Е.В. Диагностика и лечение герпетической рецидивирующей эрозии роговицы. Вестник офтальмологии. 2010; 126(5) : 3-8.
13. Майчук Ю.Ф. Офтальмоферон. Опыт расширения области применения при глазных болезнях. М.; 2012.
1. Способ диагностики смешанных хронических рецидивирующих инфекций глаза методом ПЦР, отличающийся тем, что проводят одновременное определение в четырех биологических образцах 10 инфекционных агентов Chlamydia trachomatis, Mycoplasma hominis, Ureaplasma urealyticum и ВПЧ 1 и 2, ВПЧ 6, ВПЧ 7, ВВЗ, ЦМВ, ВЭБ, при этом для определения ВПЧ 1 и 2 типа, ЦМВ, ВЭБ и ВПЧ 6 и 7 применяют РТ-ПЦР, остальные инфекционные агенты определяют с помощью ПЦР с флуоресцентной детекцией результатов по конечной точке, определение Chlamydia trachomatis, Mycoplasma hominis, Ureaplasma urealyticum проводят только в двух образцах: слюне и моче.
2. Способ по п. 1, где четыре биологических образца представляют собой: слезу или соскоб с конъюнктивы, а также мочу, кровь и слюну.