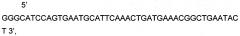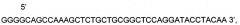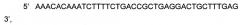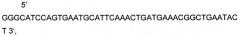Средство для лечения состояний человеческого организма, связанных с уменьшением уровня экспрессии гена р4на1 и/или уменьшением количества белка пролил 4- гидрокислазы альфа 1 на основе генно-терапевтических субстанций с геном р4на1, способ получения и использования
Иллюстрации
Показать всеИзобретение относится к молекулярной биологии, биотехнологии, генной инженерии и медицине и представляет собой средство для лечения состояний человеческого организма, связанных с уменьшением экспрессии гена Р4НА1 и/или уменьшением количества белка пролил 4-гидроксилазы альфа 1, на основе генно-терапевтических субстанций с геном Р4НА1, представляющее собой, по крайней мере, одну генно-терапевтическую субстанцию, выбранную из группы генно-терапевтических субстанций, каждая из которых представляет генетическую конструкцию на основе векторной плазмиды, включающей кДНК гена Р4НА1, с кодирующей последовательностью белка пролил 4-гидроксилазы альфа 1, с делециями 5'- и 3'-нетранслируемых областей, а именно полученной на основе участка немодифицированной кДНК гена Р4НА1 SEQ ID No: 1, или модифицированной кДНК гена Р4НА1, при этом в качестве модифицированной кДНК гена Р4НА1 используют SEQ ID No: 2, или SEQ ID No: 3, или SEQ ID No: 4, или SEQ ID No: 5, или SEQ ID No: 6, или SEQ ID No: 7, или сочетание этих генетических конструкций, каждая из которых содержит также регуляторные элементы, обеспечивающие высокий уровень экспрессии гена Р4НА1 в эукариотических клетках. Изобретение позволяет эффективно увеличить количество белка пролил 4-гидроксилазы альфа 1 в эукариотических клетках и получить высокоэффективное средство для лечения состояний человеческого организма, связанных с уменьшением уровня экспрессии гена Р4НА1 и/или уменьшением количества белка пролил 4-гидроксилазы альфа 1. 3 н. и 4 з.п. ф-лы, 20 ил., 18 пр.
Реферат
Область, к которой относится изобретение
Изобретение относится к молекулярной биологии, биотехнологии, генной инженерии и медицине и может быть использовано для коррекции патологических состояний клеток различных органов и тканей, а также собственно органов и тканей человека, связанных с уменьшением уровня экспрессии гена Р4НА1 и/или уменьшением количества белка пролил 4-гидроксилазы альфа 1, в частности, в терапевтических целях.
Предшествующий уровень.
Гликопротеин коллаген является самым распространенным белком не только во внеклеточном матриксе, но и во всем организме человека. Он составляет одну треть от всех белков тела и 70% всех белков кожи. Коллаген является основой соединительной ткани, структурной основой кожи, хрящей, синовиальной жидкости суставов, бронхов, легочной ткани, сосудистой стенки, межпозвонковых дисков, стенок кишечника и желудка. В коллагене одна треть аминокислотных остатков приходится на глицин и еще одна треть на пролин и гидроксипролин. Гидроксипролин, представленный в коллагене весьма большим числом остатков, стабилизирует тройную спираль коллагена по отношению к действию протеаз. В связи с чем, коллаген обеспечивает структурную поддержку ткани, придает ей твердость и стойкость.
Коллаген синтезируется в фибробластах в виде высокомолекулярного предшественника - проколлагена. Полипептидные цепи коллагенов синтезируются на мембраносвязанных рибосомах и поступают в просвет эндоплазматического ретикулума в форме предшественников большего размера (про-альфа-цепи), имеющих дополнительные аминокислотные остатки (пропептиды) на N- и С-концах, а также короткий N-концевой сигнальный пептид, необходимый для поступления образующегося полипептида внутрь эндоплазматического ретикулума. Далее некоторые остатки пролина и лизина гидроксилируются. Гидроксильные группы данных аминокислот, образуют межспиральные водородные связи, что необходимо для правильного трехмерного складывания вновь синтезированных цепочек проколлагена.
Образование гидроксипролила и гидроксилизила катализируют железосодержащие ферменты - пролилгидроксилаза и лизилгидроксилаза, находящиеся в микросомальной фракции многих тканей (кожи, печени, легких, сердца, скелетной мышцы, гранулирующих раневых поверхностей). Эти ферменты являются пептидилгидроксилазами, поскольку гидроксилирование происходит только после включения пролина или лизина в полипептидную цепь.
Пролил-4-гидроксилаза - фермент класса оксидоредуктаз, который катализирует гидроксилирование в положении 4 конкретных остатков пролина в зарождающихся цепях проколлагена. Фермент требует активности Fe2+, аскорбата и α-кетоглутарата для активности, и реакция необходима для термической стабильности тройной спиральной структуры коллагена. Фермент представляет собой тетрамер, содержащий 2α- и 2β-цепи; β-цепь в мономерной форме представляет собой фермент дисульфидизомеразу белков. При этом α-субъединица содержит каталитические и пептид-субстратные связывающие домены, но неактивна в отсутствие β-субъединицы. Фермент является оксигеназой со смешанной функцией и функционирует при участии молекулярного кислорода.
Экспрессия in vitro активной рекомбинантной пролил-4-гидроксилазы из ее субъединиц была успешно получена путем коинфекции клеток насекомых Spodoptera frugiperda и Trichoplusia ni (Vuori, K., et al. (1992) Proc Natl Acad Sci USA 89, 7467-7470) с рекомбинантными бакуловирусами или котрансфекцией с экспрессирующими векторами в клеточных линиях млекопитающих COS-1 (John, DC и Bulleid, NJ (1996) Biochem J 317 (Pt 3), 659-665) и HEK293 (Wagner, K., et al. (2000) Biochem J352 Pt 3, 907-911), в дрожжах Pichia pastoris (Vuorela, A., et al. (1997) Embo J16, 6702-6712) и Saccharomyces cerevisiae (Toman, P.D. и др. (2000) J Biol Chem 275, 23303-23309).
Системами экспрессии для получения рекомбинантных коллагенов являются также клетки Е. coli, трансгенные животные и растения. Однако почти все вышеназванные системы экспрессии имеют свои недостатки. Например, система экспрессии Е. coli не имеет посттрансляционной модификации, а система экспрессии дрожжей не обладает пролил-4-гидроксилазной активностью, хотя выход коллагенов в Pichia pastoris является самым высоким среди этих экспрессионных систем. Система экспрессии клеточной линии млекопитающих имеет низкий выход и пределы для конкретных типов тканей, а система экспрессии клеток насекомых имеет низкую активность пролил-4-гидроксилазы. Что касается трансгенных животных (шелковый червь или мыши) или растений (табак), в них продукты коллагена были чрезмерно «сшиты». Кроме того, трудно восстановить или очистить рекомбинантные коллагены из-за клеточного лизиса. Поэтому создание эффективной системы экспрессии для получения коллагенов с высоким выходом очень актуально.
Известен ген Р4НА1 пролил 4-гидроксилазы альфа-полипептида I Homo sapiens, кодирующий каталитическую α (I) субъединицу основного изофермента С-Р4Н (С-Р4Н-I) (https://cgwb.nci.nih.gov/cgi-bin/hgGene?hgg_gene=uc001jth.3&hgg_prot=Q5VSQ6&hgg_chrom=chr10&hgg_start=74766979&hgg_end=74856732&hgg_type=knownGene&db=hg19&hgsid=1030298). Ген P4HA1 находится в положении 10q22.1 хромосомы, имеет длину более 69 кБ, и состоит из 16 экзонов. Белок гена Р4НА1 катализирует образование 4-гидроксипролина, который необходим для правильного трехмерного складывания вновь синтезированных цепочек проколлагена.
Были исследованы мутации человеческого биаллельного гена Р4НА1 в семье с врожденным расстройством соединительной ткани, которое проявлялось как ранняя суставная гипермобильность, суставные контрактуры, мышечная слабость и дисплазия кости, также и высокая миопия, с подтверждением клинического улучшения двигательной функции с течением времени у выжившего пациента. Как и у нулевых мышей P4ha1, которые умирают пренатально, мышечная ткань из поколений Р1 и Р2 обнаружила пониженную иммунореактивность коллагена IV на мембране базального мышц. Пациенты были гетерозиготными по мутантному гену, что приводило к уменьшению, но не отсутствию уровня белка Р4НА1 и активности пролил-4-гидроксилазы С-Р4Н в дермальных фибробластах по сравнению с контрольными образцами. Дифференциальная сканирующая калориметрия показала уменьшенную термическую стабильность коллагена в дермальных фибробластах, полученных из пациентов, по сравнению с контрольными образцами. Мутации, влияющие на семейство белков C-P4Hs и, в частности, C-P4H-I, следует учитывать у пациентов с врожденными нарушениями соединительной ткани / миопатии с совместной гипермобильностью, контрактурами, легкой скелетной дисплазией и высокой миопией (Yaqun Zou, Sandra Donkervoort et al. Молекулярная генетика человека, том 26, выпуск 12, 15 июня 2017 г., страницы 2207-2217, https://doi.org/10.1093/hmg/ddx110).
В заявке WO 2014170460 (А2) описан метод получения коллагена из морских губок (Chondrosia reniformis) в дрожжах Pichia pastoris. В частности, было создано три векторные конструкции:
- с кДНК, кодирующей альфа-субъединицу пролил-4-гидроксилазы (pPinkHC \ <хо pPinkLC \ а векторы),
- с кДНК, кодирующей бета-субъединицу пролил-4-гидроксилаза (pPIC6B \ PDI-вектор),
- с кДНК, кодирующей нефибриллярный коллагеновый белок С. Reniformis (pPICZB \ ColCH).
В заявке описан способ, который предусматривает совместную трансформацию дрожжевого штамма с двумя различными векторами, содержащими: первый - кодирующую последовательность для альфа-субъединицы, второй - кодирующую последовательность бета-субъединицы фермента пролил-4-гидроксилазы, с последующей трансформацией с помощью вектора, содержащего одну кодирующую последовательность коллагенового белка морской губки.
Недостатком данного подхода является то, что для экспрессии генов субъединиц пролил-4-гидроксилазы морской губки выбрана система экспрессии дрожжевых клеток, которая согласно литературным данным не обладает значимой пролил-4-гидроксилазной активностью. В данной патентной заявке не рассматривается возможность экспрессии в клетках человека в качестве генно-терапевтического средства с учетом индивидуальных характеристик пациента, в связи с которыми может понадобиться группа вариаций для данного средства.
За прототип авторами было принято решение по патенту US 7759090 (В2), в котором описана экспрессионная система для получения коллагена. В частности, показаны стабильно трансфицированные клеточные линии насекомых, содержащие кДНК, кодирующие α и β-субъединицы пролил-4-гидроксилазы человека в клетках Trichoplusia ni и Drosophila melanogaster S2. Дополнительно охарактеризовано участие пролил-4-гидроксилазы в сборке трех альфа-цепей с образованием миниколлагена XXI тримерного типа, который содержит интактный С-терминальный неколлагеновый домен (NC1) и коллагеновый домен (COL1) в системе Drosophila. Миниколлаген XXI, коэкспрессированный пролил-4-гидроксилазой, содержал достаточное количество гидроксипролина для образования термостойких устойчивых к пепсину тройных спиралей.
Один из вариантов осуществления изобретения описывает рекомбинантную клетку насекомого, включающую трансфицированный ген, кодирующий пролил-4-гидроксилазу. Этот ген включает α-субъединицу и/или β-субъединицу пролил-4-гидроксилазы. Рекомбинантная клетка насекомого дополнительно включает трансфицированный ген, кодирующий коллагеновый (COL1) домен и С1-терминальный домен (NC1) коллагена типа XXI.
Гены кодирующие α-субъединицу и β-субъединицу пролил-4-гидроксилазы человека были клонированы совместно в векторе экспрессии pIZ / V5-His под контролем промотора OplE2, полученного из вируса полипептида многояде (в системе InsectSelect), а в системе Drosophila inducible expression (DES®) (Invitrogen) гены кодирующие α-субъединицу и β-субъединицу пролил-4-гидроксилазы были клонированы раздельно в векторе экспрессии рМТ / V5-HisA под контролем промотора металлотионеина, который индуцируется добавлением ионов меди или кадмия.
Показано, что Р4Нα- и Р4Нβ-субъединицы способны собираться в активный тетрамер α2β2. Полученная пролил-4-гидроксилаза обеспечивает синтез коллагена с устойчивыми тройными спиралями. Общая активность пролил-4-гидроксилазы в стабильно трансфицированных клетках Trichoplusia ni Р4Н увеличивалась только в 2 раза по сравнению с эндогенным ферментом в контроле без трансфекции клеток, а в системе Drosophila S2, была в 3-4 раза выше, чем в системе Trichoplusia ni. Это объясняется более высокой копийностью рекомбинантных плазмидных векторов, которые были использованы для трансфекции генома клеток Drosophila S2. Сравнение уровней экспрессии Р4Нα и Р4Нβ в лизатах клеток Trichoplusia ni показало, что уровень экспрессии белка Р4Нα примерно в 5 раз меньше, чем Р4Нβ. Для экспрессии Р4Н в индуцибельной Drosophila системе экспрессии клетки Drosophila S2 были совместно трансфицированы рМТ / Р4Нα, рМТ / Р4Нβ и pCoHygro в соотношении 10:10:1 с использованием реагента для трансфекции Effectene (Qiagen). Домены коллагена были введены в клетки путем трансформации вектором рМТ / BiP-mC21. Таким образом, рекомбинантный коллаген получен с использованием системы экспрессии трех генов в клетках Drosophila melanogaster.
Недостатком данного подхода является то, что для экспрессии генов субъединиц пролил-4-гидроксилазы человека выбрана система экспрессии клеток насекомых, которая согласно литературным данным имеет низкую активность пролил-4-гидроксилазы. Также не рассматривается возможность экспрессии в клетках человека в качестве генно-терапевтического средства с учетом индивидуальных характеристик пациента, в связи с которыми может понадобиться группа вариаций для данного средства.
Раскрытие изобретения
Задачей данного изобретения является создание высокоэффективного средства для лечения состояний человеческого организма, связанных с уменьшением уровня экспрессии гена Р4НА1 и/или уменьшением количества белка пролил 4-гидроксилазы альфа 1, на основе генно-терапевтических субстанций с геном Р4НА1, представляющих собой группу генно-терапевтических субстанций, при использовании которых с учетом индивидуальных особенностей пациента, происходит повышение уровня экспрессии гена Р4НА1 и/или повышение количества белка пролил 4-гидроксилазы альфа 1, в клетках органов и тканей и/или органах и тканях организма
Указанная задача решается за счет того, что создано средство для лечения состояний человеческого организма, связанных с уменьшением экспрессии гена Р4НА1 и/или уменьшением количества белка пролил 4-гидроксилазы альфа 1, на основе генно-терапевтических субстанций с геном Р4НА1, представляющее собой, по крайней мере, одну генно-терапевтическую субстанцию, выбранную из группы генно-терапевтических субстанций, каждая из которых представляет генетическую конструкцию на основе векторной плазмиды, включающей кДНК гена Р4НА1, с кодирующей последовательностью белка пролил 4-гидроксилазы альфа 1, с делециями 5'- и 3'-нетранслируемых областей, а именно, полученной на основе участка немодифицированной кДНК гена Р4НА1 SEQ ID No: 1, или модифицированной кДНК гена Р4НА1, при этом в качестве модифицированной кДНК гена Р4НА1 используют SEQ ID No: 2, или SEQ ID No: 3, или SEQ ID No: 4, или SEQ ID No: 5, или SEQ ID No: 6, или SEQ ID No: 7, или сочетание этих генетических конструкций, каждая из которых содержит также регуляторные элементы, обеспечивающие высокий уровень экспрессии гена Р4НА1 в эукариотических клетках, в частности в клетках органов и тканей человека, и способную увеличить количество белка пролил 4-гидроксилазы альфа 1, в клетках органов и тканей и/или органах и тканях человека, в частности в гемопоэтических клетках, или мезенхимальных стволовых клетках, или хондробластах, или миоцитах, или миобластах, или фибробластах, или остеобластах, или кератоцитах, или эпителиальных клетках, или клетках роговицы, или эндотелиальных клетках, или эпителиальных клетках, в сочетании с транспортной молекулой или без нее при трансфекции этими генно-терапевтическими субстанциями клеток органов и тканей человека и/или в органах и тканях человека в частности, в соединительно-тканных структурах, или коже, или суставах, или хрящевой ткани, или костной ткани, или мышечной ткани, или сухожилиях, или связках, или кровеносных сосудах, или стенке артерий, или роговице глаза, или склере, или плаценте, или дентине, или строме внутренних органов в сочетании с транспортной молекулой или без нее при введении этих генно-терапевтических субстанций в органы и ткани человека. При этом генетическая конструкция с модифицированной кДНК гена Р4НА1 содержит последовательность нуклеотидов, включающую в себя белок-кодирующую область кДНК гена Р4НА1, которая несет модификации, не затрагивающие структуру белка пролил 4-гидроксилазы альфа 1, а именно: нуклеотидные замены, не приводящие к аминокислотным заменам или обрыву аминокислотной цепи. Или генетическая конструкция с модифицированной кДНК гена Р4НА1 содержит последовательность нуклеотидов, включающую в себя белок-кодирующую область кДНК гена Р4НА1, которая несет модификации, затрагивающие структуру белка пролил 4-гидроксилазы альфа 1, а именно: нуклеотидные замены, приводящие к аминокислотным заменам или обрыву аминокислотной цепи. Или генетическая конструкция с модифицированной кДНК гена Р4НА1 содержит последовательность нуклеотидов, включающую в себя белок-кодирующую область кДНК гена Р4НА1, которая несет модификации, не затрагивающие структуру белка пролил 4-гидроксилазы альфа 1, а именно: нуклеотидные замены, не приводящие к аминокислотным заменам или обрыву аминокислотной цепи, в комбинации с модификациями, затрагивающими структуру белка пролил 4-гидроксилазы альфа 1, а именно: нуклеотидные замены, приводящие к аминокислотным заменам или обрыву аминокислотной цепи. В качестве транспортной молекулы используют липосомы или дендримеры 5-го и выше поколений, или амфифильные блоксополимеры, или transfection reagent на основе Polyethylenimine (PEI).
Способ получения средства для лечения состояний человеческого организма связанного с уменьшением экспрессии гена Р4НА1 и/или уменьшением количества белка пролил 4-гидроксилазы альфа 1, заключается в получении каждой генно-терапевтической субстанции из группы генно-терапевтических субстанций, при этом получают кДНК гена Р4НА1, затем помещают кДНК в векторную плазмиду, способную обеспечить высокий уровень экспрессии этой кДНК в клетках различных органов и тканей человека, наращивают и выделяют необходимое количество генетической конструкции, затем комбинируют генетическую конструкцию с транспортной молекулой для трансфекции полученной генно-терапевтической субстанцией клеток органов и тканей и/или введения полученной генно-терапевтической субстанции в органы и ткани человека, при этом используют кДНК гена Р4НА1 с кодирующей последовательностью белка пролил 4-гидроксилазы альфа 1, с делециями 5'- и 3'-нетранслируемых областей, а именно, полученной на основе участка немодифицированной кДНК гена Р4НА1 SEQ ID No: 1, или модифицированной кДНК гена Р4НА1, при этом в качестве модифицированной кДНК гена Р4НА1 используют, или SEQ ID No: 2, или SEQ ID No: 3, или SEQ ID No: 4, или SEQ ID No: 5, или SEQ ID No: 6, или SEQ ID No: 7, или сочетание этих генетических конструкций.
Способ использования средства для лечения состояний человеческого организма, связанных с уменьшением экспрессии гена Р4НА1 и/или уменьшением количества белка пролил 4-гидроксилазы альфа 1, заключающийся в трансфекции генно-терапевтической субстанцией, выбранной из группы созданных генно-терапевтических субстанций, клеток органов и тканей пациента и/или во введении в органы и ткани пациента аутологичных клеток пациента, трансфицированных генно-терапевтической субстанцией, выбранной из группы созданных генно-терапевтических субстанций по п. 1, и/или во введении в органы и ткани пациента генно-терапевтической субстанции или нескольких субстанций, выбранной / выбранных из группы созданных генно-терапевтических субстанций по п. 1., или сочетанием обозначенных способов.
Перечень фигур
На фиг. 1
Представлена нуклеотидная последовательность немодифицированной кДНК гена Р4НА1, последовательность которой гомологична приводимой в базе данных GenBank под номером NM_000917 P4HA1SEQ ID No: 1.
На фиг. 2
Представлена нуклеотидная последовательность модифицированной кДНК гена Р4НА1, SEQ ID No: 2, которая
содержит 2 нуклеотидные замены G>C в позициях 730, 790; 3 нуклеотидных замены T>G в позициях 511, 649, 1123; 4 нуклеотидных замены A>G в позициях 487, 502, 646, 727; 2 нуклеотидных замены Т>С в позициях 500, 644, не приводящие к изменениям в аминокислотной последовательности белка пролил 4-гидроксилазы альфа 1.
На фиг. 3
Представлена нуклеотидная последовательность модифицированной кДНК гена Р4НА1, SEQ ID No: 3, которая
содержит 3 нуклеотидных замены G>C в позициях 730,790,1828; 6 нуклеотидных замен T>G в позициях 511, 649, 1123, 1192, 1249, 1801; 8 нуклеотидных замен A>G в позициях 487, 502, 646, 727, 1327, 1336, 1429, 1816; 2 нуклеотидных замены Т>С в позициях 500, 644, не приводящие к изменениям в аминокислотной последовательности белка пролил 4-гидроксилазы альфа 1.
На фиг. 4
Представлена нуклеотидная последовательность модифицированной кДНК гена Р4НА1, SEQ ID No: 4, которая
содержит 28 несинонимических нуклеотидных замен 1324 C>G, 1330 Т>С, 1333 А>С, 1334 G>A, 1336 А>Т, 13370Т, 1338 А>С, 1339 Т>А, 1340 G>A,1345 Т>А, 1346 G>A, 1347 А>Т, 1348 G>A, 1351 Т>А, 1355 A>G, 1357 А>С, 1361 A>G, 1362 С>А, 1363 C>G, 1366 A>G, 1368 C>Т, 1372 G>T, 1379 G>A, 1381 А>Т, 1382 Т>А, 1383 C>G, 1384 Т>С, 1387 G>A, приводящих к изменениям в аминокислотной последовательности белка пролил 4-гидроксилазы альфа 1.
На фиг. 5
Представлена нуклеотидная последовательность модифицированной кДНК гена Р4НА1, SEQ ID No: 5, которая содержит 28 несинонимических нуклеотидных замен 1324 C>G, 1330 Т>С, 1333 А>С, 1334 G>A, 1336 А>Т, 1337 С>Т, 1338 А>С, 1339 Т>А, 1340 G>A, 1345 Т>А, 1346 G>A, 1347 А>Т, 1348 G>A, 1351 Т>А, 1355 A>G, 1357 А>С, 1361 A>G, 1362 C>A, 1363 C>G, 1366 A>G, 1368 C>Т, 1372 C>Т, 1379 G>A, 1381 А>Т, 1382 Т>А, 1383 C>G, 1384 Т>С, 1387 G>A, приводящих к изменениям в аминокислотной последовательности белка пролил 4-гидроксилазы альфа 1, а также-3 нуклеотидных замены G>C в позициях 730, 790, 1828; 6 нуклеотидных замен T>G в позициях 511, 649, 1123, 1192, 1249, 1801; 6 нуклеотидных замен A>G в позициях 487, 502, 646, 727, 1429, 1816; 2 нуклеотидных замены Т>С в позициях 500, 644.
На фиг. 6
Представлена нуклеотидная последовательность модифицированной кДНК гена Р4НА1, SEQ ID No: 6, которая
содержит делецию с 1490 по 1544 н.п., приводящую к изменениям в аминокислотной последовательности белка пролил 4-гидроксилазы альфа 1.
На фиг. 7
Представлена нуклеотидная последовательность модифицированной кДНК гена Р4НА1, SEQ ID No: 7, которая
содержит 3 нуклеотидных замены G>C в позициях 730, 790, 1828; 6 нуклеотидных замен T>G в позициях 511, 649, 1123, 1192, 1249, 1801; 8 нуклеотидных замен A>G в позициях 487, 502, 646, 727, 1327, 1336, 1429, 1816; 2 нуклеотидных замены Т>С в позициях 500, 644; делецию с 1490 по 1544 н.п., приводящие к изменениям в аминокислотной последовательности белка пролил 4-гидроксилазы альфа 1.
На фиг. 8
С целью последующего корректного определения генно-терапевтического эффекта после трансфекции фибробластов генно-терапевтической субстанцией с кДНК гена Р4НА1 проводили анализ эндогенной экспрессии гена Р4НА1 в культуре первичных фибробластов. На фигуре представлены графики накопления продуктов полимеразной цепной реакции (ПЦР), соответствующих:
1 - кДНК гена Р4НА1, фибробласты со сниженной экспрессией гена Р4НА1
2 - кДНК гена Р4НА1, фибробласты с нормальной экспрессией гена Р4НА1
3 - кДНК гена В2М, фибробласты со сниженной экспрессией гена Р4НА1
4 - кДНК гена В2М, фибробласты с нормальной экспрессией гена Р4НА1
В качестве референтного гена использовали ген В2М (Бета-2-микроглобулин) приведенного в базе данных GenBank под номером NM 004048.2.
На фиг. 9
С целью подтверждения увеличения экспрессии гена Р4НА1 в клеточной культуре фибробластов со сниженной экспрессией гена Р4НА1 при трансфекции данных клеток генно-терапевтической субстанцией с кДНК гена Р4НА1 представлены графики накопления ПЦР-продуктов, соответствующих:
1 - кДНК гена Р4НА1 в фибробластах с нормальной экспрессией гена Р4НА1,
2 - кДНК гена Р4НА1 в фибробластах со сниженной экспрессией гена Р4НА1 до трансфекции ГТС с кДНК гена Р4НА1
3 - кДНК гена Р4НА1 в фибробластах со сниженной экспрессией гена Р4НА1 после трансфекции ГТС с кДНК гена Р4НА1
4 - кДНК гена Р4НА1 в фибробластах со сниженной экспрессией гена Р4НА1 после трансфекции вектором без кДНК гена Р4НА1
5- кДНК гена В2М в фибробластах с нормальной экспрессией гена Р4НА1,
6- кДНК гена В2М в фибробластах со сниженной экспрессией гена Р4НА1 до трансфекции ГТС с кДНК гена Р4НА1
7- кДНК гена В2М в фибробластах со сниженной экспрессией гена Р4НА1 после трансфекции ГТС с кДНК гена Р4НА1
8 - кДНК гена В2М в фибробластах со сниженной экспрессией гена Р4НА1 после трансфекции вектором без кДНК гена Р4НА1
Из графиков следует, что в случае трансфекции вектором без вставки кДНК гена Р4НА1 уровень кДНК гена Р4НА1 в фибробластах не изменился, а в случае трансфекции вектором с кДНК Р4НА1- уровень кДНК фибробластов со сниженной экспрессией гена Р4НА1 многократно увеличился (до уровня выше, чем уровень кДНК гена Р4НА1в нормальных фибробластах).
На фиг. 10
С целью подтверждения увеличения количества белка пролил 4-гидроксилазы альфа 1 в клеточной культуре фибробластов с нормальной экспрессией гена Р4НА1 при трансфекции данных клеток генно-терапевтической субстанцией содержащей кДНК гена Р4НА1 представлен график изменения количества белка пролил 4-гидроксилазы альфа 1 нетрансфицированных фибробластов (культура А), трансфицированных вектором pCDNA 3.1 (+) не содержащим кДНК Р4НА1 (культура В) и трансфицированных генно-терапевтической субстанцией на базе генетической конструкции pCDNA 3.1-P4HA1SEQ ID No: 1 (культура С). Из графика следует, что при трансфекции фибробластов генно-терапевтической субстанцией с кДНК гена Р4НА1 происходит увеличение количества белка пролил 4-гидроксилазы альфа 1 в клеточном лизате.
На фиг. 11
С целью подтверждения увеличения количества белка пролил 4-гидроксилазы альфа 1 в коже человека при введении в кожу клеточной культуры фибробластов, трансфицированной генно-терапевтической субстанцией представлен анализ изменения количества белка пролил 4-гидроксилазы альфа 1 в коже пациентов. При этом пациентам вводили три варианта культуры аутологичных фибробластов - нетрансфицированные (А), трансфицированные вектором pCMV6-XL5 (Б) и трансфицированные генно-терапевтической субстанцией на базе pCMV6- P4HA1SEQ ID No: 7 (С) - в кожу предплечья. Также анализировали количественный уровень белка пролил 4-гидроксилазы альфа 1 в интактной коже. Показано повышение количества белка пролил 4-гидроксилазы альфа 1 в коже пациента в области введения фибробластов, трансфицированных генно-терапевтической субстанцией с кДНК гена Р4НА1(С).
На фиг. 12
С целью подтверждения увеличения количества белка пролил 4-гидроксилазы альфа 1 до различного индивидуального уровня в клеточных культурах фибробластов пациентов при трансфекции данных клеток генно-терапевтическими субстанциями с модифицированными и немодифицированной кДНК гена Р4НА1 в зависимости от наличия и типа в них той или иной модификации кДНК гена Р4НА1 представлен анализ изменения количественного уровня белка пролил 4-гидроксилазы альфа 1 в культурах фибробластов кожи человека в зависимости от наличия и типа модификаций в кДНК гена Р4НА1, используемой для трансфекции фибробластов.
Культуры фибробластов 28 пациентов делили на 8 частей каждую с (А) по (Н); первые части (А) клеточных культур пациентов трансфицировали генно-терапевтической субстанцией pCMV6-P4HA1SEQ ID No: 1, части (В) трансфицировали генно-терапевтической субстанцией pCMV6-P4HA1SEQ ID No: 2, части (С) трансфицировали генно-терапевтической субстанцией pCMV6-P4HA1SEQ ID No: 3, части (D) трансфицировали генно-терапевтической субстанцией pCMV6-P4HA1SEQ ID No: 4, части (Е) трансфицировали генно-терапевтической субстанцией pCMV6-P4HA1SEQ ID No: 5, части (F) трансфицировали генно-терапевтической субстанцией pCMV6-P4HA1SEQ ID No: 6, части (G) трансфицировали генно-терапевтической субстанцией pCMV6-P4HA1SEQ ID No: 7, части (Н) трансфицировали векторной плазмидой, не содержащей кДНК гена Р4НА1.
По итогам анализа количественного уровня белка пролил 4-гидроксилазы альфа 1 выбрали показатели, касательно каждой части клеточной культуры от каждого пациента, продемонстрировавшие наибольшее количество белка пролил 4-гидроксилазы альфа 1 и объединили их в семь групп, исходя из следующего критерия:
В группе 1 наибольшее количество белка пролил 4-гидроксилазы альфа 1 наблюдалась при трансфекции pCMV6-P4HA1SEQ ID No: 1,
в группе 2 наибольшее количество белка пролил 4-гидроксилазы альфа 1 наблюдалась при трансфекции pCMV6-P4HA1 SEQ ID No: 2,
в группе 3 наибольшее количество белка пролил 4-гидроксилазы альфа 1 наблюдалась при трансфекции pCMV6-P4HA1 SEQ ID No: 3,
в группе 4 наибольшее количество белка пролил 4-гидроксилазы альфа 1 наблюдалась при трансфекции pCMV6-P4HA1 SEQ ID No: 4,
в группе 5 наибольшее количество белка пролил 4-гидроксилазы альфа 1 наблюдалась при трансфекции pCMV6-P4HA1 SEQ ID No: 5,
в группе 6 наибольшее количество белка пролил 4-гидроксилазы альфа 1 наблюдалась при трансфекции pCMV6-P4HA1 SEQ ID No: 6,
в группе 7 наибольшее количество белка пролил 4-гидроксилазы альфа 1 наблюдалась при трансфекции pCMV6-P4HA1 SEQ ID No: 7.
Ни в одной из клеточных культур не наблюдалось того, что наибольшее количество белка пролил 4-гидроксилазы альфа 1 присутствует при трансфекции вектором без вставки кДНК гена Р4НА1.
На фигуре 12 для каждой группы клеточных культур приведены диаграммы показателей концентрации белка пролил 4-гидроксилазы альфа 1 (усредненных в рамках группы, в случае, если в группу входит более одной клеточной культуры) применительно ко всем, участвующим в эксперименте генно-терапевтическим субстанциям, после трансфекции этих клеточных культур генно-терапевтическими субстанциями, содержащими модифицированные и немодифицированной кДНК гена Р4НА1.
Из фигуры следует, что достижение наибольшего количества белка пролил 4-гидроксилазы альфа 1 в культурах фибробластов кожи различных пациентов при их трансфекции генно-терапевтическими субстанциями, связано с индивидуальными особенностями пациентов и зависит от наличия и типа модификаций в кДНК гена Р4НА1, входящих в генно-терапевтические субстанции.
Каждая генно-терапевтическая субстанция из группы генно-терапевтических субстанций является эффективной в некоторой значительной группе пациентов. Следовательно, для выбора наиболее эффективной генно-терапевтической субстанции из группы генно-терапевтических субстанций для терапевтических целей необходимо предварительное персонализированное исследование пациента.
Обозначения:
части клеточных культур, трансфицированных ГТС Р4НА1 SEQ ID No: 1 (A)
части клеточных культур, трансфицированных ГТС Р4НА1 SEQ ID No: 2 (B)
части клеточных культур, трансфицированных ГТС Р4НА1 SEQ ID No: 3 (С)
части клеточных культур, трансфицированных ГТС Р4НА1 SEQ ID No: 4 (D)
части клеточных культур, трансфицированных ГТС Р4НА1 SEQ ID No: 5 (Е)
части клеточных культур, трансфицированных ГТС Р4НА1 SEQ ID No: 6 (F)
части клеточных культур, трансфицированных ГТС Р4НА1 SEQ ID No: 7 (G)
части клеточных культур, трансфицированных плацебо (Н)
На фиг. 13
С целью подтверждения увеличения экспрессии гена Р4НА1 в клеточной культуре кератоцитов и эпителиальных клеток роговицы глаза при трансфекции данных клеток генно-терапевтической субстанцией с кДНК гена Р4НА1 приведены графики накопления ПЦР-продуктов, соответствующих:
1 - кДНК гена Р4НА1, кератоциты до трансфекции
2 - кДНК гена Р4НА1, эпителий роговицы до трансфекции
3 - кДНК гена Р4НА1, кератоциты после трансфекции
4 - кДНК гена Р4НА1, эпителий роговицы после трансфекции
5 - кДНК гена В2М, кератоциты до трансфекции
6 - кДНК гена В2М, эпителий роговицы до трансфекции
7 - кДНК гена В2М, кератоциты после трансфекции
8 - кДНК гена В2М, эпителий роговицы после трансфекции
Ген В2М использовали в качестве референтного.
Из фигуры следует, что в результате трансфекции уровень специфической кДНК гена Р4НА1 в культуре кератоцитов и в культуре эпителия многократно вырос.
На фиг. 14
С целью подтверждения увеличения экспрессии гена Р4НА1 в клеточной культуре хондробластов при трансфекции данных клеток генно-терапевтической субстанцией с кДНК гена Р4НА1 приведены графики накопления ПЦР-продуктов, соответствующих:
1 - кДНК гена Р4НА1, до трансфекции
2 - кДНК гена Р4НА1, после трансфекции
3 - кДНК гена В2М, до трансфекции
4 - кДНК гена В2М, после трансфекции
Ген В2М использовали в качестве референтного.
Из фигуры следует, что в результате трансфекции уровень специфической кДНК гена Р4НА1 вырос многократно.
На фиг. 15
С целью подтверждения увеличения количества белка пролил 4-гидроксилазы альфа 1 в коже человека при введении в кожу генно-терапевтической субстанции представлен анализ изменения количественного уровня белка пролил 4-гидроксилазы альфа 1 в коже. При этом пациенту вводили генно-терапевтическую субстанцию, содержащую генетическую конструкцию pCMV6-P4HA1 SEQ ID No: 4 (В) с транспортной молекулой и параллельно вводили плацебо, представляющее собой комбинацию векторной плазмиды pCMV-XL5 не содержащей кДНК гена Р4НА1 с транспортной молекулой (А) - в кожу предплечья. Показано увеличение количества белка пролил 4-гидроксилазы альфа в биоптате кожи пациента 1В, которому вводились генно-терапевтическая субстанция, содержащая генетическую конструкцию с кДНК гена Р4НА1, что говорит об эффективности генно-терапевтической субстанции.
Обозначения:
пациент 1А
пациент 1В
пациент 1В до введения ГТС
На фиг. 16
С целью подтверждения увеличения количества белка пролил 4-гидроксилазы альфа 1
в хрящевой ткани человека при введении в хрящевую ткань генно-терапевтической субстанции представлен анализ изменения количественного уровня белка пролил 4-гидроксилазы альфа 1 в хрящевой ткани. При этом пациенту вводили генно-терапевтическую субстанцию, содержащую векторную плазмиду с кДНК гена P4HA1pCDNA 3.1 P4HA1SEQ ID No: 5 (В) с транспортной молекулой и параллельно вводили плацебо pCDNA 3.1(+), представляющее собой комбинацию векторной плазмиды не содержащей кДНК гена Р4НА1 с транспортной молекулой (А) - в хрящевую ткань.
Показано увеличение количественного уровня белка пролил 4-гидроксилазы альфа в лизате биоптата хрящевой ткани пациента 1В, которому вводились генно-терапевтическая субстанция, содержащая генетическую конструкцию с кДНК гена Р4НА1, что говорит об эффективности генно-терапевтической субстанции.
Обозначения:
пациент 1А
пациент 1В
пациент 1В до введения ГТС
На фиг. 17
С целью подтверждения увеличения количества белка пролил 4-гидроксилазы альфа 1 в мышечной ткани человека при введении в мышечную ткань генно-терапевтической субстанции представлен анализ изменения количества белка пролил 4-гидроксилазы альфа 1 в мышечной ткани. При этом пациенту вводили генно-терапевтическую субстанцию, содержащую векторную плазмиду с кДНК гена Р4НА1- pCMV6-Kan/Neo P4HA1SEQ ID No: 6 (В) с транспортной молекулой и параллельно вводили плацебо pCMV6-Kan/Neo, представляющее собой комбинацию векторной плазмиды не содержащей кДНК гена Р4НА1 с транспортной молекулой (А) - в мышечную ткань в зоне предплечья. Показано увеличение количества белка пролил 4-гидроксилазы альфа 1 в биоптате мышечной ткани пациента 1В, которому вводились генно-терапевтическая субстанция, содержащая генетическую конструкцию с кДНК гена Р4НА1, что говорит об эффективности генно-терапевтической субстанции.
Обозначения:
пациент 1А
пациент 1В
пациент 1В до введения ГТС
На фиг. 18
С целью подтверждения увеличения количества белка пролил 4-гидроксилазы альфа 1 до различного индивидуального уровня при введении в кожу пациентов генно-терапевтических субстанций с модифицированными и немодифицированной кДНК гена Р4НА1 анализировали количественный уровень белка пролил 4-гидроксилазы альфа 1в коже человека в зависимости от наличия и типа модификаций в кДНК гена Р4НА1.
Каждому из 24-х пациентов, отобранных в случайном порядке, вводили в кожу предплечья 7 генно-терапевтических субстанций pCMV6- SEQ ID No: 1, pCMV6- SEQ ID No: 2, pCMV6-SEQ ID No: 3, pCMV6-SEQ ID No: 4, pCMV6- SEQ ID No: 5, pCMV6-SEQ ID No: 6, pCMV6-SEQ ID No: 7, и плацебо pCMV6- XL5.
По итогам анализа количества белка пролил 4-гидроксилазы альфа 1 в биоптатах выбрали показатели, касательно каждого биоптата от каждого пациента, продемонстрировавшие наибольшие количественные уровни белка пролил 4-гидроксилазы альфа 1 и объединили их в семь групп, исходя из следующего критерия:
В группе 1 наибольшее количество белка пролил 4-гидроксилазы альфа 1 наблюдалась при введении pCMV6-P4HA1 SEQ ID No: 1,
в группе 2 наибольшее количество белка пролил 4-гидроксилазы альфа 1 наблюдалась при введении pCMV6-P4HA1 SEQ ID No: 2,
в группе 3 наибольшее количество белка пролил 4-гидроксилазы альфа 1 наблюдалась при введении pCMV6-P4HA1 SEQ ID No: 3,
в группе 4 наибольшее количество белка пролил 4-гидроксилазы альфа 1 наблюдалась при введении pCMV6-P4HA1 SEQ ID No: 4,
в группе 5 наибольшее количество белка пролил 4-гидроксилазы альфа 1 наблюдалась при введении pCMV6-P4HA1 SEQ ID No: 5,
в группе 6 наибольшее количество белка пролил 4-гидроксилазы альфа 1 наблюдалась при введении pCMV6-P4HA1 SEQ ID No: 6,
в группе 7 наибольшее количество белка пролил 4-гидроксилазы альфа 1 наблюдалась при введении pCMV6-P4HA1 SEQ ID No: 7.
Ни в одном из биоптатов не наблюдалось того, что наибольшее количество белка пролил 4-гидроксилазы альфа 1 присутствует в случае введения плацебо.
На фигуре 18 для каждой группы биоптатов приведены диаграммы показателей концентрации белка пролил 4-гидроксилазы альфа 1 (усредненных в рамках группы, в случае, если в группу входит более одного биоптата) применительно ко всем, участвующим в эксперименте генно-терапевтическим субстанциям, после введения