Химерные антигенные рецепторы м971
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к химерному антигенному рецептору (CAR), вызывающему антигенспецифический ответ против CD22 при связывании CAR с CD22, нуклеиновой кислоте, его кодирующей, а также к вектору и клетке-хозяину, содержащим вышеуказанную нуклеиновую кислоту. Также раскрыты фармацевтическая композиция для лечения или профилактики рака у млекопитающего, а также способ лечения или профилактики рака у млекопитающего с использованием вышеуказанного CAR. Изобретение также относится к применению вышеуказанной клетки-хозяина для изготовления лекарственного средства для лечения или профилактики рака, где рак экспрессирует CD22, а также для изготовления композиции для обнаружения рака, где рак экспрессирует CD22. Изобретение позволяет эффективно осуществлять лечение или профилактику рака у млекопитающего. 10 н. и 21 з.п. ф-лы, 6 ил., 3 табл., 7 пр.
Реферат
Перекрестная ссылка на родственную заявку
[0001] Данная патентная заявка претендует на приоритет предварительной патентной заявки США №61/717960, поданной 24 октября 2012 года, которая включена в данный документ во всей ее полноте посредством ссылки. Заявление о Федеральной поддержке научных исследований Настоящее изобретение было создано при поддержке Правительства с №проекта Z01 ZIA ВС 010701 Национальным институтом здоровья, Национальным институтом онкологии. Правительство имеет определенные права на изобретение.
Включение посредством ссылки материала, представленного в электронном виде
[0002] Включенный в данный документ в полном объеме посредством ссылки читаемый на компьютере список нуклеотидных/аминокислотных последовательностей, представленный одновременно с данной заявкой и определенный следующим образом: один файл размером 31786 байт ASCII (Text) с названием "714144_ST25.txt", созданный 30 августа 2013 г.
Уровень техники
[0003] Рак является проблемой общественного здравоохранения. Несмотря на успехи в лечении, такие как химиотерапия, прогноз для многих видов рака, в том числе гематологических злокачественных новообразований, может быть плохим. Например, было подсчитано, что в 2000 году в Соединенных Штатах Америки ожидалось более 45000 смертей от неходжкинской лимфомы и лейкемии (Greenlee et al., СА Cancer J. Clin., 50:7-33 (2000)). Соответственно, существует неудовлетворенная потребность в дополнительных способах лечения рака, в частности, гематологических злокачественных новообразований.
Сущность изобретения
[0004] Воплощение данного изобретения предусматривает химерный антигенный рецептор (chimeric antigen receptor, CAR), содержащий антигенсвязывающий домен с SEQ ID NO 1-6, трансмембранный домен и внутриклеточный домен Т-клеточного сигналинга.
[0005] Другие воплощения изобретения предусматривают родственные нуклеиновые кислоты, рекомбинантные экспрессионные векторы, клетки-хозяева, популяции клеток, антитела или их антигенсвязывающие части и фармацевтические композиции, относящиеся к CAR согласно изобретению.
[0006] Дополнительные воплощения данного изобретения предусматривают способы обнаружения присутствия рака у млекопитающего и способы лечения или профилактики рака у млекопитающего.
Краткое описание графических материалов
[0007] На фиг. 1A-1G представлены графики, показывающие % лизиса целевых 51Cr-меченых лейкемических клеточных линий REH (A), SEM (В), NALM6-GL (С), KOPN8 (D), Daudi (Е), Raji (F) и К562 (G) эффекторными Т-клетками человека, которые были нетрансдуцированными (имитирующими, контрольными, mock; •; круги) или трансдуцированными следующими CAR: HA22-SH второго поколения версии 1 (▲), m971 второго поколения версии 1 (▲; прозрачный треугольник) или CD19-специфический CAR (■; квадраты); с различным соотношением эффектора к мишени (Е: Т).
[0008] На фиг. 2А-2С представлены графики, показывающие % лизиса целевых лейкемических клеточных линий Raji (A), NALM6-GL (В) или K562 (С) эффекторными нетрансдуцированными Т-клетками (mock, •; круги), m971 второго поколения версии 1 CAR (▲) или m971 третьего поколения CAR (▼) с различным соотношением Е: Т.
[0009] На фиг. 3А-3С представлены графики, показывающие количества интерферона (IFN)-γ (пг/мл), секретируемые Т-клетками, которые были нетрансдуцированными (mock) или трансдуцированными одним из следующих CAR: анти-CD19, m971 второго поколения версии 1 (SEQ ID NO 23), m971 третьего поколения (SEQ ID NO 24), HASH22 второго поколения версии 1, HASH22 второго поколения версии 2 или HASH22 третьего поколения; при совместном культивировании с лейкемическими клеточными линиями NALM6-GL (CD22низ) (А), Raji (CD22выс) (В) или K562 (CD22-отрицательная) (С).
[0010] На фиг. 3D-3F представлены графики, показывающие количества интерлейкина (IL) 2 (пг/мл), секретируемые Т-клетками, которые были нетрансдуцированными (mock) или трансдуцированными одним из следующих CAR: анти-CD19, m971 второго поколения версии 1 (SEQ ID NO 23), m971 третьего поколения (SEQ ID NO 24), HASH22 второго поколения версии 1, HASH22 второго поколения версии 2 или HASH22 третьего поколения; при совместном культивировании с лейкемическими клеточными линиями NALM6-GL (CD22низ) (А), Raji (CD22выс) (В) или K562 (CD22-отрицательная) (С).
[0011] На фиг. 3G-3I представлены графики, показывающие количества фактора некроза опухоли (TNF) α (пг/мл), секретируемые Т-клетками, которые были нетрансдуцированными (mock) или трансдуцированными одним из следующих CAR: анти-CD19, m971 второго поколения версии 1 (SEQ ID NO 23), m971 третьего поколения (SEQ ID NO 24), HASH22 второго поколения версии 1, HASH22 второго поколения версии 2 или HASH22 третьего поколения; при совместном культивировании с лейкемическими клеточными линиями NALM6-GL (CD22низ) (А), Raji (CD22выс) (В) или K562 (С022-отрицательная) (С).
[0012] На фиг. 4А представлен график, показывающий биолюминесцентные сигналы (фотон/с/см2/стерадиан), полученные в результате реакции люциферазы (трансфицированной в лейкемические клетки, которые вводили мышам) с люциферином, который вводили мышам, и измеряемые в течение 30 дней. Мышам вводили контрольные Т-клетки ("mock", нетрансдуцированные, •; круги) или Т-клетки, трансдуцированные CAR HASH22 второго поколения версии 1 (■; квадраты) или т971 второго поколения версии 1 (треугольники, SEQ ID NO 23). Большие значения фотонов/с/см2/стерадиан указывают на большую опухолевую массу.
[0013] На фиг. 4В представлен график, показывающий процент выживаемости мышей, получавших контрольные Т-клетки ("mock" нетрансдуцированные, квадраты) или Т-клетки, трансдуцированные CAR HASH22 второго поколения версии 1 (круги) или CAR 971 второго поколения версии 1 (треугольники, SEQ ID NO 23) в течение 30 дней, (mock в сравнении с НА22, р=0,0019;. mock в сравнении с m971, р=0,0019;. М971 в сравнении с НА22, р=0,003).
[0014] На фиг. 5 представлена таблица, показывающая биолюминесцентные изображения мышей с лейкемией через три, пять и восемь дней после введения нетрансдуцированных Т-клеток (mock) или 15×106, 5×106, 1×106 или 1×105Т-клеток, трансдуцированных нуклеотидной последовательностью, кодирующей CAR m971 второго поколения версии 2 (SEQ ID NO 22). Изменение штриховки от серого к белому показывает увеличение массы опухоли.
[0015] На фиг. 6 представлен график, показывающий общее число фотонов, испускаемых при биолюминесценции мышей, показанной на фиг.5, в течение 44 дней. Общее число фотонов количественно оценивали и наносили на график, и средние и стандартные отклонения показывали для каждой временной точки. Мышам вводили нетрансдуцированные Т-клетки (mock) (знак плюса) или 15×106 (ромб), 5×106 (цветок), 1×106 (крест) или 1×105 (звезда) Т-клеток, трансдуцированных нуклеотидной последовательностью, кодирующей CAR m971 второго поколения версии 2 (SEQ ID NO 22).
Подробное описание изобретения
[0016] Воплощение данного изобретения предусматривает химерный антигенный рецептор (CAR), содержащий антигенсвязывающий домен с SEQ ID NO 1-6, трансмембранный домен и внутриклеточный домен Т-клеточного сигналинга.
[0017] CAR представляет собой искусственно созданный гибридный белок или полипептид, содержащий антигенсвязывающие домены антитела (например, одноцепочечный вариабельный фрагмент (scFv)), связанный с доменами Т-клеточного сигналинга. Характеристики CAR включают способность перенаправлять Т-клеточную специфичность и реактивность на выбранную мишень МНС-неограниченным образом, используя антигенсвязывающие свойства моноклональных антител. МНС-неограниченное распознавание антигена дает Т-клеткам, экспрессирующим CAR, способность распознавать антиген независимо от процессинга антигена, таким образом, минуя главный механизм избегания опухоли. Более того, при экспрессии в Т-клетках CAR преимущественно не димеризуются с альфа- и бета-цепями эндогенного Т-клеточного рецептора (TCR).
[0018] Фразы "обладает антигенной специфичностью" и "вызывает антигенспецифический ответ", используемые в данном документе, означают, что CAR может специфически связываться и иммунологически распознавать антиген таким образом, что связывание CAR с антигеном вызывает иммунный ответ.
[0019] CAR согласно изобретению обладают антигенной специфичностью к CD22. CD22 представляет собой линиеспецифический В-клеточный антиген, принадлежащих суперсемейству иммуноглобулинов (lg). CD22 экспрессируется на 60-70% В-клеточных лимфом и лейкемий (например, В-хроническом лимфолейкозе, волосатоклеточной лейкемии, остром лимфобластном лейкозе (ALL) и лимфоме Беркитта) и не присутствует на клеточной поверхности на ранних стадиях В-клеточного развития или на стволовых клетках. Vaickus et al., Crit. Rev. Oncol./Hematol., 11:267-297 (1991); Bang et al., Clin. Cancer Res., 11: 1545-50 (2005).
[0020] Без связи с конкретной теорией или механизмом, полагают, что, вызывая антигенспецифический ответ против CD22, CAR согласно изобретению вызывают одно или более чем одно из следующих явлений: нацеливание и разрушение CD22-экспрессирующих раковых клеток, уменьшение или устранение раковых клеток, облегчение инфильтрации мест(а) опухоли иммунными клетками и усиление/удлинение противораковых ответов. Поскольку CD22 не экспрессируется на ранних стадиях В-клеточного развития или на стволовых клетках, предполагается, что CAR согласно изобретению преимущественно по существу не вызывают нацеливания/уничтожения стволовых клеток и/или В-клеток на ранних стадиях развития.
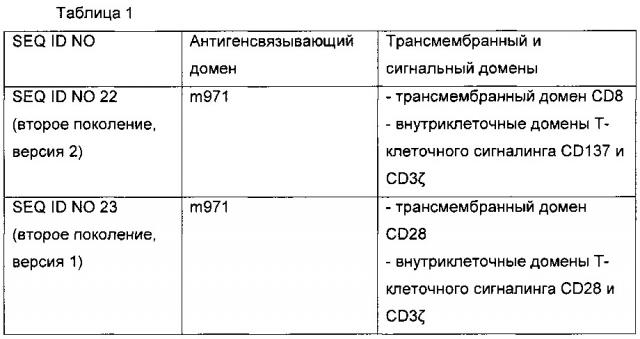
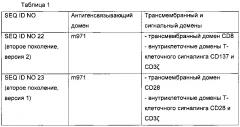
[0021] Воплощение данного изобретения предусматривает CAR, содержащий антигенсвязывающий домен антитела m971 ("m971"). Антигенсвязывающий домен m971 специфически связывается с CD22. В связи с этим предпочтительное воплощение данного изобретения предусматривает CAR, содержащие антигенсвязывающий домен, содержащий, состоящий из или состоящий по существу из одноцепочечного вариабельного фрагмента (scFv) антигенсвязывающего домена m971. Антитело m971 имеет улучшенное связывание с CD22 по сравнению с иммунотоксином НА22, а также связывается с другим эпитопом CD22. Xiao et al., mAbs 1:3, 297-303 (2009).
[0022] Антигенсвязывающий домен может содержать вариабельную область легкой цепи и/или вариабельную область тяжелой цепи. В одном воплощении изобретения вариабельная область тяжелой цепи содержит область CDR1, область CDR2 и область CDR3. В связи с этим антигенсвязывающий домен может содержать одну или более чем одну из CDR1-области тяжелой цепи, включающей SEQ ID NO 1; CDR2-области тяжелой цепи, включающей SEQ ID NO 2; и CDR3-области тяжелой цепи, включающей SEQ ID NO 3. Предпочтительно тяжелая цепь содержит все SEQ ID NO 1-3.
[0023] В одном воплощении изобретения вариабельная область легкой цепи может содержать CDR1-область легкой цепи, CDR2-область легкой цепи и CDR3-область легкой цепи. В связи с этим антигенсвязывающий домен может содержать одну или более чем одну из CDR1-области легкой цепи, включающей SEQ ID NO 4; CDR2-область легкой цепи, включающей SEQ ID NO 5; и CDRS-области легкой цепи, включающей SEQ ID NO 6. Предпочтительно, легкая цепь содержит все SEQ ID NO 4-6. В особенно предпочтительном воплощении антигенсвязывающий домен содержит все последовательности SEQ ID NO 1-6.
[0024] Вариабельная область легкой цепи антигенсвязывающего домена может содержать, состоять из или состоять по существу из SEQ ID NO 7. Вариабельная область тяжелой цепи антигенсвязывающего домена может содержать, состоять из или состоять по существу из SEQ ID NO 8. Соответственно, в одном из воплощений изобретения антигенсвязывающий домен содержит вариабельную область легкой цепи, содержащую последовательность SEQ ID NO 7, и/или вариабельную область тяжелой цепи, содержащую последовательность SEQ ID NO 8. Предпочтительно, антигенсвязывающий домен содержит обе SEQ ID NO 7 и 8.
[0025] В одном воплощении изобретения вариабельная область легкой цепи и вариабельная область тяжелой цепи могут быть соединены с помощью линкера. Линкер может содержать любую подходящую аминокислотную последовательность. В одном воплощении изобретения линкер может содержать, состоять или по существу состоять из SEQ ID NO 11.
[0026] В одном воплощении антигенсвязывающий домен содержит вариабельную область легкой цепи и вариабельную область тяжелой цепи. В связи с этим воплощение антигенсвязывающего домена, содержащего и вариабельную область легкой цепи, и вариабельную область тяжелой цепи, содержит, состоит из или по существу состоит из SEQ ID NO 9.
[0027] В одном воплощении антигенсвязывающий домен содержит лидерную последовательность. Лидерная последовательность может быть расположена на амино-конце вариабельной области легкой цепи. Лидерная последовательность может содержать любую подходящую лидерную последовательность. В одном воплощении лидерная последовательность является последовательностью рецептора человеческого гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF). В связи с этим антигенсвязывающий домен содержит лидерную последовательность, содержащую, состоящую из или по существу состоящую из SEQ ID NO 10. В одном воплощении данного изобретения, в то время как лидерная последовательность может облегчить экспрессию CAR на поверхности клетки, наличие лидерной последовательности в экспрессированном CAR не является необходимым для того, чтобы CAR функционировал. В одном воплощении изобретения при экспрессии CAR на клеточной поверхности лидерная последовательность может быть отщеплена от CAR. Соответственно, в одном воплощении изобретения CAR не имеет лидерной последовательности.
[0028] В одном воплощении изобретения CAR содержит трансмембранный домен. В одном воплощении изобретения трансмембранный домен содержит i) CD8 и/или ii) CD28. В предпочтительном воплощении CD8 и CD28 являются человеческими. CD8 или CD28 могут содержать меньше, чем целый CD8 или CD28, соответственно. В связи с этим CAR содержит трансмембранный домен CD8, содержащий, состоящий из или состоящий по существу из SEQ ID NO 12 или 18, и/или трансмембранный домен CD28, содержащий, состоящий из или по существу состоящий из SEQ ID NO 15.
[0029] В одном воплощении изобретения CAR включает внутриклеточный домен Т-клеточного сигналинга, содержащий один или более чем один из i) CD28, ii) CD137 и/или iii) CD3 дзета (ζ). В предпочтительном воплощении CD28, CD137 и CD3 дзета являются человеческими. CD28 является Т-клеточным маркером, важным в костимуляции Т-клеток. CD137, также известный как 4-1 ВВ, передает мощный костимулирующий сигнал Т-клеткам, стимулируя дифференцировку и удлиняя долгосрочное выживание Т-лимфоцитов. CD3ζ ассоциируется с TCR, образуя сигнал, и содержит мотив активации иммунорецептора на основе тирозина (ITAM). CD28, CD137 или CD3 дзета могут содержать меньше, чем целый CD28, CD137 или CD3 дзета, соответственно. В связи с этим внутриклеточный домен Т-клеточного сигналинга содержит аминокислотную последовательность CD28 содержащую, состоящую из или по существу состоящую из SEQ ID NO 16 или 19, аминокислотную последовательность CD137, включающую, состоящую из или по существу состоящую из SEQ ID NO 13 или 20, и/или аминокислотную последовательность CD3 дзета, включающую, состоящую из или по существу состоящую из SEQ ID NO 14, 17 или 21.
[0030] В одном воплощении изобретения CAR содержит трансмембранный домен, содержащий CD28, и внутриклеточный домен Т-клеточного сигналинга, содержащий CD28 и CD3 дзета. В связи с этим CAR может содержать каждый из SEQ ID NO 15-17. Предпочтительно, CAR включает а) каждый из SEQ ID NO 1-6 и 15-17; b) 7-8 и 15-17; с) 9 и 15-17; или d) 9-10 и 15-17.
[0031] В одном воплощении изобретения CAR содержит трансмембранный домен, содержащий CD8, и внутриклеточный домен Т-клеточного сигналинга, включающий CD28, CD137 и CD3 дзета. В связи с этим CAR может содержать каждый из SEQ ID NO 18-21. Предпочтительно, CAR включает а) каждый из SEQ ID NO 1-6 и 18-21; b) 7-8 и 18-21; с) 9 и 18-21; или d) 9-10 и 18-21.
[0032] В одном воплощении изобретения CAR содержит трансмембранный домен, содержащий CD8, и внутриклеточный домен Т-клеточного сигналинга, содержащий CD137 и CD3 дзета. В связи с этим CAR может содержать каждый из SEQ ID NO 12-14. Предпочтительно, CAR включает а) каждый из SEQ ID NO 1-6 и 12-14; b) 7-8 и 12-14; с) 9 и 12-14; или d) 9-10 и 12-14.
[0033] Дополнительные воплощения данного изобретения предусматривают CAR, содержащие, состоящие из или по существу состоящие из любой аминокислотной последовательности, приведенной в таблице 1.
[0034] В объем данного изобретения включены функциональные части описанных CAR согласно изобретению. Термин "функциональная часть", используемый в отношении к CAR, относится к любой части или фрагменту CAR согласно изобретению, где часть или фрагмент сохраняет биологическую активность того CAR, частью которого он является (родительского CAR). Функциональные части охватывают, например, те части CAR, которые сохраняют способность распознавать клетки-мишени или обнаруживать, излечивать или предотвращать заболевание в подобной степени, в той же степени или в большей степени, чем родительский CAR. В отношении родительского CAR функциональная часть может содержать, например, примерно 10%, 25%, 30%, 50%, 68%, 80%, 90%, 95% или более от родительского CAR.
[0035] Функциональная часть может содержать дополнительные аминокислоты на амино- или карбокси-конце или на обоих концах, где дополнительные аминокислоты не присутствуют в аминокислотной последовательности родительского CAR. Желательно, чтобы дополнительные аминокислоты не мешали биологической функции функциональной части, например, распознаванию клеток-мишеней, обнаружению рака, лечению или профилактике рака и т.д. Более предпочтительно, чтобы дополнительные аминокислоты повышали биологическую активность CAR по сравнению с биологической активностью родительского CAR.
[0036] В объем данного изобретения включены функциональные варианты описанного CAR согласно изобретению. Термин "функциональный вариант", используемый в данном документе, относится к CAR, полипептиду или белку, имеющему существенную или значительную идентичность или сходство последовательности с родительским CAR, при этом функциональный вариант сохраняет биологическую активность того CAR, вариантом которого он является. Функциональные варианты охватывают, например, те варианты CAR, описанные в данном документе (родительский CAR), которые сохраняют способность распознавать клетки-мишени в подобной степени, в той же степени или в большей степени, чем родительский CAR. В отношении родительского CAR функциональный вариант может быть, например, примерно на 30% идентичен, примерно на 50% идентичен, примерно на 75% идентичен, примерно на 80% идентичен, примерно на 90% идентичен, примерно на 98% идентичен или примерно на 99% идентичен аминокислотной последовательности родительского CAR.
[0037] Функциональный вариант может, например, включать аминокислотную последовательность родительского CAR по меньшей мере с одной консервативной аминокислотной заменой. Альтернативно или дополнительно, функциональные варианты могут содержать аминокислотную последовательность родительского CAR по меньшей мере с одной неконсервативной аминокислотной заменой. В этом случае предпочтительно, чтобы неконсервативная аминокислотная замена не мешала или не ингибировала биологическую активность функционального варианта. Неконсервативная аминокислотная замена может повышать биологическую активность функционального варианта, так что биологическая активность функционального варианта увеличивается по сравнению с родительским CAR.
[0038] Аминокислотные замены CAR согласно изобретению предпочтительно являются консервативными аминокислотными заменами. Консервативные аминокислотные замены известны в данной области и включают аминокислотные замены, в которых одна аминокислота с определенными физическими и/или химическими свойствами заменена на другую аминокислоту с такими же или подобными химическими или физическими свойствами. Например, консервативная аминокислотная замена может быть кислой/отрицательно заряженной полярной аминокислотой, замененной на другую кислую/отрицательно заряженную полярную аминокислоту (например, Asp или Glu), аминокислотой с неполярной боковой цепью, замененной на другую аминокислоту с неполярной боковой цепью (например, Ala, Gly, Val, He, Leu, Met, Phe, Pro, Trp, Cys, Val и т.д.), основной/положительно заряженной полярной аминокислотой, замененной на другую основную/положительно заряженную полярную аминокислоту (например, Lys, His, Arg и т.д.), незаряженной аминокислотой с полярной боковой цепью, замененной на другую незаряженную аминокислоту с полярной боковой цепью (например, Asn, Gin, Ser, Thr, Туг и т.п.), аминокислотой с бета-разветвленной боковой цепью, замененной на другую аминокислоту с бета-разветвленной боковой цепью (например, lie, Thr и Val), аминокислотой с ароматической боковой цепью, замененной на другую аминокислоту с ароматической боковой цепью (например, His, Phe, Trp и Туг) и т.д.
[0039] CAR может состоять по существу из конкретной аминокислотной последовательности или последовательностей, описанных в данном документе, так что другие компоненты, например другие аминокислоты, существенно не изменяют биологическую активность функционального варианта.
[0040] CAR воплощений изобретения (в том числе функциональные части и функциональные варианты) могут быть любой длины, т.е. могут содержать любое число аминокислот, при условии, что CAR (или их функциональные части или функциональные варианты) сохраняют их биологическую активность, например способность специфически связываться с антигеном, обнаруживать больные клетки у млекопитающего или лечить или предотвращать заболевание у млекопитающего и т.д. Например, CAR может быть длиной от примерно 50 до примерно 5000 аминокислот, например 50, 70, 75, 100, 125, 150, 175, 200, 300, 400, 500, 600, 700, 800, 900, 1000 или более аминокислот.
[0041] CAR воплощений изобретения (в том числе функциональные части и функциональные варианты) могут содержать синтетические аминокислоты вместо одной или более чем одной природной аминокислоты. Такие синтетические аминокислоты известны в данной области и включают, например, аминоциклогексанкарбоновую кислоту, норлейцин, α-амино-n-декановую кислоту, гомосерин, S-ацетиламинометилцистеин, транс-3- и транс-4-гидроксипролин, 4-аминофенилаланин, 4-нитрофенилаланин, 4-хлорофенилаланин, 4-карбоксифенилаланин, β-фенилсерин-β-гидроксифенилаланин, фенилглицин, α-нафтилаланин, циклогексилаланин, циклогексилглицин, индолин-2-карбоновую кислоту, 1,2,3,4-тетрагидроизохинолин-3-карбоновую кислоту, аминомалоновую кислоту, моноамид аминомалоновой кислоты, N'-бензил-N'-метиллизин, N',N'-дибензиллизин, 6-гидроксилизин, орнитин, α-аминоциклопентанкарбоновую кислоту, α-аминоциклогексанкарбоновую кислоту, α-аминоциклогептанкарбоновую кислоту, α-(2-амино-2-норборнан)карбоновую кислоту, α,γ-диаминомасляную кислоту, α,β-диаминопропионовую кислоту, гомофенилаланин и α-трет-бутилглицин.
[0042] CAR воплощений изобретения (в том числе функциональные части и функциональные варианты) могут быть гликозилированными, амидированными, карбоксилированными, фосфорилированными, этерифицированными, N-ацилированными, циклизованными, например, через дисульфидный мостик, или могут быть превращены в кислотно-аддитивную соль и/или, возможно, димеризованы, полимеризованы или конъюгированы.
[0043] CAR воплощений изобретения (в том числе функциональные части и функциональные варианты) могут быть получены способами, известными в данной области. CAR могут быть изготовлены с помощью любого подходящего способа изготовления полипептидов или белков. Подходящие способы синтеза полипептидов и белков de novo описаны в ссылках, таких как Chan et al., Fmoc Solid Phase Peptide Synthesis, Oxford University Press, Oxford, United Kingdom, 2000; Peptide and Protein Drug Analysis, ed. Reid, R., Marcel Dekker, Inc., 2000; Epitope Mapping, ed. Westwood et al., Oxford University Press, Oxford, United Kingdom, 2001; и в патенте США 5449752. Кроме того, полипептиды и белки могут быть рекомбинантно получены с использованием нуклеиновых кислот, описанных в данном документе, с помощью стандартных рекомбинантных способов. См., например, Sambrook et al., Molecular Cloning: A Laboratory Manual, 3rd ed., Cold Spring Harbor Press, Cold Spring Harbor, NY 2001; и Ausubel et al., Current Protocols in Molecular Biology, Greene Publishing Associates and John Wiley & Sons, NY, 1994. Кроме того, некоторые из CAR согласно изобретению (в том числе функциональные части и функциональные варианты) могут быть выделены и/или очищены из источника, такого как растение, бактерия, насекомое или млекопитающее, например, крыса, человек и т.д. Способы выделения и очистки хорошо известны в данной области. Альтернативно, CAR, описанные в данном документе, могут быть коммерчески синтезированы такими компаниями как Synpep (Дублин, Калифорния), Peptide Technologies Corp. (Гейтерсберг, Мэриленд) и Multiple Peptide Systems (Сан-Диего, Калифорния). В этой связи CAR согласно изобретению может быть синтетическим, рекомбинантным, выделенным и/или очищенным.
[0044] Воплощение данного изобретения также предусматривает антитело или его антигенсвязывающую часть, которая специфически связывается с эпитопом CAR согласно изобретению. Антитело может представлять собой любой тип иммуноглобулина, который известен в данной области. Например, антитело может быть любого изотипа, например, IgA, IgD, IgE, IgG, IgM и т.д. Антитело может быть моноклональным или поликлональным. Антитело может быть природным антителом, например, антителом, выделенным и/или очищенным из млекопитающего, например, мыши, кролика, козы, лошади, курицы, хомяка, человека и т.д. Альтернативно, антитело может быть генно-инженерным антителом, например, гуманизированным антителом или химерным антителом. Антитело может находиться в мономерной или полимерной форме. Кроме того, антитело может иметь любой уровень аффинности или авидности к функциональной части CAR согласно изобретению.
[0045] Способы анализа антител на способность связываться с какой-либо функциональной частью CAR согласно изобретению известны в данной области и включают любой анализ связывания "антиген-антитело", такой как, например, радиоиммуноанализ (RIA), ИФА (ELISA), вестерн-блот, иммунопреципитацию и анализы конкурентного ингибирования (см., например, Janeway et al., см. ниже, и публикацию патентной заявки США NO 2002/0197266 А1).
[0046] Подходящие способы получения антител хорошо известны в данной области. Например, стандартные гибридомные способы описаны в Kohler and Milstein, Eur. J. Immunol., 5, 511-519 (1976), Harlow and Lane (eds.), Antibodies: A Laboratory Manual, CSH Press (1988), и C.A. Janeway et al. (eds.), Immunobiology, 5th Ed., Garland Publishing, New York, NY (2001)). Альтернативно, в данной области известны и другие способы, такие как EBV-гибридомыные способы (Haskard and Archer, J. Immunol. Methods, 74(2), 361-67 (1984), и Roder et al., Methods Enzymol., 121, 140-67 (1986)), и экспрессионные системы на основе бактериофаговых векторов (см., например, Huse et al., Science, 246, 1275-81 (1989)). Кроме того, способы получения антител в животных описаны, например, в патентах США 5545806, 5569825 и 5714352, а также в заявке на патент США 2002/0197266 А1.
[0047] Кроме того, для создания антитела можно использовать фаговый дисплей. В связи с этим фаговые библиотеки, кодирующие антигенсвязывающие вариабельные (V) домены антител, могут быть получены с использованием стандартной молекулярной биологии и методик рекомбинантной ДНК (см., например, Sambrook et al., см. выше, и Ausubel et al., см. выше). Фаг, кодирующий вариабельную область с нужной специфичностью, выбирают по специфическому связыванию с нужным антигеном и восстанавливают полное или частичное антитело, содержащее выбранный вариабельный домен. Нуклеиновокислотные последовательности, кодирующие восстановленное антитело, вводят в подходящую клеточную линию, такую как клетка миеломы, используемая для получения гибридомы, так что клетка секретирует антитела с характеристиками моноклональных антител (см., например, Janeway et al., см. выше, Huse et al., см. выше, и патент США NO 6265150).
[0048] Антитела могут быть получены с помощью трансгенных мышей, которые являются трансгенными по специфическим генам тяжелой и легкой цепей иммуноглобулина. Такие способы известны в данной области и описаны, например, в патентах США 5545806 и 5569825, а также в Janeway et al., см. выше.
[0049] Способы получения гуманизированных антител хорошо известны в данной области и описаны подробно, например, Janeway et al., см. выше, патентах США 5225539, 5585089 и 5693761, европейском патенте NO 0239400 В1 и патенте Великобритании NO 2188638. Гуманизированные антитела также могут быть получены с использованием методики перекладки антитела, описанной в патенте США 5639641 и в Pedersen et al., J. Mol. Biol., 235, 959-973 (1994).
[0050] Воплощение изобретения также предусматривает антигенсвязывающие части любого из антител, описанных в данном документе. Антигенсвязывающая часть может быть любой частью, которая имеет по меньшей мере один антигенсвязывающий сайт, например Fab, F(ab')2, dsFv, sFv, димерные и тримерные антитела.
[0051] Одноцепочечный фрагмент вариабельной области (sFv), который представляет собой усеченный Fab-фрагмент, включающий вариабельный (V) домен тяжелой цепи антитела, связанный с V доменом легкой цепи антитела с помощью синтетического пептида, может быть получен с использованием обычных методик рекомбинантных ДНК (например, Janeway et al., см. выше). Аналогичным образом стабилизированные дисульфидным мостиком вариабельные фрагменты (dsFv) могут быть получены с помощью методики рекомбинантной ДНК (см., например, Reiter et al., Protein Engineering, 7, 697-704 (1994)). Тем не менее, фрагменты антител согласно изобретению не ограничиваются этими иллюстративными типами фрагментов антител.
[0052] Кроме того, антитело или его антигенсвязывающая часть могут быть изменены так, чтобы включать обнаруживаемую метку, такую как, например, радиоактивный изотоп, флуорофор (например, флуоресцеин изотиоцианат (FITC), фикоэритрин (РЕ)), фермент (например, щелочную фосфатазу, пероксидазу хрена) и элементарные частицы (например, частицы золота).
[0053] Воплощением данного изобретения также является нуклеиновая кислота, содержащая нуклеотидную последовательность, кодирующую любой из описанных в данном документе CAR (в том числе их функциональные части и функциональные варианты). Нуклеиновые кислоты согласно изобретению могут содержать нуклеотидную последовательность, кодирующую любую из лидерных последовательностей, антигенсвязывающих доменов, трансмембранных доменов и/или внутриклеточных доменов Т-клеточного сигналинга, описанных в данном документе.
[0054] Воплощение данного изобретения предусматривает нуклеиновую кислоту, содержащую нуклеотидную последовательность, кодирующую лидерную последовательность и антигенсвязывающий домен (включая вариабельную область легкой цепи и вариабельную область тяжелой цепи). В связи с этим нуклеиновая кислота может содержать, состоять из или по существу состоять из SEQ ID NO 25.
[0055] Нуклеиновые кислоты согласно изобретению могут содержать нуклеотидную последовательность, кодирующую любой из трансмембранных доменов и/или внутриклеточных доменов Т-клеточного сигналинга, описанных в данном документе. Воплощение данного изобретения предусматривает нуклеиновую кислоту, содержащую нуклеотидную последовательность, кодирующую трансмембранный домен, содержащий CD28, внутриклеточный домен Т-клеточного сигналинга, содержащий домен CD28, и внутриклеточный домен Т-клеточного сигналинга, содержащий CD3ζ. В связи с этим нуклеиновая кислота может содержать, состоять из или по существу состоять из SEQ ID NO 27. Другое воплощение изобретения предусматривает нуклеиновую кислоту, содержащую нуклеотидную последовательность, кодирующую трансмембранный домен, содержащий CD8, внутриклеточный домен Т-клеточного сигналинга, содержащий CD28, внутриклеточный домен Т-клеточного сигналинга, содержащий CD137, и внутриклеточный домен Т-клеточного сигналинга, содержащий CD3ζ. В связи с этим нуклеиновая кислота может содержать, состоять из или по существу состоять из SEQ ID NO 28. Еще одно воплощение изобретения предусматривает нуклеиновую кислоту, содержащую нуклеотидную последовательность, кодирующую трансмембранный домен, содержащий CD8, внутриклеточный домен Т-клеточного сигналинга, содержащий CD137, и внутриклеточный домен Т-клеточного сигналинга, содержащий CD3ζ. В связи с этим нуклеиновая кислота может содержать, состоять из или по существу состоять из SEQ ID NO 26.
[0056] В одном воплощении изобретения нуклеиновая кислота содержит нуклеотидную последовательность, которая кодирует лидерную последовательность, антигенсвязывающий домен (в том числе вариабельную область легкой цепи и вариабельную область тяжелой цепи), трансмембранный домен, включающий CD28, внутриклеточный домен Т-клеточного сигналинга, включающий CD28, и внутриклеточный домен Т-клеточного сигналинга, включающий CD3ζ. В связи с этим нуклеиновая кислота может включать, состоять из или по существу состоять из обеих SEQ ID NO 25 и 27.
[0057] В одном воплощении изобретения нуклеиновая кислота содержит нуклеотидную последовательность, которая кодирует лидерную последовательность, антигенсвязывающий домен (в том числе вариабельную область легкой цепи и вариабельную область тяжелой цепи), трансмембранный домен, включающий CD8, внутриклеточный домен Т-клеточного сигналинга, включающий CD28, внутриклеточный домен Т-клеточного сигналинга, включающий CD137, и внутриклеточный домен Т-клеточного сигналинга, включающий CD3ζ. В связи с этим нуклеиновая кислота может включать, состоять из или по существу состоять из обеих SEQ ID NO 25 и 28.
[0058] В одном воплощении нуклеиновая кислота содержит нуклеотидную последовательность, которая кодирует лидерную последовательность, антигенсвязывающий домен (в том числе вариабельную область легкой цепи и вариабельную область тяжелой цепи), трансмембранный домен, включающий CD8, внутриклеточный домен Т-клеточного сигналинга, включающий CD137, и внутриклеточный домен Т-клеточного сигналинга, включающий CD3ζ. В связи с этим нуклеиновая кислота может включать, состоять из или по существу состоять из обех SEQ ID NO 25 и 26.
[0059] Понятие "нуклеиновой кислоты", используемое в данном документе, включает "полинуклеотид", "олигонуклеотид" и "нуклеиновокислотную молекулу" и обычно означает полимер ДНК или РНК, который может быть одноцепочечным или двухцепочечным, синтезированным или полученным (например, выделенным и/или очищенным) из природных источников, который может содержать природные, неприродные или измененные нуклеотиды, и который может содержать природную, неприродную или измененную межнуклеотидную связь, например, фосфорамидатную связь или фосфоротиоатную связь, вместо фосфодиэфирной, находящейся между нуклеотидами немодифицированного олигонуклеотида. В некоторых воплощениях нуклеиновая кислота не содержит никаких вставок, делеций, инверсий и/или замен. Тем не менее, в некоторых случаях может быть подходящим, как описано в данном документе, чтобы нуклеиновая кислота включала одну или более чем одну вставку, делецию, инверсию и/или замену. В некоторых воплощениях нуклеиновая кислота может кодировать дополнительные аминокислотные последовательности, которые не влияют на функцию CAR и которые могут транслироваться или могут не транслироваться при экспрессии нуклеиновой кислоты в клетке-хозяине.
[0060] Нуклеиновые кислоты согласно воплощению изобретения могут быть рекомбинантными. Используемый в данном документе термин "рекомбинантный" относится к (i) молекулам, которые создаются вне живых клеток путем присоединения природных или синтетических нуклеиновокислотных сегментов к нуклеиновокислотным молекулам, которые могут реплицироваться в живой клетке, или к (ii) молекулам, которые являются результатом репликации таких молекул, которые описаны в (i) выше. В данном изобретении репликация может быть репликацией in vitro или репликацией in vivo.
[0061] Рекомбинантная нуклеиновая кислота может быть такой, которая имеет неприродную последовательность, или такой, которая имеет последовательность, изготовленную с помощью искусственного объединения двух сегментов последовательности, в противном случае разделенных. Это искусственное сочетание часто осуществляется путем химического синтеза или, чаще, путем искусственной манипуляции с выделенными сегментами нуклеиновых кислот, например, с помощью методик генной инженерии, таких как те, которые описаны в Sambrook et al., см. выше. Нуклеиновые кислоты могут быть сконструированы на основе химического синтеза и/или ферментативных реакций лигирования с использованием процедур, известных в данной области. См., например, Sambrook et al., см. выше, и Ausubel et al., см. выше. Например, нуклеиновая кислота может быть химически синтезирована с использованием природных нуклеотидов или различным образом модифицированных нуклеотидов, разработанных для повышения биологической стабильности молекул или для повышения физической стабильности дуплекса, формирующегося при гибридизации (например, фосфоротиоатные производные и акридин-замещенные нуклеотиды). Примеры модифицированных нуклеотидов, которые могут быть использованы для создания нуклеиновых кислот включают, но не ограничиваясь ими, 5-фторурацил, 5-бромурацил, 5-хлор