Способ получения клеток, экспрессирующих маркеры, характерные для панкреатических эндокринных клеток
Иллюстрации
Показать всеИзобретение относится к области клеточной биологии и биотехнологии, конкретно к способам получения клеток, экспрессирующих маркеры, характерные для панкреатических эндокринных клеток, включения экспрессии и индуцирования PDX1, NKX6.1 и HB9. Способы включают дифференцировку плюрипотентных клеток, полученных без разрушения эмбриона, плюрипотентных клеток неэмбрионального происхождения, линии эмбриональных стволовых клеток Н1, линии эмбриональных стволовых клеток Н7, линии эмбриональных стволовых клеток Н9, индуцибельных плюрипотентных клеток или перепрограммированных плюрипотентных клеток, или клеток дефинитивной энтодермы, полученных из них, в клетки, экспрессирующие маркеры, характерные для панкреатических клеток-предшественников передней кишки. Полученные клетки дифференцируют в клетки, экспрессирующие маркеры, характерные для панкреатических эндокринных клеток, путем обработки по меньшей мере ингибитором ALK5 и/или гормоном щитовидной железы, выбранным из трииодотиронина, тироксина, аналогов трииодотиронина, аналогов тироксина или их смеси, и культивируют в воздушно-жидкостной зоне взаимодействия. Изобретение позволяет повысить выход панкреатических эндокринных клеток. 4 н. и 48 з.п. ф-лы, 13 табл., 69 ил., 14 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка истребует приоритет, предоставляемый в связи с подачей Предварительной заявки на патент США №61/747662, поданной 31 декабря 2012 года, которая в полном объеме содержится в настоящем документе в виде ссылки.
ОБЛАСТЬ ПРИМЕНЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к области дифференцировки клеток. Более детально, настоящее изобретение представляет способы, клеточные культуры и среду для получения панкреатических энтодермальных, панкреатических эндокринных клеток-предшественников и одногормонных панкреатических эндокринных клеток из плюрипотентных стволовых клеток человека путем культивирования клеток в воздушно-жидкой зоне взаимодействия.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Последние достижения в области заместительной клеточной терапии для лечения сахарного диабета 1 типа и нехватка островков Лангерганса с возможностью трансплантации заставили обратить внимание на разработку источников инсулин-продуцирующих клеток, или бета-клеток, подходящих для приживления трансплантата. Один подход представляет собой получение функциональных бета-клеток из плюрипотентных стволовых клеток, таких как, например, эмбриональные стволовые клетки.
При эмбриональном развитии позвоночных плюрипотентные клетки дают начало группе клеток, содержащих три зародышевых листка (эктодерму, мезодерму и энтодерму), в ходе процесса, известного как гаструляция. Ткани, такие как ткань щитовидной железы, вилочковой железы, поджелудочной железы, кишечника и печени, будут развиваться из энтодермы через промежуточную стадию. Промежуточная стадия данного процесса представляет собой образование дефинитивной энтодермы.
К концу гаструляции энтодерма разделяется на передний и задний отделы, которые могут быть распознаны по экспрессии ряда факторов, однозначно выделяющих переднюю, среднюю и заднюю области энтодермы. Например, HHEX и SOX2 идентифицируют переднюю область, в то время как CDX1, 2 и 4 идентифицируют заднюю половину энтодермы.
Миграция ткани энтодермы приближает энтодерму к различным мезодермальным тканям, которые способствуют регионализации кишечной трубки. Это достигается за счет целого ряда секретируемых факторов, таких как FGFs, Wnts, TGF-Bs, ретиноевой кислоты (RA), лигандов BMP и их антагонистов. Например, FGF4 и BMP способствуют экспрессии CDX2 в предполагаемой энтодерме задней кишки и подавляют экспрессию передних генов Hhex и SOX2 (Development 2000 г., 127: 1563-1567). Было продемонстрировано, что сигнализация WNT также действует параллельно с сигнализацией FGF, способствуя развитию задней кишки и препятствуя зачаткам передней кишки (Development 2007 г., 134: 2207-2217). Наконец, ретиноевая кислота, секретируемая мезенхимой, регулирует границу между передней и задней кишкой (Curr Biol 2002 г., 12: 1215-1220).
Уровень экспрессии специфических факторов транскрипции может использоваться для определения типа ткани. Во время преобразования дефинитивной энтодермы в примитивную кишечную трубку кишечная трубка становится разделенной на широкие домены, которые можно наблюдать на молекулярном уровне с помощью ограниченных паттернов экспрессии генов. Например, регионализованный отдел поджелудочной железы в кишечной трубке демонстрирует очень высокую экспрессию PDX1 и очень низкую экспрессию CDX2 и SOX2. PDX1, NKX6.1, PTF1A и NKX2.2 высоко экспрессируются тканью поджелудочной железы; а экспрессия CDX2 высока в кишечной ткани.
Образование поджелудочной железы происходит при дифференцировании дефинитивной энтодермы в панкреатическую энтодерму. Дорсальный и вентральный домены поджелудочной железы формируются из эпителия передней кишки. Передняя кишка также дает начало формирования пищевода, трахеи, легких, щитовидной железы, желудка, печени, поджелудочной железы и системы желчных протоков.
Клетки панкреатической энтодермы экспрессируют панкреодуоденальный, содержащий гомеобокс ген PDX1. В отсутствие PDX1 поджелудочная железа не развивается дальше образования вентрального и дорсального зачатков. Следовательно, экспрессия PDX1 является важным этапом органогенеза поджелудочной железы. Зрелая поджелудочная железа содержит как экзокринную, так и эндокринную ткани, которые образуются при дифференцировании панкреатической энтодермы.
D'Amour et al. описывает производство обогащенных культур дефинитивной энтодермы, полученной из эмбриональных стволовых клеток человека в присутствии высокой концентрации активина и низкой концентрации сыворотки (Nature Biotechnology 2005 г., 23: 1534-1541; патент США №7704738). Трансплантация этих клеток под капсулу почки у мышей приводила к дифференцированию в более зрелые клетки с характеристиками ткани энтодермы (патент США №7704738). Клетки дефинитивной энтодермы, полученные из эмбриональных стволовых клеток человека, могут быть далее дифференцированы в PDX1-положительные клетки после добавления FGF10 и ретиноевой кислоты (заявка на патент США №2005/0266554). Последующая трансплантация таких клеток-предшественников панкреатических клеток в жировое тело иммунодефицитных мышей привела к образованию функциональных панкреатических эндокринных клеток с последующей 3-4-месячной стадией созревания (патент США №7993920 и патент США №7534608).
Fisk et al. сообщают о системе получения клеток панкреатических островков из эмбриональных стволовых клеток человека (патент США №7033831). В данном случае процесс дифференцирования был разделен на три стадии. Эмбриональные стволовые клетки человека сначала были дифференцированы в энтодерму при помощи комбинации бутирата натрия и активина A (патент США №7326572). Затем клетки культивировали с антагонистами BMP, такими как Noggin, в комбинации с EGF или бета-целлюлином для генерирования PDX1-положительных клеток. Конечное дифференцирование индуцировали никотинамидом.
Низкомолекулярные ингибиторы также применяли для индуцирования клеток-предшественников панкреатических эндокринных клеток. Например, низкомолекулярные ингибиторы рецептора TGF-β и рецепторов ВМР (Development 2011, 138: 861-871; Diabetes 2011, 60: 239-247) применялись для значительного увеличения количества эндокринных клеток поджелудочной железы. Кроме того, низкомолекулярные активаторы также применяли для генерирования клеток дефинитивной энтодермы или клеток-предшественников панкреатических клеток (Curr Opin Cell Biol 2009 г., 21: 727-732; Nature Chem Biol 2009, 5: 258-265).
НВ9 (также известный как HIXB9 и MNX1) является транскрипционным активаторным белком BHLH, экпрессируемым на ранней стадии развития поджелудочной железы, начинающейся приблизительно на 8 эмбриональный день. НВ9 также экспрессируется в нотохорде и спинном мозге. Экспрессия HB9 неравномерна и достигает пика примерно в день 10,5 в эпителии поджелудочной железы, будучи экспрессированной в клетках, экспрессирующих PDX1 и NKX6.1. Примерно в день 12,5 экспрессия HB9 снижается и на поздних стадиях ограничивается только β клетками. В гомозиготах мышей с нулевой мутацией HIXB9, дорсальная доля поджелудочной железы не развивается (Nat Genet 23: 67-70, 1999; Nat Genet 23: 71-75, 1999). HB9-/- бета-клетки экспрессируют низкие уровни глюкозного транспортера, GLUT2 и NKX6.1. Далее, HB9 -/- поджелудочной железы демонстрирует значительное снижение в количестве инсулин-положительных клеток в то же время, не оказывая значительного влияния на экспрессию прочих гормонов поджелудочной железы. Таким образом, временной контроль HB9 чрезвычайно важен для нормального развития и функционирования бета-клетки. В то время как немного известно о факторах, регулирующих экспрессию HB9 в бета-клетках, недавнее исследование на данио предполагает, что ретиноевая кислота может положительно регулировать экспрессию HB9 (Development, 138, 4597-4608, 2011).
Гормоны щитовидной железы, тироксин («T4») и трииодотиронин («Т3»), являются гормонами, основанными на тирозине, которые производятся щитовидной железой и первоначально отвечают за регулирование метаболизма. Основной формой гормонов щитовидной железы в крови является Т4, обладающий более длительным периодом полужизни, чем Т3. Соотношение Т4 и Т3, выделяемых в кровь, составляет точно 20 к 1. Т4 конвертируется в более активный Т3 (в три-четыре раза более мощный, чем Т4) внутри клеток с помощью деиодиназы.
Т3 прикрепляется к рецепторам гормонов щитовидной железы, TRα1 и TRβ1 (TR). TR является ядерным рецептором гормонов, который гетеродимеризуется с ретиноидным Х рецептором. Димеры связываются с отвечающими элементами щитовидной железы (TREs) в отсутствии лиганда и действуют как транскрипционные репрессоры. Прикрепление Т3 к TR понижает репрессию TRE-зависимых генов и стимулирует экспрессию различных целевых генов. В то время как многочисленные исследования предполагали, что роль Т3 состоит в увеличении пролиферации бета-клеток, снижении апоптоза и улучшении секреции инсулина, его роль в дифференцировке клеток не определена.
Трансформирующий фактор роста бета (TGF-β) относится к большому семейству плеотропных цитокинов, которые задействованы во многих биологических процессах, включая контроль роста, дифференцировку, миграцию, выживание клеток, фиброз и спецификацию процесса развития. Представители суперсемейства TGF-β передают сигнал посредством рецепторного комплекса, содержащего рецепторы типа I и типа II. Лиганды TGF-B (такие как активины и факторы дифференцировки роста(«GDF»)) связывают вместе рецептор типа II с рецептором типа I. Рецептор типа II фосфорилирует и активирует рецептор типа I в комплексе. Существует пять видов рецепторов типа II у млекопитающих: TβR-II, ActR-II, ActR-IIB, BMPR-II, и AMHR-II и семь рецепторов типа I (ALKs 1-7). Активин и родственные ему лиганды сигнализируют через комбинации ActR-II или ActR-IIB и ALK4 или ALK5, и BMP сигнализируют через комбинации ALK2, ALK3, и ALK6 с ActR-II, ActR-IIB, или BMPR-II. AMH сигнализирует через комплекс AMHR-II с ALK6, и лимфоузел, как выяснилось недавно, сигнализирует через комплекс ActR-IIB и ALK7 (Cell. 2003, 113(6): 685-700). После закрепления лиганда TGF-B на соответствующем рецепторе испускаемые сигналы передаются в ядро, первоначально через активацию комплексов Smad-белков. При активации рецепторы типа I фосфолирируют представителей рецептор-регулируемого подсемейства Smad-белков. Это активирует их и дает возможность формировать комплексы с обычными медиаторами Smad, Smad4. Smad 1, 5, и 8 являются субстратами для ALK 1, 2, 3, и 6, в то время как Smad 2 и 3 являются субстратами для ALK 4, 5, и 7 (FASEB J 13: 2105-2124). Активированные комплексы Smad аккумулируются в ядре, где они напрямую задействованы в транскрипции целевых генов, как правило, в ассоциации с другими специфическими ДНК-связывающими транскрипционными факторами. Составы, которые избирательно ингибируют рецепторы TGF-β, были разработаны для терапевтического применения и для изменения судьбы клетки в контексте репрограммирования и дифференцировки из различных популяций стволовых клеток. В частности, ингибиторы ALK5 ранее применялись для направления дифференцировки эмбриональных стволовых клеток к эндокринной судьбе (Diabetes, 2011, 60(1): 239-47).
В целом, процесс дифференцировки прогениторных клеток в функциональные бета-клетки проходит через различные стадии; и протоколы получения панкреатических клеток из прогениторных клеток, таких как плюрипотентные стволовые клетки человека, были в значительной степени улучшены. Несмотря на эти продвижения в расследованиях, каждый шаг в процессе дифференцировки прогениторных клеток является уникальной задачей. Таким образом, сохраняется необходимость в протоколе, который бы привел к получению функциональных эндокринных клеток и, в частности, функциональных бета-клеток.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
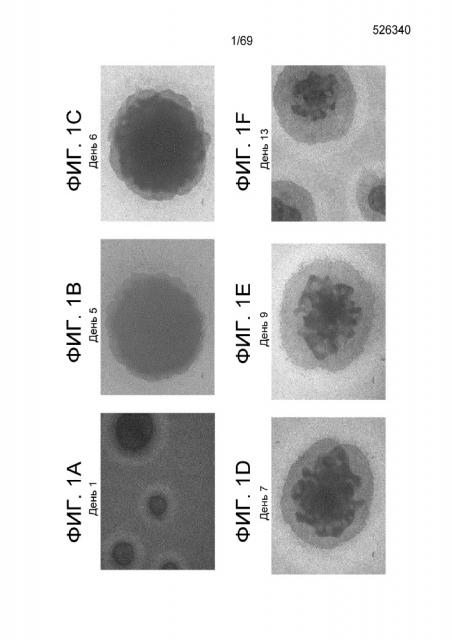
На Фиг. 1А-Н показаны фазовые контрастные образцы клеток, культивированных в воздушно-жидкостной зоне взаимодействия с применением способа, описанного в Примере 1 на следующих временных точках: День 1 (Фиг. 1A); день 5 (Фиг. 1B); день 6 (Фиг. 1C); день 7(Фиг. 1D); день 9 (Фиг. 1E); день 13 (Фиг. 1F); день 16 (Фиг. 1G); и день 21 (Фиг. 1H).
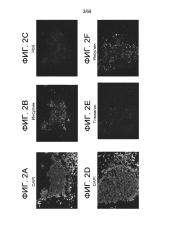
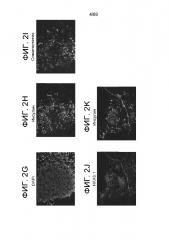
На Фиг. 2А-К показаны образы клеток, дифференцированных на протяжении одной недели в воздушно-жидкостной зоне взаимодействия с применением способов, описанных в примере 1 и иммуноокрашенных для следующего: DAPI (Фиг. 2A); инсулин (Фиг. 2B); HB9 (Фиг. 2С), DAPI (Фиг. 2D); глюкагон (Фиг. 2E); инсулин (Фиг. 2F); DAPI (Фиг. 2G); инсулин (Фиг. 2H); соматостатин (Фиг. 2I); NKX6.1 (Фиг. 2J); инсулин (Фиг. 2K). Панели A-C, D-F, G-I и J-K были взяты из того же поля.
На Фиг. 3А-Н показаны образы клеток, дифференцированных на протяжении двух недель в воздушно-жидкостной зоне взаимодействия с применением способов, описанных в примере 1 и иммуноокрашенных для следующего: инсулин (Фиг. 3А); глюкагон (Фиг. 3В); инсулин (Фиг. 3С); соматостатин (Фиг. 3D); инсулин (Фиг. 3Е); NKX6.1 (Фиг. 3F); НВ9 (Фиг. 3G); и NKX6.1 (Фиг. 2Н). Панели А-В, С-D, E-F и G-H были взяты из того же поля.
На Фиг. 4А-D показаны образы клеток, дифференцированных на протяжении трех недель в воздушно-жидкостной зоне взаимодействия с применением способов, описанных в примере 1 и иммуноокрашенных для инсулина (Фиг. 4А); глюкагона (Фиг. 4В); инсулина (Фиг. 4С) и соматостатина (Фиг. 4D). Панели А-В и С-D были взяты из того же поля.
На Фиг. 5А-R представлены данные анализов ПЦР в реальном времени по экспрессии следующих генов в клетках линии эмбриональных стволовых клеток человека H1, дифференцированных как описано в примере 1: PDX1 (Фиг. 5A); NKX6.1 (Фиг. 5B); PAX4 (Фиг. 5C); PAX6 (Фиг. 5D), NGN3 (Фиг. 5E); NKX2.2 (Фиг. 5F); ABCC8 (Фиг. 5G); хромогранин-А (Фиг. 5H); PCSK1 (Фиг. 5I); IAPP (Фиг. 5J); инсулин (Фиг. 5К); глюкагон (Фиг. 5L); соматостатин (Фиг. 5М); грелин (Фиг. 5N); PTFIA (Фиг. 5О); ZIC1 (Фиг. 5Р); CDX2 (Фиг. 5Q) и SOX9 (Фиг. 5R). Клетки культивировались в воздушно-жидкостной зоне взаимодействия после стадии 5.
На Фиг. 6А-L представлены данные анализов ПЦР в реальном времени по экспрессии следующих генов в клетках линии эмбриональных стволовых клеток человека H1, дифференцированных как описано в примере 2: PDX1 (Фиг. 6A); NKX6.1 (Фиг. 6B); PAX4 (Фиг. 6C); PAX6 (Фиг. 6D), NGN3 (Фиг. 6E); NKX2.2 (Фиг. 6F); ABCC8 (Фиг. 6G); хромогранин-А (Фиг. 6Н); PCSK1 (Фиг. 6I); IAPP (Фиг. 6J); инсулин (Фиг. 6) и глюкагон (Фиг. 6L).
На Фиг. 7А-L представлены данные анализов ПЦР в реальном времени по экспрессии следующих генов в клетках линии эмбриональных стволовых клеток человека H1, дифференцированных как описано в примере 3: PDX1 (Фиг. 7А); NKX6.1 (Фиг. 7В); PAX4 (Фиг. 7C); PAX6 (Фиг. 7D), NGN3 (Фиг. 7E); NKX2.2 (Фиг. 7F); ABCC8 (Фиг. 7G); хромогранин-А (Фиг. 7Н); PCSK1 (Фиг. 7I); IAPP (Фиг. 7J); инсулин (Фиг. 7K) и глюкагон (Фиг. 7L).
На Фиг. 8А-H представлены данные анализов ПЦР в реальном времени по экспрессии следующих генов в клетках линии эмбриональных стволовых клеток человека H1, дифференцированных как описано в примере 4: PDX1 (Фиг. 8A); NKX6.1 (Фиг. 8B); NGN3 (Фиг. 8C); ABCC8 (Фиг. 8D); PCSK1 (Фиг. 8E); грелин (Фиг. 8F); глюкагон (Фиг. 8G); и инсулин (Фиг. 8Н).
На Фиг. 9А-F представлены данные анализов ПЦР в реальном времени по экспрессии следующих генов в клетках линии эмбриональных стволовых клеток человека H1, дифференцированных как описано в примере 4: PDX1 (Фиг. 9А); NKX6.1 (Фиг. 9B); NGN3 (Фиг. 9C); ABCC8 (Фиг. 9D); глюкагон (Фиг. 9E); и инсулин (Фиг. 9F).
На Фиг. 10А-В описаны результаты иммуноокрашивания клеток стадии 6, культивированных в воздушно-жидкостной зоне взаимодействия в соответствии с примером 4 и обработанных либо 1 микромолярным SD208 ингибитором (Фиг. 10А), либо 1 микромолярным ALK5 ингибитором II (Фиг. 10В) и окрашенным для хромогранина-А (пан-эндокринный маркер) и NKX6.1 (панкреатический прекурсорный маркер и специфический маркер бета-клеток).
На Фиг. 11А-Н представлены данные анализов ПЦР в реальном времени по экспрессии следующих генов в клетках линии эмбриональных стволовых клеток человека Н1, дифференцированных как описано в примере 6: ABCC8 (Фиг. 11A), глюкагон (Фиг. 11B), амилин (Фиг. 11C), инсулин (Фиг. 11D), NGN3 (Фиг. 11Е), NKX2.2 (Фиг. 11F), NKX6.1 (Фиг. 11G) и PDX1 (Фиг. 11H). Данные представлены как кратное возрастание по сравнению с недифференцированной линией Н1.
На Фиг. 12А-Н представлены данные анализов ПЦР в реальном времени по экспрессии следующих генов в клетках линии эмбриональных стволовых клеток человека H1, дифференцированных как описано в примере 7 и культивированных в ВЖЗВ: ABCC8 (Фиг. 12A), глюкагон (Фиг. 12B), амилин (Фиг. 12C), инсулин (Фиг. 12D), NGN3 (Фиг. 12Е), NKX2.2 (Фиг. 12F), NKX6.1 (Фиг. 12G) и PDX1 (Фиг. 12H).
На Фиг. 13А-Н представлены данные анализов ПЦР в реальном времени по экспрессии следующих генов в клетках линии эмбриональных стволовых клеток человека H1, дифференцированных как описано в примере 8 и культивированных в ВЖЗВ: ABCC8 (Фиг. 13A), глюкагон (Фиг. 13B), амилин (Фиг. 13C), инсулин (Фиг. 13D), NGN3 (Фиг. 13Е), NKX2.2 (Фиг. 13F), NKX6.1 (Фиг. 13G) и PDX1 (Фиг. 13H).
На Фиг. 14А-Н представлены данные анализов ПЦР в реальном времени по экспрессии следующих генов в клетках линии эмбриональных стволовых клеток человека H1, дифференцированных как описано в примере 9 и культивированных в ВЖЗВ: ABCC8 (Фиг. 14A), глюкагон (Фиг. 14B), амилин (Фиг. 14C), инсулин (Фиг. 14D), ISL-1 (Фиг. 14Е), MNX1 (Фиг. 14F), NKX6.1 (Фиг. 14G) и SLC30A8 (Фиг. 14H).
На Фиг. 15А-J показаны профили FACS клеток стадии 5 день 3, дифференцированных как описано в примере 10 и окрашенных для следующего: Изотипический контроль (Фиг. 15А); NKX6.1 (Фиг. 15В); NKX2.2 (Фиг. 15С); NKX6.1 (ось Y) со-окрашенный с инсулином (ось Х) (Фиг. 15D); PDX1 (ось Х) со-окрашенный с KI-67 (ось Y) (Фиг. 15Е); PAX6 (Фиг. 15F); ISL-1 (Фиг. 15G); FOXA2 (Фиг. 15Н); NeuroD (Фиг. 15I) и глюкагон (ось Y) со-окрашенный с инсулином (ось Х) (Фиг. 15J).
На фиг. 16А-I показаны профили FACS клеток стадии 6 день 5, дифференцированных как описано в примере 10 и окрашенных для: Изотипический контроль (Фиг. 16А); NKX6.1 (ось Y) со-окрашенный с хромогранином-А (ось Х) (Фиг. 16В); NKX2.2 (ось Y) со-окрашенный с хромогранином-А (ось Х) (Фиг. 16С); NKX6.1 (ось Y) со-окрашенный с инсулином (ось Х) (Фиг. 16D); PDX1 (ось Х) со-окрашенный с KI-67 (ось Y) (Фиг. 16Е); PAX6 (Фиг. 16F); ISL-1 (Фиг. 16G); FOXA2 (Фиг. 16Н) и NeuroD (Фиг. 16I).
На Фиг. 17А-I показаны профили FACS (сортировка флуоресцентно-активированных клеток) клеток стадии 6 день 15, дифференцированных как описано в примере 10 и окрашенных для: Изотипический контроль (Фиг. 17А); NKX6.1 (ось Y) со-окрашенный с хромогранином-А (ось Х) (Фиг. 17В); NKX2.2 (ось Y) со-окрашенный с хромогранином-А (ось Х) (Фиг. 17С); глюкагон (ось Y) со-окрашенный с инсулином (ось Х) (Фиг. 17D); NKX6.1 (ось Y) со-окрашенный с инсулином (ось Х) (Фиг. 17Е); PDX1 (ось Х) со-окрашенный с KI-67 (ось Y) (Фиг. 17F); ISL-1 (Фиг. 17G); FOXA2 (Фиг. 17Н) и NeuroD (Фиг. 17I).
На Фиг. 18А-С показаны профили FACS (сортировка флуоресцентно-активированных клеток) клеток стадии 4 день 4, дифференцированных как описано в примере 1 и окрашенных для: NKX6.1 (ось Y) со-окрашенный с хромогранином-А (ось Х) (Фиг. 18А); PDX1 (ось Х) со-окрашенный с KI-67 (ось Y) (Фиг. 18В); и NKX6.1 (ось Y) со-окрашенный с инсулином (ось Х) (Фиг. 18С).
На Фиг. 19А-С показаны профили FACS (сортировка флуоресцентно-активированных клеток) клеток стадии 6 день 6, дифференцированных как описано в примере 11 и окрашенных для: NKX6.1 (ось Y) со-окрашенный с хромогранином-А (ось Х) (Фиг. 19А); PDX1 (ось Х) со-окрашенный с KI-67 (ось Y) (Фиг. 19В); и NKX6.1 (ось Y) со-окрашенный с инсулином (ось Х) (Фиг. 19С).
Фиг. 20 показывает кинетику производства человеческого С-пептида в условиях in vivo в NOD-SCID мыши, куда трансплантированы различные популяции клеток, как описано в примере 11.
На Фиг. 21А -F представлены данные анализов ПЦР в реальном времени по экспрессии следующих генов в клетках линии эмбриональных стволовых клеток человека H1, дифференцированных как описано в примере 12: Амилин (Фиг. 21А); инсулин (Фиг. 21В), MAFA (Фиг. 21C), NKX6.1 (Фиг. 21D), PTF1a (Фиг. 21E) и SOX9 (Фиг. 21F).
На Фиг. 22А-D представлены данные анализов ПЦР в реальном времени по экспрессии следующих генов в клетках линии эмбриональных стволовых клеток человека Н1, дифференцированных как описано в примере 13: MAFA (Фиг. 22А); инсулин (Фиг. 22В); Амилин (Фиг. 22С) и NKX6.1 (Фиг. 22D).
На Фиг. 23А-F представлены данные анализов ПЦР в реальном времени по экспрессии следующих генов в клетках линии эмбриональных стволовых клеток человека H1, дифференцированных как описано в примере 5: PDX1 (Фиг. 23А); NKX6.1 (Фиг. 23B); NGN3 (Фиг. 23C); ABCC8 (Фиг. 23D); глюкагон (Фиг. 23E); и инсулин (Фиг. 23F).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Приведенное ниже подробное описание настоящего изобретения, будет более понятно при изучении вместе с приложенными рисунками. Рисунки предоставлены с целью иллюстрации определенных вариантов осуществления настоящего изобретения. Однако настоящее изобретение не ограничивается только приведенными точными конструкциями, примерами и устройствами. Для четкости описания, а не для ограничения настоящего изобретения, подробное описание настоящего изобретения разделено на подразделы, описывающие или иллюстрирующие определенные особенности, варианты осуществления или области применения настоящего изобретения.
Настоящее изобретение направлено на дифференцировку энтодермальных прогениторных клеток, таких как плюрипотентные стволовые клетки, в клетки, демонстрирующие характеристики панкреатических эндокринных клеток путем культивирования упомянутых прогениторных клеток, по меньшей мере частично, в воздушно-жидкостной зоне взаимодействия, которая существует в открытом культуральном сосуде или культуральном сосуде, частично заполненном субстратом. Хотя термин «воздух» применяется здесь для удобства, изобретение не ограничено смесью газов и составляющих, находящихся в нормальной окружающей среде. Изобретение детально рассматривает и включает газообразные смеси, обладающие составом, отличным от нормальной окружающей среды, включая, например, смеси, обогащенные определенным компонентом или в которых содержание определенного компонента понижено или исключено.
Дополнительно, настоящее изобретение представляет клеточные культуры для дифференцировки плюрипотентных стволовых клеток в клетки, демонстрирующие характеристики панкреатических эндокринных клеток, так же как и дифференцировочную среду, которая инициирует и упрощает подобную дифференцировку. Преимуществом является то, что эти клеточные культуры и дифференцировочная среда могут применяться в сочетании с дифференцировкой в воздушно-жидкостной зоне взаимодействия для обеспечения не полученных ранее урожаев клеток, экспрессирующих маркеры, характерные для панкреатических эндокринных клеток.
Культивирование в воздушно-жидкостной зоне взаимодействия может производиться на всех стадиях, задействованных в дифференцировке от плюрипотентных стволовых клеток до панкреатических эндокринных клеток, или может включать культивирование планарной культуры, погруженной в субстрат на ранних стадиях дифференцировки, и культивирование в воздушно-жидкостной зоне взаимодействия во время поздних стадий дифференцировки. В предпочтительном варианте процесс изобретения включает комбинацию культивирования плюрипотентных стволовых клеток на поддерживающей поверхности, погруженной в среду, на ранних стадиях, и затем культивирование в воздушно-жидкостной среде на поздних стадиях дифференцировки. В таких вариантах осуществления клетки могут быть первоначально посеяны на твердую поверхность для погруженного культивирования, а затем удалены с твердой поверхности и пересеяны на пористую поверхность для культивирования в воздушно-жидкостной зоне взаимодействия. Альтернативно, клетки могут быть изначально посеяны на пористую поддерживающую поверхность, которая затем погружается в субстрат, на ранних стадиях дифференцировки и затем перемещены в воздушно-жидкостную зону взаимодействия на поздних стадиях дифференцировки. Культивирования в воздушно-жидкостной зоне взаимодействия на поздних стадиях дифференцировки в значительной степени улучшает экспрессию эндокринных маркеров по сравнению с культивированием клеток в погруженном состоянии на протяжении всего процесса, указывая, что больший процент клеток был дифференцирован в панкреатические эндокринные клетки.
В одном из вариантов осуществления настоящее изобретение направлено на дифференцировку энтодермальных прогениторных клеток в воздушно-жидкостной зоне взаимодействия культурального сосуда, частично заполненного субстратом, в панкреатические энтодермальные клетки, положительные для NKX6.1, PDX1, и НВ9. Это изобретение частично основано на открытии того, что культивирование в воздушно-жидкостной зоне взаимодействия значительно улучшает экспрессию эндокринных маркеров. Более того, было открыто, что панкреатические эндокринные клетки-предшественники могут быть быстро получены в воздушно-жидкостной зоне взаимодействия, что приводит к получению предоминантных одногормонных инсулин-положительных клеток. Было обнаружено, что одноклеточный посев в воздушно-жидкостной зоне взаимодействия улучшает консистенцию производства инсулина.
Определения
Стволовые клетки представляют собой недифференцированные клетки, определяемые как обладающие способностью на одноклеточном уровне к самообновлению и дифференциации. Стволовые клетки могут производить клетки-потомки, включая самообновляющиеся прогениторные клетки, необновляющиеся прогениторные клетки и окончательно дифференцированные клетки. Стволовые клетки также характеризуются своей способностью дифференцироваться in vitro в функциональные клетки различных линий дифференцирования из множества зародышевых листков (энтодермы, мезодермы и эктодермы). Стволовые клетки также дают начало тканям множества зародышевых листков после трансплантации и вносят значительный вклад в образование большинства, если не всех тканей после инъекции в бластоцисты.
Стволовые клетки классифицируются по потенциалу развития. Плюрипотентные клетки способны преобразовываться во все виды эмбриональных клеток.
Дифференцировка представляет собой процесс, посредством которого неспециализированная («некоммитированная») или менее специализированная клетка приобретает свойства специализированной клетки, например нервной клетки или мышечной клетки. Дифференцированная клетка представляет собой клетку, занявшую более специализированное («коммитированное») положение в линии дифференцировки клетки. Термин «коммитированная» применительно к процессу дифференцирования относится к клетке, дошедшей в ходе процесса дифференцирования до стадии, с которой в нормальных условиях она продолжит дифференцироваться до конкретного типа клеток или подмножества типов клеток и не сможет в нормальных условиях дифференцироваться в иной тип клеток или вернуться к менее дифференцированному типу. «Дедифференцировка» обозначает процесс, в ходе которого клетка возвращается к менее специализированной (или коммитированной) позиции в клеточной линии дифференцировки. Применяемый в настоящем документе термин «клеточная линия дифференцировки» означает наследственность клетки, т.е. из каких клеток произошла данная клетка и каким клеткам она может дать начало. В клеточной линии дифференцировки клетка помещается в наследственную схему развития и дифференцировки. Маркер, специфичный для линии дифференцирования, относится к характеристике, специфически ассоциированной с фенотипом клеток интересующей линии дифференцирования, и его можно использовать для оценки дифференцирования некоммитированной клетки в клетки интересующей линии дифференцирования.
В настоящем документе термин «маркеры» означает молекулы нуклеиновых кислот или полипептидов с дифференциальной экспрессией в исследуемых клетках. В данном контексте под дифференциальной экспрессией понимают повышенный уровень положительного маркера и пониженный уровень отрицательного маркера по сравнению с недифференцированной клеткой. Обнаруживаемый уровень маркерной нуклеиновой кислоты или полипептида в интересующих клетках оказывается значительно выше или ниже по сравнению с другими клетками, что позволяет идентифицировать интересующую клетку и отличить ее от других клеток с помощью любого из множества способов, известных в данной области.
В настоящем документе клетка «положительна по» заданному маркеру или «положительна», если заданный маркер явно обнаруживается в клетке. Аналогично клетка «отрицательна по» заданному маркеру или «отрицательна», если заданный маркер не обнаруживают в клетке. В частности, положительность по FACS как правило выше, чем 2%, в то время как отрицательный предел по FACS, как правило, менее 1%. Положительность по ПЦР, как правило, менее 34 циклов (Cts): в то время как отрицательность по ПЦР, как правило, более 34,5 циклов.
В попытках воспроизвести дифференцировку плюрипотентных стволовых клеток в функциональные клетки энтодермы поджелудочной железы в статичных клеточных культурах в условиях in vitro, процесс дифференцировки часто рассматривается как прогрессирование через несколько последовательных стадий. В частности, процесс дифференцировки в целом рассматривается как прогрессирование через шесть стадий. В этой постадийной прогрессии «стадия 1» относится к первому шагу в процессе дифференцировки, дифференцировке плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для клеток дефинитивной энтодермы (здесь и далее упоминаются как «клетки стадии 1»). «Стадия 2» относится ко второму шагу, дифференцировке клеток, экспрессирующих маркеры, характерные для клеток дефинитивной энтодермы, в клетки, экспрессирующие маркеры, характерные для клеток кишечной трубки (здесь и далее упоминаются как «клетки стадии 2»). «Стадия 3» относится к третьему шагу, дифференцировке клеток, экспрессирующих маркеры, характерные для клеток кишечной трубки, в клетки, экспрессирующие маркеры, характерные для клеток энтодермы передней кишки (здесь и далее упоминаются как «клетки стадии 3»). «Стадия 4» относится к четвертому шагу, дифференцировке клеток, экспрессирующих маркеры, характерные для клеток энтодермы передней кишки кишечной трубки, в клетки, экспрессирующие маркеры, характерные для клеток-предшественников панкреатической передней кишки (здесь и далее упоминаются как «клетки стадии 4»). «Стадия 5» относится к пятому шагу, дифференцировке клеток, экспрессирующих маркеры, характерные для клеток-предшественников панкреатической передней кишки, в клетки, экспрессирующие маркеры, характерные для панкреатических энтодермальных клеток и/или панкреатических эндокринных клеток-предшественников (здесь и далее упоминаются как «панкреатические энтодермальные клетки/эндокринные клетки-предшественники» или альтернативно как «клетки стадии 5»). «Стадия 6» относится к дифференцировке клеток, экспрессирующих маркеры, характерные для панкреатических энтодермальных клеток и/или эндокринных панкреатических клеток-предшественников, в клетки, экспрессирующие маркеры, характерные для панкреатических эндокринных клеток (здесь и далее упоминаются как «клетки стадии 6»).
Однако следует отметить, что не все клетки в отдельно взятой популяции прогрессируют через эти стадии с одинаковой скоростью. Вследствие этого, в клеточных культурах в условиях in vitro нередко обнаруживается присутствие клеток, которые прогрессировали менее или более по пути дифференцировки, чем большинство клеток, присутствующих в популяции, в особенности на поздних стадиях дифференцировки. Например, нередко наблюдается появление маркеров, характерных для панкреатических энтодермальных клеток, во время стадии 5 культивирования клеток. Для иллюстративных нужд настоящего изобретения характеристики различных типов клеток ассоциированы с определенными выше стадиями, как описано в настоящем документе.
«Клетки дефинитивной энтодермы», как используется в настоящем документе, относится к клеткам, которые несут в себе характеристики клеток, появившиеся из эпибласта во время гаструляции, и которые формируют желудочно-кишечный тракт и его производные. Клетки дефинитивной энтодермы экспрессируют по меньшей мере один из следующих маркеров: FOXA2 (также известный как гепатоцитный ядерный фактор 3-β (HNF3β)), GATA4, SOX17, CXCR4, брахиурия, Cerberus, OTX2, goosecoid, C-Kit, CD99, и MIXL1. Маркерные характеристики клеток дефинитивной энтодермы включают CXCR4, FOXA2 и SOX17. Таким образом, клетки дефинитивной энтодермы могут быть охарактеризованы их экспрессией CXCR4, FOXA2 и SOX17. Дополнительно, в зависимости от длительности времени, на протяжении которого клеткам позволяется оставаться на стадии 1, можно наблюдать рост в HNF4α.
«Клетки кишечной трубки», как используется в данном документе, относится к клеткам, произошедшим от дефинитивной энтодермы, которые могут дать начало всем энтодермальным органам, таким как легкие, печень, поджелудочная железа, желудок и кишечник. Клетки кишечной трубки могут быть охарактеризованы их постоянно растущей экспрессией HNF4α, выше, чем экспрессия клеток дефинитивной энтодермы. Например, рост экспрессии HNF4α в мРНК в десять-сорок раз можно наблюдать на стадии 2.
«Энтодерма передней кишки», как используется в данном документе, относится к клеткам энтодермы, которые дают начало пищеводу, легким, желудку, печени, поджелудочной железе, желчному пузырю и части двенадцатиперстной кишки. Клетки энтодермы передней кишки экспрессируют по меньшей мере один из следующих маркеров: PDX1, FOXA2, CDX2, SOX2 и HNF4α. Клетки энтодермы передней кишки могут быть охарактеризованы ростом экспресии PDX1 по сравнению с клетками кишечной трубки. Например, более пятидесяти процентов клеток в культурах стадии 3 типично экспрессируют PDX1.
«Клетка-предшественник панкреатической передней кишки», как используется в данном документе, относится к клеткам, экспрессирующим по меньшей мере один из следующих маркеров: PDX1, NKX6.1, HNF6, NGN3, SOX9, PAX4, PAX6, ISL1, гастрин, FOXA2, PTF1a, PROX1 и HNF4α. Клетки-предшественники панкреатической передней кишки поджелудочной железы можно охарактеризовать как положительные по отношению к экспрессии PDX1, NKX6.1 и SOX9.
Используемый в настоящей заявке термин, «панкреатическая энтодермальная клетка» относится к клеткам, экспрессирующим по меньшей мере один из следующих маркеров: PDX1, NKX6.1, HNF1 β, PTF1 α, HNF6, HNF4 α, SOX9, NGN3; гастрин; HB9, или PROX1. Панкреатические энтодермальные клетки могут характеризоваться отсутствием у них значительной экспрессии CDX2 или SOX2.
«Панкреатическая эндокринная клетка-предшественник», как используется в настоящем документе, относится к клеткам энтодермы поджелудочной железы, обладающим возможностью стать клеткой, экспрессирующей гормон поджелудочной железы. Панкреатические эндокринные клетки-предшественники экспрессируют по меньшей мере один из следующих маркеров: NGN3, NKX2.2, NeuroD1, ISL1, PAX4, PAX6 или ARX. Панкреатические эндокринные клетки-предшественники могут быть охарактеризованы их экспрессией NKX2.2 и NeuroD1.
Используемый в настоящей заявке термин «панкреатическая эндокринная клетка» относится к клеткам, способным к секреции по меньшей мере одного из следующих гормонов: инсулин, глюкагон, соматостатин или панкреатический полипептид. В дополнение к этим гормонам, маркерные характеристики панкреатических эндокринных клеток включают один или несколько из NGN3, NeuroD1, ISL1, PDX1, NKX6.1, PAX4, ARX, NKX2.2, и PAX6. Панкреатические эндокринные клетки, экспрессирующие маркеры бета-клеток, могут характеризоваться их экспрессией инсулина и по меньшей мере одного из следующих транскрипционных факторов: PDX1, NKX2.2, NKX6.1, NeuroD1, ISL1, HNF3β, MAFA и PAX6.
В настоящем документе используются попеременно «д1», «1д», и «день1», «д2», «2д», и «день 2» и так далее. Эти комбинации цифр и букв относятся к конкретному дню инкубации на различных стадиях в процессе поэтапного протокола дифференцировки настоящей заявки.
В настоящем документе термин «глюкоза» применяют относительно декстрозы, сахару, обычно встречающемуся в природе.
В настоящем документе термин «NeuroD1» применяют для обозначения белка, экспрессируемого в прогениторных клетках панкреатических эндокринных клеток, и гена, кодирующего его.
«LDN-193189» относится к ((6-(4-(2-(пиперидин-1-ил)этокси)фенил)-3-(пиридин-4-ил)пиразоло[1,5-a]пиримидин, гидрохлорид; DM-3189)), ингибитору рецептора BMP, доступному по торговой маркой STEMOLECULE™ от Stemgent, Inc., Cambridge, MA, USA.
Характеристики, источник, размножение и культивирование плюрипотентных стволовых клеток
А. Характеристики плюрипотентных стволовых клеток
Плюрипотентные стволовые клетки могут экспрессировать одно или несколько определенных TRA-1-60 и TRA-1-81 антител (Thomson et al. 1998, Science 282:1145-1147). Дифференцирование плюрипотентных стволовых клеток in vitro приводит к потере экспрессии TRA-1-60 и TRA-1-81. Недифференцированные плюрипотентные стволовые клетки, как правило, имеют щелочнофосфатазную активность, которую можно обнаружить путем обработки клеток 4%-м раствором параформальдегида, а затем выращивая с щелочнофосфатазным набором субстратов, который продается под торговой маркой VECTOR® Red, как описано производителем (Vector Laboratories, штат Калифорния, США). Недифференцированные плюрипотентные стволовые клетки также, как правило, экспрессир