Человеческие антитела к fel d1 и способы их применения
Иллюстрации
Показать всеНастоящее изобретение относится к области биохимии, а именно к антителу, которое связывается с кошачьим аллергеном, Fel d1, композициям, содержащим указанное антитело, нуклеиновой кислоте, его кодирующей, а также к способу применения указанного антитела. Антитела по настоящему изобретению также могут быть пригодны для диагностических целей, для определения, имеет ли больной аллергию на кошачий аллерген Fel d1. Изобретение позволяет предупреждать высвобождение гистамина или других медиаторов воспаления из тучных клеток или базофилов, таким образом предупреждая или ослабляя нежелательные эффекты, наблюдаемые у больных, сенсибилизированных к кошачьему аллергену. 18 н. и 36 з.п. ф-лы, 20 табл., 9 пр.
Реферат
Область техники, к которой относится настоящее изобретение
Настоящее изобретение относится к человеческим антителам и к антигенсвязывающим фрагментам человеческих антител, которые специфично связываются с кошачьим аллергеном Fel d1, к терапевтическим композициям, содержащим антитела, и способам применения таких антител.
Предшествующий уровень техники настоящего изобретения
Белок Fel d1 представляет собой секретируемый кошачий белок, который принадлежит к семейству секретоглобинов - небольших, связанных дисульфидными мостиками гетеродимерных белков, встречающихся только у млекопитающих (Klug, J. et al. (2000), Ann. N.Y. Acad. Sci. 923:348-354). Он является основной причиной аллергии на кошек у людей (Platts-Mills, Т.А., et al. (1997), J. Allergy Clin. Immunol. 100:S2-S24). Приблизительно у 90-95% больных аллергией на кошек наблюдают реакцию с выработкой IgE на белок Fel d1 (van Ree, et al. (1999), J. Allergy Clin. Immunol. 104:1223-1230). Симптомы у больного, который испытывает аллергическую реакцию на Fel d1, могут варьировать от слабого ринита и конъюнктивита до опасных для жизни астматический реакций. Fel d1 вырабатывается сальными железами, и ороговевающим эпителиальным слоем желез, и клетками плоского эпителия и переносится на шкуру при вылизывании и уходом за шерстью (Bartholome, К. et al. (1985), J. Allergy Clin. Immunol. 76:503-506; Charpin, С. et al. (1991), J. Allergy Clin. Immunol. 88:77-82; Dabrowski, A.J. (1990), et al. J. Allergy Clin. Immunol. 86:462-465). Он также присутствует в слюнных, околоанальных и слезных железах (Andersen, М.С., et al. (1985), J. Allergy Clin. Immunol. 76:563-569; van Milligen, F.J. (1992), et al., Int. Arch. Allergy Appl. Immunol. 92(4):375-378), а основными резервуарами, по видимому, являются шкура и шерсть (Mata, P. et al. (1992), Ann. Allergy 69(4):321-322).
Природный Fel d1 представляет собой гетеродимерный гликопротеин с массой примерно 18 кДа. Каждый гетеродимер содержит две полипептидные цепи, которые ковалентно связаны тремя внутрицепочечными связями и кодируются двумя отдельными генами (Duffort, OA, et al., (1991), Mol. Immunol. 28:301-309; Morgenstern, JP, et al., (1991), PNAS 88:9690-9694; Griffith, I.J., et al. (1992), Gene 113:263-268; Kristensen, A.K. et al. (1997), Biol. Chem. 378:899-908). Цепь 1 содержит 70 аминокислотных остатков, а цепь 2 содержит приблизительно 90-92 аминокислотных остатка. Структурно две цепи похожи, но характеризуются лишь 10-15% идентичности последовательностей (Kaiser, L. et al. (2003) J. Biol. Chem. 278(39):37730-37735). Хотя иногда отдельно каждую цепь называют Fel d1, для полного белка аллергена необходимы обе цепи.
Белок Fel d1 имеет неизвестную функцию у животных, но вызывает реакцию с выработкой IgG или IgE у восприимчивых людей (в виде либо аллергической, либо астматической реакции). Несмотря на то, что известны другие аллергены, в том числе Fel d2 (альбумин) и Fel d3 (цистатин), от 60% до 90% вырабатываемого IgE к кошачьим аллергенам направлено к Fel d1 (Leitermann, K. et al., (1984), J Allergy Clin. Immunol. 74:147-153; Lowenstein, H. et al., (1985), Allergy 40:430-441; van Ree, R. et al., (1999), J. Allergy Clin. Immunol. 104:1223-1230; Ichikawa, K. et al., (2011), Clin. Exp. Allergy, 31:1279-1286).
Иммуноглобулин Ε (IgE) ответственен за гиперчувствительность 1 типа, которая обнаруживается при аллергических ринитах, аллергических конъюнктивитах, сенной лихорадке, аллергической астме, аллергии на пчелиный яд и аллергиях на продукты питания. IgE циркулирует в крови и связывается с высокоаффинными рецепторами FcεR1α к IgE на базофилах и тучных клетках. При большинстве аллергических реакций аллергены попадают в организм посредством вдыхания, приема внутрь или через кожу. Затем аллерген связывается с преформированным IgE, уже связавшимся с высокоаффинным рецептором на поверхностях тучных клеток и базофилов, что в результате приводит к сшиванию нескольких молекул IgE и запуску высвобождения гистамина и других медиаторов воспаления, обуславливая появление различных аллергических симптомов.
Лечение аллергий предусматривает стероиды для подавления иммунной активности и бронхиальные дилататоры для ослабления симптомов астмы. Также для некоторых больных с тяжелой формой аллергии применяют гипосенсибилизирующую терапию. Комбинации пептидных вакцин были протестированы в отношении гипосенсибилизации индивидуумов к конкретным аллергенам, например, Fel d1 (см. US 2010/0239599 A1 и ЕР 2380591 А2). В качестве средств для лечения аллергий были предложены антитела, поскольку они могут блокировать попадание аллергенных молекул в слизистую оболочку ткани или могут связывать аллерген до того, как у него появится возможность связаться с IgE, связавшимся с высокоаффинным рецептором на тучных клетках или базофилах, таким образом предупреждая высвобождение гистамина и других медиаторов высвобождения из этих клеток.
В патенте США №5670626 описано применение моноклональных антител для лечения IgE-опосредованных аллергических заболеваний, таких как аллергический ринит, аллергическая астма и аллергический конъюнктивит, путем блокировки связывания аллергенов со слизистой оболочкой ткани. В патенте США №6849259 описано применение аллерген-специфических антител для подавления аллергического воспаления в in vivo мышиной модели аллергии. Были описаны молочные и яичные системы антител. Например, в US 20030003133 A1 раскрыто применение молока в качестве носителя аллергенов для индукции толерантности при пероральном приеме кошачьей перхоти и других аллергенов. В US 2010/0143266 были описаны композиции и способы снижения аллергической реакции у животных на аллерген в окружающей среде посредством применения молекулы, которая подавляет способность аллергена связываться с тучными клетками. Другие антитела к Fel d1 описаны в работе de Groot et. al. (de Groot et. al., (1988), J. Allergy Clin. Immunol. 82:778-786).
Краткое раскрытие настоящего изобретения
Настоящее изобретение относится к полностью человеческим моноклональным антителам (mAb) и их антигенсвязывающим фрагментам, которые специфично связываются с кошачьим аллергеном Fel d1. Такие антитела могут быть пригодны для связывания аллергена Fel d1 in vivo после того, как сенсибилизированный больной подвергся воздействию кошачьего аллергена, и в связи с этим может содействовать либо ускорению выведения Fel d1, либо блокировке связывания аллергена с преформированным IgE на поверхности тучных клеток или базофилов. Таким образом, антитела согласно настоящему изобретению могут предупреждать высвобождение гистамина или других медиаторов воспаления из тучных клеток или базофилов, таким образом предупреждая или ослабляя нежелательные эффекты, наблюдаемые у больных, сенсибилизированных к кошачьему аллергену. В соответствии с некоторыми вариантами осуществления антитела могут быть способны уменьшать, минимизировать или предупреждать по меньшей мере один симптом у больного, восприимчивого к кошачьему аллергену Fel d1, такой как чихание, гиперемия, заложенность носа, кашель, бронхолегочная обструкция, бронхоконстрикция, ринит или конъюнктивит. В соответствии с некоторыми вариантами осуществления антитела могут быть способны предупреждать еще более серьезные in vivo осложнения, связанные с воздействием на сенсибилизированных индивидуумов кошачьего аллергена, таких как астматические реакции, анафилактическая реакция или даже летальный исход.
Антитела согласно настоящему изобретению могут иметь полную длину (например, антитело IgG1 или IgG4) или могут содержать только антигенсвязывающую часть (например, фрагмент Fab, F(ab')2 или scFv) и могут быть модифицированы с затрагиванием функциональности, например, для устранения остаточных эффекторных функций (Reddy et al., (2000), J. Immunol. 164:1925-1933).
В соответствии с первым аспектом настоящее изобретение относится к выделенному человеческому моноклональному антителу или его антигенсвязывающему фрагменту, которые специфично связываются с Fel d1.
В соответствии с одним вариантом осуществления антитело или его антигенсвязывающий фрагмент относятся к изотипу, отличному от изотипа IgA.
В соответствии с одним вариантом осуществления выделенное человеческое антитело или его антигенсвязывающий фрагмент относятся к изотипу, выбранному из группы, состоящей из IgG1, IgG2 и IgG4.
В соответствии с одним вариантом осуществления выделенное человеческое антитело или его антигенсвязывающий фрагмент специфично связываются с Fel d1 с KD, равной или меньше 10-6 М. В соответствии с одним вариантом осуществления выделенное человеческое антитело или его антигенсвязывающий фрагмент специфично связываются с Fel d1 с KD, равной или меньше 1,8 нМ.
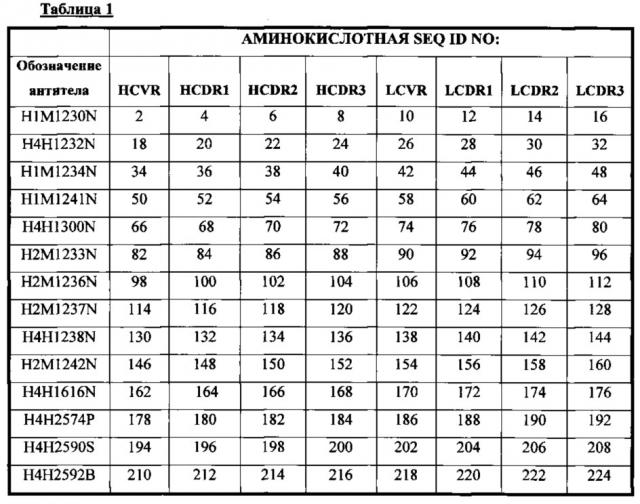
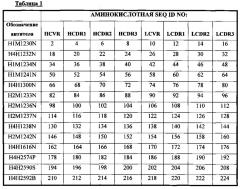
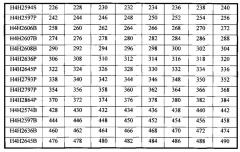
В соответствии с одним вариантом осуществления выделенное человеческое антитело или его антигенсвязывающий фрагмент содержат три CDR тяжелой цепи (HCDR1, HCDR2 и HCDR3), содержащиеся в любой из последовательностей вариабельного участка тяжелой цепи (HCVR), выбранной из группы, состоящей из SEQ ID NO: 2, 18, 34, 50, 66, 82, 98, 114, 130, 146, 162, 178, 194, 210, 226, 242, 258, 274, 290, 306, 322, 338, 354, 370 и 460, и три CDR легкой цепи (LCDR1, LCDR2 и LCDR3), содержащиеся в любой из последовательностей вариабельного участка легкой цепи (LCVR), выбранной из группы, состоящей из SEQ ID NO: 10, 26, 42, 58, 74, 90, 106, 122, 138, 154, 170, 186, 202, 218, 234, 250, 266, 282, 298, 314, 330, 346, 362, 378 и 468. Способы и методики определения CDR в аминокислотных последовательностях HCVR и LCVR хорошо известны из уровня техники и могут быть применены для определения CDR в раскрываемых в настоящем описании указанных аминокислотных последовательностях HCVR и/или LCVR. Иллюстративные условные обозначение, которые можно применять для определения границ CDR, включают, например, обозначение по Kabat, обозначение по Chothia и AbM-обозначение. В общих чертах, обозначение по Kabat основано на вариабельности последовательности, обозначение по Chothia основано на расположении структурных петельных участков, и AbM-обозначение является нечто средним между подходами Kabat и Chothia. См., например, Kabat, "Sequences of Proteins of Immunological Interest," National Institutes of Health, Bethesda, Md. (1991); A1-Lazikani et al., (1997), J. Mol Biol 273:927-948; and Martin et al., (1989), Proc. Natl Acad. Sci. USA 56:9268-9272. Находящиеся в общем доступе базы данных также доступны для определения последовательностей CDR в антителе.
В соответствии с одним вариантом осуществления выделенное человеческое антитело или его антигенсвязывающий фрагмент содержат три CDR тяжелой цепи (HCDR1, HCDR2 и HCDR3), содержащиеся в любой из последовательностей вариабельного участка тяжелой цепи (HCVR), выбранной из группы, состоящей из SEQ ID NO: 18, 66, 130, 162, 242, 306, 322, 370 и 460, и три CDR легкой цепи (LCDR1, LCDR2 и LCDR3), содержащиеся в любой из последовательностей вариабельного участка легкой цепи (LCVR), выбранной из группы, состоящей из SEQ ID NO: 26, 74, 138, 170, 250, 314, 330, 378 и 468.
В соответствии с одним вариантом осуществления выделенное человеческое антитело или его антигенсвязывающий фрагмент содержат HCVR с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 2, 18, 34, 50, 66, 82, 98, 114, 130, 146, 162, 178, 194, 210, 226, 242, 258, 274, 290, 306, 322, 338, 354, 370 и 460.
В соответствии с одним вариантом осуществления выделенное человеческое антитело или его антигенсвязывающий фрагмент содержат HCVR с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 18, 66, 130, 162, 242, 306, 322, 370 и 460.
В соответствии с одним вариантом осуществления выделенное человеческое антитело или его антигенсвязывающий фрагмент содержат LCVR с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 10, 26, 42, 58, 74, 90, 106, 122, 138, 154, 170, 186, 202, 218, 234, 250, 266, 282, 298, 314, 330, 346, 362, 378 и 468.
В соответствии с одним вариантом осуществления выделенное человеческое антитело или его антигенсвязывающий фрагмент содержат LCVR с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 26, 74, 138, 170, 250, 314, 330, 378 и 468.
В соответствии с одним вариантом осуществления выделенное человеческое антитело или его антигенсвязывающий фрагмент содержат: (a) HCVR с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 2, 18, 34, 50, 66, 82, 98, 114, 130, 146, 162, 178, 194, 210, 226, 242, 258, 274, 290, 306, 322, 338, 354, 370 и 460, (b) LCVR с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 10, 26, 42, 58, 74, 90, 106, 122, 138, 154, 170, 186, 202, 218, 234, 250, 266, 282, 298, 314, 330, 346, 362, 378 и 468.
В соответствии с одним вариантом осуществления выделенное человеческое антитело или его антигенсвязывающий фрагмент содержат: (a) HCVR с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 18, 66, 130, 162, 242, 306, 322, 370 и 460, и (b) LCVR с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 26, 74, 138, 170, 250, 314, 330, 378 и 468.
В соответствии с одним вариантом осуществления выделенное человеческое антитело или его антигенсвязывающий фрагмент содержат:
(a) домен HCDR1 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 4, 20, 36, 52, 68, 84, 100, 116, 132, 148, 164, 180, 196, 212, 228, 244, 260, 276, 292, 308, 324, 340, 356, 372 и 462,
(b) домен HCDR2 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 6, 22, 38, 54, 70, 86, 102, 118, 134, 150, 166, 182, 198, 214, 230, 246, 262, 278, 294, 310, 326, 342, 358, 374 и 464,
(c) домен HCDR3 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 8, 24, 40, 56, 72, 88, 104, 120, 136, 152, 168, 184, 200, 216, 232,248, 264, 280, 296, 312, 328, 344, 360, 376 и 466,
(d) домен LCDR1 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 12, 28, 44, 60, 76, 92, 108, 124, 140, 156, 172, 188, 204, 220, 236, 252, 268, 284, 300, 316, 332, 348, 364, 380 и 470,
(e) домен LCDR2 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 14, 30, 46, 62, 78, 94, 110, 126, 142, 158, 174, 190, 206, 222, 238, 254, 270, 286, 302, 318, 334, 350, 366, 382 и 472, и
(f) домен LCDR3 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 16, 32, 48, 64, 80, 96, 112, 128, 144, 160, 176, 192, 208, 224, 240, 256, 272, 288, 304, 320, 336, 352, 368, 384 и 474.
В соответствии с одним вариантом осуществления выделенное человеческое антитело или его антигенсвязывающий фрагмент содержат:
(a) домен HCDR1 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 20, 68, 132, 164, 244, 308, 324, 372 и 462,
(b) домен HCDR2 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 22, 70, 134, 166, 246, 310, 326, 374 и 464,
(c) домен HCDR3 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 24, 72, 136, 168, 248, 312, 328, 376 и 466,
(d) домен LCDR1 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 28, 76, 140, 172, 252, 316, 332, 380 и 470,
(e) домен LCDR2 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 30, 78, 142, 174, 254, 318, 334, 382 и 472, и
(f) домен LCDR3 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 32, 80, 144, 176, 256, 320, 336, 384 и 474.
В соответствии с одним вариантом осуществления выделенное человеческое антитело или его антигенсвязывающий фрагмент содержат пару аминокислотных последовательностей HCVR/LCVR, выбранную из группы, состоящей из SEQ ID NO: 2/10, 18/26, 34/42, 50/58, 66/74, 82/90, 98/106, 114/122, 130/138, 146/154, 162/170, 178/186, 194/202, 210/218, 226/234, 242/250, 258/266, 274/282, 290/298, 306/314, 322/330, 338/346, 354/362, 370/378 и 460/468.
В соответствии с одним вариантом осуществления выделенное человеческое антитело или его антигенсвязывающий фрагмент содержат пару аминокислотных последовательностей HCVR/LCVR, выбранную из группы, состоящей из SEQ ID NO: 18/26, 66/74, 130/138, 162/170, 242/250, 306/314, 322/330, 370/378 и 460/468.
В соответствии с одним вариантом осуществления выделенное человеческое антитело или его антигенсвязывающий фрагмент, которые связываются с Fel d1, содержат пару аминокислотных последовательностей HCVR/LCVR, выбранную из группы, состоящей из SEQ ID NO: 18/26, 66/74, 130/138 и 162/170.
В соответствии с одним вариантом осуществления выделенное человеческое антитело или его антигенсвязывающий фрагмент, которые связываются с Fel d1, содержат пару аминокислотных последовательностей HCVR/LCVR, выбранную из группы, состоящей из SEQ ID NO: 18/26 и 322/330.
В соответствии с одним вариантом осуществления выделенное человеческое антитело или его антигенсвязывающий фрагмент, которые связываются с Fel d1, содержат пару аминокислотных последовательностей HCVR/LCVR, выбранную из группы, состоящей из SEQ ID NO: 18/26 и 306/314.
В соответствии с одним вариантом осуществления выделенное человеческое антитело или его антигенсвязывающий фрагмент, которые связываются с Fel d1, содержат пару аминокислотных последовательностей HCVR/LCVR, выбранную из группы, состоящей из SEQ ID NO: 18/26 и 370/378.
В соответствии с одним вариантом осуществления выделенное человеческое антитело или его антигенсвязывающий фрагмент, которые связываются с Fel d1, содержат пару аминокислотных последовательностей HCVR/LCVR, выбранную из группы, состоящей из SEQ ID NO: 242/250 и 306/314.
В соответствии с одним вариантом осуществления выделенное человеческое антитело или его антигенсвязывающий фрагмент, которые связываются с Fel d1, содержат пару аминокислотных последовательностей HCVR/LCVR, выбранную из группы, состоящей из SEQ ID NO: 242/250 и 322/330.
В соответствии с одним вариантом осуществления выделенное человеческое антитело или его антигенсвязывающий фрагмент, которые специфично связываются с Fel d1, взаимодействуют по меньшей мере с одной аминокислотной последовательностью, выбранной из группы, состоящей из аминокислотных остатков, находящихся в диапазоне от приблизительно положения 15 до приблизительно положения 24 в SEQ ID NO: 396, аминокислотных остатков, находящихся в диапазоне от приблизительно положения 85 до приблизительно в положении 103 в SEQ ID NO: 396, аминокислотных остатков, находящихся в диапазоне от приблизительно положения 85 до приблизительно в положении 104 в SEQ ID NO: 396, и аминокислотных остатков, находящихся в диапазоне от приблизительно положения 113 до приблизительно в положении 116 в SEQ ID NO: 396.
В соответствии с одним вариантом осуществления выделенное человеческое антитело или его антигенсвязывающий фрагмент, которые связываются с Fel d1, взаимодействуют с аминокислотными остатками, находящимися в диапазоне от приблизительно положения 15 до приблизительно в положении 24 в SEQ ID NO: 396.
В соответствии с одним вариантом осуществления выделенное человеческое антитело или его антигенсвязывающий фрагмент, которые связываются с Fel d1, взаимодействуют с аминокислотными остатками, находящимися в диапазоне от приблизительно положения 85 до приблизительно в положении 103 в SEQ ID NO: 396.
В соответствии с одним вариантом осуществления выделенное человеческое антитело или его антигенсвязывающий фрагмент, которые связываются с Fel d1, взаимодействуют с аминокислотными остатками, находящимися в диапазоне от приблизительно положения 85 до приблизительно в положении 104 в SEQ ID NO: 396.
В соответствии с одним вариантом осуществления выделенное человеческое антитело или его антигенсвязывающий фрагмент, которые связываются с Fel d1, взаимодействуют с аминокислотными остатками, находящимися в диапазоне от приблизительно положения 113 до приблизительно в положении 116 в SEQ ID NO: 396.
В соответствии с одним вариантом осуществления выделенное человеческое антитело или его антигенсвязывающий фрагмент, которые связываются с Fel d1, взаимодействуют по меньшей мере с одной аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 402, 403, 404 и 412.
В соответствии с одним вариантом осуществления выделенное человеческое антитело или его антигенсвязывающий фрагмент, которые связываются с Fel d1, взаимодействуют с SEQ ID NO: 402.
В соответствии с одним вариантом осуществления выделенное человеческое антитело или его антигенсвязывающий фрагмент, которые связываются с Fel d1, взаимодействуют с SEQ ID NO: 403.
В соответствии с одним вариантом осуществления выделенное человеческое антитело или его антигенсвязывающий фрагмент, которые связываются с Fel d1, взаимодействуют с SEQ ID NO: 404.
В соответствии с одним вариантом осуществления выделенное человеческое антитело или его антигенсвязывающий фрагмент, которые связываются с Fel d1, взаимодействуют с SEQ ID NO: 426.
В соответствии с одним вариантом осуществления выделенное человеческое антитело или его антигенсвязывающий фрагмент, которые связываются с Fel d1, взаимодействуют с SEQ ID NO: 412.
В соответствии с одним вариантом осуществления выделенное человеческое антитело или его антигенсвязывающий фрагмент, которые взаимодействуют с SEQ ID NO: 402, 403, 404 и/или 426, содержат три HCDR, содержащиеся в вариабельном участке тяжелой цепи, с SEQ ID NO: 18 и три LCDR, содержащиеся в вариабельном участке легкой цепи, с SEQ ID NO: 26.
В соответствии с одним вариантом осуществления выделенное человеческое антитело или его антигенсвязывающий фрагмент, которые взаимодействуют с SEQ ID NO: 402, 403, 404 и/или 426, содержат HCDR1 с SEQ ID NO: 20, HCDR2 с SEQ ID NO: 22, HCDR3 с SEQ ID NO: 24, LCDR1 с SEQ ID NO: 28, LCDR2 с SEQ ID NO: 30 и LCDR3 с SEQ ID NO: 32.
В соответствии с одним вариантом осуществления выделенное человеческое антитело или его антигенсвязывающий фрагмент, которые взаимодействуют с SEQ ID NO: 412, содержат свободные HCDR, содержащиеся в вариабельном участке тяжелой цепи, с SEQ ID NO: 306 и три LCDR, содержащиеся в вариабельном участке легкой цепи, с SEQ ID NO: 314.
В соответствии с одним вариантом осуществления выделенное человеческое антитело или его антигенсвязывающий фрагмент, которые взаимодействуют с SEQ ID NO: 412, содержат HCDR1 с SEQ ID NO: 308, HCDR2 с SEQ ID NO: 310, HCDR3 с SEQ ID NO: 312, LCDR1 с SEQ ID NO: 316, LCDR2 с SEQ ID NO: 318 и LCDR3 с SEQ ID NO: 320.
В соответствии с одним вариантом осуществления человеческое антитело или его антигенсвязывающий фрагмент, которые связывают Fel d1, содержат аминокислотные последовательности HCDR1, HCDR2 и HCDR3 с SEQ ID NO: 20, 22 и 24, соответственно, и аминокислотные последовательности LCDR1, LCDR2 и LCDR3 с SEQ ID NO: 28, 30 и 32, соответственно.
В соответствии с одним вариантом осуществления человеческое антитело или его антигенсвязывающий фрагмент, которые связываются с Fel d1, содержат аминокислотные последовательности HCDR1, HCDR2 и HCDR3 с SEQ ID NO: 68, 70 и 72, соответственно, и аминокислотные последовательности LCDR1, LCDR2 и LCDR3 с SEQ ID NO: 76, 78 и 80, соответственно.
В соответствии с одним вариантом осуществления человеческое антитело или его антигенсвязывающий фрагмент, которые связываются с Fel d1, содержат аминокислотные последовательности HCDR1, HCDR2 и HCDR3 с SEQ ID NO: 132, 134 и 136, соответственно, и аминокислотные последовательности LCDR1, LCDR2 и LCDR3 с SEQ ID NO: 140, 142 и 144, соответственно.
В соответствии с одним вариантом осуществления человеческое антитело или его антигенсвязывающий фрагмент, которые связываются с Fel d1, содержат аминокислотные последовательности HCDR1, HCDR2 и HCDR3 с SEQ ID NO: 164, 166 и 168, соответственно, и аминокислотные последовательности LCDR1, LCDR2 и LCDR3 с SEQ ID NO: 172, 174 и 176, соответственно.
В соответствии с одним вариантом осуществления человеческое антитело или его антигенсвязывающий фрагмент, которые связываются с Fel d1, содержат аминокислотные последовательности HCDR1, HCDR2 и HCDR3 с SEQ ID NO: 244, 246 и 248, соответственно, и аминокислотные последовательности LCDR1, LCDR2 и LCDR3 с SEQ ID NO: 252, 254 и 256, соответственно.
В соответствии с одним вариантом осуществления человеческое антитело или его антигенсвязывающий фрагмент, которые связываются с Fel d1, содержат аминокислотные последовательности HCDR1, HCDR2 и HCDR3 с SEQ ID NO: 308, 310 и 312, соответственно, и аминокислотные последовательности LCDR1, LCDR2 и LCDR3 с SEQ ID NO: 316, 318 и 320, соответственно.
В соответствии с одним вариантом осуществления человеческое антитело или его антигенсвязывающий фрагмент, которые связываются с Fel d1, содержат аминокислотные последовательности HCDR1, HCDR2 и HCDR3 с SEQ ID NO: 324, 326 и 328, соответственно, и аминокислотные последовательности LCDR1, LCDR2 и LCDR3 с SEQ ID NO: 332, 334 и 336, соответственно.
В соответствии с одним вариантом осуществления человеческое антитело или его антигенсвязывающий фрагмент, которые связываются с Fel d1, содержат аминокислотные последовательности HCDR1, HCDR2 и HCDR3 с SEQ ID NO: 372, 374 и 376, соответственно, и аминокислотные последовательности LCDR1, LCDR2 и LCDR3 с SEQ ID NO: 380, 382 и 384, соответственно.
Согласно одному варианту осуществления настоящее изобретение относится к полностью человеческому моноклональному антителу или его антигенсвязывающий фрагменту, которые связываются с Fel d1, причем у антитела или его фрагмента наблюдают одну или несколько из следующих характеристик: (i) содержит HCVR с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 18, 66, 130, 162, 242, 306, 322, 370 и 460, или практически сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; (ii) содержит LCVR с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 26, 74, 138, 170, 250, 314, 330, 378 и 468, или практически сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; (iii) содержит домен HCDR3 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 24, 72, 136, 168, 248, 312, 328, 376 и 466, или практически сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; и домен HCDR3 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 32, 80, 144, 176, 256, 320, 336, 384 и 474, или практически сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; (iv) содержит домен HCDR1 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 20, 68, 132, 164, 244, 308, 324, 372 и 462, или практически сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; домен HCDR2 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 22, 70, 134, 166, 246, 310, 326, 374 и 464, или практически сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; домен LCDR1 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 28, 76, 140, 172, 252, 316, 332, 380 и 470, или практически сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; и домен LCDR2 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 30, 78, 142, 174, 254, 318, 334, 382 и 472, или практически сходной с ней последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; (v) связывается с Fel d1 с KD, равной или меньше 10-6 и предпочтительно равной или меньше 10-9; (vi) характеризуется эффективностью по меньшей мере в одной животной модели анафилактической реакции или воспаления; или (vii) конкурирует с эталонным антителом за связывание с Fel d1.
В соответствии с одним вариантом осуществления "эталонное антитело" может включать, например, антитела, имеющие комбинацию пар аминокислотных последовательностей тяжелой цепи и легкой цепи, выбранную из группы, состоящей из 18/26, 66/74, 130/138, 162/170, 242/250, 306/314, 322/330, 370/378 и 460/468.
В соответствии с одним вариантом осуществления полностью человеческое моноклональное антитело или его антигенсвязывающий фрагмент, которые связываются с Fel d1, содержат последовательность HCDR1, характеризующуюся формулой X1-X2-X3-X4-X5-X6-X7-X8 (SEQ ID NO: 386), где X1 представляет собой Gly, X2 представляет собой Phe, Tyr или Gly, X3 представляет собой Thr или Ser, X4 представляет собой Phe или Ile, X5 представляет собой Ser, Arg, Thr или Asn, X6 представляет собой Asn, Thr, Asp или Ser, X7 представляет собой Tyr и X8 представляет собой Asn, Tyr или Ala; последовательность HCDR2, характеризующуюся формулой X1-X2-X3-X4-X5-X6-X7-X8 (SEQ ID NO: 387), где X1 представляет собой Ile, X2 представляет собой Tyr, Ser или Asn, X3 представляет собой Tyr, Ser, Gly, Pro или Asp, X4 представляет собой Asp, Arg или Ser, X5 представляет собой Gly, Val или Ser, X6 представляет собой Ser, Gly, Arg или Tyr, X7 представляет собой Tyr, Arg, Thr, Ser или Asn, и X8 представляет собой Ile, Thr, Ala, Ser или отсутствует; последовательность HCDR3, характеризующуюся формулой X1-X2-X3-X4-X5-Χ6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16 (SEQ ID NO: 388), где X1 представляет собой Ala, X2 представляет собой Lys или Arg, X3 представляет собой Arg, Gly, His, Ser, Asp, Leu или Thr, X4 представляет собой Thr, Pro, Arg, Gly или Glu, X5 представляет собой Leu, Val, Gly, Lys, Tyr или Asn, X6 представляет собой Ser, Arg, Thr, Ala, Tyr, Phe или Trp, X7 представляет собой Tyr, Gly, Arg, Ala, Asn, Asp, His или Asn, X8 представляет собой Tyr, Thr, Ser или His, X9 представляет собой Val, Ser, Ala, Phe, Pro или отсутствует, X10 представляет собой Met, Gly, Asp, Pro, Val, или отсутствует, Χ11 представляет собой Asp, Tyr, Ser, Gly, Phe, или отсутствует, X12 представляет собой Val, Asp, Phe или отсутствует, X13 представляет собой Phe, Asp или отсутствует, X14 представляет собой Phe, Tyr или отсутствует, X15 представляет собой Asp или отсутствует, X16 представляет собой Tyr или отсутствует; последовательность LCDR1, характеризующуюся формулой Х1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12 (SEQ ID NO: 389), где X1 представляет собой Gln, X2 представляет собой Gly, Ser или Asp, X3 представляет собой Ile или Val, X4 представляет собой Ser, Leu, Asn или Gly, Χ5 представляет собой Asn, Tyr, Gly или Ser, Χ6 представляет собой Tyr, Ser, Phe или Trp, Χ7 представляет собой Ser или отсутствует, X8 представляет собой Asn или отсутствует, X9 представляет собой Asn или отсутствует, X10 представляет собой Lys или отсутствует, X11 представляет собой Gln или отсутствует, X12 представляет собой Tyr или отсутствует; последовательность LCDR2, характеризующуюся формулой X1-X2-X3 (SEQ ID NO: 390), где X1 представляет собой Ala, Trp, Asp, Tyr, Lys, Gly или Ser, X2 представляет собой Ala или Thr, и X3 представляет собой Ser; и последовательность LCDR3, характеризующуюся формулой X1-X2-X3-X4-X5-Χ6-X7-X8-X9 (SEQ ID NO: 391), где X1 представляет собой Gln, Leu или His, X2 представляет собой Lys, Gin или His, Χ3 представляет собой Tyr, Ser или Leu, X4 представляет собой Tyr, Asn, Gly, Asp или Ser, Χ5 представляет собой Ser, Asp или Asn, X6 представляет собой Leu, Ala, Tyr, Thr или Phe, Χ7 представляет собой Pro или Arg, X8 представляет собой Leu, Phe, Tyr или Thr, и Χ9 представляет собой Thr или отсутствует.
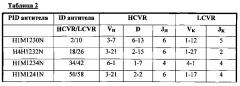
В соответствии с одним вариантом осуществления настоящее изобретение относится к человеческому антителу или антигенсвязывающему фрагменту, специфичному к Fel d1, содержащему HCVR, кодируемый сегментами нуклеотидной последовательности, полученными из последовательностей зародышевой линии VH, DH и JH, и LCVR, кодируемый сегментами нуклеотидной последовательности, полученными из последовательностей зародышевой линии VK и JK, с комбинациями, которые описаны в таблице 2.
Настоящее изобретение относится к антителам с модифицированными профилями гликозилирования. В некоторых областях применения может быть пригодна модификация, удаляющая нежелательные сайты гликозилирования, или, например, удаление фукозного фрагмента для повышения функции антителозависимой клеточноопосредованной цитотоксичности (ADCC) (см. Shield et al. (2002) JBC 277:26733). В других областях применения для модификации комплементзависимой цитотоксичности (CDC) можно выполнить модификацию галактозилирования.
Согласно второму аспекту настоящее изобретение относится к выделенному антителу или его антигенсвязывающему фрагменту, которые конкурируют за специфичное связывание с Fel d1 с антителом или антигенсвязывающим фрагментом, содержащим определяющие комплементарность участки (CDR) вариабельного участка тяжелой цепи (HCVR), причем HCVR имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 2, 18, 34, 50, 66, 82, 98, 114, 130, 146, 162, 178, 194, 210, 226, 242, 258, 274, 290, 306, 322, 338, 354, 370 и 460; и CDR вариабельного участка легкой цепи (LCVR), причем LCVR имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 10, 26, 42, 58, 74, 90, 106, 122, 138, 154, 170, 186, 202, 218, 234, 250, 266, 282, 298, 314, 330, 346, 362, 378 и 468.
Согласно одному варианту осуществления настоящее изобретение относится к выделенному антителу или его антигенсвязывающему фрагменту, которые конкурируют за специфичное связывание с Fel d1 с антителом или антигенсвязывающим фрагментом, содержащим определяющие комплементарность участки (CDR) вариабельного участка тяжелой цепи (HCVR), причем HCVR имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 18, 66, 130, 162, 242, 306, 322, 370 и 460; и CDR вариабельного участка легкой цепи (LCVR), причем LCVR имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID: 26, 74, 138, 170, 250, 314, 330, 378 и 468.
Согласно соответствующему варианту осуществления настоящее изобретение относится к выделенному антителу или его антигенсвязывающий фрагменту, которые конкурируют за специфичное связывание с Fel d1 с антителом или антигенсвязывающим фрагментом, содержащим CDR тяжелой и легкой цепи, которые содержатся в парах последовательностей тяжелой и легкой цепей, выбранных из группы, состоящей из SEQ ID NO: 18/26, 66/74, 130/138, 162/170, 242/250, 306/314, 322/330, 370/378 и 460/468.
Согласно третьему аспекту настоящее изобретение относится к выделенному антителу или его антигенсвязывающему фрагменту, которые связывают тот же эпитоп на Fel d1, что и антитело или антигенсвязывающий фрагмент, содержащие определяющие комплементарность участки (CDR) вариабельного участка тяжелой цепи (HCVR), причем HCVR имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 2, 18, 34, 50, 66, 82, 98, 114, 130, 146, 162, 178, 194, 210, 226, 242, 258, 274, 290, 306, 322, 338, 354, 370 и 460; и CDR вариабельного участка легкой цепи (LCVR), причем LCVR имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 10, 26, 42, 58, 74, 90, 106, 122, 138, 154, 170, 186, 202, 218, 234, 250, 266, 282, 298, 314, 330, 346, 362, 378 и 468.
Согласно одному варианту осуществления настоящее изобретение относится к выделенному антителу или его антигенсвязывающему фрагменту, который связывает тот же эпитоп на Fel d1, что и антитело или антигенсвязывающий фрагмент, содержащие определяющие комплементарность участки (CDR) вариабельного участка тяжелой цепи (HCVR), причем HCVR имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 18, 66, 130, 162, 242, 306, 322, 370 и 460; и CDR вариабельного участка легкой цепи (LCVR), причем LCVR имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID: 10, 26, 42, 58, 74, 90, 106, 122, 138, 154, 170, 186, 202, 218, 234, 250, 266, 282, 298, 314, 330, 346, 362, 378 и 468.
Согласно соответствующему варианту осуществления настоящее изобретение относится к выделенному антителу или его антигенсвязывающий фрагменту, которые связывают тот же эпитоп на Fel d1, что и антитело или антигенсвязывающий фрагмент, содержащие CDR тяжелой и легкой цепи, которые содержатся в парах последовательностей тяжелой и легкой цепей, выбранных из группы, состоящей из SEQ ID NO: 18/26, 66/74, 130/138, 162/170, 242/250, 306/314, 322/330, 370/378 и 460/468.
Согласно четвертому аспекту настоящее изобретение относится к биспецифической антигенсвязывающей молекуле, которая специфично связывает Fel d1 и содержит два антигенсвязывающих домена (два плеча), содержащих аминокислотную последовательность HCVR и аминокислотную последовательность LCVR из любых двух или более описанных в настоящем документе антител.
В соответствии с одним вариантом осуществления биспецифическая антигенсвязывающая молекула содержит первый антигенсвязывающий домен, который содержит аминокислотную последовательность HCVR, приведенную в SEQ ID NO: 370, и аминокислотную последовательность LCVR, приведенную в SEQ ID NO: 378, и второй антигенсвязывающий домен, который содержит аминокислотную последовательность HCVR, приведенную в SEQ ID NO: 18, и аминокислотную последовательность LCVR, приведенную в SEQ ID NO: 378.
В соответствии с одним вариантом осуществления биспецифическая антигенсвязывающая молекула содержит первый антигенсвязывающий домен, который содержит три определяющих комплементарность участка тяжелой цепи (HCDR1, HCDR2 и HCDR3), состоящих из аминокислотных последовательностей, приведенных в SEQ ID NO: 372, 374 и 376, соответственно, и три определяющих комплементарность участка легкой цепи (LCDR1, LCDR2 и LCDR3), состоящих из аминокислотных последовательностей, приведенных в SEQ ID NO: 380, 382 и 384, соответственно; а второй антигенсвязывающий домен содержит три определяющих комплементарность участка тяжелой цепи (HCDR1, HCDR2 и HCDR3), состоящих из аминокислотных последовательностей, приведенных в SEQ ID NO: 20, 22 и 24, соответственно, и три определяющих комплементарность участка легкой цепи (LCDR1, LCDR2 и LCDR3), состоящих из аминокислотных последовательностей, приведенных в SEQ ID NO: 380, 382 и 384, соответственно.
В соответствии с одним вариантом осуществления биспецифическая антигенсвязывающая молекула содержит первый антигенсвязывающий домен, который содержит аминокислотную последовательность HCVR, приведенную в SEQ ID NO: 306, и аминокислотную последовательность LCVR, приведенную в SEQ ID NO: 314, и второй антигенсвязывающий домен, который содержит аминокислотную последовательн