Способ восстановления кожного покрова
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к дерматологии, и может быть использовано для восстановления кожного покрова. Для этого в область повреждения кожи последовательно вводят биорезорбируемый носитель с культурой клеток фибробластов и биорезорбируемый носитель с культурой кераноцитов, где носитель представляет собой частицы диаметром 100-500 мкм, обладающие отрицательным зарядом при физиологических значениях рН, полученные измельчением трехмерных матриксов на основе фиброина шелка Bombyx mori. Способ позволяет ускорить процесс заживления раны за счет ускорения контракции раны на ранних этапах восстановления и ускорения реэпителизации. 5 з.п. ф-лы, 2 ил., 4 пр.
Реферат
Область техники
Изобретение относится к биотехнологии и медицине. Более подробно изобретение относится к области применения витализированных биорезорбируемых микроносителей для восстановления кожного покрова.
Уровень техники
Кожный покров играет важную роль в жизнедеятельности организма, обеспечивая целый ряд важных функций, таких как механическая, термическая и химическая защита тканей тела, барьер для микроорганизмов, поддержание гомеостаза, обеспечение механической рецепции. Наличие долго незаживающих ран может стать причиной развития инфекций, привести к инвалидности или смерти пациента.
Кроме того, на месте обширных повреждений вследствие процессов восстановления может образоваться рубцовая ткань, которая отличается по механическим и физиологическим свойствам от нормальной кожи. Это может приводить как к проявлениям дискомфорта и неудобств косметического характера, так и к ограничениям функциональных возможностей работы отдельных частей тела.
Успешное заживление ран зависит от своевременного и оптимального течения самых разнообразных процессов, взаимодействия разных типов клеток, молекулярных медиаторов и структурных элементов. В различных этапах восстановления доминируют различные клетки, и клеточные ансамбли варьируют в зависимости от различных видов травм и степени повреждения тканей. При нормальном заживлении ран закрытие тканевых дефектов развивается через серию скоординированных молекулярных и клеточных событий, в результате чего происходит регенерация или заживление тканей [Y. Zeng, et al. Acta Biomater. 2015. V. 25. P. 291-303, J. Zhou et al. Mater. Sci. Eng. C. Mater. Biol. Appl. 2016. V. 60. Р. 437-445].
При нарушении целостности капилляров в слое дермы происходит образование тромба, что в свою очередь приводит к высвобождению противоспалительных факторов, таких как трансформирующие факторы роста α и β (TGF-α, TGF-β) и тромбоцитарный фактор роста (PDGF). В области раны начинает расти число нейтрофилов и макрофагов, развивается воспаление. Выделение макрофагами цитокина TGF-β1 индуцирует дифференцировку дермальных фибробластов в миофибробласты, которые синтезируют внеклеточный матрикс, преимущественно состоящий из фибронектина и гиалуроновой кислоты, стимулирующей миграцию фибробластов. Миграция кератиноцитов приводит к восстановлению барьерной функции. После этого происходит апоптоз миофибробластов с последующим их замещением фибробластами из прилегающих участков кожи, создающих коллагеновый внеклеточный матрикс.
Наименее сложным является заживление чистых ран без потери ткани и неинфицированных хирургических разрезов с использованием швов. Это быстрый процесс, и он заметно контрастирует с заживлением открытой раны с обширной потерей тканей. Здесь репаративный процесс более сложен, так как утраченная ткань должна быть заменена новообразованной. Процесс занимает больше времени и требует формирования большого количества грануляционной ткани для заполнения дефекта ткани.
Таким образом, в процессы восстановления и регенерации вовлечено множество клеток разных типов и биологически активных веществ. Использование их в различных сочетаниях с биомедицинскими изделиями может качественно изменить подходы к восстановлению кожных покровов после различных повреждений.
В настоящее время для улучшения посттравматического восстановления кожных покровов активно исследуется возможность применения выделенных из костного мозга или жировой ткани мультипотентных мезенхимальных стромальных клеток (ММСК). ММСК способны к дифференцировке в различные типы клеток, выделению факторов роста, а также участию в воспалительных процессах, что делает перспективным их применение в клеточной трансплантологии [Tony Kwang-Poh Goh et al. Biores Open Access. 2013. V. 2(2). P. 84-97]. Однако существенным недостатком применения суспензии свободных клеток является их низкая приживаемость в области поражения, что привело к необходимости создания эффективной системы доставки. Одним из таких методов является конструирование биоинженерных микроскаффолдов (микроносителей). Для их создания используются различные материалы, такие как коллаген, гиалуроновая кислота, фиброин, хитозан и желатин [Dal P. Et al. Biomaterials. 2005. V. 26. P. 1987-1999, Lee J. et al. Tissue Eng Part В Rev. 2008b. V. 14. Р. 61-86].
Выбор материала является серьезным этапом создания скаффолда, поскольку он определяет биосовместимость, скорость биодеградации, адгезионные и антибактериалные свойства готового продукта, определяющие в свою очередь скорость и качество восстановления кожного покрова.
Важной характеристикой является не только материал, но также форма и размер скаффолда. Для развития методов клеточной терапии перспективно использование биорезорбируемых микроносителей - небольших частиц от 50 до 500 мкм, поскольку это позволяет использовать иммобилизованные на носителях клетки в инъекционной форме и помогает исключить травматичную для клеток стадию снятия культуры с подложки. Биорезорбируемые микроносители наиболее удобны для иммобилизации клеток и последующего введения в повреждение кожи.
Кроме того, микроносители не только доставляют мультипотентные мезенхимальные стромальные клетки непосредственно в повреждение, они повышают жизнеспособность клеток, обеспечивают их длительное высвобождение и, имея структуру, напоминающую внеклеточный матрикс, влияют на экспрессию генов и секрецию белков, модулируют клеточный фенотип.
Таким образом, лечение кожных покровов с помощью микроносителей способствует как большей выживаемости вводимых клеток, так и повышает скорость и полноту регенерации кожи.
Прототипом настоящего изобретения является способ обработки повреждений живой кожи, включающий нанесение заменителя живой кожи на области повреждений кожи, отличающийся тем, что он содержит в качестве биосовместимого носителя микросферы из биорезорбируемого in vivo материала, имеющие средний диаметр 50-500 мкм, предпочтительно 80-250 мкм, и культуру клеток кожи в виде покрытия, нанесенного на поверхность этих микросфер, который наносят в виде суспензии покрытых клетками микросфер на область повреждения кожи (документ RU 2104039 С1).
Существенным недостатком данного изобретения является использование в качестве материала микросфер полигидроксибутирата, сополимера полигидроксибутирата и полигидроксивалериата, полимеров лактидогликолидов, полилактонов, полиэфиров, полилактидов, полиглюколидов, полиангидридов, так как в результате биодеградации данных материалов образуются кислые продукты распада, что отрицательно сказывается на биосовместимости носителя. Ранее было показано, что синтетические полимеры, применяемые для создания трехмерных пористых матриц, такие как полигликолиевая кислота (PGA), полимолочная кислота (PLA) и полиортоэфир (РОЕ), при деградации образуют вещества, обладающие токсическим действием. Продукты распада PGA и PLА в водной среде существенно понижают уровень рН среды, а при быстрой деградации уровень образующихся кислот превышает емкость буферного раствора TRIS (рН 7,4) [Sachlos Е. and Czernuszka J.T., 2003; Taylor M.S. et al., 1994]. Изменение уровня рН среды влияет на физиологическое состояние клеток, их экспрессионный профиль и синтез межклеточного матрикса [Kohn D.H. et al., 2002; Wu M.H. et al., 2007]. Еще одним значительным недостатком данного изобретения является сферическая форма носителя, которая не защищает доставляемые клетки от механических воздействий и, как следствие, разрушений, в процессе введения в область повреждения, в результате чего возможно происходит снижение эффективности лечения. Данные факторы будут приводить к увеличению времени восстановления кожного покрова.
Раскрытие изобретения
Задачей изобретения является разработка эффективного способа восстановления кожного покрова.
Поставленная задача решается способом восстановления кожного покрова, включающим последовательное введение в область повреждения кожи суспензии, содержащей биорезорбируемый носитель с иммобилизованными фибробластами, затем через 2-4 часа суспензии, содержащей биорезорбируемый носитель с иммобилизованными кератиноцитами, где носитель представляет собой частицы диаметром 100-500 мкм, обладающие отрицательным зарядом при физиологических значениях рН, полученные измельчением трехмерных матриксов на основе фиброина шелка Bombyx mori.
Измельчение трехмерных матриксов включает следующие стадии:
a) заморозку в течение 12-24 ч при -80-90°С;
b) криоизмельчение трехмерных матриксов на основе фиброина шелка с применением диспергатора.
При этом трехмерные матриксы на основе фиброина шелка получают путем замораживания-оттаивания водного раствора фиброина и включает в себя следующие стадии:
a) получение водного раствора фиброина с концентрацией 18-30 мг/мл с использованием смеси СаCl2/С2Н5ОН/Н2О в следующем молярном соотношении 1/2/8;
b) заморозку смеси раствора фиброина с ДМСО, при этом содержание ДМСО в растворе составляет 0,5-2 об.%;
c) размораживание и обработку 96% этанолом для формирования β-складчатой структуры.
Введение биорезорбируемого носителя с фибробластами и носителя с кератиноцитами осуществляют посредством инъекции подкожно на расстоянии 0,5-2 мм от места повреждения, при этом каждая суспензия содержит 260-270 тыс. кл/мл, а введение осуществляют посредством трех-пяти инъекций по 20-30 мкл на 1 мм2 повреждения.
Техническим результатом, достигаемым при использовании изобретения, является замедление контракции поврежденной области на ранних этапах восстановления и ускорение реэпителизации при введении суспензий, содержащих биорезорбируемый носитель с иммобилизованными фибробластами и биорезорбируемый микроноситель с иммобилизованными кератиноцитами, и, как следствие, ускорение заживления кожного покрова с восстановлением всех структурных и функциональных слоев. Заявляемый способ позволяет сохранить клетки, участвующие в регенерации, при осуществлении инъекций вокруг повреждения. Это достигается за счет того, что предлагаемый биорезорбируемый композитный микроскаффолд представляет собой микрочастицы с поверхностью сложной формы, обеспечивающей защиту клеток от механических воздействий и являющейся оптимальным субстратом для адгезии, пролиферации и миграции клеток. При этом дальнейшая деградация фиброина в организме сопровождается образованием нетоксичных и, в некоторых случаях, даже полезных для регенерации продуктов, и поддается контролю [Wang Y. et al. In vivo degradation of three-dimensional silk fibroin scaffolds. // Biomaterials. Vol. 29, №24-25. P. 3415-3428; Park S.-H. et al. Relationships between degradability of silk scaffolds and osteogenesis. // Biomaterials. 2010. Vol. 31, №24. P. 6162-6172]. Многие фиброиновые продукты прошли тестирование in vivo и показали эффективность для регенерации кожных повреждений [Thurber А.Е., Omenetto F.G., Kaplan D.L. In vivo bioresponses to silk proteins. // Biomaterials. 2015. Vol. 71. P. 145-157], костной ткани, хрящей [Foss С. et al. Silk fibroin/hyaluronic acid 3D matrices for cartilage tissue engineering. // Biomacromolecules. 2013. Vol. 14, №1. P. 38-47], сердца [Chi N.-H. et al. Cardiac repair using chitosan-hyaluronan/silk fibroin patches in a rat heart model with myocardial infarction // Carbohydr. Polym. 2013. Vol. 92, №1. P. 591-597], сосудов [Lovett M. et al. Silk fibroin microtubes for blood vessel engineering // Biomaterials. 2007. Vol. 28, №35. P. 5271-5279], печени [Yang Z. et al. In vitro and in vivo characterization of silk fibroin/gelatin composite scaffolds for liver tissue engineering // J. Dig. Dis. 2012. Vol. 13, №3. P. 168-178], а также в качестве носителей лекарственных соединений с регулируемым высвобождением [Liu Q., Liu Н., Fan Y. Preparation of silk fibroin carriers for controlled release // Microsc. Res. Tech. 2015. P. n/a-n/a].
Краткое описание чертежей
Изобретение поясняется чертежами.
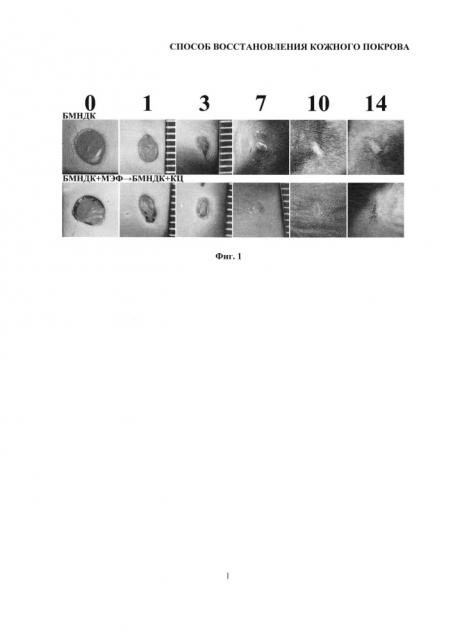
На фиг. 1 представлены макрофотографии состояния полнослойных повреждений кожного покрова мыши, демонстрирующие влияние последовательного внесения экспериментальных образцов биорезорбируемых микроносителей для доставки клеток (БМНДК), витализированных мышиными эмбриональными фибробластами (МЭФ) и кератиноцитами (КЦ) и невитализированных БМНДК (контроль), на скорость затягивания полнослойной раны кожи и образование рубца в течение 14 дней после нанесения раны.
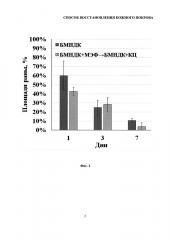
На фиг. 2 представлена гистограмма, демонстрирующая влияние последовательного внесения экспериментальных образцов БМНДК, витализированных МЭФ КЦ и невитализированных БМНДК (контроль), на скорость затягивания полнослойной раны кожи. На гистограмме отражены % площади раны относительно площади раны в нулевой точке в экспериментальной и контрольной группах.
Осуществление изобретения
Получение водного раствора фиброина шелка осуществляли с использованием нитей хирургических нестерильных 100% натуральный шелк, произведенных по ГОСТ 396-84 (соответствие упаковки и маркировки ГОСТу 396-84, наличие сертификата соответствия №0302120, гарантии производителя, срок годности, условия хранения по ГОСТ 396-84, сертификат соответствия), растворяя навеску в смеси dH2O, кальция хлористого (х.ч., о.с.ч., ГОСТ 450-77; соответствие упаковки и маркировки ГОСТу 3885-73, наличие гарантии производителя, срок годности, внешний вид) и спирта этилового ректификованного 96% (ГОСТ 5962-67). Формирование макроносителей для дальнейшего криоизмельчения с целью получения микроносителей проводили путем заморозки водного раствора фиброина с добавлением 1% ДМСО (х.ч., ТУ 2635-114-44493179-08). Криоизмельчение сформированных макроносителей выполняли с помощью диспергатора).
Перечисленные выше процедуры осуществлялись с использованием следующего оборудования: система очистки воды Еliх 70, «Millipore» (Франция, система включает: картридж предварительной очистки Progard TL, картридж обратного осмоса, модуль Elix; производительность 70 л/час при температуре 7-30°С, рабочее давление 0,7-1,0 МПа, 220 В, 50 Гц, габариты (ШГВ): 662×441×733 мм, 56 кг); резервуар для сбора очищенной воды SDS 200, «Millipore» (Франция, объем 200 л), весы электронные RV 1502, «OHAUS» (США, (1500,00±0,01) г, 220 В, 50 Гц); шкаф вытяжной 1200 ШВМкв (Россия, ООО «ЛаМО» макс, мощность подключаемых приборов 3,5 кВт, 220 В, габариты (ШГВ): 1280×750×2400 мм); холодильник бытовой Атлант МХМ 1707-02 (Минск, Белоруссия, емкость камеры холодильника 175 л, температура от 0°С до 10°С, емкость мороз, камеры 115 л, температура минус 18 до минус 24°С, 220 В, 50 Гц); диспергатор Bosch MSM 66150 ERGOMIXX (Словения, мощность 600 Вт, 220 В, погружной, турборежим, габариты (ВГШ):210×620×550, вес: 1.15 кг); центрифуга MiniSpin, «Eppindorf», (Германия, скорость вращения 13400 об/мин, ротор F-45-12-11, 12×1,5/2 мл, 220 В, 70 Вт, габариты (ВГШ): 122×240×226 мм, 4,3 кг); баня водяная BWT-U/20, Biosan (Латвия, ванна из н/ж стали объем 20 л. Диапазон регулирования температуры от 30°С до 100°С, точность поддержания температуры ±0,1°С, внутренняя циркуляция, внутр. размеры ванны: 300×320×140 мм, габариты: 345×550×290 мм, 11 кг, 220 В, 50 Гц, 1 кВт).
Выделение и культивирование первичных культур фибробластов и кератиноцитов для последующей витализации полученных микроносителей выполняли с использованием стандартных сред и добавок по известным протоколам (Мойсенович М.М. и др. Фундаментальные основы использования биорезорбируемых микроносителей на основе фиброина шелка в терапевтической практике на примере регенерации кожи // Терапевтический архив, 2015, 87 (12), с. 66-72). Витализацию микроносителей проводили по оригинальной методике, включающей следующие стадии:
1. Подготовка микроносителей
Стерильную навеску микроносителя переносят в среду культивирования ДМЕМ в центрифужную пробирку из расчета 5 мг на 1 мл, ресуспендируют и центрифугируют 3 минуты при 1500 об/мин. Заменяют супернатант на 1 мл полной среды культивирования и инкубируют при 37°С 1 час. Полученную суспензию используют на стадии 3.
2. Подготовка суспензии фибробластов МЭФ/кератиноцитов
Культивируемые клетки снимают раствором трипсин-Версена, трипсин инактивируют ЭТС и переносят в центрифужные пробирки в полную среду культивирования, осаждают клетки, центрифугируя при 1500 об/мин в течение 7 минут. Супернатант удаляют и ресуспендируют осадок в среде культивирования. Проводят подсчет клеток в камере Горяева и готовят суспензию, содержащую 400 тыс.клеток в 1 мл полной среды культивирования. Полученную суспензию используют на стадии 3.
3. Иммобилизация клеток на микроносителе
Суспензию микрочастиц, полученную на стадии 1, вносят в лунки 96-луночной круглодонной плашки по 50 мкл на 1 лунку и добавляют по 100 мкл суспензии клеток, полученной на стадии 2. Помещают плашку в СО2-инкубатор и инкубируют 6 часов при 37°С в атмосфере 5% СО2. Суспензию микроносителей с иммобилизованными клетками переносят в лунки 24-луночной плашки, содержащие 1,5 мл полной культуральной среды. Планшет помещают в СО2-инкубатор на 37°С с 5% СО2 в атмосфере.
Для восстановления кожного покрова осуществляли последовательное введение на расстоянии 0,5-2 мм от места повреждения суспензии, содержащей биорезорбируемый носитель с иммобилизованными фибробластами, затем с интервалом в 2-4 часа суспензии, содержащей биорезорбируемый носитель с иммобилизованными кератиноцитами.
Настоящее изобретение поясняется следующими примерами.
Пример 1. Получение биорезорбируемых микроносителей для доставки клеток в область восстановления и регенерации ран
1. Подготовка рабочих растворов:
1.1. Подготовка раствора 1. Готовят раствор хлорида кальция в смеси этанола и воды. Молярное соотношение компонентов CaCl2:C2H5OH:H2O составляет 1:2:8.
1.2. Подготовка раствора 2. Готовят навеску шелка из расчета 150 мг на 1 мл раствора 1 и переносят в емкость с раствором 1. Инкубируют в течение 5 часов на водяной бане при 70°С. Полученный раствор центрифугируют 15 минут при 15500 g и супернатант диализуют против дистиллированной воды, проводя 4 смены диализа. Полученный раствор центрифугируют 15 минут при 15500 g и определяют концентрацию фиброина по оптической плотности при 280 нм. Доводят раствор до концентрации фиброина 20 мг/мл, вносят 1% ДМСО и используют на стадии 2.
2. Формирование матриксов
Раствор 2 вносят в форму и замораживают в морозильной камере при -20°С в течение 7 дней. Обрабатывают 96% этанолом полученные заготовки матриксов 3 раза по 45 минут. Полученные матриксы переносят в дистиллированную воду и используют на стадии 3.
3. Получение микрочастиц из матриксов
Матриксы, полученные на стадии 2, погружают в дистиллированную воду и помещают на ночь в морозильную камеру при -20°С. Переносят замороженные в воде матриксы в морозильную камеру на 4 часа при -90°С. За это время охлаждают 96% этанол. Замороженные в воде матриксы переносят в диспергатор и размельчают в течение 45 секунд. Полученную взвесь переносят в 50 мл центрифужные пробирки и используют на стадии 4.
4. Сортинг и стерилизация микрочастиц из матриксов
Полученные микрочастицы последовательно пропускают через сита с диаметром отверстий 500, 250 и 100 мкм. Собирают фракции частиц 500-250 мкм, 100-250 мкм в центрифужные пробирки типа Falcon и центрифугируют 10 минут при 150 g. Супернатант отбирают, вносят дистиллированную воду, замораживают и лиофильно высушивают. Хранят при +4°С в герметично закрытой таре, защищающей от влаги.
Пример 2. Выделение клеток
Выделение мышиных фибробластов проводили из GFP+ эмбрионов на 13 день внутриутробного развития. Датированную беременность получали, подсаживая двух самок C57BL/6N к GFP+ самцу на ночь, утром проверяли наличие копулятивной пробки у самок. Момент обнаружения копулятивной пробки считали 1-м днем беременности. На 13 день беременности мышь эвтаназировали и извлекали матку. Наличие экспрессии GFP проверяли на УФ-трансиллюминаторе. Удаляли голову и внутренние органы у эмбрионов, а оставшиеся ткани измельчали глазными ножницами в стерильных условиях, диссоциировали в 0.05%-ном растворе трипсин-ЭДТА и осаждали 5 минут при 200 g. Полученную клеточную суспензию переносили во флакон в среде ДМЕМ с 10% ЭТС Из расчета 1,2×106 клеток в 10 мл и помещали в СО2- инкубатор на 37°С с содержанием СО2 в атмосфере 5%.
Первичную культуру мышиных кератиноцитов получали из новорожденных мышей C57BL/6N на 0-3 день развития. Фрагмент кожи обеззараживали антибиотиком/антимикотиком (Gibco) следующего состава: 100 ед./мл пенициллина, 100 мкг/мл стептомицина и 0.25 мкг/мл амфотерицина в ФСБ в течение 5 минут. Далее в течение ночи при +4°С обрабатывали дерму 0.025%-ным раствором трипсин/ЭДТА. Затем дерму удаляли, а эпидермис измельчали и центрифугировали при 200 g в среде FAD следующего состава: ДМЕМ/Ham’s F12 (Lonza, Швейцария) в соотношении 3.5:1.1 с добавлением 10% ЭТС, 0.18 мМ аденина, 0.5 мкг/мл гидрокортизона, 5 мкг/мл инсулина, 0.1 нМ холерного токсина, 10 нг/мл EGF, 2 мМ глутамина, 1 мМ пирувата, с последующим ресуспендированием. Переносили суспензию клеток в чашки Петри диаметром 60 мм из расчета 0,2-0,8×106 клеток на чашку. В течение 14 дней проводили ежедневную замену среды на свежую. Характеристику полученной из суспензии первичной культуры кератиноцитов проводили путем выявления цитокератинов 5 и 14 на поверхности клеток посредством непрямой иммунофлуоресценции с использованием мышиных моноклональных антител к цитокератину 5 с поликлональными козьими антителами против иммуноглобулина G мыши, меченных CF™ 555 и кроличьих моноклональных антител к цитокератину 14 с поликлональными козьими антителами против иммуноглобулина G кролика, меченных CF™ 633. Использовали антитела производства Sigma-Aldrich, США.
Пример 3. Витализация экспериментальных образцов биорезорбируемого микроносителя для направленной доставки клеток
1. Подготовка микроносителей
Стерильную навеску микроносителя (100-250 мкм) переносят в среду культивирования ДМЕМ в центрифужную пробирку из расчета 5 мг на 1 мл, ресуспендируют и центрифугируют 3 минуты при 1500 об/мин. Заменяют супернатант заменяют на 1 мл полной культуральной среды с 10% эмбриональной телячьей сыворотки (ЭТС) и инкубируют при 37°С 1 час. Полученную суспензию используют на стадии 2.
2. Иммобилизация клеток на микроносителе
Суспензию микрочастиц, полученную на стадии 1, переносят в конические пробирки типа Falcon объемом 50 мл и добавляют супензию клеток (400 тыс./мл) МЭФ или первичный эпидермальных кератиноцитов, полученных в примере 2, из расчета 1 мл супензии микроносителей и 2 мл суспензии клеток, полученных в примере 2. Помещают плашку в CO2-инкубатор и инкубируют 6 часов при 37°С в атмосфере 5% CO2.
Пример 4. Исследование влияния витализации микроносителей на скорость восстановления и регенерации кожных покровов in vivo
Эксперимент проводили на 6 мышах линии C57BL/6N категории SPF (specific pathogen free), полученных из лабораторного питомника Пущино. Перед имплантацией со спины удаляли шерсть депилляционным кремом и обеззараживали поверхность 70% этанолом. Операцию проводили под общей анестезией. Внутрибрюшинно вводили 100 мкл смеси препаратов: наркотизирующего Золетил 100 (Virbac Sante Animale, Каррос, Франция) и миорелаксанта Rometar (Bioveta, a. s., Чешская республика). Полнослойную асептическую рану кожи формировали с помощью стерильного одноразового стилета для биопсии диаметром 4 мм (EPITHEASY, Medax, Италия). Экспериментальные образцы БМНДК с клетками МЭФ и образцы с иммобилизованными кератиноцитами (КЦ), последовательно вводили интрадермально посредством 3 инъекций по 60 мкл суспензии (16 тыс. клеток, иммобилизованных на экспериментальных образцах БМНДК) по краям раны, с интервалом 2 часа, контрольной группе вводили суспензию невитализированных микроносителей. Экспериментальная и контрольная группы содержали каждая по три мыши с двумя полнослойными ранами. Анализ динамики затягивания раны проводили по макрофотографиям. Макрофотографии ран получали в день операции (0 день), через 1, 3, 7, 10 и 14 дней. Полученные данные представлены на фиг. 1. На макрофотографиях представлены изображения области раны на 0, 1, 3, 7, 10 и 14 дни после нанесения раны.
Далее по полученным макрофотографиям проводили анализ изменения площади раны. Оценку выполняли с использованием приложения ImageJ (National Institute of Health, Bethesda, MD, USA) следующим образом: область раны выделяли и вычисляли пиксельную площадь. Площадь раны оценивали в процентах относительно нулевой точки для каждого из трех животных во всех группах. Результаты выполненного анализа представлены на фиг. 2.
Площадь раны животных, инъецированных образцами БМНДК, витализированными фибробластами и кератиноцитами посредством последовательных введений клеток на БМНДК, через 1 день после нанесения травмы была меньше, чем у животных, которым вводили невитализированные частицы. При этом площадь раны составляла не менее 40%, а к третьему дню площади ран выравнивались. На седьмой день после нанесения раны струп наблюдался только в группе животных, которым вводили невитализированные БМНДК.
Таким образом, приведенные примеры показывают, что применение последовательного введения БМНДК, витализированных МЭФ и кератиноцитами, способствовало ускорению контракции раны на ранних этапах восстановления и ускорению реэпителизации и, как следствие, заживлению раны.
1. Способ восстановления кожного покрова, включающий последовательное введение в область повреждения кожи суспензии, содержащей биорезорбируемый носитель с иммобилизованными фибробластами, затем с интервалом в 2-4 ч суспензии, содержащей биорезорбируемый носитель с иммобилизованными кератиноцитами, где носитель представляет собой частицы диаметром 100-500 мкм, обладающие отрицательным зарядом при физиологических значениях рН, полученные измельчением трехмерных матриксов на основе фиброина шелка Bombyx mori.
2. Способ по п. 1, характеризующийся тем, что измельчение трехмерных матриксов включает следующие стадии:
a) заморозку в течение 12-24 ч при (-80)-(-90)°С;
b) криоизмельчение трехмерных матриксов на основе фиброина шелка с применением диспергатора.
3. Способ по п. 1, характеризующийся тем, что трехмерные матриксы на основе фиброина шелка получены путем замораживания-оттаивания водного раствора фиброина, и включает в себя следующие стадии:
a) получение водного раствора фиброина с концентрацией 18-30 мг/мл с использованием смеси CaCl2/С2Н5ОН/Н2О в следующем молярном соотношении: 1/2/8;
b) заморозку смеси раствора фиброина с ДМСО, при этом содержание ДМСО в растворе составляет 0,5-2 об.%;
c) размораживание и обработку 96% этанолом для формирования β-складчатой структуры.
4. Способ по п. 1, характеризующийся тем, что введение биорезорбируемого носителя с фибробластами и носителя с кератиноцитами осуществляют посредством инъекции подкожно на расстоянии 0,5-2 мм от места повреждения.
5. Способ по п. 1, характеризующийся тем, что каждая инъецируемая суспензия носителя с фибробластами и носителя с кератиноцитами содержит 260-270 тыс. кл/мл.
6. Способ по п. 1, характеризующийся тем, что введение осуществляют посредством трех-пяти инъекций по 20-30 мкл на 1 мм2 повреждения.