Рекомбинантная плазмида для экспрессии в дрожжах pichia pastoris гена химерного белка ангиогенина человека и штамм дрожжей pichia pastoris - продуцент рекомбинантного химерного белка ангиогенина человека
Иллюстрации
Показать всеИзобретение относится к генной инженерии и биотехнологии и может быть использовано для получения химерного белка ангиогенина человека. Предложена рекомбинантная плазмида pPICZaA:ZZ_ANG, содержащая синтетический ген химерного белка ангиогенина человека (SEQ ID NO: 1), состоящего из аминокислотной последовательности двух IgG-связывающих доменов белка A (SEQ ID NO: 2) и ангиогенина человека (SEQ ID NO: 3), соединенных между собой пептидным линкером (SEQ ID NO: 4). Плазмида имеет размер 4228 п.о. Предложен штамм дрожжей Pichia pastoris X-33/pPICZaA:ZZ-ANG, являющийся продуцентом рекомбинантного химерного белка ангиогенина человека ZZ-ANG и полученный путем трансформации дрожжей Pichia pastoris X-33 линеаризованной плазмидой pPICZaA:ZZ-ANG. Группа изобретений обеспечивает получение активного рекомбинантного химерного ангиогенина человека, секретируемого в культуральную среду с высоким выходом. 2 н.п. ф-лы, 4 ил., 5 пр.
Реферат
Рекомбинантная плазмида для экспрессии в дрожжах Pichia pastoris гена химерного белка ангиогенина человека и штамм дрожжей Pichia pastoris - продуцент рекомбинантного химерного белка ангиогенина человека
Изобретение относится к биотехнологии и касается штамма дрожжей Pichia pastoris - продуцента химерного белка ангиогенина человека и рекомбинантной плазмиды, которой трансформирован этот штамм. Посредством представленного изобретения может быть получен рекомбинантный химерный белок - ангиогенин человека, слитый с IgG-связывающим доменом белка А стафилококка, секретируемый в культуральную среду.
Ангиогенин, или РНКаза 5 - это растворимый секретируемый негликозилированный белок с молекулярной массой 14 кДа, состоящий из 124 аминокислотных остатков. Он играет важную роль в ангиогенезе, стимулируя эндотелиальные клетки к образованию новых сосудов. Ангиогенин вызывает большой интерес как полифункциональный терапевтический белок, в частности, его применяют для лечения ран, ожогов, а также при заболеваниях, связанных с нарушением кровообращения (1, 2).
Получение штаммов-продуцентов ангиогенина человека и его химерных форм пролонгированного действия методами генной инженерии является наиболее подходящим способом производства данного белка в промышленных масштабах.
Известен метод получения рекомбинантного ангиогенина человека путем химического гидролиза химерного рекомбинантного полипептида, состоящего из фрагмента β-галактозидазы, слитого с белком ангиогенина человека. Химерный полипептид получают в клетках Escherichia.coli. в виде телец включения. Рекомбинантный ангиогенин, полученный после химического гидролиза, ренатурируют с восстановлением вторичной и третичной структуры [ЕР 0292763, дата приоритета 19.05.1988]. Недостатком этого способа получения ангиогенина является большая трудоемкость и низкий выход целевого белка.
Известен синтетический ген белка ангиогенина человека, оптимизированный по встречаемости кодонов в клетках Е. coli. Рекомбинантный ангиогенин нарабатывается в нерастворимой форме в телах включения, активную форму ангиогенина человека получают ренатурацией с восстановлением вторичной и третичной структуры белка [FR 2610324, дата приоритета 29.01.1987]. Недостатком этого способа является малый размер получаемого рекомбинантного белка и, следовательно, короткое время полужизни при введении в организм человека.
Известны два штамма Е. coli - продуцента химерных форм рекомбинантного белка ангиогенина человека: «ангиогенин- β-галактозидаза» и «IgG связывающий домен белка А - ангиогенин». Штаммы получены путем клонирования синтетического гена ангиогенина человека в составе нескольких экспрессирующих бактериальных векторов и трансформации ими штамма Е. Coli JM103 (3). Известен штамм-продуцент Е. coli VL1222p R AngT (ВКПМ B-6895), продуцирующий свободный ангиогенин (4).
Недостатками указанных бактериальных штаммов-продуцентов является низкий выход рекомбинантного ангиогенина, который составляет 2 мг/л, что эквивалентно 0,02% суммарного клеточного белка (5).
Известна бактериальная рекомбинантная плазмида pJZZ-A, наиболее близкая заявляемой рекомбинантной плазмиде. Бактериальная рекомбинантная плазмида pJZZ-A содержит синтетический химерный ген ангиогенина человека, состоящий из 5'-концевого фрагмента, кодирующего N-концевую аминокислотную последовательность двух IgG-связывающих доменов (ZZ) белка A Staphylococcus aureus, и 3'-концевого фрагмента, кодирующего С-концевую аминокислотную последовательность ангиогенина человека [RU 2512527, дата приоритета 10.07.2012].
Бактериальный штамм-продуцент рекомбинантного химерного ангиогенина белка Escherichia coli BL21(DE3)/pJZZ-А, полученный с помощью бактериальной плазмиды pJZZ-A, обеспечивает высокий выход химерного ангиогенина человека в клетках Е. Coli - 500 мг на 5 г биомассы, или 10% от суммарного клеточного белка. Высокий выход химерного белка ангиогенина достигается благодаря использованию в указанной рекомбинантной плазмиде pJZZ-A ориджина репликации pUC, который обеспечивает увеличенное количество копий плазмиды в клетке, а также благодаря оптимизированной по встречаемости кодонов в клетках E. coli нуклеотидной последовательности синтетического гена химерного ангиогенина.
В заявляемой плазмиде pPICZαA:ZZ-ANG использован такой же состав синтетического гена ZZ_ANG, как и в прототипе pJZZ-A, однако, в отличие от бактериальной плазмиды, синтетический ген заявляемой плазмиды pPICZαA:ZZ-ANG имеет другую нуклеотидную последовательность (состав кодонов), и адаптирован для экспрессии в дрожжах Pichia pastoris.
Недостатком бактериальных продуцентов является то, что ангиогенин накапливается в клетка Е. Coli в виде тел включения. Чтобы обеспечить функциональную активность рекомбинантного ангиогенина из тел включения, требуется трудоемкая процедура ренатурации и рефолдинга белка, после которой, как правило, все равно возникают проблемы с растворимостью.
Известен способ получения растворимого рекомбинантного ангиогенина в клетках Е. Coli с использованием вектора pTED, который содержит последовательность сигнала секреции Е. Coli OmpA (б). Выход рекомбинантного ангиогенина (свободная форма) составил около 50 мг/л после 72 часов культивирования. Однако в работе не показана ангиогенная активность полученного белка, что связано, вероятно, с отсутствием правильного процессинга в клетках Е. Coli.
Кроме того, рекомбинантные белки, получаемые в клетках Е. Coli, загрязнены эндотоксинами (липополисахаридами), остаточные количества которых вызывают серьезные побочные эффекты в организме человека (7, 8), поэтому рекомбинантный ангиогенин, получаемый в Е. Coli, требует дополнительной стадии очистки.
Экспрессия чужеродных генов в метилотрофных дрожжах Pichia pastoris позволяет получать не загрязненные эндотоксинами рекомбинантные белки с более высоким выходом, чем в клетка Е. Coli. Поскольку дрожжи Pichia pastoris являются эукариотами, они производят растворимые белки, обеспечивая фолдинг и посттрансляционные модификации, необходимые для функциональной активности белка (9). Поэтому получение рекомбинантного ангиогенина человека в системе экспрессии Pichia pastoris является наиболее привлекательным методом.
Наиболее близким к заявляемому штамму-продуценту (прототипом) является штамм дрожжей Pichia pastoris - продуцент секретируемого ангиогенина человека (10). Ген ангиогенина человека (378 пар оснований) клонирован в составе плазмиды pPIC9 по сайтам EcoRI и NotI в рамке считывания с ATG кодоном альфа-сигнала секреции. Экспрессия гена ангиогенина человека в составе полученной рекомбинантной плазмиды pPIC9-Ang находится под контролем промотора гена АОХ1, обеспечивающего активацию транскрипции в присутствии метанола в культуральной среде. Компетентные клетки Pichia pastoris GS115 были трансформированы при помощи электропорации плазмидой pPIC9-Ang, линеаризованной по сайту BglII. Полученные трансформанты проверяли на наличие секреции белка ангиогенина, выращивая клоны в 5 мл среды BMGY в течение 36 часов, затем проводили индукцию, добавляя метанолом до концентрации 1% каждые 24 часа в течение 120 часов. Позитивные трансформанты обеспечивали секрецию рекомбинантного ангиогенина в культуральную среду, концентрация белка в супернатанте составляла 50 мг/л. По результатам электрофоретического анализа молекулярный вес рекомбинантного ангиогенина соответствовал ожидаемому (14,4 кДа). Были подобраны оптимальные условия получения белка в колбах на качалке: температура 29°С, скорость качания 290 об/мин, время индукции 72 часа. Содержание рекомбинантного ангиогенина в супернатанте составляло 70% от общего количества секретируемых белков. После очистки при помощи ионообменной хроматографии на SP сефарозе был получен рекомбинантный ангиогенин с выходом 30 мг на 1 л культуры.
С помощью теста на хориоаллантоисной оболочке (ХАО) куриного эмбриона было установлено, что указанный рекомбинантный ангиогенин обладает специфической ангиогенной активностью.
Недостатком указанного метода является низкий выход белка - 30 мг/л. Кроме того, для терапевтического применения малый размер рекомбинантного полипептида (126 аминокислотных остатков) будет являться недостатком из-за короткого времени полужизни белка.
Технический результат заявляемой группы изобретений заключается в увеличении выхода секретируемого химерного белка ангиогенина человека в системе экспрессии Pichia pastoris.
Технический результат достигается путем конструирования рекомбинантной плазмиды pPICZαA:ZZ-ANG, обеспечивающей биосинтез и секрецию химерного белка ангиогенина человека ZZ-ANG (SEQ ID NO: 1), состоящего из аминокислотной последовательности двух IgG-связывающих доменов белка A (SEQ ID NO: 2) и ангиогенина человека (SEQ ID NO: 3), соединенных между собой пептидным линкером (SEQ ID NO: 4), имеющая размер 4228 п.о. и состоящая из следующих элементов (Фиг. 1):
а) AOX1 promoter - 5'-концевая область промотора алкоголь оксидазы: 1-940;
б) Alpha factor signal peptide - участок, кодирующий N-концевой сигнальный пептид из Saccharomyces cerevisiae: 941-1207;
в) ZZ - 5'-концевой фрагмент синтетического гена ZZ_ANG, кодирующий аминокислотную последовательность двух IgG-связывающих доменов (ZZ) белка A Staphylococcus aureus: 1214 - 1567 п.о.;
г) Link - фрагмент, кодирующий аминокислотную последовательность линкера, связывающего последовательность IgG связывающей области ZZ белка А из Staphylococcus aureus и последовательность ангиогенина человека: 1568 - 1573 п.о.;
д) ANG - 3'-концевой фрагмент синтетического гена ZZ_ANG, кодирующий аминокислотную последовательность ангиогенина человека: 1574 - 1945 п.о.;
е) AOX1 transcription terminator - терминатор транскрипции: 1973-2317 п.о.;
ж) TEF1 promoter - эукариотический промотор: 2318-2729 п.о.;
з) ЕМ7 promoter - бактериальный промотор: 2730-2797 п.о.;
и) Zeo(R) - ген Sh ble устойчивости к селективному антибиотику зеоцину: 2798-3172 п.о.;
к) CYC1 transcription terminator - терминатор транскрипции гена цитохрома С1: 3173-3490 п.о.;
л) pUC origin - бактериальная точка начала репликации pUC: 3501 - 4174 п.о.
Технический результат также достигается получением штамма дрожжей Pichia pastoris X-33/pPICZαA:ZZ-ANG - продуцента рекомбинантного химерного белка ангиогенина человека ZZ-ANG, состоящего из аминокислотной последовательности двух IgG-связывающих доменов белка A (ZZ) и ангиогенина человека (ANG), соединенных между собой пептидным линкером, путем трансформации дрожжей Pichia pastoris Х-33 линеаризованной плазмидой pPICZαA:ZZ-ANG.
Для получения рекомбинантной плазмиды pPICZαA:ZZ-ANG сначала был спроектирован химерный синтетический ген ZZ-ANG, кодирующий химерный белок ангиогенина человека. Ген ZZ-ANG состоит из 5'-концевого фрагмента, кодирующего аминокислотную последовательность двух IgG-связывающих доменов (ZZ) белка A Staphylococcus aureus, связанного через последовательность, кодирующую пептидный линкер аспарагин/серин, с геном ангиогенина человека.
Далее проводится оптимизация нуклеотидной последовательности синтетического гена по составу кодонов, для экспрессии в дрожжах Pichia pastoris. Оптимизацию кодонового состава осуществляют с использованием компьютерной программы «Gene designer» ("DNA 2.0", США) удаляя при этом ненужные сайты рестрикции путем синонимических замен. Кроме этого, используют синонимические замены наиболее часто встречаемых пар кодонов в геноме Pichia pastoris, так как в соответствующих участках затормаживается трансляция мРНК (11).
Нуклеотидная последовательность полученного химерного гена ZZ-ANG указана в SEQ ID NO 1, его синтез осуществляют в составе плазмиды pMK-RQ:ZZ_ANG.
Рекомбинантную плазмиду pPICZαA:ZZ-ANG получают, проводя лигирование фрагмента плазмиды pPICZαA, гидролизованной рестриктазами EcoRI и Sall, и фрагмента ампликона химерного гена ZZ-ANG, полученного на матрице плазмиды pMK-RQ:ZZ_ANG, гидролизованного рестриктазами EcoRI и XhoI, при помощи ДНК-лигазы фага Т4, как в примерах 1 и 2.
Штамм дрожжей Pichia pastoris X-33/pPICZαA:ZZ-ANG - продуцент рекомбинантного химерного белка ангиогенина человека ZZ-ANG, получают путем трансформации компетентных клеток нативного штамма дрожжей Pichia pastoris Х-33 линеаризованной по сайту BstXI в области 5'-АОХ1 промотора плазмидой pPICZαA:ZZ-ANG методом электропорации, как в примере 3.
Биосинтез рекомбинантного химерного белка ангиогенина человека ZZ-ANG проводят в клетках заявляемого штамма дрожжей Pichia pastoris X-33/pPICZαA:ZZ-ANG при культивировании и последующей индукции метанолом, как в примерах 4 и 5.
Функциональную ангиогенную активность рекомбинантного химерного белка ангиогенина человека ZZ-ANG определяют с помощью теста на хориоаллантоисной мембране куриных эмбрионов, как в примере 4.
Предложенная группа технических решений позволяет значительно увеличить выход рекомбинантного ангиогенина в сравнении с прототипами и другими аналогами. При культивировании клеток рекомбинантного штамма Pichia pastoris X-33/pPICZαA:ZZ-ANG и последующей индукции метанолом в культуральную среду секретируется растворимый химерный ангиогенин человека с выходом около 200 мг на 1 л среды, при этом доля рекомбинантного ангиогенина по отношению к общему количеству секретируемых белков превышает 75%. Проверка ангиогенной активности с помощью теста на хориоаллантоисной мембране показывает, что полученный химерный ангиогенин человека обладает специфической ангиогенной активностью.
Достижение заявленного технического результата обусловлено следующим:
1. Получением рекомбинантного штамма дрожжей Pichia pastoris путем трансформации дрожжей Pichia pastoris Х-33 линеаризованной плазмидой pPICZαA:ZZ-ANG, что обеспечивает экспрессию гена химерного белка ангиогенина человека ZZ-ANG, а также секрецию и процессинг химерного белка, что позволяет получить растворимый, обладающий специфической активностью химерный ангиогенин человека.
2. Использованием в составе линеаризованной плазмиды pPICZαA:ZZ-ANG синтетического гена химерного белка ангиогенина человека, полученного с оптимизацией состава кодонов и с учетом синонимичных замен пар кодонов, наиболее часто встречаемых пар кодонов в геноме Pichia pastoris, приводящих к торможению трансляции мРНК в соответствующих участках, что в совокупности способствовало увеличению экспрессии гена химерного ангиогенина человека.
Сущность заявляемого изобретения далее поясняется на чертежах.
Фиг. 1 содержит физическую карту рекомбинантной плазмиды pPICZαA:ZZ_ANG.
АОХ1 promoter - 5'-концевая область промотора алкоголь оксидазы; Alpha factor signal peptide - участок, кодирующий N-концевой сигнальный пептид из Saccharomyces cerevisiae; ZZ - 5'-концевой фрагмент синтетического гена ZZ_ANG, кодирующий аминокислотную последовательность двух IgG-связывающих доменов (ZZ) белка A Staphylococcus aureus; Link - фрагмент, кодирующий аминокислотную последовательность пептидного линкера; ANG - 3'-концевой фрагмент синтетического гена ZZ_ANG, кодирующий аминокислотную последовательность ангиогенина человека; АОХ1 transcription terminator - терминатор транскрипции; TEFl promoter - эукариотический промотор; ЕМ7 promoter - бактериальный промотор; Zeo(R) - ген Sh ble устойчивости к зеоцину; CYC1 transcription terminator - терминатор транскрипции гена цитохрома C1; pUC origin - бактериальная точка начала репликации.
Фиг. 2. Физическая карта бактериальной плазмиды pMK-RQ:ZZ_ANG.
ZZ_ANG - синтетический ген химерного белка ангиогенина человека ZZ-ANG; Col E1 origin - точка начала репликации; Kan R - ген устойчивости к антибиотику канамицину.
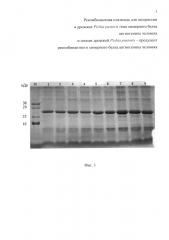
Фиг. 3. Электрофореграмма белков культуральной жидкости, полученных при отборе рекомбинантных клонов штамма Pichia pastoris X-33/pPICZαA:ZZ-ANG. М - маркер молекулярных масс; 1-9 номера клонов.
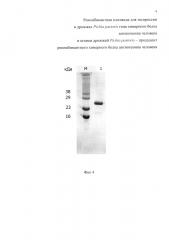
Фиг. 4. Электрофореграмма очищенного препарата рекомбинантного химерного ангиогенина человека. М - маркер молекулярных масс; 1 препарат белка.
Осуществление изобретения пояснено на примерах.
Пример 1. Оптимизация нуклеотидной последовательности проектируемого синтетического гена химерного белка ангиогенина человека для его эффективной экспрессии в клетках P. pastoris. Клонирование синтетического гена апоА-I человека в составе плазмиды pMK-RQ:ZZ_ANG в клетках Е. coli. Оптимизированную нуклеотидную последовательность гена химерного белка ангиогенина человека получают путем синонимичных замен кодонов на наиболее часто встречаемые в геноме P. pastoris кодоны и удалением возникающих сайтов рестрикции при помощи программы Gene designer (DNA2.0 USA). Кроме того, производят синонимичную замену наиболее часто встречающихся пар кодонов, а именно TTCAAG/TTTAAG, AAGAAG/AAGAAA и TTTGAA/TTCGAA, при помощи собственной программы.
Также проверяют наличие в мРНК, кодируемой синтетическим геном, нежелательных участков вторичной структуры.
Синтетический ген химерного белка ангиогенина человека ZZ_ANG (SEQ ID NO 1) получают химическим синтезом, клонированным в составе бактериальной плазмиды pMK-RQ:ZZ_ANG, карта плазмиды представлена на Фиг. 2.
Пример 2. Получение рекомбинантной химерной плазмиды pPICZαA:ZZ_ANG.
Ампликона химерного гена ZZ-ANG получают методом ПЦР на матрице плазмиды pMK-RQ:ZZ_ANG с помощью высокоточной термостабильной полимеразы Phusion (Thermo scientific, USA). с прямым праймером 427 CAGAATTCGACAACAAGTTCAACAAAGAGC с достройкой 5'-концевого сайта рестрикции EcoRI и обратного праймера 428 CCGCTCGAGTCATGGTCTTCTGAAGATGGACTG с достройкой 3'-концевого сайта рестрикции XhoI. Ампликон выделяют экстракцией фенолом/хлороформом с последующим осаждением изопропанолом и гидролизуют рестриктазами EcoRI и XhoI. Полученный фрагмент очищают при помощи фенол/хлороформной экстракции и осаждают изопропанолом.
Плазмиду pPICZαA гидролизуют по сайтам рестрикции EcoRI и SalI, фрагмент плазмиды размером 3487 п.о. получают, выделяя из 0,8% агарозного гела при помощи набора Qiagen USA.
Полученные фрагменты лигируют с использованием Т4 ДНК лигазы (Сибэнзим, Россия) в амплификаторе «Терцик» в течение 12-ти часов по заданной программе при температуре, меняющейся циклически от 10°С до 30°С (12). Полученной лигазной смесью трансформировали клетки E. coli BL21 (DE3). Отбор клонов, содержащих рекомбинантную плазмиду pPICZαA:ZZ_ANG, проводили на агаризованной среде LB, содержащей 50 мкг/мл зеоцина. Наличие целевой ДНК-вставки определяли методом ПЦР колоний, с праймерами AOX1-F: GACTGGTTCCAATTGACAAGC и AOX1-R GCAAATGGCATTCTGACATCC, а также проводили рестрикционный анализ плазмид, выделенных из полученных клонов. Клон, содержащий плазмиду pPICZαA:ZZ_ANG, использовали для препаративной наработки.
Пример 3. Получение рекомбинантного штамма дрожжей Pichia pastoris X-33/pPICZαA:ZZ-ANG - продуцента рекомбинантного химерного белка ангиогенина человека.
Рекомбинантную плазмиду, полученную в примере 2, обрабатывают рестриктазой BstXI, находящейся в области АОХ1 промотора (Фиг. 1). При этом происходит встройка экспрессирующей кассеты, состоящей из гена устойчивости к зеоцину и синтетического гена химерного белка ангиогенина человека ZZ_ANG, который слит с находящимся в плазмиде pPICZαA:ZZ-ANG альфа-сигналом секреции, путем гомологичной рекомбинации. Таким образом, трансформанты, выросшие на агаризованной среде с селективным антибиотиком зеоцином, генетически стабильны как в присутствии, так и в отсутствие в среде культивирования селективного антибиотика (13).
Кроме того, отбор трансформантов на высоких концентрациях зеоцина (1000-2000 мкг/мл) позволяет отобрать клоны, в которых содержится несколько экспрессирующих кассет с геном устойчивости к зеоцину, таким образом, эти клоны должны продуцировать большее количество рекомбинантного белка (13).
Компетентные клетки Pichia pastoris Х-33 для электропорации получали по следующей методике: Выращивали 5 мл штамма Pichia pastoris Х-33 в среде YPD в 5 мл пробирке при 30°С в течение ночи; инокулировали 200 мл среды YPD в 1 литровой колбе 0,1-0,5 мл ночной культуры; выращивали в течение ночи до OD600 = 1.3-1.5; центрифугировали клетки при 1500 хд в течение 5 мин при +4°С (ЦФ) в центрифуге Beckman Allegra X-12R с ротором SX4750; промывали осадок в 200 мл ледяной (0°С) стерильной деионизованной воды; ЦФ; промывали осадок в 100 мл ледяной (0°С) стерильной деионизованной воды; ЦФ; промывали осадок в 8 мл ледяного (0°С) стерильного 1М сорбита; ЦФ; ресуспендировали осадок в 400 мкл ледяного (0°С) 1М сорбитола, получив конечный объем примерно 600 мкл. Клетки использовали в аликвотах по 4 0 мкл.
16 мкг плазмиды pPICZαA:ZZ-ANG гидролизовали 10 мкл рестриктазы BstXI в течение ночи, линеаризованную плазмиду очищали фенолом/хлороформом с последующим осаждением изопропанолом, растворяли в 10 мкл ТЕ буфера. К 4 0 мкл компетентных клеток, находящихся на льду, добавляли 10 мкл линейной плазмиды, инкубировали 2 мин при 0°С, клетки переносили в охлажденную 0,2 см кювету, прводили электропорацию при 2000 В, время импульса 5,3 мс, заливали в кювету 1 мл ледяной среды YPDS, клетки переносили в стерильный фалькон емкостью 15 мл инкубировали на качалке, 200 об/мин при 30°С в течение примерно 3-х часов. Высевали по 50, 100 и 200 мкл на чашки со средой YPD с концентрациями зеоцина 200 и 1000 мкг/мл. Чашки инкубировали при 30°С. На третьи сутки вырастали клоны, которые далее анализировали при помощи индукции синтеза рекомбинантного белка метанолом в 96-луночном глубоком планшете (объем лунок по 2 мл, квадратной формы. Axygen р - 2ml- sq- с) следующим образом: в лунки добавляли по 300 мкл среды BMGY, стерильной зубочисткой переносили часть колонии в лунки, при этом перекалывая этой же зубочисткой колонии на 2 чашки параллельно. Выращивали при 30°С на качалке, 300 об/мин в течение 60 часов, планшет при этом накрывали 2-мя слоями стерильной марли. Добавляли по 250 мкл среды ВММ2, инкубировали далее в течение 12 часов. Добавляли по 50 мкл среды ВММ10 через каждые последующие 24 часа. На третьи сутки индукции клетки осаждали центрифугированием при 3500 xg, белки из супернатантов концентрировали в 10 раз осаждением ТХУ (добавляли 1/100 объема 1,5 раствора дезоксихолата Na, инкубировали 10 мин при комнатной t, добавляли 1/10 исходного объема насыщенного раствора ТХУ, -20°С 10 мин, 16*103 об/мин 10 мин) с промывкой ацетоном. Электрофорез по Лэммли проводили в 13% полиакриламидном геле с последующим окрашиванием кумасси G250.
На Фиг. 3 представлена электофореграмма белков, секретируемых в культуральную жидкость рекомбинантными клонами Pichia pastoris X-33/pPICZαA:ZZ-ANG, которые выросли при концентрации зеоцина 1000 мкг/мл.
Полученный рекомбинантный штамм дрожжей Pichia pastoris X-33/pPICZaA:ZZ-ANG характеризуется следующими свойствами:
Морфологические и культуральные характеристики. При росте на агаризованной среде YPD колонии круглые, гладкие, блестящие, белые, диаметр колоний 1-5 мм; консистенция пастообразная. Рост в жидкой среде YPD характеризуется ровным помутнением.
Физиолого-биохимические характеристики. Клетки растут при температуре 10-30°С при рН 5,0-7,5 без признаков лизиса. В качестве источника азота используют как минеральные соли в виде смеси, так и органические соединения в виде пептона, дрожжевого экстракта, аминокислот. В качестве источника углерода используют глицерин, глюкозу, метанол.
Устойчивость к антибиотикам. Клетки проявляют устойчивость к зеоцину (до 2000 мкг/мл), обусловленную внесением в геном при трансформации линеаризованной плазмидой pPICZαA:ZZ-ANG гена Sh-ble.
Продуктивность. Заявляемый штамм обеспечивает синтез рекомбинантного химерного белка ангиогенина человека ZZ-ANG в количестве 200 мг на литр культуральной среды при наработке белка, как в примере 4, по результатам электрофоретического анализа и замера концентрации белка.
Пример 4. Биосинтез и очистка рекомбинантного химерного белка ангиогенина человека ZZ-ANG из культуральной жидкости заявляемого штамма Pichia pastoris X-33/pPICZαA:ZZ-ANG.
Индивидуальную колонию клеток заявленного штамма дрожжей Pichia pastoris переносят в колбу с 25 мл среды GY (пептон 2%, дрожжевой экстракт 1%, глицерин 1%), выращивают на орбитальном шейкере при 25°С-30°С и 200-250 об/мин в течение 48 часов. После 2-х суток предварительного роста начинают индукцию метанолом, добавляя 10% метанол до конечной концентрации 0,5% через каждые 24 часа в течение 4-х суток. Клетки отделяют центрифугированием при 3500 g в течение 20 мин при +4°С, к супернатанту добавляют сульфат аммония до концентрации 40-60% от насыщения при 4°С и инкубируют при 4°С около 12 часов. Осадок белка получают центрифугированием при 4°С и 1000g в течение 30 мин. Осадок растворяют в 10 mM Na-фосфатном буфере и проводят диализ против 10 mM Na-фосфатного буфера при +4°С. Раствор белка фильтруют через 0,45 мкм фильтр и проводят хроматографическую очистку на DEAE сефарозе FF, при этом, по результатам электрофоретического анализа, наиболее чистым получается не связавшийся белок. На фиг. 4 показан полученный результат очистки рекомбинантного ангиогенина человека.
Пример 5. Проверка функциональной активности рекомбинантного химерного ангиогенина человека.
Ангиогенную активность рекомбинантного химерного ангиогенина человека проверяли на хориоаллантоисной оболочке куриных эмбрионов in ovo следующим способом (14): Оплодотворенные куриные яйца инкубировали при 37°С и влажности примерно 60%. На 4-й день эмбриональный яйца вскрывали в стерильных условиях под ламинаром, предварительно обработав 70% спиртом. Предварительно через маленькое отверстие в скорлупе со стороны острой вершины яйца шприцом отбирали по 2-3 мл альбумина, чтобы аллантоисная оболочка отделилась от скорлупы. На верхнем боку яйца при помощи минидрели и отрезного круга в скорлупе вырезали окно квадратной формы размером примерно 1,5*1,5 см и закрывали стерильной пленкой. Яйца помещали обратно в инкубатор. На 10-эмбриональный день на мембрану наносили препараты белка следующим способом: на предварительно простерилизованные стерильные бумажные фильтры диаметром ок. 1 см наносили по 10 мкл стерильного препарата белка с концентрациями 0,1 и 0,2 г/л и стерильный буфер как отрицательный контроль. В качестве положительного контроля использовали бактериальный препарат химерного ангиогенина человека. Фильтры высушивали под ламинаром и укладывали на аллантоисную мембрану, таким образом, чтобы та сторона фильтра, на которую наносили раствор белка, лежала на аллантоисной мембране. Окно закрывали стерильной пленкой и помещали яйца в инкубатор. Через 72 часа инкубации фильтры снимали с аллантоисной мембраны и оценивали результаты. В случае положительного ответа, на мембране наблюдался характерный рост капиллярной сетки в пределах круга, на котором находился препарат белка.
Четкий положительный ответ наблюдался при аппликации на мембрану 1 мкг химерного ангиогенина человека.
Источники информации
1. Комолова Г.С, Ионова И.И. Биологические функции и лечебные свойства ангиогенина // Экспериментальная и клиническая фармакология. 2010. Т. 73. №3. С. 40-44.
2. Tello-Montoliu A, Patel JV, Lip GY. Angiogenin: a review of the pathophysiology and potential clinical applications // J Thromb Haemost. 2006 Sep; 4(9):1864-74.
3. Mertvetsov N.P. Chemo-enzymatic synthesis of the human angiogenin gene. Construction of bacterial strains, producers of human angiogenin. Elaboration of a technology for the purification and preparation of angiogenin // Russian Chemical Bulletin. 1996. T. 45. №12. P. 2688-2697.
4. Никонова A.A., Серегин С.В., Чикаев H.A., Мишин В.П., Бабкина И.Н., Мертвецов Н.П. Экспрессия синтетического гена ангиогенина человека в клетках Е. coli // Биоорган, химия. - 1996, т. 22. - с. 891-893.
5. Studier FW, Rosenberg АН, Dunn JJ, Dubendorff JW. Use of T7 RNA polymerase to direct expression of cloned genes // Methods Enzymol. 1990; 185:60-89.
6. Yoon JM, Kim SH, Kwon OB, Han SH, Kim BK. High level expression of soluble angiogenin in Escherichia coli // Biochem Mol Biol Int. 1999 Feb; 47(2):267-73.
7. Mayer H, Rapin AM, Schmidt G, Boman HG. Immunochemical studies on lipopolysaccharides from wild-type and mutants of Escherichia coli K-12 // Eur J Biochem. 1976. 66(2). P. 357-368.
8. Petsch D., Anspach F.B. Endotoxin removal from protein solutions // J Biotechnol. 2000. 76 (2-3). P. 97-119. Review.
9. Cregg J.M. Methods in Molecular Biology: Pichia Protocols / Second Edition. Humana Press, 2007. 389. P. 1-10.
10. Xia WR, Fu WL, Cai L, Cai X, Wang YY, Zou MJ, Xu DG. Expression, purification and characterization of recombinant human angiogenin in Pichia pastoris // Biosci Biotechnol Biochem. 2012; 76(7):1384-8.
11. Hatfield G.W., Roth D.A. Optimizing scaleup yield for protein production: Computationally Optimized DNA Assembly (CODA) and Translation Engineering // Biotechnol Annu Rev. 2007. 13. P. 27-42. Review.
12. Lund A.H., Duch M., Pedersen F.S. Increased cloning efficiency by temperature-cycle ligation // Nucleic Acids Research. 1996;24(4):800-801.
13. Cregg J.M. Methods in Molecular Biology: Pichia Protocols / Second Edition. Humana Press, 2007. 389. P. 1-10.
14. Valdes TI, Kreutzer D, Moussy F. The chick chorioallantoic membrane as a novel in vivo model for the testing of biomaterials. J Biomed Mater Res. 2002 Nov; 62(2):273-82.
1. Рекомбинантная плазмида pPICZaA:ZZ-ANG, обеспечивающая биосинтез и секрецию химерного белка ангиогенина человека ZZ-ANG (SEQ ID NO: 1), состоящего из аминокислотной последовательности двух IgG-связывающих доменов белка A (SEQ ID NO: 2) и ангиогенина человека (SEQ ID NO: 3), соединенных между собой пептидным линкером (SEQ ID NO: 4), имеющая размер 4228 п.о. и состоящая из следующих элементов:
а) AOX1 promoter - 5’-концевая область промотора алкоголь оксидазы: 1-940;
б) Alpha factor signal peptide – участок, кодирующий N-концевой сигнальный пептид из Saccharomyces cerevisiae: 941-1207;
в) ZZ - 5'-концевой фрагмент синтетического гена ZZ_ANG, кодирующий аминокислотную последовательность двух IgG-связывающих доменов (ZZ) белка A Staphylococcus aureus: 1214 – 1567 п.о.;
г) Link – фрагмент, кодирующий аминокислотную последовательность линкера, связывающего последовательность IgG–связывающей области ZZ белка A из Staphylococcus aureus и последовательность ангиогенина человека: 1568 – 1573 п.о.;
д) ANG - 3'-концевой фрагмент синтетического гена ZZ_ANG, кодирующий аминокислотную последовательность ангиогенина человека: 1574 – 1945 п.о.;
е) AOX1 transcription terminator - терминатор транскрипции: 1973-2317 п.о.;
ж) TEF1 promoter – эукариотический промотор: 2318-2729 п.о.;
з) EM7 promoter – бактериальный промотор: 2730-2797 п.о.;
и) Zeo(R) – ген Sh ble устойчивости к селективному антибиотику зеоцину: 2798-3172 п.о.;
к) CYC1 transcription terminator - терминатор транскрипции гена цитохрома С1: 3173-3490 п.о.;
л) pUC origin – бактериальная точка начала репликации pUC: 3501 - 4174 п.о.,
при этом указанная плазмида характеризуется физической картой, приведенной на фиг. 1.
2. Штамм дрожжей Pichia pastoris X-33/pPICZaA:ZZ-ANG – продуцент рекомбинантного химерного белка ангиогенина человека ZZ-ANG, состоящего из аминокислотной последовательности двух IgG-связывающих доменов белка A (ZZ) и ангиогенина человека (ANG), соединенных между собой пептидным линкером, полученный путем трансформации дрожжей Pichia pastoris X-33 линеаризованной плазмидой pPICZaA:ZZ-ANG по п.1.