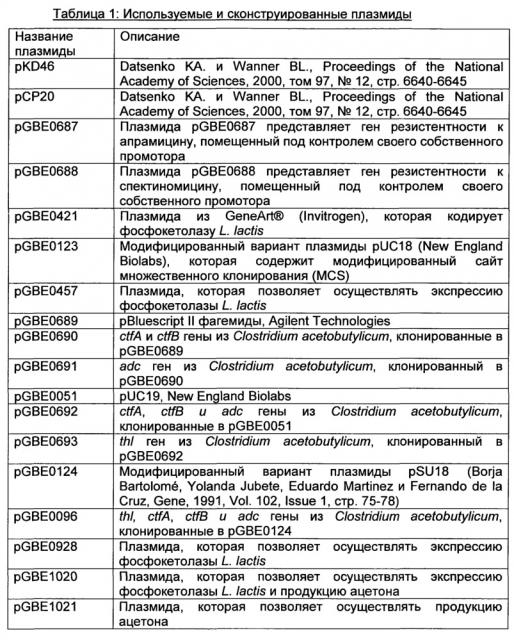
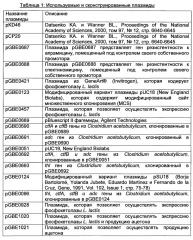
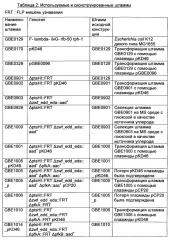
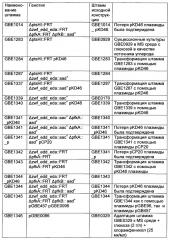
Рекомбинантный микроорганизм для получения полезных метаболитов
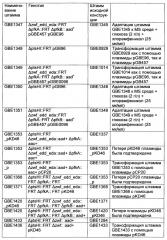
Иллюстрации
Показать всеГруппа изобретений относится к области биотехнологии. Предложена рекомбинантная бактерия для получения ацетона, которая содержит ген, кодирующий фосфокетолазу, в которой инактивирован путь Эмбдена-Мейерхофа-Парнаса путем удаления генов, кодирующих фосфофруктокиназу, и в которой инактивирована окислительная ветвь пентозафосфатного пути в результате удаления генов, кодирующих глюкозо-6-фосфатдегидрогеназу. Предложен способ получения ацетона из глюкозы с использованием указанной бактерии. Группа изобретений позволяет увеличить продукцию ацетона. 3 н. и 5 з.п. ф-лы, 3 ил., 5 табл., 16 пр.
Реферат
Настоящее изобретение относится к рекомбинантному микроорганизму, который характеризуется наличием фосфокетолазной активности и имеет сниженный или инактивированный путь Эмбдена-Мейерхофа-Парнаса (ЕМРР) путем инактивации гена(ов), который(е) кодирует(ют) фосфофруктокиназу, или путем снижения фосфофруктокиназной активности по сравнению с немодифицированным микроорганизмом или таким, который не обладает фосфофруктокиназной активностью, и имеет сниженное или инактивированное окислительное ответвление пентозафосфатного пути (РРР) путем инактивации гена(ов), которые кодируют глюкозо-6-фосфатдегидрогеназу, или путем снижения глюкозо-6-фосфатдегидрогеназной активности по сравнению с немодифицированным микроорганизм или таким, который не обладает глюкозо-6-фосфатдегидрогеназной активностью. Такой микроорганизм может использоваться для продукции полезных метаболитов, таких, как ацетон, изобутен или пропен.
На протяжении нескольких последних десятилетий специалисты-практики в области метаболического инжиниринга прилагали усилия, чтобы обеспечить биологические решения для осуществления продукции химических соединений, обеспечивая, таким образом, альтернативы для более традиционных химических процессов. В общем случае, биологически решения позволяют использовать возобновляемые источники сырья (например, сахара) и конкурировать с существующими процессами на основе нефтехимии. Многоэтапное биологическое решение для получения химического вещества типично включает микроорганизм в качестве катализатора для превращения источника сырья до целевой молекулы. Полный набор ферментативных реакций для продукции определенной целевой молекулы может быть разделен на те, которые относятся к путям метаболизма центрального атома углерода, и те, которые относятся к пути, специфическому для продукта. Реакции, которые относятся к центральному атому углерода, и пути, специфические для продукта, являются связанными тем, что окислительно-восстановительные (типично, НАД(Ф)Н) и энергетические (типично, АТФ) компоненты каждого из них и каждая ферментативная реакция должны обеспечиваться в общем балансе, который осуществляет свой вклад в конкурентность этого процесса. Исторически пути центрального атома углерода гетеротрофов, которые выращиваются на сахарах, были описаны как путь Эмбдена-Мейерхофа-Парнаса (ЕМРР), пентозафосфатный путь (РРР), путь Энтнера-Дудорова (EDP), и фосфокетолазный путь (РКР) (смотри Gottschalk (1986), Bacterial Metabolism, 2ое издание, Springer- Verlag, New York). Каждый центральный путь или комбинация центральных путей обладает преимуществами и недостатками в отношении их специфической целевой молекулы. Для того чтобы обеспечить конкурентные биопроцессы, были описаны рекомбинантные микроорганизмы с модификациями, которые вовлекают ЕМРР, РРР и EDP (M. Emmerling и др., Metab. Eng. 1: 117 (1999); L. 0. Ingram и др., Appl. Environ. Microbiol. 53: 2420 (1987); С.Т. Trinh и др., Appl. Environ. Microbiol. 74: 3634 (2008)). Совсем недавно были описаны рекомбинантные микроорганизмы с модификациями, которые вовлекают РКР (смотри Sonderegger и др. Appl. Environ. Microbiol. 70 (2004), 2892-2897, патент США №7,253,001, Chinen и др. J. Biosci. Bioeng. 103 (2007), 262-269, патент США №7,785,858; Fleige и др., Appl. Microbiol. Cell Physiol.91 (2011), 769-776).
EMPP превращает 1 моль глюкозы в 2 моля пирувата (PYR). В том случае, когда ацетил-СоА является желательным, 1 моль PYR может превращаться в 1 моль ацетил-СоА при сопутствующем образовании 1 моля С02 и 1 моля НАДФ. Подытоженные реакции являются приведенными в уравнении 1.
глюкоза+2АДФ+2H3PO4+2СоА+4НАД+→
2 ацетил-СоА+2CO2+2АТФ+2H2O+4НАДФ+4H+
(Уравнение 1)
РРР обеспечивает средства для превращения 1 моля глюкозы в 1 моль CO2 и 2 моля НАДФН при сопутствующем образовании 0,67 моля фруктоза-6-фосфата (F6P) и 0,33 моля глицеральдегид-3-фосфата (GAP). F6P и GAP, образованные таким образом, должны подвергаться метаболизму с помощью реакций других путей, например, с помощью EMPP. EDP превращает 1 моль глюкозы в 1 моль GAP и 1 моль PYR при сопутствующем образовании 1 моля НАДФН. Как и с помощью РРР, GAP, образованный таким образом, должны подвергаться метаболизму с помощью реакций других путей. РКР обеспечивает средства для превращения 1 моля глюкозы в 1 моль GAP и 1,5 моля ацетилфосфата (АсР). Когда ацетил-СоА является желательным, 1 эквивалент АсР плюс 1 эквивалент коэнзима А (СоА) может превращаться в 1 эквивалент ацетил-СоА и 1 эквивалент неорганического фосфата (Pi) при действии фосфотрансацетилазы.
Для специфических целевых молекул, имеющих происхождение от остатков АсСоА, полученных путем РКР, и приблизительно нейтральный окислительно-восстановительный потенциал к АсСоА остаткам, существует дефицит в отношении общего энергетического баланса. РКР (и, подобно ему, РРР и EDP) не образует АТФ для превращения глюкозы в глюкоза-6-фосфат. В случае зависимого от фосфоенолпирувата (PEP) потребления глюкозы PEP должен образовываться с помощью других способов, например, посредством EMPP. Повторное использование GAP с помощью РКР усугубляет вопрос, в частности, тогда, когда специфический для продукта путь обеспечивает незначительное количество АТФ.
Sonderegger (в приводившейся выше ссылке) и патент США №7,253,001 раскрывают рекомбинантные штаммы Saccharomyces cerevisiae, которые включают нативную или сверхэкспрессированную фосфокетолазную активность вместе со сверхэкспрессированной фосфотрансацетилазой для повышения выхода в процессе превращения смесей глюкоза/ксилоза в этанол. Эти штаммы демонстрируют независимое от PEP потребление глюкозы как для механизма ЕМРР, так и РРР.
Chinen (в приводившейся выше ссылке) и патент США №7,785,858 раскрывают рекомбинантную бактерию, выбранную из группы, которая состоит из семейства Enterobacteriaceae, бактерий Coryneform, бактерий Bacillus, которые имеют повышенную фосфокетолазную активность для превращения глюкозы в целевые молекулы, которые продуцируются посредством промежуточного ацетил-СоА, включая группу, которая состоит из L-глутаминовой кислоты, L-глутамина, L-пролина, L-аргинина, L-лейцина, L-цистеина, сукцината и полигидроксибутирата. Эти штаммы демонстрируют зависимое от РЕР-потребление глюкозы при использовании механизма ЕМРР. Примечательным является то, что активность фосфофруктокиназы в бактерии в соответствии с патентом США №7,785,858 является сниженной по сравнению с таковой для штамма дикого типа или немодифицированного типа (смотри страницу 33).
Вне зависимости от того, использует ли частный микроорганизм независимое от PEP потребление глюкозы или зависимое от PEP потребление глюкозы, это влияет на общий энергетический баланс процесса. Например, штаммы S. cerevisiae естественным образом используют независимое от PEP потребление глюкозы, в то время как штаммы Escherichia coli естественным образом используют зависимое от PEP потребление глюкозы. Были раскрыты штаммы Е. coli, в которых зависимое от PEP потребление глюкозы заменялось независимым от PEP потреблением глюкозы. Flores и др. (Metabolic Engineering (2005) 7, 70-87 и патент США №7,371,558. В частности, патент США №7,371,558 раскрывает модификацию потребления глюкозы для повышения выхода превращения глюкозы в 1,3-пропандиол. Эти штаммы демонстрируют независимое от PEP потребление глюкозы как с механизмом ЕМРР, так и РРР, в частности, при отсутствии фосфокетолазной активности.
Существует потребность в развитии рекомбинантных микроорганизмов, которые включают центральный атом углерода и пути, специфические для продукта, что максимизирует превращение источника сырья в продукт с помощью наилучшего приспособления окислительно-восстановительных условий и энергетических ограничений ферментативных реакций. Заявители решили эту необходимость путем обеспечения воплощений, как определено в пунктах формулы изобретения.
Таким образом, настоящее изобретение относится к рекомбинантному микроорганизму, который характеризуется:
a) наличием фосфокетолазной активности;
b) (i) сниженным или инактивированным путем Эмбдена-Мейерхофа-Парнаса (ЕМРР) посредством инактивации гена(ов), который(е) кодирует(ют) фосфофруктокиназу, или путем снижения фосфофруктокиназной активности по сравнению с немодифицированным микроорганизмом; или
(ii) отсутствием активности фосфофруктокиназы,
и
c) (i) наличием сниженного или инактивированного окислительного ответвления пентозафосфатного пути (РРР) путем инактивации гена(ов), который(е) кодирует(ют) глюкозо-6-фосфатдегидрогеназу, или путем снижения глюкозо-6-фосфатдегидрогеназной активности по сравнению с немодифицированным микроорганизмом; или
(ii) отсутствием активности глюкозо-6-фосфатдегидрогеназы.
Микроорганизм в соответствии с настоящим изобретением характеризуется наличием фосфокетолазной активности, так, что это повышает поток продуцируемого ацетил-СоА. Обычно, микроорганизм превращает глюкозу с помощью пути Эмбдена-Мейерхофа-Парнаса в пируват, который потом может превращаться в ацетил-СоА с помощью фермента пируватдегидрогеназы. Однако такое превращение сопровождается высвобождением СО2 и, таким образом, теряется один атом углерода, который мог бы использоваться в продукции полезных метаболитов. Для того чтобы увеличить количество ацетил-СоА в микроорганизме, является, таким образом, желательным, чтобы ацетил-СоА образовывался с помощью отличного пути для того, чтобы избежать потери атомов углерода. Путем использования микроорганизма, обладающего фосфокетолазной активностью, фосфат и фруктоза-6-фосфат превращаются в эритроза-4-фосфат и ацетилфосфат, а фосфотрансацетилазы далее превращают ацетилфосфат в ацетил-СоА без потери атома углерода. Таким образом, в конце процесса выход ацетил-СоА может повышаться путем применения микроорганизма, обладающего фосфокетолазной активностью. Такой микроорганизм является способным к превращению глюкозы в ацетил-СоА без потери атома углерода. Рекомбинантные микроорганизмы, в которых фосфокетолаза экспрессируется естественным образом или гетерологично, раскрываются патентах США №7,785,858 и 7,253,001.
Термин "фосфокетолазная активность", как используется в настоящем изобретении, означает ферментативную активность, которая является способной к превращению
D-ксилулоза-5-фосфата в D-глицеральдегид-3-фосфат в соответствии со следующей реакцией:
D-ксилулоза-5-фосфат+фосфат→D-глицеральдегид-3-фосфат+ацетилфосфат+вода,
или такой, которая является способной катализировать представленную выше реакцию, а также является способной превращать D-фруктоза-6-фосфат в D-эритроза-4-фосфат в соответствии со следующей реакцией:
D-фруктоза-6-фосфат+фосфат→ацетилфосфат+D-эритроза-4-фосфат+вода.
Бывшие фосфокетолазы обычно классифицируются в соответствии с ЕС 4.1.2.9, а более поздние - ЕС 4.1.2.22. Оба типа фосфокетолаз могут использоваться в рамках данного изобретения. Фигура 1 показывает схемы для общих реакций при использовании двух возможностей фосфокетолазы, как описывается в данной заявке.
Такая ферментативная активность может быть измерена с помощью анализов, которые являются известными в области техники. Пример такого анализа является приведенным в разделе Примеры, представленном ниже.
В контексте настоящего изобретения микроорганизм, который обладает фосфокетолазной активностью, может, например, представлять собой микроорганизм, который естественным образом обладает фосфокетолазной активностью, или микроорганизм, который природным образом не обладает фосфокетолазной активностью и был генетически модифицирован для экспрессии фосфокетолазы, или микроорганизм, который естественным образом обладает фосфокетолазной активностью и который был генетически модифицирован, например, трансформирован с помощью нуклеиновой кислоты, например, вектора, который кодирует фосфокетолазу, для того, чтобы повысить фосфокетолазную активность у указанного микроорганизма.
Микроорганизмы, которые наследственно, то есть природным образом, обладают фосфокетолазной активностью, являются известными в области техники, и любой из них может использоваться в контексте настоящего изобретения.
Является также возможным в контексте настоящего изобретение, чтобы микроорганизм представлял собой микроорганизм, который природным образом обладает фосфокетолазной активностью, но который является генетически модифицированным так, что включает нуклеотидную последовательность, которая позволяет осуществлять экспрессию фосфокетолазы. Подобно этому, микроорганизм может также представлять собой микроорганизм, который естественным образом обладает фосфокетолазной активностью, но который является генетически модифицированным так, что фосфокетолазная активность повышается, например, путем введения экзогенной нуклеотидной последовательности, кодирующей фосфокетолазу.
Генетическая модификация микроорганизмов для экспрессии фермента, который представляет интерес, будет подробно описана ниже.
Фосфокетолаза в соответствии с данным изобретением, которая экспрессируется в микроорганизме, может представлять собой любую фосфокетолазу, в частности, фосфокетолазу из прокариотических или эукариотических организмов. Описывают, например, прокариотические фосфокетолазы из Lactococcus lactis, и такой пример является приведенным в разделе Примеры.
В предпочтительном воплощении настоящего изобретения фосфокетолаза представляет собой фермент, который включает аминокислотную последовательность, как кодируется с помощью SQ0005, показанной в разделе Примеры, или последовательность, которая является, по крайней мере, на n% идентичной такой аминокислотной последовательности и имеющая активность фосфокетолазы, где n представляет собой целое число от 10 до 100, предпочтительно 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99.
Предпочтительно, когда степень идентичности определяется путем сравнения соответствующей последовательности с аминокислотной последовательностью какой-либо одной из упомянутых выше SEQ ID NO. Тогда, когда последовательности, которые сравнивают, не имеют одинаковую длину, степень идентичности предпочтительно либо относится к проценту аминокислотных остатков в более короткой последовательности, которые являются идентичными аминокислотным остаткам в более длинной последовательности, или к проценту аминокислотных остатков в более длинной последовательности, которые являются идентичными аминокислотным остаткам в более короткой последовательности. Степень идентичности последовательности может быть определена в соответствии со способами, известными в данной области техники при использовании предпочтительно приемлемых компьютерных алгоритмов, таких как CLUSTAL.
При использовании метода Clustal анализа для определения, является ли частная последовательность, например, на 80% идентичной эталонной последовательности, могут использоваться параметры по умолчанию или такие параметры могут предпочтительно быть такими, как описано ниже: Матрица: матрица блоков аминокислотных замен 30; штраф за внесение пробела: 10,0; штраф за продление пробела: 0,05; задержка отклонение: 40; протяженность зоны пробела: 8 для сравнения аминокислотных последовательностей. Для сравнения нуклеотидных последовательностей штраф за продление пробела предпочтительно устанавливают на уровне предпочтительно 5,0. Предпочтительно, когда степень идентичности подсчитывается на протяжении полной длины последовательности.
Фосфокетолаза, которая экспрессируется в микроорганизме в соответствии с изобретением, может представлять собой существующую в природе фосфокетолазу или она может быть фосфокетолазой, которая получена из существующей в природе фосфокетолазы, например, путем введения мутаций или других изменений, которые, например, изменяют или улучшают ферментативную активность.
Способы модификации и/или улучшения желательных ферментативных активностей белков являются хорошо известными квалифицированному специалисту в данной области техники и включают, например, случайный мутагенез или сайт-направленный мутагенез и последующую селекцию ферментов, обладающих желательными свойствами, или подходы так называемой "направленной эволюции".
Например, для генетической модификации в прокариотической клетке, молекула нуклеиновой кислоты, которая кодирует фосфокетолазу, может быть введена в плазмиды, которые позволяют осуществлять мутагенез или модификацию последовательности с помощью рекомбинации последовательностей ДНК. Стандартные способы (смотри Sambrook и Russell (2001), Molecular Cloning: A Laboratory Manual, CSH Press, Cold Spring Harbor, NY, USA) позволяют осуществлять замены оснований или прибавлять существующие в природе или синтетические последовательности. ДНК фрагменты могут быть лигированы при использовании адаптеров и линкеров, комплементарных этим фрагментам. Кроме того, могут использоваться средства инжиниринга, которые обеспечивают приемлемые сайты рестрикции или удаление избыточной ДНК или рестрикционных сайтов. В тех случаях, когда инсерции, делеции или замены являются возможными, могут использоваться in vitro мутагенез, "восстановление праймера", рестрикция или лигирование. В общем случае, анализ последовательности, рестрикционный анализ и другие способы биохимии и молекулярной биологии осуществляются как способы анализа. Полученные варианты фосфокетолазы потом подвергают анализу на желаемую активность, например, ферментативную активность, с помощью анализа так, как описано выше, и, в частности, на их повышенную ферментативную активность.
Как описано выше, микроорганизм в соответствии с изобретением может представлять собой микроорганизм, который был генетически модифицирован путем введения молекулы нуклеиновой кислоты, которая кодирует фосфокетолазу. Таким образом, в предпочтительном воплощении рекомбинантный микроорганизм представляет собой рекомбинантный микроорганизм, который был генетически модифицирован для наличия повышенной фосфокетолазной активности. Этого можно достичь, например, путем трансформации микроорганизма с помощью нуклеиновой кислоты, которая кодирует фосфокетолазу. Подробное описание генетической модификации микроорганизмов будет дополнительно приведено ниже. Предпочтительно, когда молекула нуклеиновой кислоты, которая встраивается в микроорганизм, представляет собой молекулу нуклеиновой кислоты, которая является гетерологичной по отношению к микроорганизму, то есть, она в природе не существует в указанном микроорганизме.
В контексте настоящего изобретения "повышенная активность" означает, что экспрессия и/или активность фермента, в частности, фосфокетолазы в генетически модифицированном микроорганизме, составляет, по крайней мере, 10%, предпочтительно, по крайней мере, на 20%, более предпочтительно, по крайней мере, 30% или 50%, даже более предпочтительно, по крайней мере, 70% или 80% и особенно предпочтительно, по крайней мере, 90% или 100% выше, чем в немодифицированном микроорганизме. В более предпочтительных воплощениях повышение экспрессии и/или активности может составлять, по крайней мере, 150%, по крайней мере, 200% или, по крайней мере, 500%. В особенно предпочтительных воплощениях экспрессия является, по крайней мере, 10-кратной, более предпочтительно, по крайней мере, в 100 раз и даже более предпочтительно, по крайней мере, в 1000 раз более высокой, чем в соответствующем немодифицированном микроорганизме.
Термин "повышенная" экспрессия/активность также относится к ситуации, в которой немодифицированный микроорганизм не экспрессирует соответствующий фермент, например, фосфокетолазу, так, что соответствующая экспрессия/активность в немодифицированном микроорганизме равна нулю.
Способы для измерения уровня экспрессии данного белка в клетке являются хорошо известными квалифицированному специалисту в данной области техники. В одном воплощении измерение уровня экспрессии осуществляют путем измерения количества соответствующего белка. Соответствующие способы являются хорошо известными квалифицированному специалисту в данной области техники и включают Вестер-блоттинг, ELISA и т.д. В другом воплощении измерение уровня экспрессии осуществляют путем измерения количества соответствующей РНК. Соответствующие способы являются хорошо известными квалифицированному специалисту в данной области техники и включают, например, Нозерн-блоттинг.
Способы измерения ферментативной активности фосфокетолазы являются хорошо известными в области техники и уже были описаны выше.
Микроорганизм в соответствии с настоящим изобретением дополнительно характеризуется наличием сниженного или инактивированного пути Эмбдена-Мейерхофа-Парнаса (ЕМРР) путем инактивации гена(ов), который(ые) кодирует(ют) фосфофруктокиназу, или путем снижения фосфофруктокиназной активности по сравнению с немодифицированным микроорганизмом или такими, которые не обладают фосфофруктокиназной активностью. Таким образом, микроорганизм представляет собой либо микроорганизм, который естественным образом обладает ЕМРР, включая фосфофруктокиназную активность, но который был модифицирован, в частности, генетически модифицирован, так, что фосфофруктокиназная активность является либо полностью устраненной, либо сниженной по сравнению с соответствующим немодифицированным микроорганизмом, или микроорганизм представляет собой микроорганизм, который естественным образом не обладает фосфофруктокиназной активностью.
Как уже было упомянуто выше, тогда, когда глюкоза подвергается процессингу в помощью ЕМРР до ацетил-СоА, один атом углерода теряется путем высвобождения CO2 на последнем этапе. Путем введения фосфокетолазы этой потере можно избежать. Поскольку фруктоза-6-фосфат представляет собой субстрат для фосфокетолазы, является желательным, чтобы пул фруктоза-6-фосфата поддерживался на высоком уровне в микроорганизме для того, чтобы повысить выход ацетил-СоА. Поскольку фруктоза-6-фосфат представляет собой субстрат для фермента пути Эмбдена-Мейерхофа-Парнаса, то есть, для фосфофруктокиназы, рекомбинантный микроорганизм в соответствии с настоящим изобретением имеет сниженную фосфофруктокиназную активность по сравнению с немодифицированным микроорганизмом, или ген(ы), который(ые) кодирует(ют) фосфофруктокиназу был(были) инактивирован(ы). Это обеспечивает то, что поток фруктоза-6-фосфата направляется на фосфокетолазу и продукцию ацетил-СоА без потери CO2, поскольку фруктоза-6-фосфат или большая часть фруктоза-6-фосфата не может более подвергаться процессингу при использовании пути Эмбдена-Мейерхофа-Парнаса. Рекомбинантные микроорганизмы, в которых фосфокетолаза естественным образом или гетерологично экспрессируется и которые имеют сниженную фосфофруктокиназную активность, описываются в патенте США №7,785,858.
"Фосфофруктокиназная активность" означает ферментативную активность, которая превращает АТФ и фруктоза-6-фосфат в АДФ и фруктоза-1,6-бисфосфат (ЕС 2.7.1.11). Эта ферментативная активность может быть измерена с помощью анализов, которые являются известными в области техники, как, например, описывается Kotlarz и др. (Methods Enzymol. (1982) 90, 60-70).
Термин "микроорганизм, который характеризуется наличием сниженного или инактивированного пути Эмбдена-Мейерхофа-Парнаса (ЕМРР) путем инактивации гена(ов), которые(ые) кодирует(ют) фосфофруктокиназу или путем снижения фосфофруктокиназной активности по сравнению с немодифицированным микроорганизмом" предпочтительно относится к микроорганизму, в котором инактивация гена(ов), которые(ые) кодирует(ют) фосфофруктокиназу или путем снижения фосфофруктокиназной активности по сравнению с немодифицированным микроорганизмом, достигается путем генетической модификации микроорганизма, что ведет к указанной инактивации или снижению.
В предпочтительном воплощении рекомбинантный микроорганизм в соответствии с настоящим изобретением представляет собой рекомбинантный микроорганизм, который имеет инактивированный путь Эмбдена-Мейерхофа-Парнаса (ЕМРР) путем инактивации гена(ов), которые(ые) кодирует(ют) фосфофруктокиназу. Инактивация гена(ов), которые(ые) кодирует(ют) фосфофруктокиназу в контексте настоящего изобретения означает, что ген(ы), которые(ые) кодирует(ют) фосфофруктокиназу, и которые присутствуют в микроорганизме, является(ются) инактивированным(и), так, что они уже не экспрессируют и/или не приводят к синтезу функциональной фосфофруктокиназы. Инактивация может достигаться с помощью различных путей, известных в уровне техники. Инактивация может, например, достигаться путем разрыва гена(ов), который(е) кодирует(ют) фосфофруктокиназу, или путем делеции указанного(ых) гена(ов) путем введения селективного маркера. Альтернативно, промотор гена(ов), который(ые) кодирует(ют) фосфофруктокиназу, может подвергаться мутации так, что ген уже не транскрибируется в мРНК. Другие пути инактивации гена(ов), который(ые) кодируют фосфофруктокиназу, известных в уровне техники, представляют собой: экспрессию полинуклеотида, который кодирует РНК, имеющую нуклеотидную последовательность, комплементарную транскрипту гена(ов) фосфофруктокиназы, так что мРНК может уже не транслироваться в белок, экспрессию полинуклеотида, который кодирует РНК, которая супрессирует экспрессию указанного(ых) гена(ов) с помощью эффекта РНКи; экспрессию полинуклеотида, который кодирует РНК, обладающую активностью специфического расщепления транскрипта указанного(ых) гена(ов); или экспрессию полинуклеотида, который кодирует РНК, которая супрессирует экспрессию указанного(ых) гена(ов) с помощью эффекта косупрессии. Такие полинуклеотиды могут быть встроены в вектор, который может быть введен в микроорганизм путем трансформации, для достижения инактивации гена(ов), который(ые) кодирует(ют) фосфофруктокиназу.
Термин "инактивация" в контексте настоящего изобретения предпочтительно означает полную инактивацию, то есть, означает то, что микроорганизм не демонстрирует фосфофруктокиназной активности. Это означает, в частности, что микроорганизм не демонстрирует фосфофруктокиназной активности, независимой от условий выращивания.
Предпочтительно, "инактивация" означает, что ген(ы), который(ые) кодирует(ют) фосфофруктокиназу, который(ые) присутствует(ют) в микроорганизме, являются генетически модифицированными так, что предотвращают экспрессию фермента. Этого можно достичь, например, с помощью делеции гена или его частей, где делеция его частей предотвращает экспрессию фермента, или путем нарушения гена либо в его кодирующем участке, либо в промоторном участке, где нарушение оказывает эффект, который заключается в том, что белок не экспрессируется или экспрессируется дисфункциональный белок.
В предпочтительном воплощении рекомбинантный микроорганизм в соответствии с настоящим изобретением представляет собой рекомбинантный микроорганизм, который имеет сниженный путь Эмбдена-Мейерхофа-Парнаса (ЕМРР) путем уменьшения фосфофруктокиназной активности по сравнению с немодифицированным микроорганизмом. Предпочтительно, такое снижение достигается путем генетической модификации микроорганизма. Этого можно достичь, например, с помощью случайного мутагенеза или сайт-направленного мутагенеза промотора и/или фермента и последующей селекции промоторов и/или ферментов, которые обладают желательными свойствами, или с помощью комплементарных нуклеотидных последовательностей или эффекта РНКи, как описано выше. Подробное описание генетической модификации микроорганизмов будет представлено дополнительно ниже.
В контексте настоящего изобретения "сниженная активность" означает, что экспрессия и/или активность фермента, в частности, фосфофруктокиназы, в генетически модифицированном микроорганизме является, по крайней мере, на 10%, предпочтительно, по крайней мере, 20%, более предпочтительно, по крайней мере, 30% или 50%, даже более предпочтительно, по крайней мере, 70% или 80% и особенно предпочтительно, по крайней мере, 90% или 100% ниже, чем в соответствующем немодифицированном микроорганизме. Способы для измерения уровня экспрессии данного белка в клетке являются хорошо известными квалифицированному специалисту в данной области техники. Анализы для измерения сниженной ферментативной активности фосфофруктокиназы являются известными в уровне техники.
В другом воплощении микроорганизм в соответствии с настоящим изобретением представляет собой микроорганизм, который не обладает фосфофруктокиназной активностью. Это предпочтительно означает, что такой микроорганизм в природе не обладает фосфофруктокиназной активностью. Это означает, что такой микроорганизм в природе не содержит в своем геноме нуклеотидной последовательности, которая кодирует фермент с фосфофруктокиназной активностью. Примеры таких микроорганизмов представляют собой Zymomonas mobilis (J.S. Suo и др., Nat. Biotechnol. 23:63 (2005)) и Ralstonia eutropha (C. Fleige и др., Appl. Microb. Cell Physiol. 91:769 (2011)).
Микроорганизм в соответствии с настоящим изобретением дополнительно характеризуется наличием сниженного или инактивированного окислительного ответвления пентозафосфатного пути (РРР) путем инактивации гена(ов), который(ые) кодирует(ют) глюкозо-6-фосфатдегидрогеназу, или путем снижения глюкозо-6-фосфатдегидрогеназной активности по сравнению с немодифицированным микроорганизмом или таким, который не обладает глюкозо-6-фосфатдегидрогеназной активностью. Таким образом, микроорганизм представляет собой либо микроорганизм, который естественным образом обладает РРР, включая глюкозо-6-фосфатдегидрогеназную активность, но который был модифицирован, в частности, генетически модифицирован, так, что глюкозо-6-фосфатдегидрогеназная активность является либо полностью отсутствующей, либо такой, которая является сниженной по сравнению с соответствующим немодифицированным микроорганизмом, или микроорганизм представляет собой микроорганизм, который в природе не обладает глюкозо-6-фосфатдегидрогеназной активностью.
Снижение или инактивация окислительного ответвления пентозафосфатного пути дополнительно повышает выход ацетил-СоА, поскольку глюкоза-6-фосфат не будет более прокачиваться через пентозафосфатный цикл. Весь или почти весь глюкоза-6-фосфат в микроорганизме будет превращаться в фруктоза-6-фосфат, который будет потом превращаться в ацетил-СоА.
"Глюкозо-6-фосфатдегидрогеназная активность" означает ферментативную активность, которая превращает глюкоза-6-фосфат и НАДФ+ в 6-фосфоглюконо-δ-лактон и НАДФН (ЕС 1.1.1.49). Эта ферментативная активность может быть измерена с помощью анализов, которые являются известными в области техники, как, например, те, которые описаны Noltmann и др. (J. Biol. Chem. (1961) 236, 1225-1230).
Термин "микроорганизм, который характеризуется наличием сниженного или инактивированного окислительного ответвления пентозафосфатного пути (РРР) путем инактивации гена(ов), который(ые) кодирует(ют) глюкозо-6-фосфатдегидрогеназу, или путем снижения глюкозо-6-фосфатдегидрогеназной активности по сравнению с немодифицированным микроорганизмом" предпочтительно относится к микроорганизму, в котором инактивация гена(ов), который(ые) кодирует(ют) глюкозо-6-фосфатдегидрогеназу или снижение глюкозо-6-фосфатдегидрогеназной активности по сравнению с немодифицированным микроорганизмом достигается путем генетической модификации микроорганизма, что ведет к указанной инактивации или снижению.
В предпочтительном воплощении рекомбинантный микроорганизм в соответствии с настоящим изобретением представляет собой рекомбинантный микроорганизм, который обладает инактивированным окислительным ответвлением пентозафосфатного пути (РРР) путем инактивации гена(ов), который(ые) кодирует(ют) глюкоза-6-фосфат дегидрогеназу. Инактивация гена(ов), который(ые) кодирует(ют) глюкозо-6-фосфатдегидрогеназу в контексте настоящего изобретения означает, что ген(ы), который(ые) кодирует(ют) глюкозо-6-фосфатдегидрогеназу, присутствующий(ие) в микроорганизме, является(ются) инактивированным(и) так, что они больше не экспрессируют и/или не приводят к синтезу функциональной глюкоза-6-фосфатдегидрогеназы. Инактивация может достигаться путем множества различных способов, известных в уровне техники. Инактивация может, например, достигаться путем нарушения гена(ов), который(е) кодирует(ют) глюкозо-6-фосфатдегидрогеназу, или делеции указанного(ых) гена(ов) с помощью введения селективного маркера. Альтернативно, промотор гена(ов), который(е) кодирует(ют) глюкозо-6-фосфатдегидрогеназу, может подвергаться мутации так, что этот(эти) ген(ы) больше не транскрибируется(ются) в мРНК. Другие пути для инактивации гена(ов), который(е) кодирует(ют) фосфофруктокиназу, известные в уровне техники, представляют собой: экспрессию полинуклеотида, который кодирует РНК, имеющую нуклеотидную последовательность, комплементарную транскрипту гена(ов) глюкозо-6-фосфатдегидрогеназы так, что мРНК не может более транслироваться в белок, экспрессию полинуклеотида, который кодирует РНК, супрессирующую экспрессию указанного(ых) гена(ов) посредством эффекта РНКи; экспрессию полинуклеотида, который кодирует РНК, имеющую активность специфического расщепления транскрипта указанного(ых) гена(ов); или экспрессию полинуклеотида, который кодирует РНК, которая супрессирует экспрессию указанного(ых) гена(ов) посредством эффекта косупрессии. Эти полинуклеотиды могут быть введены в вектор, который может быть введен в микроорганизм путем трансформации для достижения инактивации гена(ов), кодирующих глюкозо-6-фосфатдегидрогеназу.
Термин "инактивация" в контексте настоящего изобретения предпочтительно означает полную инактивацию, то есть, тот факт, что микроорганизм не демонстрирует активности глюкозо-6-фосфатдегидрогеназы. Это означает, в частности, то, что микроорганизм не демонстрирует активности глюкозо-6-фосфатдегидрогеназы, независимой от условий выращивания.
Предпочтительно, "инактивация" означает, что ген(ы), который(ые) кодирует(ют) глюкозо-6-фосфатдегидрогеназу которая присутствует в микроорганизме, является(ются) генетически модифицированными так, что предотвращают экспрессию фермента. Этого можно достичь, например, путем делеции гена или его частей, где делеция его частей предотвращает экспрессию фермента, или путем нарушения либо в кодирующем участке, либо в промоторном участке, где нарушение имеет эффект, который заключается в том, что белок не экспрессируется или экспрессируется дисфункциональный белок.
В предпочтительном воплощении рекомбинантный микроорганизм в соответствии с настоящим изобретением представляет собой рекомбинантный микроорганизм, который имеет сниженное окислительное ответвление пентозафосфатного пути (РРР) путем снижения активности глюкозо-6-фосфатдегидрогеназы по сравнению с немодифицированным микроорганизмом. Предпочтительно, такое снижение достигается путем генетической модификации микроорганизма. Этого можно достичь, например, путем случайного мутагенеза или сайт-направленного мутагенеза промотора и/или фермента, и последующей селекции промоторов и/или ферментов, которые обладают желательными свойствами или с помощью комплементарных нуклеотидных последовательностей или эффекта РНКи, как описано выше. Подробное описание генетической модификации микроорганизмов будет приведено ниже.
В контексте настоящего изобретения "сниженная активность" означает, что экспрессия и/или активность фермента, в частности, глюкоза-6-фосфатдегидрогеназы, в генетически модифицированном микроорганизме является, по крайней мере, на 10%, предпочтительно, по крайней мере, 20%, более предпочтительно, по крайней мере, 30% или 50%, даже более предпочтительно, по крайней мере, 70% или 80% и особенно предпочтительно, по крайней мере, на 90% или 100% ниже, чем в соответствующем немодифицированном микроорганизме. Способы для измерения уровня экспрессии данного белка в клетке являются хорошо известными квалифицированному специалисту в данной области техники. Анализы для измерения сниженной ферментативной активности глюкозо-6-фосфатдегидрогеназы являются известными в уровне техники.
В другом воплощении микроорганизм в соответствии с настоящим изобретением представляет собой микроорганизм, который не обладает активностью глюкозо-6-фосфатдегидрогеназы. Это предпочтительно означает, что такой микроорганизм естественным образом не обладает глюкозо-6-фосфатдегидрогеназной активностью. Это означает, что такой микр