S-кристаллическая форма хлористоводородного ивабрадина, способ ее получения и фармацевтическая композиция на основе этой формы
Иллюстрации
Показать всеИзобретение относится к новой S-кристаллической форме хлористоводородного ивабрадина, способу ее получения, и ее фармацевтической композиции. S-кристаллическая форма хлористоводородного ивабрадина имеет рентгеновскую порошковую дифрактограмму, содержащую характеристические пики в положениях, выраженных в градусах 2-тета: 8,5±0,2, 11,5±0,2, 14,6±0,2, 15,3±0,2, 16,1±0,2, 17,1±0,2, 17,5±0,2, 17,8±0,2, 18,6±0,2, 19,3±0,2, 21,6±0,2, 21,9±0,2, 27,2±0,2, и, по данным DSC, имеет эндотермический пик кристаллического превращения в виде характеристического пика при 111,6°С, и экзотермический пик кристаллического превращения в виде характеристического пика при 136,9°С, и пик плавления с разложением в виде характеристического пика при 194,9°С. Продукты на основе S-кристаллической формы легко сушатся, имеют высокую чистоту и стабильность, и являются удобными для длительного хранения, без специальных требований к температуре и влажности. 3 н. и 5 з.п. ф-лы, 5 табл., 7 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к S-кристаллической форме хлористоводородного ивабрадина, способу ее получения и к фармацевтической композиции, содержащей это соединение в качестве активного компонента.
Уровень техники
Хлористоводородный ивабрадин имеет химическое название гидрохлорид 3-{3-[{[(7S)-3,4-диметоксибицикло[4,2,0]окта-1,3,5-триен-7-ил]метил}(метил)амино]-пропил}-7,8-диметокси-1,3,4,5-тетрагидро-2Н-3-бензазепин-2-она, CAS No. 148849-67-6, и имеет структурную формулу в виде Формулы I:
Хлористоводородный ивабрадин является первым селективным и специфическим ингибитором тока сердечного ритмоводителя, который разработан фирмой Servier (Франция), причем этот продукт одобрен Европейским агентством по оценке Лекарственной продукции (ЕМЕА) в августе 2005 для продажи в 27 странах Европы с целью лечения хронической стабильной стенокардии, сопровождаемой нормальным синусовым ритмом, запретом или нетерпимостью к блокатору В рецептора, особенно суправентрикулярной аритмии или сердечной недостаточности.
В Европейском патенте ЕР 0534859 впервые раскрыты способы получения и медицинское применение ивабрадина и его фармацевтически приемлемых аддитивных солей с кислотами, особенно хлороводорода. Благодаря отличной фармацевтической ценности хлористоводородного ивабрадина, в уровне техники описано множество кристаллических форм хлористоводородного ивабрадина.
В US 20070082887 А1 описана α-кристаллическая форма хлористоводородного ивабрадина, которая приготовлена с использованием в качестве растворителя смеси толуол/метилпирролидинон, причем рентгеновская порошковая дифрактограмма для кристаллов имеет характерные пики в положениях, выраженных в градусах 2-тета, приблизительно 4,1, 7,7, 8,1, 10,4, 16,5, 17,4, 20,2, 21,9, 25,7 и 26,5.
В ЕР 1695965 А1 раскрыта β-кристаллическая форма хлористоводородного ивабрадина, которую получают путем растворения хлористоводородного ивабрадина в воде при 74°С и кристаллизации при комнатной температуре в течение 2 суток, причем рентгеновская порошковая дифрактограмма для кристаллов имеет характерные пики в положениях, выраженных в градусах 2-тета, приблизительно 9,2, 16,9, 18,4, 18,8, 19,7, 21,3, 21,6, 22,6, 23,0 и 25,3.
В ЕР 1695710 А1 описана βd-кристаллическая форма хлористоводородного ивабрадина, которую получают путем растворения хлористоводородного ивабрадина в воде при 74°С, и кристаллизации при комнатной температуре в течение 2 суток, причем рентгеновская порошковая дифрактограмма для кристаллов имеет характерные пики в положениях, выраженных в градусах 2-тета, приблизительно 9,2, 12,5, 13,6, 16,0, 17,3, 19,6, 20,4, 22,3 и 25,0.
В US 20060194963 А1 раскрыта γ-кристаллическая форма хлористоводородного ивабрадина, которую получают путем растворения хлористоводородного ивабрадина в 2-оксиэтаноле при кипячении с обратным холодильником, кристаллизации при комнатной температуре в течение 8 суток, фильтрации и промывки циклогексаном, причем рентгеновская порошковая дифрактограмма для кристаллов имеет характерные пики в положениях, выраженных в градусах 2-тета, приблизительно 4,2, 12,5, 13,4, 17,0, 21,5, 13,4, 17,0, 21,1, 24,2, 24,5, 26,4 и 28,0.
В ЕР 1695709 А1 раскрыта γd-кристаллическая форма хлористоводородного ивабрадина, которую получают путем растворения хлористоводородного ивабрадина в 2-оксиэтаноле при кипячении с обратным холодильником, причем рентгеновская порошковая дифрактограмма для кристаллов имеет характерные пики в положениях, выраженных в градусах 2-тета, приблизительно 4,3, 12,5, 13,4, 15,8, 16,9, 18,9, 20,9, 24,1, 24,4 и 26,2.
В US 20070082885 А1 описана δ-кристаллическая форма хлористоводородного ивабрадина, которую получают путем растворения хлористоводородного ивабрадина в ацетонитриле при 70°С, выдерживания в течение 2 суток и кристаллизации при комнатной температуре, причем рентгеновская порошковая дифрактограмма для кристаллов имеет характерные пики в положениях, выраженных в градусах 2-тета, приблизительно 4,1, 10,9, 14,7, 15,3, 16,3, 16,8, 17,9, 19,2, 21,7, 22,2, 23,1, 24,8, 25,2, 25,6, 26,7 и 27,6.
В US 20070082886 А1 описана δd-кристаллическая форма хлористоводородного ивабрадина, которую получают путем растворения хлористоводородного ивабрадина в ацетонитриле при 70°С, выдерживания в течение 2 суток и кристаллизации при комнатной температуре, фильтрации в вакууме, рассеивании на поддоне для кристаллизации, и сушки при 85°С, причем рентгеновская порошковая дифрактограмма для кристаллов имеет характерные пики в положениях, выраженных в градусах 2-тета, приблизительно 8,6, 14,6, 15,3, 17,2, 18,1, 21,4, 22,1, 22,5, 23,9, 26,2, 26,9 и 27,6.
В документе WO 2011098582 А1 описаны Z, X и K-кристаллические формы хлористоводородного ивабрадина, которые получены путем растворения аморфной соли в изопропаноле и кристаллизации при 22°С, или путем подкисления свободного основания ивабрадина концентрированной хлористоводородной кислотой в изопропаноле и кристаллизации при 2°С, причем полученное твердое вещество без сушки представляет собой Z-кристаллическую форму, Z-кристаллическую форму сушат в вакууме при 22°С в течение 2 ч, чтобы получить Х-кристаллическую форму, и Z-кристаллическую форму сушат в вакууме при 70°С в течение 2 ч, чтобы получить K-кристаллическую форму; рентгеновская порошковая дифрактограмма Z-кристаллической формы имеет характерные пики в положениях, выраженных в градусах 2-тета, приблизительно 3,9, 15,1, 16,2, 16,6, 17,8, 19,0, 22,0 и 24,7; рентгеновская порошковая дифрактограмма Х-кристаллической формы имеет характерные пики в положениях, выраженных в градусах 2-тета, приблизительно 11,0, 16,5, 16,9, 21,8, 22,4, 23,7, 26,0 и 27,9; и рентгеновская порошковая дифрактограмма K-кристаллической формы имеет характерные пики в положениях, выраженных в градусах 2-тета, приблизительно 8,6, 14,6, 17,2, 18,3, 21,6, 22,3, 24,0 и 26,4.
В документе WO 2012025940 А1 раскрыта зета-кристаллическая форма, которую получают путем перекристаллизации хлористоводородного ивабрадина в ацетонитриле, и удаления органического растворителя из твердого вещества путем сушки при регулируемой влажности, причем рентгеновская порошковая дифрактограмма для кристаллов имеет характерные пики в положениях, выраженных в градусах 2-тета, приблизительно 11,0, 14,5, 16,5, 16,8, 22,2, 23,5, 25,9, 27,6, 28,9, 30,7 и 34,1.
В документе WO 2008125006 А1 описана новая кристаллическая форма хлористоводородного ивабрадина, которую получают путем перекристаллизации хлористоводородного ивабрадина в бутаноне (или смеси метилпирролидинон/этилацетат), и сушки в вакууме при 60-70°С, причем рентгеновская порошковая дифрактограмма для кристаллов имеет характерные пики в положениях, выраженных в градусах 2-тета, приблизительно 4,02, 7,69, 8,03, 10,37, 11,81, 13,10, 13,72, 16,41, 17,32, 18,12, 20,02, 20,52, 21,30, 21,86, 22,28, 25,72, 26,42, 26,74 и 28,38.
В CN 101768117 А описана W-кристаллическая форма хлористоводородного ивабрадина, которую получают путем растворения хлористоводородного ивабрадина в смеси ацетон/метанол при кипячении с обратным холодильником, выдерживании и кристаллизации, фильтрации и сушки твердого вещества в вакууме при 85°С, причем рентгеновская порошковая дифрактограмма для кристаллов имеет характерные пики в положениях, выраженных в градусах 2-тета, приблизительно 4,1, 9,1, 14,6, 17,2, 18,2, 23,4, 25,4 и 37,7.
В CN 101805289 А раскрыта ω-кристаллическая форма хлористоводородного ивабрадина и способ ее получения, в котором хлористоводородный ивабрадин растворяют в воде и затем подвергают сублимационной сушке, причем рентгеновская порошковая дифрактограмма для кристаллов имеет характерные пики в положениях, выраженных в градусах 2-тета, приблизительно 6,6, 9,1, 14,8, 16,8, 18,2, 18,4, 19,6, 21,2, 21,5, 22,5, 23,1, 23,7, 25,3 и 27,4.
В CN 103012269 А описана С-кристаллическая форма хлористоводородного ивабрадина и способ ее получения, в котором хлористоводородный ивабрадин растворяют в этаноле с добавкой этилацетата и подвергают кристаллизации, фильтруют, чтобы собрать продукт, и рентгеновская порошковая дифрактограмма для кристаллов имеет характерные пики в положениях, выраженных в градусах 2-тета, приблизительно 7,9, 8,3, 9,4, 10,7, 12,1, 14,1, 16,7, 17,6, 18,5, 20,4, 21,6, 22,2, 26,0 и 26,7.
В документе WO 2008065681 А2 описана 1-кристаллическая форма хлористоводородного ивабрадина, которую получают с использованием раствора свободного основания ивабрадина в HCl/ацетонитриле, причем рентгеновская порошковая дифрактограмма для кристаллов имеет характерные пики в положениях, выраженных в градусах 2-тета, приблизительно 8,6, 9,1, 11,2, 11,7, 14,6, 15,3, 17,2, 18,2, 19,6, 20,3, 21,0, 21,5, 22,2, 22,7, 23,9, 26,4, 27,0 и 29,4.
В документе WO 2013102929 описаны кристаллические формы II и III хлористоводородного ивабрадина, где хлористоводородный ивабрадин растворяют в смешанном растворителе - метилэтилкетон/тетрагидрофуран, охлаждают и подвергают кристаллизации, продукт сушат при 40-45°С в вакууме в течение 12 ч, чтобы получить кристаллическую форму II, причем рентгеновская порошковая дифрактограмма для кристаллов имеет характерные пики в положениях, выраженных в градусах 2-тета, приблизительно 11,0, 14,5, 16,5, 16,8, 22,2, 23,5, 25,9, 27,6, 28,9, 30,7, 34,08; или хлористоводородный ивабрадин растворяют в метилэтилкетоне, охлаждают и подвергают кристаллизации, продукт сушат при 40-45°С в вакууме в течение 12 ч, чтобы получить кристаллическую форму III, причем рентгеновская порошковая дифрактограмма для кристаллов имеет характерные пики в положениях, выраженных в градусах 2-тета, приблизительно 15,48, 16,18, 19,00, 19,78, 24,12 и 24,41.
В документе WO 2013064307 А1 раскрыта кристаллическая форма IV хлористоводородного ивабрадина, которую получают путем тонкого измельчения хлористоводородного ивабрадина в толуоле, этаноле, ацетоне, метилэтилкетоне, метилизобутилкетоне, этил ацетате, изопропилацетате или в смеси указанных растворителей, и сушки при 45°С в вакууме, причем рентгеновская порошковая дифрактограмма для кристаллов имеет характерные пики в положениях, выраженных в градусах 2-тета, приблизительно 8,11, 8,74, 15,55, 17,17, 19,18, 19,89, 21,82, 22,49, 24,29 и 24,53.
В настоящее время, производитель оригинального вещества, занимающийся исследованиями, использует α-кристаллическую форму хлористоводородного ивабрадина в качестве кристаллической формы для получения препарата. Хотя α-кристаллическая форма имеет хорошую стабильность, в качестве растворителей при ее получении используется толуол/метилпирролидинон. Поскольку эти два растворителя (особенно метилпирролидинон) имеют высокие точки кипения, остаток растворителя в продукте трудно удалять, и обычно требуется длительное высушивание при высокой температуре для достижения стандартного качества. Однако указанная процедура высушивания может легко привести к ухудшению чистоты продукта, что влияет на качество препарата.
Хорошо известно, что стабильная кристаллическая форма обладает малой энтропией, высокой температурой плавления, и хорошей химической стабильностью, но имеет низкую скорость растворения и растворимость, и таким образом, обладает плохой биологической доступностью; напротив, нестабильная кристаллическая форма имеет противоположные характеристики; несмотря на то, что метастабильная кристаллическая форма имеет умеренные характеристики, и ее стабильность немного хуже стабильной кристаллической формы, ее способность к растворению и биологическая доступность лучше, чем у стабильной кристаллической формы. Поэтому многие производители ведут поиск метастабильных кристаллических форм с отличной способностью к растворению и биологической доступностью, а также с относительно хорошей стабильностью. Хотя в документах упомянуты многие кристаллические формы, их стабильность и способы получения являются неудовлетворительными. Например, δd-кристаллическая форма, упомянутая первым производителем, занимающимся исследованиями, может непрерывно превращаться в α-кристаллическую форму при комнатной температуре; и в испытании дифференциальной сканирующей калориметрии (DSC) установлено, что превращение кристаллической формы происходит при 120°С, причем эндотермический и экзотермический пики этого превращения являются весьма малыми, то есть соответствующие пики незаметны; это означает, что спустя 10 суток хранения при комнатной температуре большая часть δd-кристаллической формы может превратиться в α-кристаллическую форму. Дельта-кристаллическая форма содержит ацетонитрил, который едва ли можно удалить, причем ее трудно отличить от кристаллической формы, содержащей ацетонитрил. Кроме того, хлористоводородный ивабрадин, как гидрохлорид, очень легко поглощает влагу, в то время как изменение содержания воды может привести к многочисленным изменениям кристаллических форм, например превращению между γd и γ, превращению между βd и β.
В итоге, многие производители все еще занимаются поиском новой кристаллической формы с хорошей стабильностью, которая не только может быть легко получена в промышленном масштабе, легко сушится, обладает высокой чистотой, но также имеет высокую стабильность, может храниться в течение длительного времени, без специальных требований к температуре, влажности и тому подобному.
После массового скрининга с использованием различных кристаллических форм или аморфных форм хлористоводородного ивабрадина в качестве исходного материала, применения ряда традиционных растворителей и их смесей в качестве растворителей для кристаллизации и преобразования, с регулированием времени превращения, температуры превращения и условий сушки, с осуществлением множества экспериментов по кристаллизации и превращению, авторы изобретения неожиданно обнаружили, что можно получить новую S-кристаллическую форму путем превращения в тетрагидрофуране, в течение длительного времени δd- и δ-кристаллических форм, которые были упомянуты в документах уровня техники. В испытаниях методом DSC установлено, что S-кристаллическая форма имеет очевидный пик превращения кристаллического типа, что указывает на то, что эта кристаллическая форма обладает хорошей стабильностью. Испытания при высокой температуре и влажности подтвердили, что S-кристаллическая форма обладает хорошей стабильностью и не меняется даже при содержании воды до 3%. Таким образом, эта форма подходит для традиционного хранения. Кроме того, использованный растворитель превращения - тетрагидрофуран может быть легко удален, так что чистота продукта не меняется в ходе процедуры сушки, то есть этот растворитель подходит для получения продукта высокой чистоты.
Краткое изложение сути изобретения
Целью настоящего изобретения является получение S-кристаллической формы хлористоводородного ивабрадина; эта кристаллическая форма отличается от любой формы из уровня техники, обладает хорошей стабильностью по показателям температуры и влажности; она получается с использованием традиционных растворителей с низкой температурой кипения и, таким образом, легко сушится; обладает хорошей стабильностью по показателю поглощения воды и, таким образом, подходит для традиционного хранения. S-кристаллическая форма хлористоводородного ивабрадина имеет рентгеновскую порошковую дифрактограмму, которая показана на фиг. 1, а термограмма DSC показана на фиг. 2.
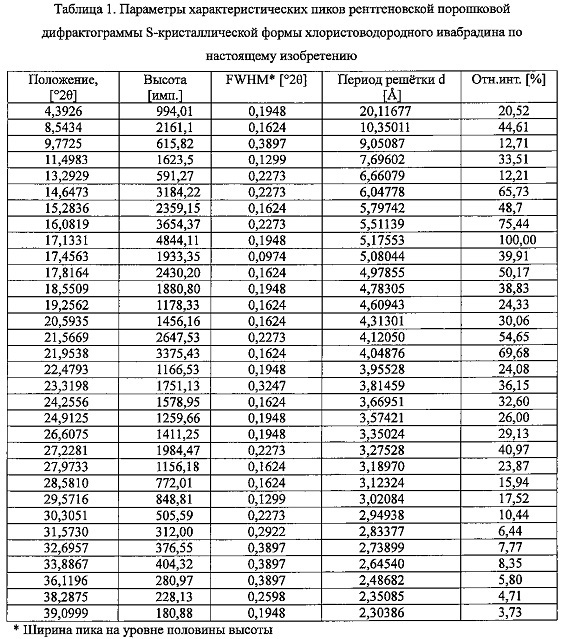
Порошковую дифрактограмму регистрировали с использованием многофункционального порошкового дифрактометра X' Pert PRO MPD фирмы PANalytical Company (Нидерланды), применяя Cu-Ka излучение, чтобы получить порошковую дифрактограмму, которая показана на фиг. 1, причем параметры характеристических пиков показаны в таблице 1.
В испытаниях DSC и термогравиметрии (TG) применялись приборы DSC-204 и STA-409. Использовали следующие условия испытания DSC: температура 14-250°С, скорость нагрева 10,0 K/мин; условия испытания TG были следующими: температура 20-250°С, скорость нагрева 10,0 K/мин.
Результаты испытания DSC показаны на фиг. 2, причем это испытание демонстрирует, что полученная S-кристаллическая форма хлористоводородного ивабрадина имеет пики превращения кристаллического типа, в том числе эндотермический характеристический пик при 111,6±1°С и экзотермический характеристический пик при 136,9±1°С, и имеет пик плавления с разложением при 194±1°С.
Результаты испытания TG показаны на фиг. 3, причем это испытание дополнительно демонстрирует, что полученная S-кристаллическая форма хлористоводородного ивабрадина начинает постепенно терять адсорбированную воду при низкой температуре (приблизительно 60°С). Сравнение с термограммой DSC подтверждает, что в термограмме DSC имеются пики преобразования кристаллического типа, включая эндотермический характеристический пик при 111,6±1°С и экзотермический характеристический пик при 136,9±1°С, и имеется эндотермический пик при 194±1°С, который является пиком плавления с разложением.
Настоящее изобретение раскрывает S-кристаллическую форму хлористоводородного ивабрадина, отличающуюся тем, что эта S-кристаллическая форма хлористоводородного ивабрадина имеет рентгеновскую порошковую дифрактограмму, в которой имеются характеристические пики в положениях, выраженных в градусах 2-тета: 8,5±0,2, 11,5±0,2, 14,6±0,2, 15,3±0,2, 16,1±0,2, 17,1±0,2, 17,5±0,2, 17,8±0,2, 18,6±0,2, 19,3±0,2, 21,6±0,2, 21,9±0,2 и 27,2±0,2.
Настоящее изобретение раскрывает S-кристаллическую форму хлористоводородного ивабрадина, рентгеновская порошковая дифрактограмма которой имеет характерные пики и относительные интенсивности, которые приведены в следующей таблице.
Другой целью настоящего изобретения является разработка способа получения S-кристаллической формы хлористоводородного ивабрадина, включающего преобразование типа кристаллов путем перемешивания кристаллической формы хлористоводородного ивабрадина или аморфной формы хлористоводородного ивабрадина в тетрагидрофуране (ТГФ) в течение длительного времени, с фильтрацией и сбором, сушкой при пониженном давлении, для получения S-кристаллической формы хлористоводородного ивабрадина. Предпочтительно кристаллическая форма хлористоводородного ивабрадина является δ-кристаллической формой или δd-кристаллической формой хлористоводородного ивабрадина. Отношение массы (в граммах) кристаллической формы хлористоводородного ивабрадина или аморфной формы хлористоводородного ивабрадина к объему (мл) тетрагидрофурана составляет 1:10 (г/мл), предпочтительно от 1:3 до 1:6 (г/мл). Перемешивание осуществляется при температуре 0-50°С, предпочтительно при 25-30°С, причем перемешивание проводят в течение 6-72 ч, предпочтительно 12-24 ч.
Еще одной целью настоящего изобретения является разработка фармацевтической композиции, содержащей указанное соединение в качестве активного компонента, которая может быть использована как фармацевтический препарат для лечения или предупреждения стенокардии, инфаркта миокарда и релевантной аритмичности.
Краткое описание чертежей
На фиг. 1 показана рентгеновская порошковая дифрактограмма S-кристаллической формы хлористоводородного ивабрадина.
На фиг. 2 показана термограмма дифференциальной сканирующей калориметрии (DSC) хлористоводородного ивабрадина.
На фиг. 3 показана термогравиметрическая (TG) кривая S-кристаллической формы хлористоводородного ивабрадина.
Конкретный вариант осуществления изобретения
Пример 1
Помещают 1 кг хлористоводородного ивабрадина в реактор объемом 50 л, добавляют 20 л ацетонитрила, растворяют при кипячении с обратным холодильником, и затем перемешивают в течение 30 мин, позволяют самопроизвольно охладиться до комнатной температуры, подвергают кристаллизации при комнатной температуре в течение 4 ч, затем фильтруют, собирают влажный продукт, и этот продукт идентифицируют методом рентгеновской порошковой дифракции как δ-кристаллическую форму.
Указанный выше влажный продукт растворяют в 5 л тетрагидрофурана, регулируя температуру внутри раствора в диапазоне 25-30°С, перемешивают в течение 24 часов с целью преобразования типа кристаллов, продукт отфильтровывают и собирают, сушат при пониженном давлении, при 50°С в течение 24 ч, чтобы получить 950 г продукта с выходом 95%.
Измеренная чистота продукта составляет 99,82%; максимальное содержание одной примеси составляет 0,03%; содержание влаги составляет 0,46%; содержание остаточных растворителей является следующим: ацетонитрил не обнаружен; содержание остаточного ТГФ составляет 0,001%.
Полученную S-кристаллическую форму хлористоводородного ивабрадина подвергают анализу методами рентгеновской порошковой дифракции, дифференциальной калориметрии и термогравиметрии.
Порошковую дифрактограмму регистрировали с использованием многофункционального порошкового дифрактометра X' Pert PRO MPD фирмы PANalytical (Нидерланды), применяя Cu-Ka излучение, чтобы получить порошковую дифрактограмму, показанную на фиг. 1, причем параметры характеристических пиков приведены в таблице 1.
В испытаниях DSC и TG применялись приборы DSC-204 и STA-409. Использовали следующие условия испытания DSC: температура 14-250°С, скорость нагрева 10,0 K/мин; условия испытания TG были следующими: температура 20-250°С, скорость нагрева 10,0 K/мин.
Результаты испытания DSC показаны на фиг. 2, причем это испытание демонстрирует, что полученная S-кристаллическая форма хлористоводородного ивабрадина имеет пики превращения кристаллического типа, в том числе эндотермический характеристический пик при 111,6±1°С и экзотермический характеристический пик при 136,9±1°С, и имеет пик плавления с разложением при 194±1°С.
Результаты испытания TG показаны на фиг. 3, причем это испытание дополнительно демонстрирует, что полученная S-кристаллическая форма хлористоводородного ивабрадина начинает постепенно терять адсорбированную воду при низкой температуре (приблизительно 60°С). Сравнение с термограммой DSC подтверждает, что в термограмме DSC имеются пики преобразования кристаллического типа, включая эндотермический характеристический пик при 111,6±1°С и экзотермический характеристический пик при 136,9±1°С, и имеется эндотермический пик при 194±1°С, который является пиком плавления с разложением.
Пример 2
Помещают 10 г хлористоводородного ивабрадина в 200 мл ацетонитрила, растворяют при кипячении с обратным холодильником, и затем перемешивают в течение 30 мин, потом позволяют самопроизвольно охладиться до комнатной температуры, подвергают кристаллизации при комнатной температуре в течение 4 ч, фильтруют и собирают, сушат при пониженном давлении, при 50°С в течение 12 ч. Получают 10 г влажного продукта.
Содержание влаги во влажном продукте составляет 0,46%; содержание ацетонитрила, как остаточного растворителя, составляет 9,2%; кристаллическая форма продукта идентифицирована как δ-кристаллическая форма.
Указанный выше влажный продукт (9 г) растворяют в 50 мл тетрагидрофурана, регулируя температуру внутри раствора в диапазоне 25-30°С, перемешивают в течение 24 часов с целью преобразования типа кристаллов, продукт отфильтровывают и собирают, сушат при пониженном давлении, при 50°С в течение 12 ч, получая 8,0 г продукта.
Измеренная чистота продукта составляет 99,88%; максимальное содержание одной примеси составляет 0,02%; содержание влаги составляет 0,32%; содержание остаточных растворителей является следующим: ацетонитрил не обнаружен; содержание остаточного ТГФ составляет 0,001%. Продукт идентифицируют методом рентгеновской порошковой дифракции как S-кристаллическую форму.
Пример 3
Добавляют 10 г хлористоводородного ивабрадина к 200 мл ацетонитрила, растворяют при кипячении с обратным холодильником, и затем перемешивают в течение 30 мин, потом позволяют самопроизвольно охладиться до комнатной температуры, подвергают кристаллизации при комнатной температуре в течение 4 ч, фильтруют и собирают, сушат при пониженном давлении, при 60°С в течение 96 ч. Получают 9 г влажного продукта.
Содержание влаги во влажном продукте составляет 0,12%; содержание ацетонитрила, как остаточного растворителя, составляет 0,015%; кристаллическая форма продукта идентифицирована как δd-кристаллическая форма.
Указанный выше влажный продукт (9 г) растворяют в 50 мл тетрагидрофурана, регулируя температуру внутри раствора в диапазоне 25-30°С, перемешивают в течение 24 часов с целью преобразования типа кристаллов, продукт отфильтровывают и собирают, сушат при пониженном давлении, при 50°С в течение 24 ч, получая 8,0 г продукта.
Измеренная чистота продукта составляет 99,90%; максимальное содержание одной примеси составляет 0,02%; содержание влаги составляет 0,12%; содержание остаточных растворителей является следующим: ацетонитрил не обнаружен; ТГФ не обнаружен. Продукт идентифицируют методом рентгеновской порошковой дифракции как S-кристаллическую форму.
Пример 4
Добавляют 10 г хлористоводородного ивабрадина к 90 мл смешанного растворителя ацетон/этанол (6:1 по объему), растворяют при кипячении с обратным холодильником, и затем перемешивают в течение 30 мин, потом позволяют самопроизвольно охладиться до комнатной температуры, подвергают кристаллизации при комнатной температуре в течение 4 ч, фильтруют и собирают, сушат при пониженном давлении, при 45°С в течение 24 ч. Получают 10 г влажного продукта.
Содержание влаги во влажном продукте составляет 0,42%; содержание остаточных растворителей является следующим: содержание ацетона составляет 0,2%; содержание этанола составляет 0,3%; кристаллическая форма продукта идентифицирована как δd-кристаллическая форма.
Указанный выше влажный продукт (9 г) растворяют в 50 мл тетрагидрофурана, регулируя температуру внутри раствора в диапазоне 25-30°С, перемешивают в течение 24 часов с целью преобразования кристаллов, продукт отфильтровывают и собирают, сушат при пониженном давлении, при 50°С в течение 24 ч, получая 8,0 г продукта.
Измеренная чистота продукта составляет 99,92%; максимальное содержание одной примеси составляет 0,02%; содержание влаги составляет 0,42%; содержание остаточных растворителей является следующим: ацетон, этанол и ТГФ как остаточные растворители не обнаружены. Продукт идентифицируют методом рентгеновской порошковой дифракции как S-кристаллическую форму.
Пример 5: Испытание стабильности к влажности
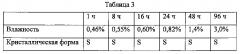
S-кристаллическую форму хлористоводородного ивабрадина, которая получена в Примере 2, распространяют на часовом стекле с образованием тонкого слоя и помещают в верхнюю часть эксикатора, в нижней части которого находится насыщенный раствор карбоната калия, определяют влажность в эксикаторе как 43,1±0,5%; контролируют условия испытания: комнатная температура (20°С) и постоянная влажность. Пробы отбирают через 1 ч, 8 ч, 16 ч, 24 ч, 48 ч, 96 ч для определения влажности и анализа методом рентгеновской дифракции. Результаты приведены в следующей таблице.
Вывод: В случае хранения продукта в открытом состоянии при определенной влажности, он постепенно и медленно поглощает воду, но его кристаллическая форма не изменяется. Таким образом, при контроле влажности на складе на уровне ниже чем 43,1%±0,5%, кристаллическая форма продукта в запечатанном состоянии не меняется.
Пример 6: Испытание стабильности при высокой температуре
Вывод: Испытание при высокой температуре 60°С демонстрирует, что после хранения продукта при 60°С в течение 10 суток его характеристики, например чистота, не меняются в значительной степени по сравнению со свойствами в начале испытания, и кристаллическая форма также является весьма стабильной. Таким образом, продукт может сохранять стабильность на складе при комнатной температуре.
Пример 7
Медицинская рецептура на 1000 таблеток, содержащих по 5 мг хлористоводородного ивабрадина в таблетке:
1. S-кристаллическая форма хлористоводородного ивабрадина, характеризующаяся тем, что эта S-кристаллическая форма хлористоводородного ивабрадина имеет рентгеновскую порошковую дифрактограмму, содержащую характеристические пики в положениях, выраженных в градусах 2-тета: 8,5±0,2, 11,5±0,2, 14,6±0,2, 15,3±0,2, 16,1±0,2, 17,1±0,2, 17,5±0,2, 17,8±0,2, 18,6±0,2, 19,3±0,2, 21,6±0,2, 21,9±0,2, 27,2±0,2.
2. S-кристаллическая форма хлористоводородного ивабрадина по п. 1, характеризующаяся тем, что рентгеновская порошковая дифрактограмма кристаллов имеет характерные пики и относительные интенсивности, приведенные в следующей таблице:
| Положение, [°2θ]±0,2 | Отн.инт. [%] |
| 8,5 | 44,61 |
| 11,5 | 33,51 |
| 14,6 | 65,73 |
| 15,3 | 48,70 |
| 16,1 | 75,44 |
| 17,1 | 100,00 |
| 17,5 | 39,91 |
| 17,8 | 50,17 |
| 18,6 | 38,83 |
| 19,3 | 24,33 |
| 21,6 | 54,65 |
| 21,9 | 69,68 |
| 27,2 | 40,97 |
3. S-кристаллическая форма хлористоводородного ивабрадина по п. 1, имеющая термограмму DSC, как показано на фиг. 2.
4. S-кристаллическая форма хлористоводородного ивабрадина по п. 1, отличающаяся тем, что эта S-кристаллическая форма хлористоводородного ивабрадина имеет термограмму DSC с эндотермическим пиком при 111,6±1°C, экзотермическим пиком при 136,9±1°C и эндотермическим пиком при 194±1°C.
5. S-кристаллическая форма хлористоводородного ивабрадина по п. 1, имеющая рентгеновскую порошковую дифрактограмму, как показано на фиг. 1.
6. Способ получения S-кристаллической формы хлористоводородного ивабрадина по п. 1, включающий:
осуществление превращения типа кристаллов путем перемешивания кристаллической формы хлористоводородного ивабрадина или аморфной формы хлористоводородного ивабрадина в тетрагидрофуране в течение длительного периода времени; и фильтрацию и сбор, сушку при пониженном давлении, для получения S-кристаллической формы хлористоводородного ивабрадина;
где указанная кристаллическая форма хлористоводородного ивабрадина предпочтительно является δ-кристаллической формой или δd-кристаллической формой хлористоводородного ивабрадина;
где отношение массы (в граммах) кристаллической формы хлористоводородного ивабрадина или аморфной формы хлористоводородного ивабрадина к объему (мл) тетрагидрофурана составляет 1:10 (г/мл) или от 1:3 до 1:6 (г/мл);
причем перемешивание осуществляют при температуре 0-50°C, предпочтительно при 25-30°C, и перемешивание осуществляют в течение 6-72 ч, предпочтительно 12-24 ч.
7. Фармацевтическая композиция для лечения или предупреждения стенокардии, инфаркта миокарда и релевантной аритмичности, содержащая S-кристаллическую форму хлористоводородного ивабрадина по любому из пп. 1-6.
8. Фармацевтическая композиция по п. 7, имеющая препаративную форму таблетки, разрушающейся внутри рта, диспергирующейся таблетки, таблетки с непрерывным и регулируемым высвобождением, капсулы или капсулы с непрерывным и регулируемым высвобождением.