Способы получения 4-амино-3-галоген-6(замещенных)пиколинатов и 4-амино-5-фтор-3-галоген-6-(замещенных)пиколинатов
Иллюстрации
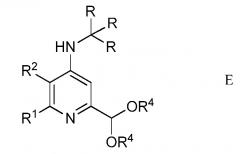
Показать всеИзобретение относится к способу получения 4-амино-3-галоген-6-(замещенного)пиколината Формулы I, который включает следующие стадии: (a) приведение в контакт дифторуксусной кислоты или трифторуксусной кислоты с тритиламином или трет-бутиламином в присутствии триарилфосфина и основания триалкиламина в четыреххлористом углероде в качестве растворителя с получением 2,2-дифтор- или 2,2,2-трифтор-N-(тритил или трет-бутил)этанимидоилхлорида (Формула A); (b) приведение в контакт 2,2-дифтор- или 2,2,2-трифтор-N-(тритил или изо-бутил)этанимидоилхлорида (Формула A) с 3,3-диалкоксипроп-1-ином (Формула B), где R4 представляет собой C1-C4 алкил, в присутствии иодида меди (I), иодида щелочного металла и фосфата щелочного металла в полярном апротонном растворителе с получением (имино)пент-2-ина диалкилацеталя Формулы C; (c) циклизацию (имино)пент-2-ина диалкилацеталя Формулы C с амином R1-CH2-NH2 Формулы D, в присутствии неорганического основания щелочного металла в полярном апротонном растворителе при температуре примерно от температуры окружающей среды примерно до 100°C с получением тритил- или изо-бутил-защищенного 4-амино-6-(замещенного)пиридин-2-диалкилацеталя Формулы E; (d) снятие защиты и гидролиз тритил- или изо-бутил-защищенного 4-амино-6-(замещенного)пиридин-2-диалкилацеталя Формулы E с помощью минеральной кислоты в полярном растворителе с получением 4-амино-6-(замещенного)пиколинальдегида Формулы F; (e) окисление 4-амино-6-(замещенного)пиколинальдегида Формулы F с помощью хлорита щелочного металла в присутствии неорганической кислоты и поглотителя хлорноватистой кислоты в водном спиртовом растворителе с получением 4-амино-6-(замещенной)пиколиновой кислоты Формулы G; (f) этерификацию 4-амино-6-(замещенной)пиколиновой кислоты Формулы G соединением Формулы R3Y; и (g) галогенирование 4-амино-6-(замещенного)пиколината Формулы H с помощью источника галогена с получением 4-амино-3-галоген-6-(замещенного)пиколината Формулы I. При этом X, R, R1, R2 и R3, R4 приведены в формуле изобретения. Изобретение относится к способу получения 4-амино-3-галоген-6-(замещенного)пиколината Формулы I, который включает следующие стадии: (a)-(d), приведенные выше; (e) галогенирование 4-амино-6-(замещенного)пиколинальдегида Формулы F с помощью источника галогена с получением 4-амино-3-галоген-6-(замещенного)пиколинальдегида Формулы J; (f) окисление 4-амино-3-галоген-6-(замещенного)пиколинальдегида Формулы J с помощью хлорита щелочного металла в присутствии неорганической кислоты и поглотителя хлорноватистой кислоты в водном спиртовом растворителе с получением 4-амино-3-галоген-6-(замещенной)пиколиновой кислоты Формулы K; и (g) этерификацию 4-амино-3-галоген-6-(замещенной)пиколиновой кислоты Формулы K соединением Формулы R3Y, с получением 4-амино-3-галоген-6-(замещенного)пиколината Формулы I. Также изобретение относится к соединениям формулы А, Формулы C, Формулы E и Формулы F, где R, R1, R2, R4 приведены в формуле изобретения. Настоящие способы позволяют получить 4-амино-5-фтор-3-галоген-6-(замещенных)пиколинатов и 4-амино-3-галоген-6-(замещенных)пиколинатов из непиридинового источника. 6 н.п. ф-лы, 32 пр.
, , , , , , , , , .
Реферат
Область техники, к которой относится изобретение
В настоящем документе предлагаются способы получения 4-амино-5-фтор-3-галоген-6-(замещенных)пиколинатов и 4-амино-3-галоген-6-(замещенных)пиколинатов. Более конкретно, в настоящем документе предлагаются способы получения 4-амино-5-фтор-3-галоген-6-(замещенных)пиколинатов и 4-амино-3-галоген-6-(замещенных)пиколинатов из не-пиридинового источника.
Предшествующий уровень техники
Патенты США №№ 6784137 B2 и 7314849 B2 описывают, среди прочего, определенные соединения 4-амино-5-фтор-3-галоген-6-(арил)пиколината и 4-амино-3-галоген-6-(арил)пиколината и их использование в качестве гербицидов. Патент США № 7432227 B2 описывает, среди прочего, определенные соединения 4-амино-5-фтор-3-галоген-6-(алкил)пиколината и 4-амино-3-галоген-6-(алкил)пиколината и их использование в качестве гербицидов. Каждый из этих патентов описывает получение исходных материалов 4-амино-5-фтор-3-галогенпиколината посредством фторирования соответствующих 5-незамещенных пиридинов 1-(хлорметил)-4-фтор-1,4-диазонийбицикло[2.2.2]октан бис(тетрафторборатом). Каждый из этих патентов также описывает получение 4-амино-6-(арил)пиколинатов с помощью реакций связывания, включающих пиколины, имеющие либо доступную уходящую группу, либо производное металла в 6-положении пиколинового кольца. Может быть преимущественным получение 4-амино-5-фтор-3-галоген-6-(замещенных)пиколинатов и 4-амино-3-галоген-6-(замещенных)пиколинатов без необходимости в использовании связывания с помощью металлов. Может быть преимущественным получение 4-амино-5-фтор-3-галоген-6-(замещенных)пиколинатов и 4-амино-3-галоген-6-(замещенных)пиколинатов из не-пиридинового источника эффективно и с высоким выходом. Также может быть преимущественным получение 4-амино-5-фтор-3-галоген-6-(замещенных)пиколинатов без необходимости в использовании прямого фторирования 5-положения пиридинового кольца и без дорогостоящего фторирующего агента, подобного 1-(хлорметил)-4-фтор-1,4-диазонийбицикло[2.2.2]октан бис(тетрафторборату).
Сущность изобретения
В настоящем документе предлагаются способы получения 4-амино-3-галоген-5-фтор-6-(замещенных)пиколинатов и 4-амино-3-галоген-6-(замещенных)пиколинатов из не-пиридинового источника без связывания с помощью металлов и без фторирования с помощью дорогостоящего фторирующего агента, подобного 1-(хлорметил)-4-фтор-1,4-диазонийбицикло[2.2.2]октан бис(тетрафторборату). Более конкретно, в настоящем документе предлагаются способы получения 4-амино-3-галоген-6-(замещенного)пиколината Формулы I
,
где
X представляет собой Cl, Br или I,
R1 представляет собой H, C1-C6 алкил, C3-C6 циклоалкил, C4-C6 циклоалкилалкил, C3-C6 гетероцикл, C2-C4 алкенил или фенил, арилалкил или гетероарилалкил, замещенный 1-4 заместителями, независимо выбранными из галогена, C1-C4 алкила, C1-C4 галогеналкила, C1-C4 алкокси или C1-C4 галогеналкокси,
R2 представляет собой H или F, и
R3 представляет собой C1-C12 алкил или незамещенный или замещенный C7-C11 арилалкил,
которые включают следующие стадии:
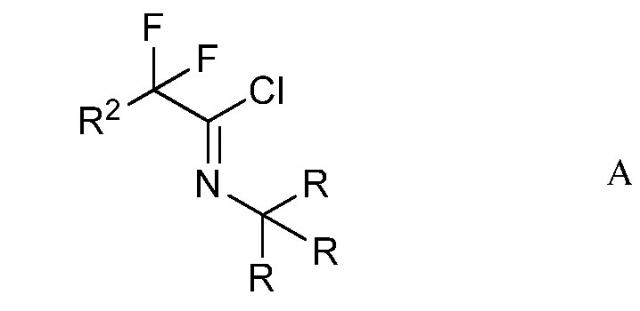
a) приведение в контакт дифторуксусной кислоты или трифторуксусной кислоты с тритиламином или трет-бутиламином в присутствии триарилфосфина и основания триалкиламина в четыреххлористом углероде в качестве растворителя с получением 2,2-дифтор- или 2,2,2-трифтор-N-(тритил или трет-бутил)этанимидоилхлорида (Формула A)
,
где
каждый из R представляет собой CH3, или каждый из R представляет собой C6H5 и
R2 представляет собой H или F;
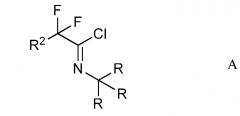
b) приведение в контакт 2,2-дифтора- или 2,2,2-трифтор-N-(тритил или изо-бутил)этанимидоилхлорида (Формула A) с 3,3-диалкоксипроп-1-ином (Формула B)
,
где R4 представляет собой C1-C4 алкил,
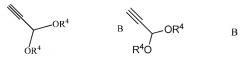
в присутствии иодида меди (I), иодида щелочного металла и фосфата щелочного металла в полярном апротонном растворителе с получением (имино)пент-2-ина диалкилацеталя Формулы C
где R, R2 и R4 являются такими, как определено ранее;
c) циклизацию (имино)пент-2-ина диалкилацеталя Формулы C с амином Формулы D
где R1 представляет собой H, C1-C6 алкил, C3-C6 циклоалкил, C4-C6 циклоалкилалкил, C3-C6 гетероцикл, C2-C4 алкенил или фенил, арилалкил или гетероарилалкил, замещенный 1-4 заместителями, независимо выбранными из галогена, C1-C4 алкила, C1-C4 галогеналкила, C1-C4 алкокси или C1-C4 галогеналкокси,
в присутствии неорганического основания щелочного металла в полярном апротонном растворителе при температуре примерно от температуры окружающей среды примерно до 100°C с получением тритил- или изо-бутил-защищенного 4-амино-6-(замещенного)пиридин-2-диалкилацеталя Формулы E
,
где R, R1, R2 и R4 являются такими, как определено ранее;
d) снятие защиты и гидролиз тритил- или изо-бутил-защищенного 4-амино-6-(замещенного)пиридин-2-диалкилацеталя Формулы E с помощью минеральной кислоты в полярном растворителе с получением 4-амино-6-(замещенного)пиколинальдегида Формулы F
,
где R1 и R2 являются такими, как определено ранее;
e) окисление 4-амино-6-(замещенного)пиколинальдегида Формулы F с помощью хлорита щелочного металла в присутствии неорганической кислоты и поглотителя хлорноватистой кислоты в водном спиртовом растворителе с получением 4-амино-6-(замещенной)пиколиновой кислоты Формулы G
,
где R1 и R2 являются такими, как определено ранее;
f) этерификацию 4-амино-6-(замещенной)пиколиновой кислоты Формулы G соединением Формулы
,
где
Y представляет собой OH, Cl, Br или I, и
R3 представляет собой C1-C12 алкил или незамещенный или замещенный C7-C11 арилалкил, с получением 4-амино-6-(замещенного)пиколината Формулы H
,
где R1, R2 и R3 являются такими, как определено ранее; и
g) галогенирование 4-амино-6-(замещенного)пиколината Формулы H с помощью источника галогена с получением 4-амино-3-галоген-6-(замещенного)пиколината Формулы I.
Галогенирование (стадия g)) может также осуществляться на альдегиде непосредственно после стадии d). Таким образом, в настоящем документе предлагаются также способы получения 4-амино-3-галоген-6-(замещенного)пиколината Формулы I
,
где
X представляет собой Cl, Br или I,
R1 представляет собой H, C1-C6 алкил, C3-C6 циклоалкил, C4-C6 циклоалкилалкил, C3-C6 гетероцикл, C2-C4 алкенил или фенил, арилалкил или гетероарилалкил, замещенный 1-4 заместителями, независимо выбранными из галогена, C1-C4 алкила, C1-C4 галогеналкила, C1-C4 алкокси или C1-C4 галогеналкокси,
R2 представляет собой H или F, и
R3 представляет собой C1-C12 алкил или незамещенный или замещенный C7-C11 арилалкил, которые включают следующие стадии:
a) приведение в контакт дифторуксусной кислоты или трифторуксусной кислоты с тритиламином или трет-бутиламином в присутствии триарилфосфина и основания триалкиламина в четыреххлористом углероде в качестве растворителя с получением 2,2-дифтор- или 2,2,2-трифтор-N-(тритил или трет-бутил)этанимидоилхлорида (Формула A)
,
где
каждый из R представляет собой CH3, или каждый из R представляет собой C6H5, и
R2 представляет собой H или F;
b) приведение в контакт 2,2-дифтор- или 2,2,2-трифтор-N-(тритил или изо-бутил)этанимидоилхлорида (A) с 3,3-диалкоксипроп-1-ином (Формула B)
,
где R4 представляет собой C1-C4 алкил,
в присутствии иодида меди (I), иодида щелочного металла и фосфата щелочного металла в полярном апротонном растворителе с получением (имино)пент-2-ина диалкилацеталя Формулы C
,
где R, R2 и R4 являются такими, как определено ранее;
c) циклизацию (имино)пент-2-ина диалкилацеталя Формулы C с амином Формулы D
,
где
R1 представляет собой H, C1-C6 алкил, C3-C6 циклоалкил, C4-C6 циклоалкилалкил, C3-C6 гетероцикл, C2-C4 алкенил или фенил, арилалкил или гетероарилалкил, замещенный 1-4 заместителями, независимо выбранными из галогена, C1-C4 алкила, C1-C4 галогеналкила, C1-C4 алкокси или C1-C4 галогеналкокси,
в присутствии неорганического основания щелочного металла в полярном апротонном растворителе при температуре примерно от температуры окружающей среды примерно до 100°C с получением тритил- или изо-бутил-защищенного 4-амино-6-(замещенного)пиридин-2-диалкилацеталя Формулы E
,
где R, R1, R2 и R4 являются такими, как определено ранее;
d) снятие защиты и гидролиз тритил- или изо-бутил-защищенного 4-амино-6-(замещенного)пиридин-2-диалкилацеталя Формулы E с помощью минеральной кислоты в полярном растворителе с получением 4-амино-6-(замещенного)пиколинальдегида Формулы F
,
где R1 и R2 являются такими, как определено ранее;
e) галогенирование 4-амино-6-(замещенного)пиколинальдегида Формулы F с помощью источника галогена с получением 4-амино-3-галоген-6-(замещенного)пиколинальдегида Формулы J
,
где R1, R2 и X являются такими, как определено ранее;
f) окисление 4-амино-3-галоген-6-(замещенного)пиколинальдегида Формулы J с помощью хлорита щелочного металла в присутствии неорганической кислоты и поглотителя хлорноватистой кислоты в водном спиртовом растворителе с получением 4-амино-3-галоген-6-(замещенной)пиколиновой кислоты Формулы K
,
где R1, R2 и X являются такими, как определено ранее; и
g) этерификацию 4-амино-3-галоген-6-(замещенной)пиколиновой кислоты Формулы K соединением Формулы
,
где
Y представляет собой OH, Cl, Br или I, и
R3 представляет собой C1-C12 алкил или незамещенный или замещенный C7-C11 арилалкил, с получением 4-амино-3-галоген-6-(замещенного)пиколината Формулы I.
Другой вариант осуществления представляет собой соединение Формулы A
,
где
каждый из R представляет собой CH3, или каждый из R представляет собой C6H5, и
R2 представляет собой H или F.
Другой вариант осуществления представляет собой соединение Формулы C
,
где
каждый из R представляет собой CH3, или каждый из R представляет собой C6H5, и
R2 представляет собой H или F, и
R4 представляет собой C1-C4 алкил.
Другой вариант осуществления представляет собой соединение Формулы E
,
где
R1 представляет собой H, C1-C6 алкил, C3-C6 циклоалкил, C4-C6 циклоалкилалкил, C3-C6 гетероцикл, C2-C4 алкенил или фенил, арилалкил или гетероарилалкил, замещенный 1-4 заместителями, независимо выбранными из галогена, C1-C4 алкила, C1-C4 галогеналкила, C1-C4 алкокси или C1-C4 галогеналкокси,
каждый из R представляет собой CH3, или каждый из R представляет собой C6H5,
R2 представляет собой H или F, и
R4 представляет собой C1-C4 алкил.
Другой вариант осуществления представляет собой соединение Формулы F
,
где
R1 представляет собой H, C1-C6 алкил, C3-C6 циклоалкил, C4-C6 циклоалкилалкил, C3-C6 гетероцикл, C2-C4 алкенил или фенил, арилалкил или гетероарилалкил, замещенный 1-4 заместителями, независимо выбранными из галогена, C1-C4 алкила, C1-C4 галогеналкила, C1-C4 алкокси или C1-C4 галогеналкокси, и
R2 представляет собой H или F.
Подробное описание
Термины "алкил" и "алкенил", а также производные термины такие как "алкокси", как используется в настоящем документе, включают в свои рамки остатки с прямой цепью и с разветвленной цепью.
Термин "арилалкил", как используется в настоящем документе, относится к фенил-замещенной алкильной группе, имеющей в целом от 7 до 11 атомов углерода, такой как бензил (-CH2C6H5), 2-метилнафтил (-CH2C10H7) и 1- или 2-фенетил (-CH2CH2C6H5 или -CH(CH3)C6H5). Фенильная группа может сама по себе быть незамещенной или замещенной одним или несколькими заместителями, независимо выбранными из галогена, нитро, циано, C1-C6 алкила, C1-C6 алкокси, галогенированного C1-C6 алкила, галогенированных C1-C6 алкокси, C1-C6 алкилтио, C(O)OC1-C6 алкила, или такой, где два соседних заместителя берутся вместе как -O(CH2)nO-, где n=1 или 2, при условии, что заместители являются стерически совместимыми и удовлетворяют правилам образования химической связи и энергии деформации.
Если конкретно не утверждается иного, термин "галоген", а также производные термины, такие как "галогеновый", относятся к фтору, хлору, брому и иоду.
Фенильные группы, замещенные 1-4 заместителями, независимо выбранными из галогена, C1-C4 алкила, C1-C4 галогеналкила, C1-C4 алкокси или C1-C4 галогеналкокси, могут иметь любую ориентацию, но предпочтительными являются изомеры 4-замещенный фенил, 2,4-дизамещенный фенил, 2,3,4-тризамещенный фенил, 2,4,5-тризамещенный фенил и 2,3,4,6-тетразамещенный фенил.
Термин "гетероцикл", как используется в настоящем документе, относится к кольцу, содержащему 3-6 атомов углерода и, по меньшей мере, один атом N, O или S, такому как пиридин, тиазол или тетрагидрофуранил. Гетероцикл может быть незамещенным или замещенным 1-4 заместителями, независимо выбранными из галогена, C1-C4 алкила, C1-C4 галогеналкила, C1-C4 алкокси или C1-C4 галогеналкокси любой ориентации. Гетероцикл может быть насыщенным, частично ненасыщенным или ароматическим.
Термин "гетероарилалкил", как используется в настоящем документе, относится к замещенной гетероциклом алкильной группе, имеющей в целом от 4 до 10 атомов углерода, такой как тиазол-2-илметил (-CH2C3H2NS) или тиофен-2-илметил (-CH2C4H3S).
4-Амино-5-фтор-3-хлор-6-(замещенные)пиколинаты получают из трифторуксусной кислоты, тритиламина, 3,3-диалкоксипроп-1-ина и замещенного метиленамина с помощью ряда стадий.
а)
b)
c)
d)
e)
f)
g)
4-Амино-3-хлор-6-(замещенные)пиколинаты получают подобным же образом из дифторуксусной кислоты, тритиламина, 3,3-диалкоксипроп-1-ина и замещенного метиленамина.
Как для 4-амино-5-фтор-3-хлор-6-(замещенных)пиколинатов, так и для 4-амино-3-хлор-6-(замещенных)пиколинатов, тритиламиновая защитная группа может быть заменена изо-бутиламиновой защитной группой.
На стадии a) трифторуксусная кислота взаимодействует с тритиламином и четыреххлористым углеродом в присутствии триарилфосфина и основания триалкиламина с получением 2,2,2-трифтор-N-(тритил)этанимидоилхлорида. Хотя требуется один эквивалент тритиламина для каждого эквивалента трифторуксусной кислоты, часто удобно использовать избыток тритиламина, как правило, избыток 10-20%. Подобный же избыток основания триалкиламина является также предпочтительным. Часто удобно использовать гораздо больший избыток триарилфосфина, как правило, в пределах 2-4 кратного избытка. Четыреххлористый углерод, хотя и используется в качестве реагента, также удобно использовать в качестве растворителя для начальной реакции. Реакция является экзотермической, и выделение тепла удобно контролировать с помощью внешнего охлаждения и контролируемого добавления раствора тритиламина в четыреххлористом углероде к смеси трифторуксусной кислоты, триалкиламина и раствора триарилфосфина в четыреххлористом углероде. Когда заканчивается начальное выделение тепла, реакционную смесь, как правило, нагревают с обратным холодильником до завершения преобразования.
При типичной реакции смесь примерно 3 эквивалентов трифенилфосфина и трифторуксусной кислоты в четыреххлористом углероде охлаждают примерно до 0°C на ледяной бане, и добавляют 20% избыток триэтиламина. При продолжении охлаждения медленно добавляют примерно 20% избыток раствора тритиламина в четыреххлористом углероде. После завершения добавления, смесь нагревают примерно до 70°C в течение нескольких часов. После охлаждения, реакционную смесь экстрагируют гексаном, и растворитель выпаривают с получением сырого 2,2,2-трифтор-N-(тритил)этанимидоилхлорида.
На стадии b) 2,2,2-трифтор-N-(тритил)этанимидоилхлорид связывается с 3,3-диалкоксипроп-1-ином в присутствии иодида меди (I), иодида щелочного металла и фосфата щелочного металла в полярном апротонном растворителе с получением N-(5,5-диалкокси-1,1,1-трифторпент-3-ин-2-илиден)-1,1,1-трифенилметанамина. Хотя требуется один эквивалент 3,3-диалкоксипроп-1-ина для каждого эквивалента этанимидоилхлорида, часто удобно использовать избыток 3,3-диалкоксипроп-1-ина, как правило, избыток 10 - 20%. Подобным же образом, как правило, предпочтительным является 10-20% молярный избыток иодида щелочного металла и фосфата щелочного металла. В то время как реакция катализируется иодидом меди (I), обычно используют примерно от 0,1 примерно до 0,3 эквивалента. Реакцию связывания осуществляют в полярном апротонном растворителе при температуре примерно от 40°C примерно до 100°C. Предпочтительные полярные апротонные растворители включают простые эфиры, подобные тетрагидрофурану, сложные эфиры, подобные этилацетату, нитрилы, подобные ацетонитрилу, амиды, подобные N,N-диметилформамиду, и N-метилпирролидинону и сульфоксиды, подобные диметилсульфоксиду. Предпочтительными являются безводные растворители, при этом безводный ацетонитрил является особенно предпочтительным.
При типичной реакции 2,2,2-трифтор-N-(тритил)этанимидоилхлорид и небольшой избыток 3,3-диэтоксипроп-1-ина смешивают примерно с 0,3 эквивалентами иодида меди (I) и небольшим избытком фосфата калия и иодида калия в безводном ацетонитриле. Смесь нагревают примерно при 60°C в атмосфере азота до тех пор, пока реакция не завершится. После охлаждения экстракционный растворитель, подобный галогенированному углеводороду, добавляют к смеси вместе с водой. Органический слой извлекают, промывают насыщенным раствором соли и сушат. Растворитель выпаривают с получением сырого N-(5,5-диэтокси-1,1,1-трифторпент-3-ин-2-илиден)-1,1,1-трифенилметанамина.
На стадии c) N-(5,5-диалкокси-1,1,1-трифторпент-3-ин-2-илиден)-1,1,1-трифенилметанамин взаимодействует с метиленамином, замещенным H, алкильной, циклоалкильной, алкенильной или (замещенной)фенильной, арилалкильной или гетероарилалкильной группой, в присутствии неорганического основания щелочного металла в полярном апротонном растворителе с получением тритил-защищенного 4-амино-5-фтор-6-(замещенного)пиридина диалкилацеталя. Хотя требуется один эквивалент замещенного метиленамина для каждого эквивалента N-(5,5-диалкокси-1,1,1-трифторпент-3-ин-2-илиден)-1,1,1-трифенилметанамина, часто удобно использовать избыток замещенного метиленамина, как правило, 2-4-кратный избыток. Пригодные для использования неорганические основания щелочных металлов включают соли лития, натрия, калия и цезия, и гидроксидов, карбонатов и фосфатов. Карбонат цезия является особенно предпочтительным. Как правило, удобно использовать 2-4-кратный избыток неорганического основания щелочного металла. Предпочтительные полярные апротонные растворители включают простые эфиры, подобные тетрагидрофурану, сложные эфиры, подобные этилацетату, нитрилы, подобные ацетонитрилу, амиды, подобные N,N-диметилформамиду и N-метилпирролидинону и сульфоксиды, подобные диметилсульфоксиду. Предпочтительными являются безводные растворители, при этом безводный тетрагидрофуран и диметилсульфоксид являются особенно предпочтительными. Реакцию, как правило, осуществляют при температуре примерно от температуры окружающей среды примерно до 100°C.
При типичной реакции N-(5,5-диэтокси-1,1,1-трифторпент-3-ин-2-илиден)-1,1,1-трифенилметанамин смешивают примерно с 2,5-3-кратным избытком (4-хлор-2-фтор-3-метоксифенил)метиламина и примерно 2,5-3-кратным избытком карбоната цезия в безводном тетрагидрофуране. Смесь нагревают примерно при 80°C до тех пор, пока реакция не завершится. После охлаждения, экстракционный растворитель, подобный галогенированному углеводороду, добавляют к смеси вместе с водой. Органический слой извлекают, промывают насыщенным раствором соли и сушат. Растворитель выпаривают с получением сырого 2-(4-хлор-2-фтор-3-метоксифенил)-6-(диэтоксиметил)-3-фтор-N-тритилпиридин-4-амина.
На стадии d) тритил-защищенный 4-амино-5-фтор-6-(замещенный)пиридин-2-диалкилацеталь обрабатывают с помощью минеральной кислоты в полярном растворителе при температуре примерно от температуры окружающей среды примерно до 100°C с получением 4-амино-5-фтор-6-(замещенного)пиколинальдегида. Пригодные для использования минеральные кислоты включают серную и фосфорную кислоты, при этом серная кислота является предпочтительной. Минеральные кислоты обычно используются в виде водных растворов. Требуется приблизительно один эквивалент минеральной кислоты, но предпочтительным является 10-30% избыток. Снятие защиты/гидролиз удобно осуществлять в смеси полярных растворителей, таких как ацетонитрил с водой.
При типичной реакции 2-(4-хлор-2-фтор-3-метоксифенил)-6-(диэтоксиметил)-3-фтор-N-тритилпиридин-4-амин обрабатывают с помощью 1M (молярного) раствора серной кислоты в смеси ацетонитрил-вода. Смесь нагревают с обратным холодильником до тех пор, пока реакция не завершится. Смесь добавляют к метиленхлориду, и органический слой отделяют, промывают насыщенным раствором соли и сушат. Растворитель выпаривают с получением сырого 4-амино-6-(4-хлор-2-фтор-3-метоксифенил)-5-фторпиколинальдегида.
На стадии e) 4-амино-5-фтор-6-(замещенный)пиколинальдегид окисляется с помощью хлорита щелочного металла в присутствии соли неорганической кислоты и поглотителя хлорноватистой кислоты в водной смеси органических растворителей с получением 4-амино-5-фтор-6-(замещенной)пиколиновой кислоты. Хотя требуется один эквивалент хлорита натрия для окисления альдегида карбоновой кислоты, часто удобно использовать 2-8 эквивалентов. Окисление осуществляют в смеси воды с органическими растворителями, такими как ацетонитрил или трет-бутанол, при слегка кислотных условиях (pH 3-5), получаемых посредством добавления 2-10 эквивалентов соли неорганической кислоты, такой как динатрий гидрофосфат. Чтобы предотвратить нежелательные реакции хлорноватистой кислоты, образовавшейся во время окисления, добавляют 2-30 эквивалентов поглотителя кислорода, такого как 2-метил-2-бутен, резорцинол или сульфаминовая кислота.
При типичной реакции 4-амино-6-(4-хлор-2-фтор-3-метоксифенил)-5-фторпиколинальдегид окисляется с помощью избытка хлорита натрия, в пределах 20-30 эквивалентов 2-метил-2-бутена и примерно 5 эквивалентов динатрий гидрофосфата в смеси изо-бутанол/вода. Смесь нагревают примерно при 80°C до тех пор, пока реакция не завершится. После охлаждения, смесь обрабатывают с помощью разбавленной хлористоводородной кислоты и экстрагируют этилацетатом. Органический слой отделяют и сушат. Растворитель выпаривают с получением сырой 4-амино-6-(4-хлор-2-фтор-3-метоксифенил)-5-фторпиколиновой кислоты.
На стадии f) 4-амино-5-фтор-6-(замещенную)пиколиновую кислоту этерифицируют. Сложные эфиры пиколиновых кислот получают посредством связывания пиколиновой кислоты со спиртом с использованием любого количества пригодных для использования активирующих агентов, таких как те, которые используются для пептидного связывания, такие как дициклогексилкарбодиимид (DCC) или карбонилдиимидазол (CDI), или посредством взаимодействия соответствующей кислоты с соответствующим арилалкиловым спиртом в присутствии кислотного катализатора. Альтернативно, сложные эфиры могут быть получены посредством взаимодействия пиколиновой кислоты с алкил- или арилалкилгалогенидом в присутствии основания. Эти процедуры хорошо известны специалистам в области органической химии и описаны, например, в публикации заявки на патент США № 2012/0190551 A1.
При типичной реакции 4-амино-6-(4-хлор-2-фтор-3-метоксифенил)-5-фтор-пиколиновая кислота взаимодействует с небольшим избытком бензилбромида и примерно 2 эквивалентами карбоната калия в полярном апротонном растворителе, таком как диметилсульфоксид или N,N-диметилформамид (DMF). Бензил 4-амино-6-(4-хлор-2-фтор-3-метоксифенил)-5-фторпиколинат извлекают посредством распределения реакционной смеси между этилацетатом и водой, отделения и сушки органической фазы и выпаривания растворителя.
На стадии g) 4-амино-5-фтор-6-(замещенный)пиколинат галогенируют с помощью источника галогена с получением 4-амино-5-фтор-3-галоген-6-(замещенного)пиколината Формулы I. При реакции галогенирования атом хлора, брома или иода вводится в 3-положение пиколината посредством взаимодействия 3-незамещенного пиколината с источником галогена в инертном растворителе.
Когда атом галогена в 3-положении представляет собой Cl, источник хлора может представлять собой сам хлор (Cl2) или реагенты, такие как сульфурилхлорид, N-хлорсукцинимид или 1,3-дихлор-5,5-диметилимидазолидин-2,4-дион. Когда используется хлор или сульфурилхлорид, используют большой избыток хлорирующего агента. Когда используют газообразный хлор, реакцию осуществляют в инертном растворителе, предпочтительно, в таком растворителе как дихлорметан, смесь дихлорметан-вода или уксусная кислота. Когда используют сульфурилхлорид, реакция может осуществляться в инертном растворителе, таком как дихлорметан или в сульфурилхлориде самом по себе. Температура, при которой осуществляется реакция, не является критичной, но обычно составляет примерно от 0°C примерно до 45°C, а предпочтительно, примерно от 10°C примерно до 30°C. Типичная реакция, как правило, требует примерно от 0,5 примерно до 5 часов. Реакция хлорирования обычно осуществляется при атмосферном давлении окружающей среды.
Когда используемый хлорирующий агент представляет собой N-хлорсукцинимид или 1,3-дихлор-5,5-диметилимидазолидин-2,4-дион, реакцию осуществляют с использованием стехиометрического количества хлорирующего реагента. При хлорировании с использованием 1,3-дихлор-5,5-диметилимидазолидин-2,4-диона в качестве хлорирующего агента, как обнаружено, взаимодействуют оба атома хлора в гидантоине. Реакцию осуществляют в инертном полярном растворителе, таком как DMF или ацетонитрил. Температура, при которой осуществляется реакция, не является критичной, но обычно составляет примерно от 20°C примерно до 85°C, а предпочтительно, примерно от 50°C примерно до 80°C. Когда в качестве растворителя используется ацетонитрил, удобно осуществлять реакцию при температуре дефлегмации. Типичная реакция, как правило, требует примерно от 0,5 примерно до 5 часов. Реакция хлорирования обычно осуществляется при атмосферном давлении окружающей среды.
Когда атом галогена в 3-положении представляет собой Br, источник брома может представлять собой сам бром (Br2) или реагенты, такие как сульфурилбромид, N-бромсукцинимид или 1,3-дибром-5,5-диметилимидазолидин-2,4-дион. Когда в качестве бромирующего агента используют Br2, можно использовать его большой избыток, и реакцию осуществляют в инертном растворителе, предпочтительно, в таком растворителе, как дихлорметан, смесь дихлорметан-вода или уксусная кислота. Температура, при которой осуществляется реакция, не является критичной, но обычно составляет примерно от 0°C примерно до 45°C, а предпочтительно, примерно от 10°C примерно до 30°C. Типичная реакция, как правило, требует примерно от 0,5 примерно до 5 часов. Реакция бромирования обычно осуществляется при атмосферном давлении окружающей среды.
Когда используемый бромирующий агент представляет собой N-бромсукцинимид или 1,3-дибром-5,5-диметилимидазолидин-2,4-дион, реакцию осуществляют с использованием стехиометрического количества бромирующего реагента. Реакция осуществляют в инертном полярном растворителе, таком как DMF или ацетонитрил. Температура, при которой осуществляется реакция, не является критичной, но обычно составляет примерно от 20°C примерно до 85°C, а предпочтительно, примерно от 50°C примерно до 80°C. Когда ацетонитрил используют в качестве растворителя, удобно осуществлять реакцию при температуре дефлегмации. Типичная реакция, как правило, требует примерно от 0,5 примерно до 5 часов. Реакцию бромирования обычно осуществляют при атмосферном давлении окружающей среды.
Когда атом галогена в 3-положении представляет собой I, источник иода может представлять собой сам иод (I2) или реагенты, такие как иод монохлорид или N-иод сукцинимид. Периодную кислоту можно использовать в сочетании с I2. Когда в качестве иодирующего агента используют I2, можно использовать большой избыток I2, и реакцию осуществляют в инертном растворителе, предпочтительно, в таком растворителе, как дихлорметан, смесь дихлорметан-вода, метиловый спирт или уксусная кислота. Температура, при которой осуществляется реакция, не является критичной, но обычно она составляет примерно от 0°C примерно до 45°C, а предпочтительно, примерно от 10°C примерно до 30°C. Типичная реакция, как правило, требует примерно от 0,5 примерно до 5 часов. Реакция иодирования обычно осуществляется при атмосферном давлении окружающей среды.
При типичной реакции бензил 4-амино-6-(4-хлор-2-фтор-3-метоксифенил)-5-фторпиколинат обрабатывают 0,55 эквивалента 1,3-дихлор-5,5-диметилимидазолидин-2,4-диона в ацетонитриле. Реакционную смесь перемешивают при температуре дефлегмации в течение 1 часа. После охлаждения до комнатной температуры, добавляют воду для преципитации продукта.
В тех случаях, когда галогенирующий агент не взаимодействует с функциональной группой альдегида, галогенирование (стадия g) может также осуществляться на альдегиде Формулы F.
Продукты, полученные с помощью любого из этих способов, могут извлекаться с помощью обычных средств, таких как выпаривание или экстракция, и могут очищаться с помощью стандартных процедур, таких как перекристаллизация или хроматография.
Описанные варианты осуществления и следующие далее примеры предназначены для иллюстративных целей и не предназначаются для ограничения рамок формулы изобретения. Другие модификации, применения или сочетания относительно композиций, описанных в настоящем документе, будут очевидны специалистам в данной области, без отклонения от духа и рамок предмета формулы изобретения.
Примеры
Термины пиколинат, пиколинальдегид и пиколиновая кислота также выражаются в настоящем документе как пиридин-2-карбоксилат, пиридин-2-карбальдегид и пиридин-2-карбоновая кислота, соответственно.
Пример 1. 2,2,2-Трифтор-N-(тритил)этанимидоилхлорид
В 1-литровую (л), трехгорлую круглодонную колбу, снабженную механической мешалкой, капельной воронкой и датчиком температуры J-KEM, загружают тритиламин (24,90 грамм (г), 96 миллимоль (ммоль), Alfa Aesar) и четыреххлористый углерод (150 миллилитр (мл)). Раствор охлаждают на ледяной бане (<5°C) и обрабатывают по частям трифторуксусной кислотой (6,13 мл, 80 ммоль). Добавление осуществляют при такой скорости, чтобы поддерживать температуру ≤10°C. После того как смесь опять охлаждают до температуры ниже 5°C, ее обрабатывают, добавляя по каплям триэтиламин (13,4 мл, 96 ммоль, без выделения тепла). После завершения добавления триэтиламина, ледяную баню удаляют, капельную воронку заменяют обратным холодильником и реакционную смесь нагревают до 65°C с использованием нагревательного кожуха. Затем добавляют по частям трифенилфосфин (Ph3P; 62,9 г, 240 ммоль) (5-10 г за один раз). При каждом добавлении трифенилфосфина температура сначала должна падать на 2-3°C, а затем подниматься до ~70°C. Реакционная смесь получает возможность для охлаждения до 65-66°C перед дополнительным добавлением Ph3P (в реакционной смеси образуется преципитат, Ph3P=O). После добавления всего трифенилфосфина, реакционную смесь нагревают до 76°C.
После перемешивания при 76°C в течение ~2 часов (ч) реакционная смесь получает возможность для охлаждения до комнатной температуры, и ее обрабатывают гексаном (400 мл). После быстрого перемешивания в течение ~30 минут (мин), смесь фильтруют через воронку Бюхнера. Собранный продукт повторно суспендируют в гексане (400 мл), и суспензию перемешивают в течение нескольких минут и фильтруют. Фильтраты объединяют и концентрируют в вакууме с получением твердого продукта. Твердый продукт суспендируют с помощью гексана (~300 мл) и фильтруют через фильтровальную бумагу. Фильтрат, желтый раствор, концентрируют в вакууме с получением 14,32 г светло-желтого твердого продукта. Твердые продукты, которые удаляют посредством фильтрования, объединяют и перемешивают вместе с гексаном (500 мл). Анализ с помощью ТСХ фазы гексана показывает что то, что появляется, представляет собой продукт. Смесь фильтруют, и твердые продукты еще раз перемешивают вместе с гексаном (500 мл). Твердые продукты удаляют с помощью вакуумного фильтрования через воронку с фильтром из спеченного стекла. Фильтрат объединяют с 14,32 г светло-желтого твердого продукта. Растворитель удаляют в вакууме с получением 30,37 г светло-желтого твердого продукта. Сырой материал кристаллизуют из ацетонитрила (~250 мл); при охлаждении образуются кристаллы. После стояния в морозилке в течение 2 часов, кристаллы удаляют с помощью вакуумного фильтрования и промывают холодным ацетонитрилом. Материал сушат на воздухе в течение нескольких минут, а затем сушат в вакуумной печи (40-50°C) с получением указанного в заглавии продукта (21,97 г, 73%) в виде мелкодисперсных белых иголок: т.пл. 144-145°C; 1H ЯМР (400 МГц, CDCl3) δ 7,34-7,19 (м, 15H); 19F ЯМР (376 МГц, CDCl3) δ -71,24; EIMS m/z 373 (M+), 338, 296, 243, 219, 193, 165, 143, 127, 119, 77; IR (тонкая пленка) 3070, 1712, 1488, 1444, 1270, 1162, 1151, 946, 770 см-1.
Пример 2. 2,2-Дифтор-N-(тритил)этанимидоилхлорид
В 1-л трехгорлую круглодонную колбу, снабженную механической мешалкой, капельной воронкой и датчиком температуры J-KEM, загружают тритиламин (24,90 г, 96 ммоль, Alfa Aesar) и четыреххлористый углерод (150 мл). Раствор охлаждают на ледяной бане (<5°C) и обрабатывают по частям дифторуксусной кислотой (5,03 мл, 80 ммоль). Добавление осуществляют при такой скорости, чтобы