Применение спейсерированных биядерных комплексов диспрозия (iii) с ацилгидразонами 1-фенил-3-метил-4-формил-5-гидроксипиразола в качестве фунгицидного средства
Иллюстрации
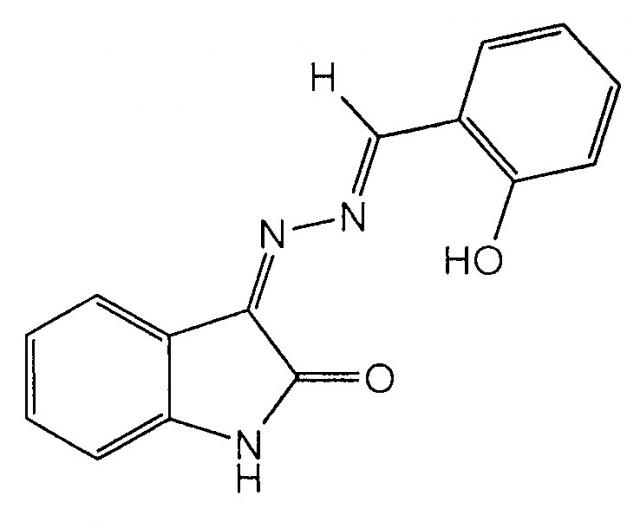
Показать всеИзобретение относится к применению спейсерированных биядерных комплексов диспрозия(III) с ацилгидразонами 1-фенил-3-метил-4-формил-5-гидроксипиразола формулы:
в качестве фунгицидного средства. Молекулярная структура предлагаемых координационных соединений позволяет плавно регулировать их фунгицидную активность за счет изменения длины алифатического спейсера, соединяющего моноядерные субъединицы. 2 табл.
Реферат
Техническое решение относится к области биологически активных координационных соединений металлов, в частности комплексов лантанидов с ацилгидразонами карбоновых кислот. Повышенный интерес к координационным соединениям лантанидов с ацилгидразонами вызван возможностями их применения в медицинской практике в качестве веществ, обладающих противотуберкулезной активностью, антираковых и противомалярийных препаратов. (Yang, Zheng-Yin. Crystal structure and antitumor activity of some rare earth metal complexes with Schiff base / Zheng-Yin Yang, Ru-Dong Yang, Fa-Shen Li, Kai-Bei Yu // Polyhedron. - 2000. - V. 19. - P. 2599-2604; Chen, Gong-Jun. Synthesis, DNA binding, photo-induced DNA cleavage, cytotoxicity studies of a family of heavy rare earth complexes / Gong-Jun Chen, Zhi-Gang Wang, Xin Qiao et al. // Journal of Inorganic Biochemistry. - 2013. - V. 127. - P. 39-15).
Недостатком аналогов является отсутствие возможности осуществлять плавное регулирование биологической активности препаратов за счет изменения их молекулярной структуры.
Известны комплексы лантанидов с бисгидразоном на основе изатина и салицилового альдегида, проявляющие фунгицидную активность.
(Mohanan, K. Microwave assisted synthesis, spectroscopic, thermal, and antifungal studies of some lanthanide(III) complexes with a heterocyclic bishydrazone / K. Mohanan, B. Sindhu Kumari, G. Rijulal // Journal of rare earths. - 2008, V. 26 P. 16-21).
Недостатком аналога является отсутствие возможности плавного регулирования биологической активности препарата за счет изменения его молекулярной структуры.
Известны спейсерированные биядерные комплексы диспрозия с ацилгидразонами 1-фенил-3-метил-4-формил-5-гидроксипиразола (Конник О.В. и др., Координационные соединения. 2014, т. 59, 11, с. 1481-1487 (см. с. 1481 синтез, с. 1483 соединения I-VII).
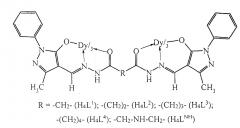
Сущность изобретения характеризуется тем, что предлагается использовать спейсерированные биядерные комплексы диспрозия с ацилгидразонами 1-фенил-3-метил-4-формил-5-гидроксипиразола следующей формулы:
в качестве фунгицидного средства.
Спейсерированные биядерные комплексы диспрозия с ацилгидразонами 1-фенил-3-метил-4-формил-5-гидроксипиразола указанного состава (Конник О.В. Координационные соединения диспрозия(III) с диацилдигидразонами 3-метил-1-фенил-4-формилпиразол-5-она / О.В. Конник. В.Ф. Шульгин, З.З. Бекирова и др. // Журнал неорганической химии. 2014, т. 59. №11, С. 1481-1487) получают следующим образом.
К раствору 4,8 ммоль 3-метил-1-фенил-4-формилпиразол-5-она в 20 мл этилового спирта добавили 2,4 ммоль дигидразида соответствующей дикарбоновой кислоты. Смесь перемешивали 2 часа на магнитной мешалке при незначительном нагревании. К образовавшейся суспензии добавили 10 мл пиридина и 1,6 моль хлорида диспрозия в 15 мг спиртового раствора. Образовавшийся раствор перемешивали на магнитной мешалке 0,5 часа и оставили на ночь. Образовавшийся осадок отделили фильтрованием, промыли этиловым спиртом и высушили на воздухе. Получены мелкокристаллические вещества светло-желтого или бежевого цвета. Выход составил 70-85% от теоретически возможного.
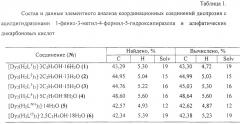
Состав и данные элементного анализа синтезированных комплексов представлены в таблице 1.
Молекулярная структура спейсерированных биядерных координационных соединений позволяет плавно регулировать их биологическую активность за счет изменения длины и природы алифатического спейсера, соединяющего моноядерные субъединицы. Для синтезированных спейсерированных биядерных комплексов было исследовано действие на плесневые грибки. В качестве биологической матрицы использованы грецкие орехи, в качестве объектов исследования были выбраны комплексы диспрозия с разной длиной углеводородного спейсера.
Полученные данные представлены в таблице 2.
В результате проведенных исследований установлено, что используемый растворитель (вода - ДМСО, 1:1) слабо стимулирует рост плесени, увеличивая число колониеобразующих единиц с 485 до 499. Введение в систему 1%-ного раствора комплекса Dy(H2L1)3, в количестве 20 мг на 1 г основы понижает численность КOE до 420. Препарат на основе комплекса Dy(H2L2)3 снижает численность КOE до 390. Это свидетельствует о том, что фунгицидная активность исследуемых димерных комплексов увеличивается при увеличении длины алифатического спейсера. Это может быть обусловлено увеличением липофильности молекулы, которая обеспечивает проводимость препарата через клеточные мембраны. Более высокую проницаемость через клеточную мембрану, а соответственно более высокую фунгицидную активность, обеспечивает также использование в качестве спейсера иминодиметиленового радикала.
Техническое решение позволяет плавно регулировать биологическую активность координационных соединений диспрозия с ацилгидразонами дикарбоновых кислот путем изменения длины и природы углеводородного спейсера.
Применение спейсерированных биядерных комплексов диспрозия(III) с ацилгидразонами 1-фенил-3-метил-4-формил-5-гидроксипиразола формулы:
в качестве фунгицидного средства.