Сложный эфир филлигенина и ибупрофена, способ его получения и его применение
Иллюстрации
Показать всеНастоящее изобретение относится к сложному эфиру филлигенина и ибупрофена с общей структурной формулой, представленной формулой (I):
(I).
Также предложены способ получения сложного эфира (I), его антивирусное применение и противовирусный медикамент. Сложный эфир филлигенина и ибупрофена, представленный формулой (I), может найти применение в качестве противовирусного средства. 5 н. и 7 з.п. ф-лы, 4 ил., 19 табл., 5 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к области фармацевтической химии и, в частности, настоящее изобретение относится к способу получения сложного эфира филлигенина и ибупрофена; а также к антивирусному, жаропонижающему, противовоспалительному и анальгезирующему фармакологическим эффектам такого соединения.
Предшествующий уровень техники
Филлигенин, также обозначаемый как филлигенол, является агликоновой частью филлирина. Он является главным активным ингредиентом растительного вида форзиции пониклой (Forsythia suspense (Thunb. Vahlof) из рода Форзиция (Forsythia) семейства Маслиновые (Oleaceae), структура которого представлена формулой (II). Современные фармакологические исследования показывают, что филлигенин обладает противовирусным, антиоксидантным, антибактериальным, противоопухолевым, противовоспалительным эффектом; способствует снижению уровня липидов в крови, удаляет свободные радикалы и т.п.
| (II) | (III) |
Молекулы филлигенина являются нестабильными и легко окисляемыми, а молекулярная конфигурация подвержена изменениям в кислой среде. Было установлено, что молекулы филлигенина крайне легко преобразуются в новые метаболиты кишечной флорой, при исследовании метаболизма филлирина, стимулированного кишечными бактериями крыс.
Ибупрофен является нестероидным противовоспалительным и анальгезирующим эффективным медикаментом, структура которого представлена формулой (III), но длительное применение медикамента вызывает такие побочные эффекты, как диспепсия, язва желудка, гепатотоксичность и тому подобное. В 1989 году итальянская компания Angelini разработала и выпустила на рынок сложный эфир ибупрофена и гваякола, синтезированный из ибупрофена и гваякола; при этом ибупрофен-гваяколовый эфир не деградирует в желудочно-кишечном тракте человека, а распадается на ибупрофен и гваякол после поступления в кровь, сохраняя жаропонижающий, анальгезирующий и противовоспалительный эффект ибупрофена in vivo, при этом снижается его раздражающее влияние на желудочно-кишечный тракт и уменьшается гепатотоксичность. В 2004 году Xiuli Zhao из Шэньянского Фармацевтического университета была проведена этерификация ибупрофена эвгенолом для получения фармацевтического соединения эвгенол-ибупрофенового эфира, который также обладает противовирусным, жаропонижающим, анальгезирующим, противовоспалительным эффектом in vivo. Кроме того, фармацевтическое соединение эвгенол-ибупрофеновый эфир обладает улучшенной стабильностью эвгенола (Китайская патентная публикация № CN 1597656A).
До настоящего времени не имеется отчетов и документов о синтезе сложноэфирного соединения филлигенина и его фармакологических эффектах, и таким образом, мы получили филлигенин-ибупрофеновый эфир посредством реакции этерификации филлигенина с ибупрофеном и предполагаем получить новое соединение, являющееся более стабильным и обладающее различными фармакологическими эффектами, такими как противовирусный, жаропонижающий, противовоспалительный и анальгезирующий эффект и т.п.
Cущность изобретения
Целью настоящего изобретения является обеспечение нового противовирусного соединения филлигенин-ибупрофенового эфира, способа его получения и применения, с учетом существующих проблем в предшествующем уровне техники; и филлигенин-ибупрофеновый эфир, обеспеченный настоящим изобретением, обладает противовирусным, жаропонижающим, анальгезирующим и противовоспалительным эффектом, и может применяться для приготовления медикаментов или полезных для здоровья продуктов для лечения с обеспечением противовирусного, жаропонижающего и анальгезирующего эффекта; способ получения филлигенин-ибупрофенового эфира является простым и удобным для выполнения, и пригоден для производства в промышленном масштабе.
Для достижения цели настоящего изобретения в одном аспекте настоящее изобретение обеспечивает соединение филлигенин-ибупрофеновый эфир с общей структурной формулой, представленной формулой (I):
(I)
В другом аспекте настоящее изобретение обеспечивает способ получения соединения филлигенин-ибупрофенового эфира, включающий этапы, проводимые в следующей последовательности:
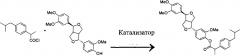
(А) Ибупрофен подвергают реакции ацилирования с ацилирующим агентом с получением ибупрофен-ацилхлорида;
и (В) проводят реакцию этерификации между филлигенином и ибупрофен-ацилхлоридом в присутствии катализатора с получением продукта.
При этом ацилирующий агент на этапе (А) выбран из тионилхлорида, фосфора трихлорида, фосфора пентахлорида, фосфора оксихлорида или фосфора оксипентахлорида.
В частности, температура реакции ацилирования составляет 10-30°С.
В частности, молярное отношение ибупрофена к ацилирующему агенту составляет 1:10-1:12, предпочтительно 1:10.
В частности, время реакции составляет 12-24 часа, предпочтительно 15-24 часа.
В частности, вначале ибупрофен растворяют в органическом растворителе, а затем смешивают с ацилирующим агентом, а затем проводят реакцию ацилирования.
При этом количество используемого органического растворителя является таким, что каждый 1 моль ибупрофена растворяют в 3-4 литрах органического растворителя, предпочтительно 4 литрах органического растворителя.
В частности, органический растворитель выбран из толуола, бензола, ацетона, дихлорметана и трихлорметана, предпочтительно дихлорметана и ацетона, и более предпочтительно дихлорметана.
В частности, способ получения дополнительно включает концентрирование смеси после реакции ацилирования под вакуумом, и удаление органического растворителя для получения ибупрофен-ацилхлорида.
В частности, обработку испарением проводят при пониженном давлении.
В частности, отношение филлигенина к катализатору составляет от 1:1 до 1,2:1, предпочтительно 1:1.
При этом неорганическое основание выбрано из натрия карбоната, калия карбоната, натрия бикарбоната или калия бикарбоната; органическое основание выбрано из пиридина, триэтиламина, N,N-диметилформамида или металла алкоксида.
В частности, металла алкоксид выбран из натрия метанолата или калия трет-бутоксида.
При этом молярное отношение филлигенина на этапе (В) к ибупрофену на этапе (А) составляет от 0,8:1 до 1,2:1, предпочтительно 1:1.
В частности, температура реакции этерификации составляет от 30°C до 70°C, предпочтительно от 40°C до 60°C; время реакции этерификации составляет 12-24 часа, предпочтительно 15-20 часов.
При этом реакцию этерификации на этапе (В) проводят в нагретом состоянии после добавления филлигенина и ибупрофен-ацилхлорида в органический растворитель.
В частности, органический растворитель выбран из толуола, бензола, ацетона, дихлорметана и трихлорметана, предпочтительно, дихлорметана или ацетона.
В частности, вначале филлигенин растворяют в органическом растворителе; затем добавляют катализатор и смесь перемешивают до однородного состояния; затем ибупрофен-ацилхлорид, приготовленный на этапе (А), добавляют в однородную смесь и проводят реакцию этерификации при перемешивании и нагревании.
В частности, органический растворитель выбран из толуола, бензола, ацетона, дихлорметана и трихлорметана, предпочтительно дихлорметана или ацетона.
В частности, количество используемого органического растворителя является таким, что каждый 1 моль филлигенина растворяют в 15-25 литрах органического растворителя, предпочтительно, 20 литрах органического растворителя.
В частности, способ получения дополнительно включает этап (С), где продукт после реакции этерификации подвергают выделению и очистке: (С-1) смесь после реакции этерификации охлаждают, и температура снижается; (С-2) затем смесь подвергают фильтрации, фильтрат подвергают концентрированию, и удаляют растворитель; (С-3) затем твердое вещество после удаления органического растворителя подвергают перекристаллизации для получения филлигенин-ибупрофенового эфира.
При этом смесь после реакции этерификации на этапе (С-1) охлаждают до 20°C-30°C; концентрирование на этапе (С-2) является упариванием охлажденной смеси под вакуумом для удаления органического растворителя; растворителем при перекристаллизации на этапе (С-3) является петролейный эфир или гексан.
Соединением из настоящего изобретения, приготовленным вышеупомянутым способом, является филлигенин-ибупрофеновый эфир, который является твердым белым веществом при комнатной температуре. Структура филлигенин-июбупрофенового эфира была подтверждена и анализирована, как указано ниже.
Масс-спектр высокого разрешения: 583,26663; C34H40O7Na+1;
Спектр инфракрасного поглощения: характерный пик поглощения (см-1) 2953,73 (-CH3); 2867,21 (-CH2-); 29835,45 (Ar-OCH3); 1760,11 (C=O); 1606,25, 1591,38, 1514,46 (Ar-CH); и 1270,57, 1042,86 (Ar-O-C).
1H-ЯМР: (CDCl3, 600 MHz) δppm: 6,856-6,961 (m, 6H), 7,135-7,145 (m, 2H), 7,322-7,335 (d, 2H, J = 7,8Hz), 4,860-4,853 (d, 1H, J = 4,2 Hz), 4,494-4,484 (d, 1H, J = 6 Hz), 4,145-4,129 (d, 1H, J = 9,6 Hz), 3,988-3,976 (d, 1H, J = 7,2 Hz), 3,900-3,843 (s, 8H), 3,720-3,713 (s, 3H), 3,346-3,323 (s, 2H), 2,891-2,881 (d, 1H, J = 6 Hz), 2,481-2,470 (d, 2H, J = 6,6 Hz), 1,882-1,860 (s, 1H), 1,620-1,609 (d, 3H, J = 6,6 Hz), 0,920-0,910 (s, 6H).
13C-ЯМР: (CDCl3, 125 MHz) δppm: 172,901(C-28), 151,374(C-12), 148,880(C-18), 148,056(C-13), 140,635(C-35), 140,203(C-17), 139,486 (C-10), 137,436(C-9), 130,971(C-31), 129,328(C-33), 127,445(C-36), 127,445(C-37), 122,578(C-34), 118,045(C-20), 117,767(C-16), 111,097(C-15), 110,035(C-14), 110,015(C-19), 109,020(C-11), 87,345(C-6), 82,043(C-4), 71,107(C-1), 69,830(C-8), 55,958(C-OMe), 55,933(C-OMe), 55,851(C-OMe), 54,694(C-2), 50,101(C-3), 45,107(C-38), 45,040(C-30), 30,252(C-39), 22,448(C-40, 41), 18,803(C-32).
В еще одном аспекте настоящее изобретение обеспечивает противовирусное применение филлигенин-ибупрофенового эфира.
В другом аспекте настоящее изобретение обеспечивает применение филлигенин-ибупрофенового эфира в изготовлении противовирусных средств или полезных для здоровья продуктов.
Настоящее изобретение также обеспечивает применение филлигенин-ибупрофенового эфира в изготовлении жаропонижающих, анальгезирующих и противовоспалительных лекарственных средств или средств медицинского назначения.
При этом настоящее изобретение обеспечивает фармацевтическую композицию или композицию медицинского назначения, содержащую филлигенин-ибупрофеновый эфир, обладающий противовирусной, жаропонижающей, анальгезирующей, противовоспалительной эффективностью.
В частности, фармацевтическая композиция включает филлигенин-ибупрофеновый эфир по настоящему изобретению и фармацевтически пригодные вспомогательные вещества.
При этом фармацевтически пригодные вспомогательные вещества означают нетоксичные твердые, полутвердые или жидкие наполнители, разбавители, носители, регуляторы рН, регуляторы ионной силы, агенты для замедленного или контролируемого высвобождения, инкапсулирующие материалы или другие фармацевтические вспомогательные вещества. Используемые носители могут быть приспособлены для соответствующего способа применения, и могут быть включены в инъекционные формы, лиофилизированные порошки (для инъекций), спреи, пероральные растворы, пероральные суспензии, таблетки, капсулы, устойчивые к действию желудочного сока таблетки, пилюли, порошки, гранулы, рецептуры пролонгированного высвобождения или отсроченного высвобождения, и тому подобные, со вспомогательными веществами, хорошо известными специалисту в данной области техники. Предпочтительно, филлигенин-ибупрофеновый эфир из первого аспекта настоящего изобретения применяют посредством инъекции или через пищеварительный тракт, и таким образом, фармацевтическая композиция из настоящего изобретения предпочтительно является составом для инъекций или применения через пищеварительный тракт, т.е. особо предпочтительными являются вспомогательные вещества, приспособленные для составов для применения посредством инъекции или энтерального применения. Таким образом, «применение через пищеварительный тракт» в настоящей заявке означает подход применения медицинских композиций через пищеварительный тракт пациента, включая пероральное применение, внутрижелудочное применение, и ректальное применение и тому подобное, предпочтительно пероральное применение; например, вспомогательные вещества, хорошо известные специалистам в данной области техники, можно применять для получения пероральных растворов, пероральных суспензий, таблеток, капсул, кишечнорастворимых таблеток, пилюль, порошков, гранул, препаратов пролонгированного высвобождения или отсроченного высвобождения, и тому подобного; где препараты для инъекций являются главным образом растворами для инъекций и порошками для инъекций.
Новое соединение филлигенин-ибупрофеновый эфир из настоящего изобретения обладает противовирусной, жаропонижающей, анальгезирующей и противовоспалительной эффективностью, и может применяться для изготовления противовирусных, жаропонижающих, анальгезирующих, противовоспалительных лекарственных средств или средств медицинского назначения; филлигенин-ибупрофеновый эфир готовят путем реакции этерификации, и способ получения имеет преимущества мягких условий реакции, высокого выхода, низкого потребления энергии, безопасности для окружающей среды, легко контролируемых условий процесса, и хорошей контролируемостью качества; и пригоден для производства в промышленных масштабах.
В вышеупомянутой реакции этерификации филлигенин растворяют в подходящем органическом растворителе, и добавляют ибупрофен-ацилхлорид в реакционную систему для проведения реакции этерификации в течение 10-24 часов. После прекращения реакции реакционную смесь промывают водой до нейтрального состояния, добавляют осушитель для итогового удаления влаги, упаривают органический растворитель при пониженном давлении для получения белого твердого вещества и полученное твердое вещество перекристаллизовывают для получения филлигенин-ибупрофенового эфира.
Краткое описание чертежей
Фиг. 1 является 1H-ЯМР спектром филлигенин-ибупрофенового эфира по настоящему изобретению.
Фиг. 2 является 13C-ЯМР спектром филлигенин-ибупрофенового эфира по настоящему изобретению.
Фиг. 3 является спектром инфракрасного (ИК) поглощения филлигенин-ибупрофенового эфира по настоящему изобретению.
Фиг. 4 демонстрирует гистологические срезы легочной ткани экспериментальных мышей, инфицированных вирусом гриппа, вызывающим пневмонию, где (А) является легочной тканью здоровой мыши; (В) является легочной тканью мыши, инфицированной вирусом гриппа, вызывающим пневмонию; (С) является легочной тканью мыши, инфицированной вирусом гриппа, вызывающим пневмонию, после лечения высокой дозой филлигенин-ибупрофенового эфира; (D) является легочной тканью мыши, инфицированной вирусом гриппа, вызывающим пневмонию, после лечения средней дозой филлигенин-ибупрофенового эфира; (Е) является легочной тканью мыши, инфицированной вирусом гриппа, вызывающим пневмонию, после лечения низкой дозой филлигенин-ибупрофенового эфира; и (F) является легочной тканью мыши, инфицированной вирусом гриппа, вызывающим пневмонию, после лечения Тамифлю.
Осуществление изобретения
Настоящее изобретение далее описано более подробно посредством следующих примеров. Однако эти примеры являются иллюстрациями настоящего изобретения и не должны рассматриваться как ограничивающие объем настоящего изобретения. Далее, реагенты и сырьевые материалы в примерах могут быть получены коммерческим путем; если они отсутствуют, можно использовать указания по органическому синтезу, указания по применению лекарств и инструкции от производителей соответствующей аппаратуры и реагентов, и тому подобное.
Пример 1
1. Реакция ацилирования
Ибупрофен (2,06 г, 0,01 моль) вносили в трехгорлую колбу, и растворяли в 40 мл дихлорметана; в трехгорлую колбу добавляли реагент для ацилирования тионилхлорид (11,9 г, 0,1 моль), реакцию проводили при комнатной температуре (20°C) в течение 15 часов, и выпаривали дихлорметан под сниженным давлением (т.е. в условиях вакуума) для получения ибупрофен-ацилхлорида, где молярное отношения ибупрофена к ацилирующему агенту составило 1:10.
2. Этерификация
Филлигенин (3,72 г, 0,01 моль) помещали в трехгорлую колбу, содержащую 200 мл ацетона, и смесь перемешивали до однородного состояния; затем добавляли катализатор калия карбонат (1,5 г, 0,01 моль), и смесь перемешивали до однородного состояния; затем ибупрофена ацилхлорид (2,24 г, 0,01 моль), приготовленный на этапе (1), добавляли по каплям в трехгорлую колбу; смесь нагревали до 60°C при перемешивании, и проводили реакцию этерификации в течение 15 часов при сохранении температуры 60°C.
3. Выделение и очистка
Полученную смесь после реакции этерификации охлаждали до комнатной температуры (20°C-25°C), смесь фильтровали, твердый осадок удаляли, и фильтрат упаривали под сниженным давлением для извлечения ацетонового растворителя и получения твердого осадка. Полученное твердое вещество после удаления растворителя растворяли в дихлорметане, полученный раствор промывали водой до нейтрального состояния и сушили безводным натрия сульфатом, и дихлорметановый растворитель упаривали под вакуумом (т.е. сниженным давлением) для получения белого твердого вещества.
Полученное белое твердое вещество подвергали перекристаллизации петролейным эфиром до получения филлигенин-ибупрофенового эфира (5,49 г) с выходом 98%.
Филлигенин-ибупрофеновый эфир является белым твердым веществом, точка плавления 110°C; растворимость: растворим в метаноле, хлороформе, дихлорметане и тому подобном.
Масс-спектр высокого разрешения: 583,26663 C34H40O7Na+1; молекулярная масса: 561.
Спектр поглощения в инфракрасной области: характерный пик поглощения (см-1) 2953,73 (-CH3); 2867,21 (-CH2-); 29835,45 (Ar-OCH3); 1760,11 (C=O); 1606,25, 1591,38, 1514,46 (Ar-CH); 1270,57, 1042,86 (Ar-O-C), как показано на Фиг. 3.
1H-ЯМР: (CDCl3, 600 MHz) δppm: 6,856-6,961 (m, 6H), 7,135-7,145 (m, 2H), 7,322-7,335 (d, 2H, J = 7,8Hz), 4,860-4,853 (d, 1H, J = 4,2 Hz), 4,494-4,484 (d, 1H, J = 6 Hz), 4,145-4,129 (d, 1H, J = 9,6 Hz), 3,988-3,976 (d, 1H, J = 7,2 Hz), 3,900-3,843 (s, 8H), 3,720-3,713 (s, 3H), 3,346-3,323 (s, 2H), 2,891-2,881 (d, 1H, J = 6 Hz), 2,481-2,470 (d, 2H, J = 6,6 Hz), 1,882-1,860 (s, 1H), 1,620-1,609 (d, 3H, J = 6,6 Hz), 0,920-0,910 (s, 6H), как показано на Фиг.1.
13C-ЯМР: (CDCl3, 125 MHz) δppm: 172,901(C-28), 151,374(C-12), 148,880(C-18), 148,056(C-13), 140,635(C-35), 140,203(C-17), 139,486 (C-10), 137,436(C-9), 130,971(C-31), 129,328(C-33), 127,445(C-36), 127,445(C-37), 122,578(C-34), 118,045(C-20), 117,767(C-16), 111,097(C-15), 110,035(C-14), 110,015(C-19), 109,020(C-11), 87,345(C-6), 82,043(C-4), 71,107(C-1), 69,830(C-8), 55,958(C-OMe), 55,933(C-OMe), 55,851(C-OMe), 54,694(C-2), 50,101(C-3), 45,107(C-38), 45,040(C-30), 30,252(C-39), 22,448(C-40, 41), 18,803(C-32), как показано на фиг. 2.
Пример 2
1. Реакция ацилирования
Ибупрофен (2,06 г, 0,01 моль) вносили в трехгорлую колбу, и растворяли в 40 мл дихлорметана; в трехгорлую колбу добавляли реагент для ацилирования фосфора оксихлорид (15,3 г, 0,1 моль), реакцию проводили при комнатной температуре (30°C) в течение 15 часов и выпаривали дихлорметан под сниженным давлением (т.е. в условиях вакуума) для получения ибупрофен-ацилхлорида, где молярное отношения ибупрофена к ацилирующему агенту составило 1:10.
2. Этерификация
Филлигенин (3,72 г, 0,01 моль) помещали в трехгорлую колбу, содержащую 200 мл растворителя дихлорметана, и смесь перемешивали до однородного состояния; затем добавляли катализатор триэтиламин (1,5 мл, 0,01 моль), и смесь перемешивали до однородного состояния; затем ибупрофена ацилхлорид (2,24 г, 0,01 моль), приготовленный на этапе (1), добавляли по каплям в трехгорлую колбу; смесь нагревали до 40°C при перемешивании и проводили реакцию этерификации в течение 20 часов при сохранении температуры 40°C.
3. Выделение и очистка
Полученную смесь после реакции этерификации охлаждали до комнатной температуры (20°C-25°C), смесь фильтровали, твердый осадок удаляли, и фильтрат упаривали под сниженным давлением для извлечения дихлорметанового растворителя и получения твердого осадка. Полученное твердое вещество после удаления растворителя растворяли в дихлорметане, полученный раствор промывали водой до нейтрального состояния и сушили безводным натрия сульфатом и дихлорметановый растворитель упаривали под вакуумом (т.е. сниженным давлением) для получения белого твердого вещества.
Полученное белое твердое вещество подвергали перекристаллизации петролейным эфиром до получения филлигенин-ибупрофенового эфира (5,44 г) с выходом 97%.
Физико-химические характеристики, спектральные данные и масс-спектральные данные белого твердого вещества, полученного путем рекристаллизации, соответствуют данным филлигенин-ибупрофенового эфира, приготовленного в примере 1.
Пример 3
1. Реакция ацилирования
Ибупрофен (2,06 г, 0,01 моль) вносили в трехгорлую колбу, и растворяли в 40 мл дихлорметана; в трехгорлую колбу добавляли реагент для ацилирования фосфора оксипентахлорид (20,8 г, 0,1 моль), реакцию проводили при комнатной температуре (10°C) в течение 15 часов, и выпаривали дихлорметан под сниженным давлением (т.е. в условиях вакуума) для получения ибупрофен-ацилхлорида, где молярное отношения ибупрофена к ацилирующему агенту составило 1:10.
2. Этерификация
Филлигенин (3,72 г, 0,01 моль) помещали в трехгорлую колбу, содержащую 200 мл растворителя трихлорметана, и смесь перемешивали до однородного состояния; затем добавляли катализатор натрия метоксид (1,5 мл, 0,01 моль), и смесь перемешивали до однородного состояния; затем ибупрофена ацилхлорид (2,24 г, 0,01 моль), приготовленный на этапе (1), добавляли по каплям в трехгорлую колбу; смесь нагревали до 50°C при перемешивании, и проводили реакцию этерификации в течение 17 часов при сохранении температуры 50°C.
3. Выделение и очистка
Полученную смесь после реакции этерификации охлаждали до комнатной температуры (20°C-30°C), смесь фильтровали, твердый осадок удаляли, и фильтрат упаривали под сниженным давлением для извлечения трихлорметанового растворителя и получения твердого осадка. Полученное твердое вещество после удаления растворителя растворяли в дихлорметане, полученный раствор промывали водой до нейтрального состояния и сушили безводным натрия сульфатом, и дихлорметановый растворитель упаривали под вакуумом (т.е. сниженным давлением) для получения белого твердого вещества.
Полученное белое твердое вещество подвергали перекристаллизации петролейным эфиром до получения филлигенин-ибупрофенового эфира (5,49 г) с выходом 98%.
Физико-химические характеристики, спектральные данные и масс-спектральные данные белого твердого вещества, полученного путем рекристаллизации, соответствуют данным филлигенин-ибупрофенового эфира, приготовленного в примере 1.
Опытный пример 1. Анализ противовирусной активности филлигенин-ибупрофенового эфира
1. Анализ противовирусной активности in vitro
1.1. Материалы для анализа
(1) Лекарственные средства
1) Филлигенин-ибупрофеновый эфир: белое твердое вещество (приготовленное в Примере 1), произведенное Dalian Fusheng Natural Drug Development Co., Ltd., и анализированное посредством ВЭЖХ системы, оснащенной УФ детектором и испарительным детектором светорассеяния, с применением способа нормирования площадей пиков; чистота составляет 99,1%.
2) Рибавирин для инъекций: бесцветная прозрачная жидкость, произведенная Henan Runhong Pharmaceutical Co., Ltd., серия №1206261; регистрационное удостоверение №H19993553; 100 мг/мл, использован в качестве лекарственного средства для положительного контроля в этом анализе;
3) Осельтамивир фосфат, поставляемый Национальным институтом контроля фармацевтических и биологических продуктов; серия №101096-200901; 100 мг/дозу, использован в качестве лекарственного средства для положительного контроля в этом анализе.
4) Филлигенин: белый порошок, произведенный Dalian Fusheng Natural Drug Development Co., Ltd., и анализированный посредством ВЭЖХ системы, оснащенной УФ детектором и испарительным детектором светорассеяния, с применением способа нормирования площадей пиков; чистота составляет 99,1%.
5) Ибупрофен: поставляемый Национальным институтом контроля фармацевтических и биологических продуктов; серия №0179-9702.
Вышеупомянутые лекарства растворяли в очищенной воде, фильтровали, стерилизовали, разливали и хранили при 4°C до применения; все лекарства подлежали анализу в настоящем тесте.
(2) Клеточный штамм
Штамм клеток Vero (клетки почки африканской зеленой мартышки) предоставлен Колледжем основных медицинских наук Цзилиньского университета.
(3) Вирусные штаммы
1) Вирус гриппа, вирус парагриппа и респираторно-синцитиальный вирус (РСВ) получены из Института вирусологии Китайской академии профилактической медицины;
2) Вирус Коксаки В3 (CVB3) получен из Уханьского института вирусологии Китайской академии наук;
3) Вирус Коксаки А16 (СохА16) и энтеровирус ЕV71 получены из Сендайского национального госпиталя из Японии;
4) Аденовирус (AdV) был предоставлен Педиатрическим исследовательским отделом Первого госпиталя Медицинского университета Нормана Бетьюна;
5) Вирус простого герпеса I типа (HSV-1) был получен из Национального института контроля фармацевтических и биологических продуктов Министерства здравоохранения.
(4) Основные приборы и реагенты
Кабинет биологической безопасности BHC-1300 II A/B3, AIRTECH
CO2 инкубатор MCO-18AIC, SANYO
Инвертированный микроскоп CKX41, OLYMPUS
Электронные аналитические весы AR1140/C, DHAUS
Среда для культивирования DMEM, HyClone
Эмбриональная телячья сыворотка HyClone
Трипсин Gibco
МТТ Sigma
ДМСО был получен от Tianjin Beilian Fine Chemicals Development Co., Ltd.
1.2. Методы анализа
(1) Приготовление клеток
Клетки Vero культивировали в субкультуре в течение 1-2 суток до формирования слоя и проявления выраженных границ и явной трехмерной ориентации и диоптрии, затем клетки расщепляли панкреатическим ферментом; после появления игольчатых отверстий на клеточной поверхности расщепляющую среду полностью удаляли, затем клетки диспергировали в нескольких миллилитрах культуральной среды, подсчитывали, затем разбавляли примерно до 5×107 клеток/литр с культуральной средой (DMEM, содержащей 10% эмбриональной телячьей сыворотки), и переносили на 96-луночный планшет для культивирования до образования монослоя.
(2) Анализ токсичности лекарства
Анализ цитотоксичности: лекарства разбавляли в соответствии концентрациями, указанными в таблице 1-1 для анализа цитотоксичности.
Таблица 1-1. Справочная таблица по разведениям лекарств (единица: г/л)
| Лекарство | Градиент концентрации | |||||||
| Градиент 1 | Градиент 2 | Градиент 3 | Градиент 4 | Градиент 5 | Градиент 6 | Градиент 7 | Градиент 8 | |
| Филлигенин-ибупрофе-новый эфир | 5 | 2,5 | 1,25 | 0,625 | 0,3125 | 0,15625 | 0,078125 | 0,039063 |
| Рибавирин | 5 | 2,5 | 1,25 | 0,625 | 0,3125 | 0,15625 | 0,078125 | 0,039063 |
| Осельтамивир фосфат | 2 | 1 | 0,5 | 0,25 | 0,125 | 0,0625 | 0,03125 | 0,015625 |
| Филлигенин | 5 | 2,5 | 1,25 | 0,625 | 0,3125 | 0,15625 | 0,078125 | 0,039063 |
| Ибупрофен | 5 | 2,5 | 1,25 | 0,625 | 0,3125 | 0,15625 | 0,078125 | 0,039063 |
Вышеуказанные лекарства, разбавленные поддерживающей средой (DMEM, содержащей 2% эмбриональной телячьей сыворотки) до различных концентраций, добавляли по каплям к монослою клеток Vero с 0,2 мл на лунку, и для каждой концентрации лекарства добавляли в шести повторностях в 6 лунок, соответственно. Кроме того, 6 лунок использовали для нормального контроля (без лекарств), а другие 6 лунок использовали в качестве пустого контроля (только среда). Клетки выращивали при 37°C в инкубаторе при 5% CO2. ЦПЭ визуализировали под инвертированным микроскопом и регистрировали ежедневно. Спустя 72 часа добавляли 20 мкл МТТ раствора (5 мг/мл) в каждую лунку, и инкубировали в течение 4 часов. Культуральную среду в каждой лунке удаляли аспирацией, добавляли 100 мкл ДМСО в каждую лунку, встряхивали в течение 5 минут, и измеряли значение ОП при 492 нм для подсчета доли выживших клеток. Долю выживших клеток анализировали с применением пробит-регрессионной модели с применением статистического программного обеспечения SPSS 18.0, и определяли максимальную нетоксичную концентрацию (TC0) и медианную токсичную концентрацию (TC50) лекарств против клеток Vero.
(3) Определение TCID50 для различных вирусов
Проводили 10-кратные серийные разведения для каждого вируса для получения разведений 10-1, 10-2, 10-3, 10-4, 10-5 и 10-6. Каждую из лунок с 6 повторностями на 96-луночном планшете для культивирования, содержащую монослой клеток Vero, инокулировали 100 мкл разбавителя для каждого разведения в последовательности при установке нормального контроля клеток. Планшеты инкубировали в течение 2 часов при 37°C в 5% CO2, затем удаляли раствор вируса, и добавляли 100 мкл среды для культивирования клеток в каждую лунку для последующей инкубации при 37°C в 5% CO2. Цитопатический эффект оценивали под микроскопом от 3 суток, и результаты определяли и регистрировали на 7-8-е сутки. Титр вирусов подсчитывали методом Кербера с максимальным титром разбавления, обеспечивающим положительный цитопатический эффект в 50% лунок с клетками в качестве конечной точки.
Уравнение: LogTCID50=XM+d-d
TCID50: доза 50% инфицирования гистиоцитов
ХМ: логарифм наибольшей концентрации разбавления вируса
d: логарифм коэффициента разведения (кратное число)
Σpi: сумма процента цитотоксического эффекта для каждого разведения
(4) Влияние лекарств на вирус-индуцированную цитотоксичность
Культуральную среду в планшетах, покрывающую монослой клеток, удаляли аспирацией, клетки инокулировали агрессивными вирусами в дозе 100TCID50 с последующей инкубацией при 37°C в инкубаторе при 5% CO2 в течение 2 часов, а затем добавляли определенную концентрацию (максимальную нетоксичную концентрацию или около того) каждого лекарственного средства. Каждую концентрацию использовали в 6 повторностях в 6 лунках с 200 мкл на лунку. Рибавирин для инъекций и осельтамивир фосфат служили в качестве групп положительного контроля, в то время как нормальную контрольную группу (без вируса и без лекарства) и группу контроля вирусов (с добавлением вируса, но без лекарства) использовали для оценки эффекта лекарств в отношении вирус-индуцированного цитопатического эффекта (ЦПЭ). Спустя 72 часа определяли значение ОП при длине волны 492 нм с применением МТТ-колориметрического метода, и рассчитывали уровень антивирусного эффекта (ER%) лекарства. Использовали дисперсионный анализ (ANOVA) со статистическим программным обеспечением SPSS 18.0 для определения достоверной разницы антивирусной эффективности лекарств из различных групп.
ER% = (среднее значение ОП в группе с применением лекарств - среднее значение ОП в контрольной группе с вирусом)/(среднее значение ОП в группе контроля клеток - среднее значение ОП в контрольной группе с вирусом)×100%
1.3. Результаты
(1) TCID50 для каждого вируса
Вирус парагриппа: LogTCID50=-2+0,5-
Вирус гриппа: LogTCID50=-2+0,5-
CVB3: LogTCID50=-2+0,5-
HSV-1: LogTCID50=-2+0,5-
AdV: LogTCID50=-2+0,5-
RSV: LogTCID50=-2+0,5-
CoxA16: LogTCID50=-2+0,5-
EV71: LogTCID50=-2+0,5-
(2) Определение токсичности лекарств
1) Определение цитотоксичности лекарств
Максимальная нецитотоксичная концентрация (TC0), медианная токсичная концентрация (TC50) каждого лекарства против клеток Vero, и концентрации лекарств, используемых в антивирусном анализе, показаны в таблице 1-2.
Таблица 1-2. Результаты анализа цитотоксичности лекарств (единица: г/л)
| Вирусы | Лекарства | |||
| Филлигенин-ибупрофен | Рибавирин | Осельтамивир фосфат | Филлигенин | |
| Максимальная не-цитотоксичная концентрация | 0,109 | 0,065 | 0,28 | 0,011 |
| Медианная токсическая концентрация | 0,485 | 1,392 | 0,832 | 0,297 |
| 0,30 | 0,03 | 0,70 | 0,30 | 0,02 |
2) Результаты защитного влияния лекарств на вирус-индуцированную цитотоксичность
Результаты анализа антивирусной эффективности лекарств и одностороннего дисперсионного анализа (ANOVA) показаны в таблице 1-3.
Таблица 1-3. Статистические данные антивирусной эффективности лекарств (ЕR%)
| Вирусы | Лекарства | ||||
| Филлигенин-ибупрофен | Рибавирин | Осельтамивир фосфат | Филлигенин | ||
| Вирус гриппа | 99,95**# | 57,49** | 81,76** | 55,12* | 75,35** |
| Вирус парагриппа | 100,00**# | 91,56** | 94,52** | 65,96* | 80,72** |
| CoxA16 | 75,89**## | 0,70 | 2,95 | 1,35 | 50,04 |
| RSV | 87,74**# | 50,08* | 37,60 |