Антигенсвязывающий белок и его применение в качестве продукта для адресной доставки при лечении рака
Иллюстрации
Показать всеИзобретение относится к биотехнологии и представляет собой антитело, способное специфически связываться с белком Axl, а также подвергаться интернализации после связывания. Изобретение относится также к конъюгату, содержащему такое антитело. Изобретение также охватывает применение указанного антитела и конъюгата для лечения рака. Изобретение позволяет расширить арсенал средств для лечения рака, характеризующегося сверхэкспрессией белка Axl. 5 н. и 19 з.п. ф-лы, 15 ил., 12 табл., 14 пр.
Реферат
Данное изобретение относится к новому антигенсвязывающему белку, в частности к моноклональному антителу, способному специфически связываться с белком Axl, а также к аминокислотной и нуклеотидной последовательностям, кодирующим указанный белок. В одном аспекте изобретение относится к новому антигенсвязывающему белку или антигенсвязывающим фрагментам, способным специфически связываться с Axl и, вызывая интернализацию Axl, подвергаться интернализации в клетку. Изобретение также относится к применению указанного антигенсвязывающего белка в качестве продукта для адресной доставки при конъюгации с другими противоопухолевыми соединениями, такими как токсины, радиоактивные элементы или лекарственные средства, а также его применению при лечении некоторых форм рака.
"Axl" (также обозначаемый "Ufo", "Ark" или "Tyro7") был клонирован из клеток пациентов с хроническим миелоидным лейкозом как онкоген, который при сверхэкспрессии в мышиных NIH3T3 вызывал трансформацию этих клеток. Он относится к семейству рецепторов, обладающих тирозинкиназной активностью (RTK, от англ. receptor tyrosine kinases), носящему название семейства ТАМ (Tyro3, Axl, Mer), включающему Tyro3 (Rse, Sky, Dtk, Etk, Brt, Tif), Axl и Mer (Eyk, Nyk, Tyro-12) [Lemke G. Nat. Rev. Immunol. (2008).8, 327-336].
Человеческий белок Axl представляет собой белок, состоящий из 894 аминокислот, последовательность которого представлена последовательностью SEQ ID NO. 29. Аминокислоты 1-25 соответствуют сигнальному пептиду, а человеческий белок Axl, без указанного сигнального пептида, представлен аминокислотной последовательностью SEQ ID NO. 30.
Gas6, первоначально выделенный как ген блокировки роста, является общим лигандом для представителей семейства ТАМ [Varnum B.C. et al. Nature (1995).373, 623-626]. Gas6 обладает наибольшей аффинностью к Axl, за ним следует Tyro3 и, наконец, Mer [Nagata K. et al. J. Biol. Chem. (1996).271, 30022-30027]. Gas6 содержит домен, богатый γ-карбоксиглутаминовой кислотой (Gla), который опосредует связывание с фосфолипидными мембранами, четыре домена, подобных эпидермальному фактору роста, и два ламинин G-подобных (LG, от англ. laminin G-like) домена [Manfioletti G., Brancolini, C, Avanzi, G. & Schneider, С. Mol. Cell Biol. (1993).13, 4976-4985]. Как и у многих других RTK, связывание лиганда приводит к димеризации рецептора и аутофосфорилированию остатков тирозина (тирозиновые остатки 779, 821 и 866 рецептора Axl), которые служат сайтами присоединения множества внутриклеточных сигнальных молекул [Linger R.M. Adv. Cancer Res. (2008).100, 35-83]. Кроме того, рецептор Axl может активироваться при лиганд-независимых процессах. Такая активация может иметь место при сверхэкспрессии рецептора Axl.
Известно, что сигнальный путь Gas6/Axl регулирует различные клеточные процессы у целого ряда клеток in vitro, включая клеточную пролиферацию, адгезию, миграцию и выживаемость [Hafizi S. & Dahlback. B. FEBS J. (2006).273, 5231-5244]. Кроме того, рецепторы ТАМ участвуют в контролировании врожденного иммунитета; они ингибируют воспалительные ответы на патогены у дендритных клеток (ДК) и макрофагов. Они также способствуют фагоцитозу апоптотических клеток этими клетками иммунной системы и необходимы для созревания и цитолитической активности естественных киллерных (NK, от англ. natural killer) клеток [Lemke G. Nat. Rev. Immunol. (2008).8, 327-336].
При слабой экспрессии нормальными клетками, он преимущественно обнаруживается на фибробластах, миелоидных клетках-предшественниках, макрофагах, нервной ткани, сердечной и скелетной мускулатуре, где он преимущественно поддерживает выживаемость клеток. Система Gas6/Axl играет важную роль в сосудистой биологии, регулируя гомеостаз гладкомышечных клеток сосудистой стенки [Korshunov V.Α., Mohan, A.M., Georger, M.A. & Berk, B.C. Circ. Res. (2006).98, 1446-1452; Korshunov V.A., Daul, M., Massett, MP. & Berk, B.C. Hypertension (2007).50, 1057-1062].
Axl играет важную роль в регуляции инвазии и миграции опухолевых клеток. Сверхэкспрессия Axl ассоциирована не только с неблагоприятным прогнозом, но также с повышенной опухолевой инвазией при различных формах рака человека, что описано для рака молочной железы, толстой кишки, карциномы пищевода, гепатоцеллюлярной карциномы, рака желудка, глиомы, рака легкого, меланомы, остеосаркомы, рака яичников, предстательной железы, рабдомиосаркомы, рака почки, щитовидной железы и рака эндометрия матки [см. обзоры Linger R.M. Adv. Cancer Res. (2008).100, 35-83 and Verma A. Mol. Cancer Ther. (2011).10, 1763-1773]. При раке молочной железы Axl является мощным эффектором эпителиально-мезенхимального перехода (ЭМП); механизм ЭМП играет важную роль в миграции и диссеминации опухолевых клеток в организме [Thiery J.P. Curr. Opin. Cell Biol. (2003).15, 740-746].
Также было показано, что Axl регулирует ангиогенез. Действительно, инактивация (нокдаун) Axl в эндотелиальных клетках нарушает формирование микротрубочек и миграцию [Holland S.J. et al. Cancer Res. (2005).65, 9294-9303], а также нарушает работу определенных сигнальных путей, участвующих в регуляции ангиогенеза [Li Y. et al. Oncogene (2009).28, 3442-3455].
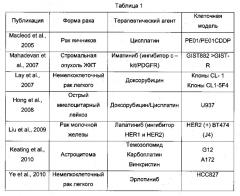
Совсем недавно в нескольких исследованиях с использованием ряда клеточных моделей было продемонстрировано, что сверхэкспрессия Axl связана с феноменом резистентности к лекарственным препаратам. В приведенной ниже Таблице 1 обобщены данные этих исследований.
В Таблице 1 процитированы следующие публикации:
- Macleod, K. et al. Cancer Res. (2005).65, 6789-6800
- Mahadevan D. et al. Oncogene (2007).26, 3909-3919
- Lay J.D. et al. Cancer Res. (2007).67, 3878-3887
- Hong С.C. et al. Cancer Lett. (2008).268, 314-324
- Liu L. et al. Cancer Res. (2009).69, 6871-6878
- Keating A.K. et al. Mol. Cancer Ther. (2010).9, 1298-1307
- Ye X. et al. Oncogene (2010).29, 5254-5264
В связи с этим, Axl RTK является мишенью, представляющей интерес для онкологии. Несколько групп исследователей уже разработали противоопухолевые стратегии, нацеленные на ось gas6/Axl, в которых используются голые моноклональные антитела или низкомолекулярные ингибиторы [Verma A. Mol. Cancer Ther. (2011).10, 1763-1773].
В первом воплощении изобретение относится к антигенсвязывающему белку или его антигенсвязывающему фрагменту, который i) специфически связывается с человеческим белком Axl и ii) подвергается интернализации после его связывания с указанным человеческим белком Axl.
В общем, изобретение относится к применению белка Axl для отбора антигенсвязывающего белка или его антигенсвязывающего фрагмента, способного подвергаться интернализации после связывания с указанной мишенью Axl. Более конкретно, указанная мишень представляет собой внеклеточный домен Axl.
Таким образом, этот конкретный аспект данного изобретения относится к способу проведения скрининга in vitro в отношении соединения или его связывающего фрагмента, способных осуществлять доставку в клетки млекопитающих или интернализацию клетками млекопитающих молекулы, представляющей интерес, указанная молекула, представляющая интерес, ковалентно связана с указанным соединением, при этом указанный способ включает следующие этапы:
a) отбор соединения, способного специфически связываться с белком Axl или его внеклеточным доменом (ECD) или его эпитопом;
b) возможно, ковалентное связывание указанной молекулы, представляющей интерес, или молекулы, служащей в качестве контроля, с указанным соединением, отобранным на этапе а), с образованием комплекса;
c) приведение в контакт указанного соединения, отобранного на этапе а), или указанного комплекса, полученного на этапе b), с клеткой млекопитающего, предпочтительно, с жизнеспособной клеткой, экспрессирующей на своей поверхности белок Axl или его функциональный фрагмент;
d) определение, были ли указанное соединение или указанная молекула, представляющие интерес, или указанный комплекс доставлены внутрь клетки или подверглись ли интернализации указанной клеткой млекопитающего; и
e) отбор указанного соединения в качестве соединения, способного обеспечивать доставку в жизнеспособную клетку млекопитающего или интернализацию жизнеспособной клеткой млекопитающего молекулы, представляющей интерес.
В предпочтительном воплощении указанное соединение, способное обеспечивать доставку в жизнеспособную клетку млекопитающего или интернализацию жизнеспособной клеткой млекопитающего молекулы, представляющей интерес, представляет собой белок (также обозначаемый в данном документе полипептидом или пептидом) или подобное белку соединение, имеющее пептидную структуру, в частности, аминокислотную последовательность по меньшей мере из 5, 10, 15 или более аминокислотных остатков, указанный аминокислотные остатки могут быть гликозилированы.
Когда указанное соединение, способное обеспечивать доставку в жизнеспособную клетку млекопитающего или интернализацию жизнеспособной клеткой млекопитающего молекулы, представляющей интерес, представляет собой белок или подобное белку соединение, указанное соединение в данном документе также обозначается "антигенсвязывающим белком", указанный антигенсвязывающий белок или его связывающий фрагмент способны:
- i) специфически связываться с белком Axl, предпочтительно с человеческим белком Axl, и
- ii) подвергаться интернализации в клетку млекопитающего после связывания с указанным белком Axl, когда указанный белок Axl экспрессируется на поверхности указанной клетки млекопитающего.
В предпочтительном воплощении указанная жизнеспособная клетка млекопитающего представляет собой человеческую клетку, предпочтительно, клетку, характеризующуюся естественной экспрессией белкового рецептора Axl.
В конкретном воплощении жизнеспособные клетки млекопитающих на этапе с) представляют собой клетки млекопитающих, экспрессирующие на своей поверхности рекомбинантный(ые) белок(белки) Axl.
В другом предпочтительном воплощении указанная молекула, представляющая интерес, представляет собой цитотоксическую молекулу (также обозначаемую в данном документе цитотоксическим или цитостатическим агентом).
В другом предпочтительном воплощении указанная молекула, представляющая интерес, ковалентно связана с указанным соединением, способным связывать белок Axl, при помощи линкера, более предпочтительно, пептидного линкера, более предпочтительно расщепляемого пептидного линкера, более предпочтительно, линкера, который может расщепляться под воздействием естественных внутриклеточных компонентов, содержащихся в клетках млекопитающих, в частности, в цитозоле указанных клеток млекопитающих.
В еще одном предпочтительном воплощении указанное соединение, способное связывать белок Axl, представляет собой антитело или его функциональный связывающий фрагмент, специфические в отношении белка Axl или в отношении его эпитопа, расположенного в составе внеклеточного домена Axl.
Этап отбора согласно е) можно осуществлять любым способом, известным специалистам в данной области, для оценки внутриклеточной доставки или интернализации. Исследование или анализ, способные продемонстрировать или оценить наличие, отсутствие или активность указанного соединения, способного специфически связывать белок Axl, или указанного комплекса, образованного указанным соединением и указанной молекулой, представляющей интерес, или указанной молекулы, представляющей интерес, ковалентно связанной с указанным соединением, хорошо известны специалистам (см. некоторые примеры таких анализов или исследований, раскрытые ниже, но не являющиеся исчерпывающими).
Более конкретно, эти анализы или исследования можно осуществлять с использованием метода FACS (от англ. fluorescence-activated cell sorting, флуоресцентная сортировка клеток), иммунофлуоресцентных методов, проточной цитомерии, вестерн-блоттинга, исследования цитотоксического/цитостатического эффекта и т.д.
В данном аспекте настоящее изобретение также относится к способу получения in vitro цитотоксического или цитостатического комплекса, способного обеспечивать доставку цитотоксического компонента в клетку млекопитающего, предпочтительно жизнеспособную клетку, указанный способ включает этапы:
- ковалентного связывания цитотоксического агента с соединением, которое:
- i) способно специфически связывать белок Axl, предпочтительно белок Axl человека и
- ii) подвергается интернализации клеткой млекопитающего после связывания с указанным белком Axl, причем указанный белок Axl экспрессируется на поверхности указанной клетки млекопитающего.
Предпочтительно, указанное соединение представляет собой подобное белку соединение, более предпочтительно, антитело, которое является специфическим в отношении белка Axl или в отношении его эпитопа, расположенного во внеклеточном домене Axl, или функционального связывающего фрагмента указанного антитела.
В предпочтительном воплощении указанный цитотоксический агент ковалентно связан с указанным антителом к Axl или его функциональным фрагментом при помощи линкера, более предпочтительно пептидного линкера, более предпочтительно расщепляемого пептидного линкера, более предпочтительно линкера, который может быть расщеплен, например, под воздействием естественных внутриклеточных соединений, что не имеет ограничительного характера.
Как и у других представители семейства ТАМ, внеклеточный домен (ECD) Axl имеет строение, близкое к строению внеклеточного домена адгезивных молекул. Внеклеточный домен Axl содержит два иммуноглобулин-подобных домена, к которым примыкает два фибронектин III-подобных домена_[O'Bryan J.P. et al. Mol. Cell Biol. (1991).11, 5016-5031]. Для связывания лиганда Gas6 достаточно двух N-концевых иммуноглобулин-подобных доменов [Sasaki T. et al. EMBO J. (2006).25, 80-87].
Внеклеточный домен человеческого белка Axl представляет собой фрагмент из 451 аминокислотного остатка, соответствующих аминокислотам 1-451 последовательности SEQ ID NO. 29, эта последовательность представлена в перечне последовательностей как SEQ ID NO. 31. Аминокислоты 1-25 соответствуют сигнальному пептиду, внеклеточный домен человеческого белка Axl без сигнального пептида соответствует аминокислотам 26-451 последовательности SEQ ID NO.29 и представлен последовательностью SEQ ID NO. 32.
На данный момент выявлено несколько способов интернализации. Они определяют путь белков или белковых комплексов, подвергшихся интернализации, в клетке. После эндоцитоза большинство мембранных белков или липидов возвращаются на клеточную поверхность (рециркуляция), но некоторые мембранные компоненты поступают в поздние эндосомы или комплекс Гольджи [Maxfield F.R. & McGraw, Т.Е. Nat. Rev. Mol. Cell Biol. (2004).5, 121-132].
В предпочтительном воплощении изобретение относится к антигенсвязывающему белку или его антигенсвязывающему фрагменту, который i) специфически связывается с человеческим белком Axl, и ii) подвергается интернализации после связывания с указанным человеческим белком Axl, указанный антигенсвязывающий белок содержит по меньшей мере аминокислотную последовательность, выбранную из группы, состоящей из последовательностей SEQ ID NOs. 1-14 или любой последовательности, идентичной по меньшей мере на 80%, предпочтительно на 85%, 90%, 95% и 98% последовательностям SEQ ID NOs. 1-14.
В наиболее предпочтительном воплощении изобретение относится к антигенсвязывающему белку или его антигенсвязывающему фрагменту, который
i) специфически связывается с человеческим белком Axl, предпочтительно имеющим последовательность SEQ ID NO. 29 или 30 или естественный вариант его последовательности, и
ii) подвергается интернализации после связывания с указанным человеческим белком Axl,
указанный антигенсвязывающий белок содержит по меньшей мере аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NOs. 1-14.
"Связывающий белок" или "антигенсвязывающий белок" представляет собой пептидную цепь, обладающую специфической или общей аффинностью к другому белку или молекуле (которая обычно обозначается антиген). Белки приходят в контакт и образуют комплекс, когда связывание является возможным. Антигенсвязывающий белок по изобретению предпочтительно может быть антителом, фрагментом или производным антитела, белка или пептида, но не исчерпывается этими примерами.
Под "антигенсвязывающим фрагментом" антигенсвязывающего белка по изобретению подразумевают любой пептид, полипептид или белок, сохраняющий способность специфически связываться с мишенью (как правило, также обозначаемой антигеном) и содержащий аминокислотную последовательность по меньшей мере из 5 смежных аминокислотных остатков, по меньшей мере из 10 смежных аминокислотных остатков, по меньшей мере из 15 смежных аминокислотных остатков, по меньшей мере из 20 смежных аминокислотных остатков, по меньшей мере из 25 смежных аминокислотных остатков, по меньшей мере из 40 смежных аминокислотных остатков, по меньшей мере из 50 смежных аминокислотных остатков, по меньшей мере из 60 смежных аминокислотных остатков, по меньшей мере из 70 смежных аминокислотных остатков, по меньшей мере из 80 смежных аминокислотных остатков, по меньшей мере из 90 смежных аминокислотных остатков, по меньшей мере из 100 смежных аминокислотных остатков, по меньшей мере из 125 смежных аминокислотных остатков, по меньшей мере из 150 смежных аминокислотных остатков, по меньшей мере из 175 смежных аминокислотных остатков, по меньшей мере из 200 смежных аминокислотных остатков или по меньшей мере из 250 смежных аминокислотных остатков аминокислотной последовательности антигенсвязывающего белка.
В предпочтительном воплощении, в котором антигенсвязывающий белок представляет собой антитело, такие "антигенсвязывающие фрагменты" выбраны из группы, состоящей из Fv, scFv (sc обозначает одноцепочечный, от англ. single chain), Fab, F(ab')2, Fab', scFv-Fc фрагментов или диател или любых фрагментов, время полужизни которых увеличено путем химической модификации, например, такой как добавление поли(алкилен)гликоля, такого как поли(этилен)гликоль ("пегилирование") (пегилированные фрагменты обозначают Fv-ПЭГ, scFv-ПЭГ, Fab-ПЭГ, F(ab')2-ПЭГ или Fab'-ПЭГ) ("ПЭГ обозначает Поли(Этилен)Гликоль), или путем включения в липосомы, при этом указанные фрагменты содержат по меньшей мере один из CDR, присущих антителу по изобретению. Предпочтительно, указанные "антигенсвязывающие фрагменты" будут состоять из или будут содержать часть вариабельного участка последовательности тяжелой или легкой цепи антитела, из которого они получены, указанная часть последовательности достаточна для сохранения той же специфичности связывания, что и у антитела, из которого они происходят, и достаточной аффинности к мишени, предпочтительно по меньшей мере равной 1/100, более предпочтительно по меньшей мере 1/10 от аффинности антитела, из которого они происходят. Такой функциональный фрагмент будет содержать как минимум 5 аминокислот, предпочтительно 10, 15, 25, 50 и 100 последовательных аминокислот последовательности антитела, из которого он происходит.
Термин "эпитоп" обозначает участок антигена, связанный с антигенсвязывающим белком, включая антитела. Эпитопы можно охарактеризовать как структурные или функциональные. Функциональные эпитопы обычно представляют собой подгруппу структурных эпитопов и имеют остатки, которые вносят непосредственный вклад в аффинность связывания. Эпитопы могут также быть конформационными, т.е. состоящими из аминокислот, расположенных нелинейно. В некоторых воплощениях эпитопы могут включать детерминанты, которые представляют собой химически активные поверхностные группировки молекул, таких как аминокислоты, углеводные боковые цепи, фосфорильные группы или сульфонильные группы и, в некоторых воплощениях, могут обладать определенной трехмерной структурой и/или определенным зарядом.
В данном описании эпитоп локализуется во внеклеточном домене человеческого белка Axl.
Согласно предпочтительному воплощению изобретения, антигенсвязывающий белок или его антигенсвязывающий фрагмент специфически связывается с эпитопом, локализованным во внеклеточном домене человеческого белка Axl, предпочтительно имеющем последовательность SEQ ID NO. 31 или 32 или естественный вариант его последовательности.
Понятия "специфическое связывание", "специфически связывается" и т.п. означают, что антигенсвязывающий белок или его антигенсвязывающий фрагмент образует комплекс с антигеном, являющийся относительно стабильным в физиологических условиях. Специфическое связывание можно охарактеризовать равновесной константой диссоциации, равной по меньшей мере приблизительно 1×10-6 M или менее. Способы определения специфического связывания двух молекул хорошо известны в области техники и включают, например, равновесный диализ, поверхностный плазмонный резонанс и т.п. Во избежание сомнений, это не означает, что указанный антигенсвязывающий фрагмент не может связываться или взаимодействовать с другим антигеном в низких концентрациях. Тем не менее, в предпочтительном воплощении указанный антигенсвязывающий фрагмент связывается только с указанным антигеном.
В этом контексте "ЕС50" обозначает 50% эффективную концентрацию. Более конкретно термин полумаксимальная эффективная концентрация (ЕС50) соответствует концентрации лекарства, антитела или токсического вещества, которая вызывает ответ, находящийся посередине между базовой линией и максимумом после некоторого определенного времени воздействия. Его часто используют как показатель эффективности лекарства. Таким образом, значение ЕС50 непрерывной кривой «доза-эффект» представляет концентрацию соединения, при которой наблюдается эффект, составляющий 50% от максимального. ЕС50 дискретной кривой «доза-эффект» представляет концентрацию соединения, вызывающую ожидаемый эффект у 50% особей популяции после определенной длительности воздействия. Зависимость эффекта от концентрации, как правило, описывается сигмоидной кривой, и эффективность резко возрастает при относительно небольшом изменении концентрации. Ее можно вывести математически при проведении линии наилучшего соответствия.
В предпочтительном воплощении данного изобретения определение ЕС50 характеризует эффективность связывания антитела с внеклеточным доменом Axl, экспрессируемого опухолевыми клетками. Показатель ЕС50 определяют с помощью FACS-анализа. Показатель ЕС50 отражает концентрацию антитела, при которой связывание с человеческим Axl, экспрессируемым опухолевыми клетками, составляет 50% от максимально возможного. Каждое значение ЕС50 определяют как среднюю точку на кривой зависимости «доза-эффект», с помощью программы для построения четырех-параметрической регрессионной модели (Prism Software). Этот показатель выбран как репрезентативный для физиологических/патологических состояний.
В воплощении изобретения антигенсвязывающий белок или его антигенсвязывающий фрагмент связываются со своим эпитопом со значением ЕС50, равным по меньшей мере 10-9 М, предпочтительно между 10-9 и 10-12 М.
Другое воплощение изобретения представляет собой процесс или способ для отбора антигенсвязывающего белка или его антигенсвязывающего фрагмента, способных подвергаться внутриклеточной интернализации клеткой млекопитающего, предпочтительно человеческой клеткой, предпочтительно жизнеспособной клеткой, включающий этапы:
- i) отбора антигенсвязывающего белка, специфически связывающегося с Axl, предпочтительно с его внеклеточным доменом или его эпитопом; и
- ii) отбора указанного антигенсвязывающего белка из предыдущего этапа i) который подвергается интернализации клеткой млекопитающего после связывания с белком Axl, экспрессирующимся на поверхности указанной клетки млекопитающего.
В конкретном воплощении указанная клетка млекопитающего естественным образом экспрессирует белковый рецептор Axl на своей поверхности или представляет собой клетку млекопитающего, экспрессирующую рекомбинантный белок Axl на своей поверхности, предпочтительно человеческую клетку.
Такой способ или процесс может включать этапы i) отбора антигенсвязывающего белка, специфически связывающегося с Axl со значением ЕС50, равным по меньшей мере 10-9 M и ii) отбора антигенсвязывающего белка из предыдущего этапа, который подвергается интернализации после связывания с Axl. Этап отбора согласно ii) можно осуществлять способом для оценки интернализации, известным специалисту в данной области. Более конкретно, исследования можно осуществлять с использованием метода FACS, иммунофлуоресцентных методов, проточной цитомерии, вестерн-блоттинга, исследования цитотоксического/цитостатического эффекта и т.д.
Другой характерной особенностью антигенсвязывающего белка согласно изобретению является то, что он не проявляет существенной активности в отношении пролиферации опухолевых клеток. Более конкретно, как показано в следующих примерах, антигенсвязывающий белок по изобретению не проявляет какой-либо существенной активности in vitro в отношении пролиферации на модели клеток SN12C.
В онкологии существует множество механизмов, в соответствии с которыми моноклональные антитела (МкАт) могут проявлять свое терапевтическое действие, но зачастую их активность является недостаточной для обеспечения долговременного эффекта. В связи с этим было разработано несколько стратегий для усиления их активности, в частности их комбинирование с такими лекарствами, как химиотерапевтические агенты. Иммунотоксины представляют собой новый возможный метод лечения рака, являющийся эффективной альтернативой комбинированной терапии [Beck A. et al. Discov. Med. (2010).10, 329-339; Alley S.C. et al. J. Pharmacol. Exp. Ther. (2009).330, 932-938]. Конъюгаты антитело-лекарство (ADC, от англ. antibody-drug conjugate) представляют собой один из подходов, при котором возможность использовать специфичность МкАт и осуществлять направленную доставку цитотоксического агента к опухоли могут существенно повысить активность как МкАт, так и лекарственного средства. Предпочтительно, МкАт будет специфически связываться с антигеном, характеризующимся значительной экспрессией на опухолевых клетках, но низким уровнем экспрессии на нормальных клетках.
Данное изобретение относится к специфическому белку, связывающемуся с Axl, более конкретно, к специфическому антителу, направленному против Axl, обладающему высокой способностью подвергаться интернализации после связывания с Axl. Такой антигенсвязывающий белок представляет интерес в качестве одного из компонентов иммуноконъюгата с лекарственным средством, поскольку он осуществляет адресную доставку присоединенного цитотоксического агента в опухолевые клетки-мишени. После интернализации цитотоксический агент запускает гибель опухолевой клетки.
Важной составляющей успеха терапии иммуноконъюгатами считается специфичность к антигену-мишени и интернализация комплексов антигенсвязывающий белок опухолевыми клетками. Очевидно, что антигены, не подвергающиеся интернализации, менее эффективно осуществляют доставку цитотоксических агентов по сравнению с антигенами, которые подвергаются интернализации. Процессы интернализации могут варьироваться в зависимости от антигена и зависят от множества парамеров, на которые могут оказывать влияние присоединяемые белки. RTK клеточной поверхности являются семейством антигенов, представляющим интерес для исследования этого подхода.
Цитотоксический агент в составе биомолекулы обеспечивает цитотоксическую активность, а антигенсвязывающий белок обеспечивает ее специфичность в отношении опухолевых клеток, и служит вектором, проникающим в клетки и обеспечивающим надлежащую адресную доставку цитотоксического агента.
Таким образом, для улучшения свойств молекулы иммуноконъюгата белок, связывающийся с носителем, должен проявлять выраженную способность к интернализации опухолевыми клетками-мишенями. Эффективность, с которой связывающиеся белки опосредуют интернализацию, существенно отличается в зависимости от эпитопа, являющегося мишенью. Для отбора белков, эффективно связывающихся с Axl и подвергающихся интернализации, требуется экспериментальное изучение не только снижения уровня экспрессии Axl, но и отслеживание прохождения Axl-связывающих белков в клетки.
В предпочтительном воплощении интернализацию антигенсвязывающего белка согласно изобретению предпочтительно оценивают методом иммунофлуоресценции (как показано в Примере, приведенном ниже в данном документе) или другим способом или процессом, специфическим в отношении механизма интернализации, известным специалисту в данной области.
В другом предпочтительном воплощении комплекс Axl-антигенсвязывающий белок, согласно изобретению, подвергается интернализации после присоединения связывающего белка по изобретению к внеклеточному домену указанного Axl, вызывая снижение количества Axl на поверхности клеток. Это снижение можно оценить любым способом, известным специалисту в данной области (вестерн-блоттинг, FACS, иммунофлуоресценция, и т.д.).
В воплощении изобретения данное снижение, отражающее интернализацию, предпочтительно оценивают методом FACS и выражают как разницу или показатель дельта между средней интенсивностью флуоресценции (MFI, от англ. Mean Fluorescence Intensity) необработанных клеток и MFI клеток после воздействия антигенсвязывающего белка по изобретению.
Неисчерпывающим примером данного изобретения является определение показателя дельта на основе MFI, полученной с необработанными клетками и клетками после воздействия антигенсвязывающего белка по изобретению в соответствии с описанием в Примере 9 с использованием i) опухолевых клеток почки человека SN12C через 24 часа инкубации с антигенсвязывающим белком по изобретению и ii) вторичного антитела, меченного Alexa488. Этот параметр рассчитывают по следующей формуле:
Δ (MFI24ч необработанных клеток - MFI24ч клеток после воздействия антигенсвязывающего белка).
Это различие между MFI отражает снижение уровня экспрессии Axl, поскольку значения MFI пропорциональны экспрессии Axl на клеточной поверхности.
В более предпочтительном и преимущественном аспекте антигенсвязывающий белок или его антигенсвязывающий фрагмент по изобретению представляют собой моноклональное антитело, предпочтительно выделенное МкАт, обусловливающее различие между MFI24ч необработанных клеток и MFI24ч обработанных клеток (значение Δ), составляющее по меньшей мере 200, предпочтительно по меньшей мере 300.
Антигенсвязывающий белок или его антигенсвязывающий фрагмент по изобретению вызывают снижение MFI, составляющее по меньшей мере 200.
Более конкретно, вышеупомянутое значение дельта можно определить согласно следующему способу, который следует рассматривать как иллюстративный и неисчерпывающий пример:
a) обработка и инкубация опухолевых клеток, представляющих интерес, с антигенсвязывающим белком по изобретению;
b) воздействие антигенсвязывающего белка по изобретению на клетки, обработанные на этапе а) и, параллельно, на необработанные клетки,
c) измерение MFI обработанных и необработанных клеток (репрезентативных в отношении количества Axl, присутствующего на поверхности) с использованием вторичного антитела, способного связываться с антигенсвязывающим белком, и
d) расчет значения дельта при вычитании значения MFI, полученного для обработанных клеток, из значения MFI, полученного для необработанных клеток.
Термины "антитело", "антитела" или "иммуноглобулины" используются взаимозаменяемо в самом широком смысле и включают моноклональные антитела, предпочтительно выделенные МкАт, (например, полноразмерные или интактные моноклональные антитела), поликлональные антитела, мультивалентные антитела или мультиспецифические антитела (например, биспецифические антитела, проявляющие желаемую биологическую активность).
Более конкретно, такая молекула представляет собой гликопротеин, содержащий по меньшей мере две тяжелые цепи (Н) и две легкие цепи (L), соединенные между собой дисульфидными связями. Каждая тяжелая цепь содержит вариабельный участок (или домен) тяжелой цепи (в данном документе обозначается аббревиатурой HCVR или VH) и константный участок тяжелой цепи. Константный участок тяжелой цепи содержит три домена, СН1, СН2 и СН3. Каждая легкая цепь содержит вариабельный участок легкой цепи (в данном документе обозначается аббревиатурой LCVR или VL) и константный участок легкой цепи. Константный участок легкой цепи содержит один домен, CL. Участки VH и VL можно дальше подразделить на гипервариабельные участки, называемые участками, определяющими комплементарность (CDR, от англ. complementarity determining regions), перемежающиеся более консервативными участками, называемыми каркасными участками (FR, от англ. framework regions). Каждый участок VH и VL состоит из трех CDR и четырех FR, расположенных в направлении от амино-конца к карбокси-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные участки тяжелой и легкой цепей содержат связывающий домен, который взаимодействует с антигеном. Константные участки антител могут опосредовать связывание иммуноглобулина с тканями или факторами организма-хозяина, включая различные клетки иммунной системы (например, эффекторные клетки) и первый компонент классического пути активации комплемента (C1q).
Антитела по изобретению также включают некоторые фрагменты антител. Указанные фрагменты антител проявляют необходимую специфичность и аффинность связывания, независимо от источника или типа иммуноглобулина (т.е., IgG, IgE, IgM, IgA, и т.д.), т.е. они способны специфически связываться с белком Axl с аффинностью, которая сопоставима с аффинностью полноразмерных антител по изобретению.
Как правило, для получения моноклональнх антител или их функциональных фрагментов, особенно имеющих мышиное происхождение, возможно обращаться к методам, описанным, в частности в руководстве "Antibodies" (Harlow and Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor NY, pp. 726, 1988) или к методике получения с использованием гибридом, описанной Kohlerand Milstein (Nature, 256: 495-497, 1975).
Термин "моноклональное антитело" или "МкАт" в данном документе обозначает молекулу антитела, направленную против специфического антигена, которую может продуцировать один клон В клеток или гибридома. Моноклональные антитела также могут быть рекомбинантными, т.е. полученными методами белковой инженерии. Кроме того, в отличие от препаратов поликлональных антител, как правило, содержащими различные антитела, направленные против различных детерминант или эпитопов, каждое моноклональное антитело направлено против одного эпитопа антигена. Изобретение относится к антителам, выделенным или полученным путем очистки из природных источников, или полученных рекомбинантным методом или при помощи химического синтеза.
Предпочтительное воплощение изобретения относится к антигенсвязывающему белку или его антигенсвязывающему фрагменту, содержащему или представляющему собой антитело, указанное антитело содержит три CDR легкой цепи, содержащие последовательности SEQ ID NOs. 1, 2 и 3 или любые последовательности, идентичные по меньшей мере на 80%, предпочтительно на 85%, 90%, 95% и 98% последовательностям SEQ ID NOs. 1, 2 и 3; и три CDR тяжелой цепи, содержащие последовательности SEQ ID NOs. 4, 5 и 6 или любые последовательности, идентичные по меньшей мере на 80%, предпочтительно на 85%, 90%, 95% и 98% последовательностям SEQ ID NOs. 4, 5 и 6.
В более предпочтительном воплощении изобретения антигенсвязывающий белок или его антигенсвязывающий фрагмент представляют собой антитело, указанное антитело содержит три CDR легкой цепи, содержащие последовательности SEQ ID NOs. 1, 2 и 3; и три CDR тяжелой цепи, содержащие последовательности SEQ ID NOs. 4, 5 и 6.
В предпочтительном аспекте участками CDR или CDR(s) обозначают гипервариабельные участки тяжелой и легкой цепей иммуноглобулинов, в соответствии с IMGT. Без какого-либо противоречия, в данной заявке CDR определяют в соответствии с системой нумерации IMGT.
Единая нумерация IMGT была разработана для сравнения вариабельных доменов любых антигенных рецепторов, типов цепей или видов [Lefranc M.-Р., Immunology Today 18, 509 (1997) / Lefranc M.-P., The Immunologist, 7, 132-136 (1999) / Lefranc, M.-P., Pommie, C, Ruiz, M., Giudicelli, V., Foulquier, E., Truong, L., Thouvenin-Contet, V. and Lefranc, Dev. Comp. Immunol, 27, 55-77 (2003)]. В единой нумерации IMGT консервативные аминокислоты всегда занимают одинаковое положение, например, цистеин 23 (1-й CYS), триптофан 41 (консервативный TRP), гидрофобная аминокислота 89, цистеин 104 (2-й CYS), фенилаланин или триптофан 118 (J-PHE или J-TRP). Единая нумерация IMGT позволяет стандартным образом установить границы каркасных участков (FR1-IMGT: позиции 1-26, FR2-IMGT: 39-55, FR3-IMGT: 66-104 и FR4-IMGT: 118-128) и участков, определяющих комплементарность: CDR1-IMGT: 27-38, CDR2-IMGT: 56-65 и CDR3-IMGT: 105-117. Поскольку разрывы обозначают незанятые позиции, длина CDR-IMGT (показана в скобках и разделена точками, например, [8.8.13]) приобрета