Штамм "ик-4" вируса инфекционной анемии цыплят
Иллюстрации
Показать всеИзобретение относится к области ветеринарной вирусологии и касается штамма вируса инфекционной анемии цыплят. Представленный штамм «ИК-4» выделен из паренхиматозных органов больных анемией цыплят-бройлеров. Относится к семейству Circoviridae, роду Gyrovirus. Стабильно проявляет выраженное цитопатогенное действие в клеточной культуре в течение 2-3 сут при 39,5°С, накапливается до 5,5-6,0 lgТЦД50/см3. Обладает выраженной антигенной активностью и депонирован в Государственной коллекции вирусов НИИ вирусологии им. Д.И. Ивановского под №2844. Штамм безвреден для ремонтного молодняка птицы и пригоден для изготовления вакцины. 1 табл., 4 пр.
Реферат
Изобретение относится к ветеринарной вирусологии и биотехнологии и может быть использовано при производстве вакцины против инфекционной анемии цыплят.
Вирус инфекционной анемии цыплят (ИАЦ), единственный представитель рода Gyrovirus семейства Circoviridae [1], который широко распространен во всем мире. В организме больной птицы возбудитель активно реплицируется в гемоцитобластах костного мозга и предшественниках Т-лимфоцитов и, как следствие, проявляется атрофия тимуса [2, 3]. Развитие инфекционного процесса характеризуется снижением количества лимфоцитов, особенно CD8 + Т-клеток, нарушением продукции цитокинов, иммуносупрессией и повышенной чувствительностью к различным инфекциям вирусной и бактериальной этиологии [4, 5, 6].
Клиническое проявление болезни установлено у молодняка (2-3 недель) птицы без материнских антител с признаками депрессии, анемией, задержкой роста и увеличением смертности [7]. У птицы более старшего возраста с формированием иммунной системы развивается возрастная устойчивость к вирусу ИАЦ, хотя они могут быть инфицированы и стать источником горизонтальной передачи вируса [8, 9]. Единственным и надежным способом зашиты цыплят от вируса ИАЦ является применение вакцины за месяц до начала яйцекладки.
Сведения о выделении и характеристике изолятов вируса ИАЦ в России фрагментарны. По этой причине отечественные средства диагностики и профилактики болезни до настоящего времени не разработаны.
В зарубежной литературе описан ряд штаммов вируса ИАЦ, используемых для производства вакцин. Известен штамм «CUX-1» вируса ИАЦ, который репродуцируется только в 5-6-суточных эмбрионах СПФ-кур [10] и данная биологическая модель довольно дорогая и крайне недоступная. Так, до настоящего время отечественная биологическая промышленность не располагает стадом птицы, соответствующим СПФ статусу, так как создание и содержание таких стад требует наличие специальной технологии выращивания птицы и значительных материальных средств. Недостатком данного штамма также является и низкая антигенная и иммуногенная активность.
Известен ГКВ штамм «2722» для производства диагностикумов [11]. Штамм культивируется и поддерживается на СПФ-цыплятах суточного возраста. Недостатком данного штамма является его вирулентность и непригодность для производства вакцины из-за отсутствия эффективной биологической модели для промышленного культивирования.
Наиболее близким предлагаемому изобретению по совокупности существенных признаков является штамм «26Р4» вируса ИАЦ, адаптированный к культуре клеток MDCC-MSB1 [12].
Однако штамм-прототип имеет недостаток, состоящий в том, что он обладает остаточной вирулентностью и индуцирует поражения в тимусе и костном мозге, сопровождающиеся иммунодепрессией. Недостаток штамма «26Р4» состоит также в том, что по своим антигенным и иммунобиологическим характеристикам он отличается от аналогичных характеристик эпизоотических изолятов вируса ИАЦ, выделенных на территории России.
В задачу создания настоящего изобретения входило получение нового штамма вируса ИАЦ, обладающего высокой биологической и антигенной активностью и безвредного для ремонтного молодняка птицы.
Технический результат от использования предлагаемого изобретения заключается в повышении биологической и специфической антигенной активности для производства ареактогенных средств специфической профилактики болезни.
Штамм "ИК-4" получен и поддерживается путем серийных последовательных пассажей исходного изолята вируса ИАЦ в клеточной культуре MDCC MSBI.
Штамм "ИК-4" относится к семейству Circoviridae, роду Gyrovirus, обладает морфологическими признаками, характерными для возбудителя ИАЦ: форма вириона икосаэдрическая, размер - 22-25 нм, относится к ДНК-содержащим вирусам, устойчив к воздействию температуры до +56°С в течение 30 мин, эфира и хлороформа. Капсид вирионов состоит из 32 капсомеров, оболочка отсутствует и имеет один главный структурный белок VP1. Штамм "ИК-4" активно репродуцируется в клеточной культуре МДСС - MSB1, вызывая ЦПД, стабилен в течение 20 последовательных пассажей. Штамм "ИК-4" депонирован в государственной коллекции вирусов НИИ вирусологии им. Д.И. Ивановского 26 апреля 2017 г., регистрационный номер 2844.
Для пояснения сущности предлагаемого изобретения приведены примеры его исполнения, которые не ограничивают объем изобретения.
Пример 1. Культивирование штамма "ИК-4" вируса ИАЦ в суспензионной линии клеток MDCC MSBI.
К клеточной культуре МДСС - MSB1 в посевной дозе 2,0-2,5×105 кл/см3 объемом 0,5 см3 добавляли равное количество стерильного 20%-ного гомогената внутренних органов цыплят больных анемией и инкубировали при температуре 37°С в течение 30 мин. Затем смесь клеточной культуры и гомогената переносили в пластиковый флакон объемом 25 см3 с питательной средой RPM1 - 1640, производство «Биолот» (г. Санкт-Петербург), с добавлением 1 см3 ципрофлоксацина (2 мг/см3) на 100 см3 среды и 10% фетальной бычьей сыворотки. Флаконы с зараженной культурой клеток и в контроле инкубировали в CO2 инкубаторе при 39,5°С в атмосфере 5% углекислого газа в течение 2-3 сут. Затем зараженную культуру клеток трижды замораживали и размораживали, центрифугировали при 3000 об/мин в течение 15 мин. Полученный супернатант использовали для проведения очередного пассажа методом «слепых» пассажей путем разбавления вируссодержащего материала предыдущего пассажа свежей подогретой питательной средой RPM1 - 1640 с 10% сыворотки и антибиотиками в соотношении 1:10 до проявления четких морфологических изменений в зараженных клетках. ЦПД вируса в культуре клеток характеризовалось увеличением размеров клеток с последующей их деформацией, дегенерацией и лизисом в связи с гибелью клеток и повышением рН среды. Специфичность ЦПД вируса ИАЦ подтверждается в реакции нейтрализации с гипериммунной сывороткой к вирусу ИАЦ.
Пример 2. Определение инфекционной активности "ИК-4" вируса ИАЦ.
Предварительно готовили серию 10-кратных разведений штамма "ИК-4" вируса ИАЦ на питательной среде RPM1 - 1640 от 10-1 до 10-7, которыми заражали культуру клеток МДСС - MSB1. Каждое разведение супернатанта в объеме 100 мкл вносили в 4 лунки 24-луночноого планшета, затем - 900 мкл клеточной культуры в питательной среде с плотностью 5×104 кл/см3 и инкубировали в СО2 инкубаторе при 39,5°С. Контролем служили флаконы с незараженной культурой МДСС - MSB1. Пересевы вирусных суспензий проводили через каждые 48 ч из расчета 200 мкл зараженной культуры в 800 мкл свежей подогретой питательной среды. Процедуру повторяли не менее 8 раз до проявления ЦПД в конечных разведениях и изменения цвета среды (красный) в связи с прекращением роста клеток. За титр вируса принимали максимальное (предельное) его разведение, вызывающее цитопатогенное действие в 50% лунок и выражали в lg ТЦД50/см3. Расчет активности вируса проводят по методу Рида и Менча. Титр вируса составил 5,5-6,0 lg ТЦД50/см3.
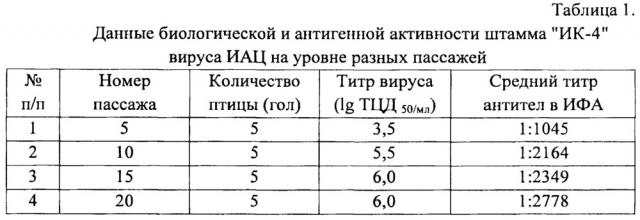
Пример 3. Оценка стабильности биологической и антигенной активности штамма "ИК-4" на уровне разных пассажей.
Предварительно пробы вируса 5-; 10-; 15- и 20-го пассажа титровали в клеточной культуре МДСС MSB1 так, как описано в примере 2. Антигенную активность вируса на разных уровнях пассажей определяли на птице путем его введения внутримышечно по 0,2 см3 каждой птице. Результаты опыта представлены в таблице 1.
Из данных таблицы 1 следует, что штамм "ИК-4", выращенный в клеточной культуре МДСС MSB1 в течение 20 пассажей, сохраняет биологические и антигенные свойства, что свидетельствует о его стабильности по указанным признакам.
Пример 4. Определение безвредности штамма "ИК-4".
Вирус в дозе 5,0 lg ТЦД50/см3 вводили внутримышечно ремонтному молодняку 8-9-недельного возраста в количестве 15 голов, свободному от антител к вирусу ИАЦ. Контролем служили 15 голов птицы аналогичного возраста, которым вводили физиологический раствор без вакцины. На 14, 21 и 28-е сутки опыта по 5 голов в каждой группе птицы подвергали диагностическому убою и соответственно отбирали трубчатую кость и тимус для выявления морфологических изменений. За период проведения опыта клинических признаков болезни у птицы не наблюдали. Патматериал фиксировали в 10% растворе нейтрального формалина и исследовали по общепринятой методике проведения гистологических исследований. Результаты патологоморфологических исследований костного мозга и тимуса цыплят в разные сроки после введения вируса показали сохранность морфологической структуры на всех этапах опыта. Таким образом, результаты испытаний показали, что штамм "ИК-4" вируса ИАЦ является безвредным в отношении ремонтного молодняка птицы.
Источники информации
1. Pringle С.R. Virus Taxonomy at the XIth International Congress of Virology, Sydney, Australia. Archives of Virology, 1999, 144, 2065-2070.
2. Gorio M., T. Suwa, T. Umemura, C. Utakura S. Yamashiro, 1989. Histopathology of chicks inoculated with chicken anaemia agent (MSB1-TK5803 strain). Avian Pathology, 18, 73-89.
3. Smyth J., D. Moffett, M. McNulty, D. Todd D. Mackie, Aequential histopathologic and immunocytochemical study of chicken anemia virus infection at one day of age. 1993. Avian Diseases, 37, 324-338.
4. Adair В.M. Immunopathogenesis of chicken anemia virus infection. Developmental and Comparative Immunology, 2000. 24, 247-255.
5. Todd D. Circoviruses: Immunosuppressive threat to avian species; a review. Avian Pathology, 2000. 29, 373-394.
6. Ragland W.L., R. Novak, J. El-Attrache, Ester, Chicken anemia virus and infectious bursal disease virus interfere with transcription of chicken IFN-alpha and IFN-gamma mRNA. 2002. Journalof Interferon and Cytokine Research, 22, 437-341.
7. Schat K.A. Chicken infectious anemia.In: Diseases of Poultry. 11th edn, eds Saif, Y.M., H.J. Barnes, J.R. Glisson, A.M. Fadly, L.R. McDougald & D.E. Swayne, Iowa State University, Ames, 2003, pp 182-202.
8. Rosenberger J.K. & S.S. Cloud, The effects of age, route of exposure, and coinfection with infectious bursal disease virus on the pathogenicity and transmissibility of chicken anemia agent (CAA). Avian Diseases, 1989, 33, 753-759.
9. Toro H., A.M. Ramirez, J. Larenas. Pathogenicity of chicken anaemia virus (isolate 10343) for young and older chickens. Avian Pathology, 1997. 26, 485-499.
10. Vielitz E., Bulow V. von, Landgraf H., Conrad C. Anemia in broilers: development of a vaccine for parent stock. - Journal of Veterinary Medicine, 1987, Vol. 34, P. 553-557.
11. Пат. США 5686077, 453-454.11.1997.
12. Пат. РФ №2489487, C12N 7/00; 10.08.2013.
Штамм вируса инфекционной анемии цыплят «ИК-4» семейство Circoviridae, род Gyrovirus, депонированный в Государственную коллекцию вирусов ФГБУ «ФНИЦЭМ им. Н.Ф. Гамалеи» Минздрава России Институт вирусологии им. Д.И. Ивановского под №2844, используемый для производства вакцины против инфекционной анемии цыплят.