Композиции и способы для лечения активной инфекции mycobacterium tuberculosis
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к фтизиатрии, и может быть использована для лечения активной туберкулезной инфекции. Способы по изобретению включают введение млекопитающему иммунологически эффективного количества терапевтической вакцины, содержащей выделенный слитый полипептид, содержащий комбинацию антигенов Rv1813, Rv3620, Rv3619 и Rv2608 в сочетании с химиотерапевтическими агентами. Использование изобретений позволяет пролонгировать выживание при лечении активной туберкулезной инфекции и сократить продолжительность химиотерапии. 3 н. и 38 з.п. ф-лы, 4 табл., 32 ил., 6 пр.
Реферат
Перекрестная ссылка на родственные заявки
По этой заявке испрашивается приоритет предварительных заявок США No. 61/679612, поданной 3 августа 2012 и 61/791213, поданной 15 марта 2013, все из которых полностью включены в данный документ посредством ссылки.
ПРЕДСТАВЛЕНИЕ СПИСКА ПОСЛЕДОВАТЕЛЬНОСТЕЙ В ТЕКСТОВОМ ФАЙЛЕ ASCII
Содержание следующего представления текстового файла ASCII полностью включено в данный документ посредством ссылки: считываемая компьютером форма (CRF) списка последовательностей (название файла: 712192000940SeqList.txt, дата записи: 31 июля, 2013 размер: 36 KB).
Предшествующий уровень техники
Область техники, к которой относится изобретение
Данное раскрытие относится к способам и композициям для лечения первичной активной инфекции M. tuberculosis или активной инфекции, являющейся следствием реактивации латентной инфекции у млекопитающего и к способам и композициям для улучшения эффективности химиотерапевтических режимов против активной инфекции M. tuberculosis.
Описание родственного уровня техники
Туберкулез (ТБ) является хроническим инфекционным заболеванием, вызванным инфекцией Mycobacterium tuberculosis и другими видами Mycobacterium. ТБ является значимым пандемическим заболеванием в развивающихся странах, а также является усиливающейся проблемой в развитых районах мира, уносящей между 1,7 и 2 миллионами жизней ежегодно. Хотя инфекция может быть бессимптомной в течение существенного промежутка времени, заболевание наиболее часто проявляется в виде острого воспаления легких, приводя в результате к жару и непродуктивному кашлю. При отсутствии лечения, как правило, результатом являются серьезные осложнения и смерть. Появление ТБ с множественной лекарственной устойчивостью (МЛУ-ТБ) дополнительно усугубляет это лечение (Dye, Nat Rev Microbiol 2009; 7:81-7).
Ход развития инфекции M. tuberculosis происходит по существу через 3 фазы. Во время острой или активной фазы бактерии пролиферируют или активно размножаются с экспоненциальной, логарифмической или полулогарифмической скоростью в органах, пока иммунный ответ не увеличивается до состояния, при котором он может контролировать инфекцию, после чего бактериальная нагрузка достигает пика и начинает снижаться. Хотя механизм не является полностью понятым, считается, что сенсибилизированные Τ лимфоциты CD4+ совместно с интерфероном гамма (IFN-gamma, γ-IFN) опосредуют контроль инфекции. Когда активный иммунный ответ снижает бактериальную нагрузку и сохраняет ее под контролем в устойчивом и низком уровне, устанавливается латентная фаза. Ранее в исследованиях сообщали о том, что во время латентного состояния M. tuberculosis переходит от активного размножения в неактивное состояние, главным образом становясь нереплицирующимся и оставаясь внутри гранулемы. Однако недавние исследования продемонстрировали, что даже в латентном состоянии, стадия инфекции характеризуется постоянными низкими количествами бактерий, по меньшей мере часть бактериальной популяции остается в состоянии активного метаболизма (Talaat et al. 2007, J of Bact 189, 4265-74).
Эти бактерии вследствие этого выживают, поддерживают активный метаболизм и минимально реплицируются ввиду сильного иммунного ответа. У инфицированного индивидуума во время латентного состояния вследствие этого имеет место баланс между нереплицирующимися бактериями (которые могут представлять большую сложность для детектирования иммунной системой, так как они расположены внутриклеточно) и медленно реплицирующимися бактериями. В некоторых случаях, латентная инфекция начинает реактивацию, когда дремлющие бактерии начинают реплицироваться снова, однако со скоростями несколько более низкими, чем при первичной инфекции. Было предположено, что переход M. tuberculosis от первичной инфекции в латентное состояние сопровождается изменениями в экспрессии генов (Honer zu Bentrup, 2001). Также вероятно, что изменения в антигенной специфичности иммунного ответа происходят потому, что бактерия модулирует экспрессию генов во время ее перехода от активной репликации в неактивное состояние. Подробная природа иммунного ответа, который контролирует латентную инфекцию, и факторы, которые ведут к реактивации, по большому счету неизвестны. Однако имеют место свидетельства того, что за это ответственен сдвиг в доминирующих клеточных типах. Исследования предполагают, что тогда как Τ-клетки CD4 являются основными и их достаточно для контроля инфекции во время острой фазы, Τ клеточные ответы CD8 являются более важными в латентной фазе. Бактерии в этой стадии, как правило, не являются мишенью для большинства профилактических вакцин, которые находятся в разработке в области ТБ, что иллюстрируется недостатком активности, когда традиционные профилактические вакцины вводят латентно инфицированным экспериментальным животным (Turner et al. 2000 Infect Immun. 68:6:3674-9).
Хотя ТБ в целом может подвергаться контролю посредством применения продолжительной антибиотической терапии, такого лечения не достаточно для предотвращения распространения заболевания. Инфицированные индивидуумы могут являться бессимптомными, но контагиозными в течение некоторого времени. Современная клиническая практика для латентного ТБ (бессимптомный и неконтагиозный) является лечением с от 6 до 9 месяцев изониазида или другого антибиотика или альтернативно с 4 месяцами рифампицина. Активный ТБ лечат комбинацией 4 лекарственных препаратов в течение от 6 до 8 недель, во время которых, как предполагается, большинство бацилл подвергаются умерщвлению, с последующими двумя лекарственными средствами с общей продолжительностью от 6 до 9 месяцев. Продолжительность лечения зависит от количества доз, вводимых каждую неделю. В добавление, несмотря на то, что соблюдение режима лечения является критичным, поведение пациента трудно контролировать. Некоторые пациенты не завершают курс лечения или из-за побочных эффектов или из-за чрезмерной продолжительности лечения (6-9 месяцев), что, как показали исследования, может привести к неэффективному лечению и развитию устойчивости к лекарственному средству.
Для того, чтобы контролировать распространение туберкулеза, имеют большое значение как эффективная профилактическая вакцинация, так и точное раннее диагностирование активного заболевания с последующими более эффективными терапевтическими режимами, включая терапевтические вакцины и затратоэффективные и приемлемые для пациента химиотерапевтические средства. В настоящее время профилактическая вакцинация с живыми бактериями, такими как бацилла Кальмета-Герена (БКГ), авирулентный штамм M. bovis, является наиболее эффективным способом для индуцирования защитного иммунитета. Однако безопасность и эффективность БКГ является предметом дискуссий, и в некоторых странах, таких как Соединенные штаты, не вакцинируют основную часть населения этим агентом. Развитие молекулярных адъювантов, комбинированных с отобранными рекомбинантными белками, позволило развитие нового поколения вакцин, которые могут быть применены профилактически, а также терапевтически для лечения, а также предотвращения инфекционных заболеваний. См., например, EP 2457926. Таким образом необходима терапевтическая вакцина, которая эффективна в стимулировании иммунного ответа на активное заболевание ТБ даже несмотря на высокую бактериальную нагрузку, для того чтобы предоставить вспомогательное средство для химиотерапевтических средств для уменьшения времени лечения, очистки от бацилл, ограничить легочную патологию, ассоциированную с заболеванием и потенциально ограничить распространение МЛУ-ТБ.
Таким образом, имеет место срочная потребность в новых более эффективных терапевтических режимах для активных инфекций M. tuberculosis, которые увеличивают приверженность лечению уменьшением времени лечения, для того чтобы уменьшить передачу ТБ.
Сущность изобретения
Данное изобретение относится к способам лечения активной инфекции M. tuberculosis или активной инфекции, являющейся следствием реактивации латентной инфекции у млекопитающего и к способам улучшения эффективности химиотерапевтических режимов против активной инфекции M. tuberculosis.
Данное изобретение основано на неожиданном открытии того, что активная инфекция M. tuberculosis может быть эффективно вылечена режимом лечения, включающим терапевтическую композицию Mtb, такую как терапевтическая вакцина Mtb, и химиотерапевтический агент, эффективный против инфекции M. tuberculosis, посредством этого сокращая время химиотерапии, необходимое для защиты, уменьшая бактериальную нагрузку и/или увеличивая время выживания. Более того, неожиданно, авторы изобретения обнаружили, что терапевтическая композиция Mtb при доставке во время активной ТБ инфекции в качестве вспомогательного средства к антибиотической терапии может вырабатывать преимущественный иммунный ответ к M. tuberculosis, который улучшает эффективность химиотерапевтического режима по отношению к заболеванию ТБ. Авторы изобретения дополнительно обнаружили, что введение терапевтической композиции Mtb, такой как терапевтическая вакцина во время активной ТБ инфекции в качестве вспомогательного средства с химиотерапевтическим агентом, эффективным против инфекции M. tuberculosis, стимулировало значительно более сильный, высококачественный (полифункциональный) и долговременный Τ-клеточный ответ CD4+ типа TH1.
Вследствие этого, в одном варианте предоставлен способ лечения активной туберкулезной инфекции у млекопитающего, включающий стадию введения млекопитающему, имеющему активную туберкулезную инфекцию (например, M. tuberculosis) химиотерапевтического агента и иммунологически эффективного количества терапевтической вакцины, в котором вакцина содержит фармацевтическую композицию, содержащую антиген Mtb или его иммуногенный фрагмент видов Микобактерий туберкулезного комплекса и адъювант.
Будет принято во внимание, что в этом и родственных способах изобретения по меньшей мере одна стадия введения терапевтической вакцины, как правило, первая стадия введения терапевтической вакцины, будет происходить, когда млекопитающее является активно инфицированным M. tuberculosis и/или проявляет по меньшей мере один клинический симптом или положительный результат исследования, ассоциированный с активной инфекцией. Также будет принято во внимание, что способы по данному изобретению могут дополнительно включать дополнительные стадии введения той же или другой терапевтической вакцины по данному изобретению в одной или более дополнительных временных точек впоследствии, безотносительно к тому, имеет ли все еще место активная инфекция или ее симптомы у млекопитающего и безотносительно к тому, является ли результат исследования, ассоциированный с активной инфекцией, все еще положительным, для того чтобы улучшить эффективность режимы химиотерапии. Также будет принято во внимание, что способы по данному изобретению могут включать введение терапевтической вакцины или отдельно, или в сочетании с другими агентами, и сама по себе терапевтическая вакцина может являться одним из множества компонентов лечения в виде части более обширного режима терапевтического лечения. Соответственно, способы по данному изобретению преимущественным образом улучшают эффективность химиотерапевтического режима лечения для лечения активной туберкулезной инфекции.
В некоторых вариантах осуществления терапевтическая вакцина содержит выделенный слитый полипептид, содержащий комбинацию двух или более ковалентно связанных антигенов M. tuberculosis или их иммуногенные фрагменты, где антигены выбраны из группы, состоящей из Rv0164, Rv0496, Rv2608, Rv3020, Rv3478, Rv3619, Rv3620, Rv1738, Rv1813, Rv3810, Rv2389, Rv2866, Rv3876, Rv0054, Rv0410, Rv0655, Rv0831, Rv1009, Rv1099, Rv1240, Rv1288, Rv1410, Rv1569, Rv1789, Rv1818, Rv1860, Rv1886, Rv1908, Rv2220, Rv2032, Rv2623, Rv2875, Rv3044, Rv3310, Rv3881, Rv0577, Rv1626, Rv0733, Rv2520, Rv1253, Rv1980, Rv3628, Rv1884, Rv3872, Rv3873, Rv1511 и Rv3875 и антигенов, имеющих по меньшей мере 90% идентичности с любой из вышеприведенных последовательностей.
В конкретном варианте осуществления терапевтическая вакцина содержит слитый полипептид ID93, который содержит антигены Rv2608, Rv3619, Rv3620 и Rv1813.
В другом конкретном варианте осуществления терапевтическая вакцина содержит слитый полипептид ID93, который содержит антигены Rv2608, Rv3619, Rv3620 и Rv1813, где последовательности антигенов происходят от M. tuberculosis. В более конкретном варианте осуществления слитый полипептид ID93 содержит последовательность, приведенную в SEQ ID NO:1, или последовательности, имеющие по меньшей мере 90% идентичности с ней.
Также в данном документе представлен способ лечения активной туберкулезной инфекции у млекопитающего, включающий стадию введения млекопитающему, имеющему активную инфекцию туберкулезом, иммунологически эффективного количества терапевтической вакцины в сочетании с одним или более химиотерапевтическими агентами, где вакцина содержит фармацевтическую композицию, содержащую выделенный слитый полипептид, в котором слитый полипептид содержит (a) комбинацию антигена Rv3620 и Rv2608 видов микобактерий туберкулезного комплекса, и антигены являются ковалентно связанными, или (b) последовательности, имеющие по меньшей мере 90% идентичности с комбинацией антигенов.
Также в данном документе представлен способ лечения активной туберкулезной инфекции у млекопитающего, включающий стадии введения млекопитающему, имеющему активную инфекцию туберкулезом, иммунологически эффективного количества терапевтической вакцины в сочетании с одним или более химиотерапевтическими агентами, где вакцина содержит фармацевтическую композицию, содержащую выделенный слитый полипептид, в котором слитый полипептид содержит (a) комбинацию антигена Rv1813, Rv3620 и Rv2608 видов микобактерий туберкулезного комплекса, и антигены являются ковалентно связанными, или (b) последовательности, имеющие по меньшей мере 90% идентичности с комбинацией антигенов.
В некоторых вариантах осуществления активная инфекция, которая будет подвергаться лечению в соответствии с раскрытыми способами, является активной инфекцией, которая вызывает у млекопитающего клинический симптом активного ТБ, выбранный из группы, состоящей из слабости, жара, простуд, потери веса, анорексии и ночной потливости. В других вариантах осуществления активная инфекция вызывает клинические симптомы легочного ТБ у млекопитающего, выбранные из группы, состоящей из непрекращающегося кашля, густой слизи, боли в груди и кровохарканья. В других вариантах осуществления активная инфекция характеризуется бактериями Mtb, которые пролиферируют, репродуцируются, распространяются или активно размножаются с экспоненциальной, логарифмической или полулогарифмической скоростью в органе млекопитающего. В других более конкретных вариантах осуществления активную инфекцию идентифицируют с применением анализа, выбранного из группы, состоящей из анализа кислотоустойчивого окрашивания (AFS); анализа бактериальной культуры, такого как анализ BACTEC MGIT 960; тест IGR, такой как тест QFT®-Gold или ТБ тест QFT®-Gold In-tube Τ SPOT™; кожный тест, такой как кожный тест TST Mantoux (TST); и внутриклеточное цитокиновое окрашивание цельной крови или выделенных МКПК после антигенной стимуляции.
Будет очевидно, что в некоторых вариантах осуществления активная инфекция будет активной первичной инфекцией M. tuberculosis, тогда как в других она будет результатом реактивации латентной инфекции M. tuberculosis. В некоторых вариантах осуществления млекопитающее будет инфицировано штаммом M. tuberculosis с множественной лекарственной устойчивостью (МЛУ). В других вариантах осуществления млекопитающее ранее иммунизировано с бациллой Кальмета-Герена (БКГ).
Некоторые варианты осуществления раскрытых способов включают введение одного или более химиотерапевтических агентов, эффективных в лечении инфекции M. tuberculosis, таких как изониазид и/или рифампицин. В некоторых ситуациях млекопитающему сначала вводят один или более химиотерапевтических агентов в течение промежутка времени и затем вводят терапевтическую вакцину. В других ситуациях млекопитающему сначала вводят терапевтическую вакцину и затем вводят один или более химиотерапевтических агентов в течение промежутка времени. В еще одном виде ситуаций введение одного или более химиотерапевтических агентов и терапевтической вакцины инициируют в одно и то же время. Дополнительно будет принято во внимание, что при воплощении на практике раскрытых способов может быть желательно вводить фармацевтическую композицию и/или терапевтическую вакцину млекопитающему в нескольких интервалах времени, например, один или более последующих интервалов времени после первого введения.
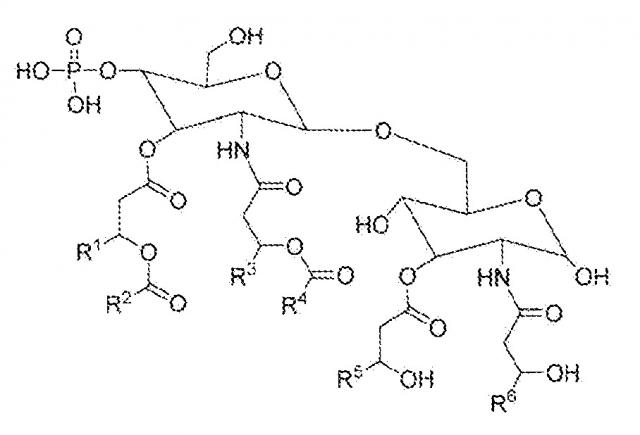
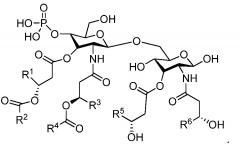
В некоторых вариантах осуществления терапевтическая вакцина дополнительно содержит адъювант. В некоторых вариантах осуществления адъювант, применяемый в терапевтической вакцине, представляет собой адъювант GLA, такой как адъювант GLA, имеющий следующую структуру:
где R1, R3, R5 и R6 представляют собой C11-C20 алкил; и R2 и R4 представляют собой C12-C20 алкил или C9-C20 алкил.
В более конкретном варианте осуществления при применении GLA, имеющего вышеприведенную структуру, R1, R3, R5 и R6 представляют собой C11-14 алкил; и R2 и R4 представляют собой C12-15 алкил. В еще более конкретном варианте осуществления GLA вышеприведенной структуры является таким, в котором Rl, R3, R5 и R6 представляют собой С11 алкил; и R2 и R4 представляют собой C13 алкил. В еще более конкретном варианте осуществления GLA вышеприведенной структуры является таким, в котором R1, R3, R5 и R6 представляют собой C11 алкил; и R2 и R4 представляют собой C9 алкил.
В другом варианте композиции применяют в способах для уменьшения времени курса химиотерапии при активной туберкулезной инфекции у индивида, который включает стадию введения млекопитающему с активной инфекцией Mycobacterium tuberculosis иммунологически эффективного количества терапевтической вакцины, как описано в данном документе, например, содержащей слитый белок или полипептид или иммуногенный фрагмент из видов микобактерий туберкулезного комплекса и адъювант в качестве вспомогательного средства с одним или более химиотерапевтическими агентами, эффективными против инфекции M. tuberculosis, посредством этого снижая время курса химиотерапии против инфекции M. tuberculosis. В другом варианте в данном документе представлен способ для уменьшения времени курса химиотерапии против активной туберкулезной инфекции, при этом способ содержит введение млекопитающему, имеющему активную инфекцию туберкулезом, иммунологически эффективного количества терапевтической вакцины в сочетании с химиотерапией, где вакцина содержит фармацевтическую композицию, содержащую выделенный слитый полипептид, в котором слитый полипептид содержит (a) комбинацию антигена Rv1813, Rv3620 и Rv2608 видов микобактерий туберкулезного комплекса, и антигены являются ковалентно связанными, или (b) последовательности, имеющие по меньшей мере 90% идентичности с комбинацией антигенов, и в котором вакцина индуцирует иммунный ответ против туберкулеза, посредством этого обеспечивая уменьшенное время курса химиотерапии против активной туберкулезной инфекции. В некоторых вариантах время курса терапии укорочено до приблизительно 3, 4, 5, 6 или 7 месяцев, например, не более чем приблизительно 3, 4, 5, 6 или 7 месяцев. Посредством сокращения времени курса химиотерапии против инфекции M. tuberculosis способы по данному изобретению также эффективны в усилении приверженности индивидуума, подвергающегося лечению от инфекции M. tuberculosis, к завершению полного курса лечения.
В дополнительном варианте композиции применяют в способах стимулирования полифункционального, долговременного Τ-клеточного ответа CD4+ типа TН1 при активной туберкулезной инфекции у индивида, где способ включает стадию введения млекопитающему с активной инфекцией Mycobacterium tuberculosis иммунологически эффективного количества терапевтической вакцины, как описано в данном документе, например, содержащей слитый белок или его иммуногенный фрагмент из видов микобактерий туберкулезного комплекса и адъювант в качестве вспомогательного средства с одним или более химиотерапевтическими агентами, эффективными против инфекции M. tuberculosis, посредством этого стимулируя полифункциональный, долговременный Τ-клеточный ответ CD4+ типа TH1-типа. Посредством сокращения времени курса химиотерапии против инфекции M. tuberculosis, способы по данному изобретению также эффективны для усиления приверженности индивидуума, подвергающегося лечению от инфекции M. tuberculosis, к завершению полного курса лечения.
В любом из вышеупомянутых вариантов осуществления млекопитающее может быть человеком.
Краткое описание рисунков
Файл патента или заявки содержит по меньшей мере один рисунок, выполненный в цвете. Копии этого патента или публикации патентной заявки с цветным(и) рисунком(ами) будут предоставлены организацией при запросе и оплате требуемой пошлины.
Фигура 1 демонстрирует бактериальную нагрузку и выживаемость мышей SWR/J и C57BL/6, инфицированных Mycobacterium tuberculosis (Mtb) и подвергаемых лечению с антибиотиками. Мышей SWR/J и C57BL/6 инфицировали с низкой дозой (50-100 бактерии) аэрозоля (LDA) Mtb H37Rv (ATCC #27294). (фиг. 1A) Количество жизнеспособных бактерий в легких (5 мышей/группу) определяли через 15, 30 и 100 дней после инфекции. Обозначения указывают среднее +/- стандартное отклонение. (фиг. 1B) За выживаемостью мышей SWR/J и C57BL/6 наблюдали на животных (8 мышей/группу), инфицированных с Mtb H37Rv и подвергаемых лечению имитационно или с 90-дневным антибиотическим режимом (Rx 90 д), состоящим из INH и RIF, вводимыми в дни 30-120. (фиг. 1C) Мышей SWR/J инфицировали с LDA Mtb H37Rv и подвергали лечению с 30, 60 или 90 днями антибиотиков, начиная с дня 15 (Rx 30 д, 60 д, 90 д) или с дня 30 (Rx 90 д (30)). Продемонстрирована выживаемость мышей SWR/J (7 мышей/группу). (фиг. 1D) Количество жизнеспособных бактерий в легких животных (5 мышей/группу) подвергаемых лечению имитационно или с 90-дневным режимом INH/RIF (Rx 90 д), вводимым в дни 30-120, определяли через 30, 60, 90, 120 и 150 дней после инфекции. * Ρ<0,05 (однофакторный ANOVA с последующим критерием множественного сравнения Даннетта или логарифмический ранговый критерий) считали значимым. Продемонстрирован один репрезентативный эксперимент из двух.
Фигура 2 демонстрирует количества колониеобразующих единиц и выживаемость мышей SWR/J, инфицированных с LDA Mtb и подвергаемых лечению с антибиотиками и ID93/GLA-SE. Мышей SWR/J инфицировали с LDA Mtb (день 0). Через пятнадцать дней (день 15) мышей подвергали лечению имитационно или с антибиотиками в течение 90 дней (Rx 90 д). Подгруппу подвергаемых антибиотическому лечению мышей в каждой группе также иммунизировали 3×3 отдельных недели от ID93/GLA-SE или во время (ВТЛ; дни 15, 36, 57), или после антибиотического терапевтического лечения (ПТЛ; дни 107, 128, 149). (фиг. 2A) Схема иммунотерапевтических экспериментов. (фиг. 2B) Количество жизнеспособных бактерий в легких животных (6 или 7 мышей/группу) определяли через 177 дней после инфекции. * Ρ<0,05 считали значимыми. (фиг. 2C) Защиту оценивали посредством наблюдения за смертями животных (9 или 10 мышей/группу), вызванными Mtb с течением времени. Продемонстрирован один репрезентативный эксперимент из четырех. Ρ<0,05 (логарифмический ранговый критерий) считали значимым.
Фигура 3 демонстрирует выживаемость мышей SWR/J, инфицированных с Mtb и подвергаемых лечению с вакциной ID93/GLA-SE и сниженной антибиотической химиотерапией. Мышей SWR/J инфицировали c LDA Mtb H37Rv. Через пятнадцать дней мышей подвергали лечению в течение 60 или 90 дней с антибиотиками (Rx 60 д и Rx 90, соответственно). После завершения 60 дневного антибиотического режима мышей иммунизировали 3×3 отдельные недели с ID93/GLA-SE. (фиг. 3A) Защиту оценивали наблюдениям за смертями животных (7 мышей/группу), вызванным Mtb с течением времени. Ρ<0,05 (логарифмический ранговый критерий) считали значимым. (фиг. 3B-3M) Гистопатологическая оценка легочных тканей после стимулирования с Mtb H37Rv. Воспалительные ответы и образование гранулемы (г) продемонстрированы в секциях H и E (фиг. 3B-3I) и наличие оценивали AFB (стрелки) (фиг. 3J-3M). (фиг. 3B, 3F, 3J) Имитационно-подвергаемые лечению мыши, день 106; (фиг. 3C, 3J и 3K) 90-дневная антибиотическая терапия, день 106; (фиг. 3D, 3H, 3L) 90-дневная антибиотическая терапия + ID93/GLA-SE, день 241; (фиг. 3E, 3I и 3M) 60-дневная антибиотическая терапия + ID93/GLA-SE, день 295. Представленные данные являются репрезентативными для 5 мышей/группу. Продемонстрирован один репрезентативный эксперимент из трех.
Фигура 4 демонстрирует ID93-специфичные цитокиновые ответы у мышей SWR после иммунотерапии. Мышей SWR инфицировали с LDA Mtb H37Rv и подвергали лечению в течение 90 дней или с антибиотиками отдельно или с антибиотиками с последующей иммунизацией с ID93/GLA-SE 3×3 отдельные недели. (фиг. 4A) Цитокиновый профиль ID93-стимулированных спленоцитов регистрировали или в день 177, или 241 после инфекции. Клетки инкубировали в течение 24 часов в присутствии антигена или контроля среды и супернатанты собирали и анализировали посредством мультиплексного гранулярного блока на IFN-γ, IL-2, TNF, IL-5, IL-10, IL-13 и IL-17. Коробчатые диаграммы демонстрируют серединный и интерквартильный диапазон после вычитания фона. P-величины из критерия суммы рангов Уилкоксона. (фиг. 4B-4D) Внутриклеточное цитокиновое окрашивание на ID93-специфичные T-клеточные ответы в дни 149 и 177 после инфекции. Клетки стимулировали с ID93 или контролем среды в присутствии брефелдина A в течение 8-12 часов, окрашивали коньюгированными с флуорохромом антителами против CD3, CD4, CD8, CD44, IFN-γ, IL-2 и TNF. (фиг. 4B и 4C) Панели демонстрируют схему пропускания для анализа FACS. (фиг. 4D) Коробчатые диаграммы в нижней панели демонстрируют серединный и интерквартильный диапазон после вычитания фона. P-величины из критерия суммы рангов Уилкоксона. Продемонстрирован один репрезентативный эксперимент из двух.
Фигура 5 демонстрирует выживаемость, клинические параметры и бактериальную нагрузку приматов кроме человека (Non-Human Primates, NHP) инфицированных с Mtb и подвергаемых лечению с антибиотиками и ID93/GLA-SE. Яванских макак инокулировали внутритрахеально с 1000 КОЕ вирулентной M. tuberculosis (штамм Эрдмана). Передоставляли инфекции возможность протекать в течение 60 дней с последующим лечением с 30 днями антибиотиков INH/RIF, доставляемыми гаважем: или солевого раствора (имитация). Обезьян (7 в расчете на группу) инъецировали ID93/GLA-SE (Rx + ID93/GLA-SE), вводимыми 3 раза в 2 отдельных недели, или они не получали дополнительное лечение (имитация, Rx). (фиг. 5A) Схема иммунотерапевтического эксперимента NHP. (фиг. 5B) За выживаемостью наблюдали в течение 50 недель после воздействия. (фиг. 5C) Изменения CYR также оценивали ежемесячно в течение 50 недель после воздействия. (фиг. 5D) Бактерии определяли количественно подсчетом бактериологической нагрузки (КОЕ) в легких обезьян. (фиг. 5E) Гистологический вид окрашенных H&E срезов легочных тканей, полученных из NHP.
Фигура 6 демонстрирует log10 количества КОЕ в легком после 6 недель (фиг. 6A) и 12 недель (фиг. 6B) лечения.
Фигура 7 демонстрирует бактериальный рост после прекращения терапии.
Подробное описание изобретения
Как описано в данном документе, данное изобретение в целом относится к композициям и способам для лечения активной ТБ инфекции с применением терапевтических ТБ вакцин в комбинации с химиотерапевтическими агентами против ТБ, что может привести к укороченным продолжительностям лечения, устранению бацилл ТБ и потенциально к ограничению распространения МЛУ-ТБ.
Терапевтические вакцинные композиции по данному изобретению в целом содержат по меньшей мере два гетерологичных полипептида видов Mycobacterium (микобактерии) tuberculosis (туберкулезного) комплекса. Виды Mycobacterium туберкулезного комплекса включают в себя виды, которые, как традиционно считается, вызывают заболевание туберкулез, а также окружающие Mycobacterium и условно-патогенные виды, которые вызывают туберкулез и легочное заболевание у пациентов со сниженным иммунитетом, таких как пациенты с ВИЧ, например, Mycobacterium tuberculosis (Mtb), Mycobacterium bovis или Mycobacterium africanum, БКГ, Mycobacterium avium, Mycobacterium intracellulare, Mycobacterium celatum, Mycobacterium genavense, Mycobacterium haemophilum, Mycobacterium kansasii, Mycobacterium simiae, Mycobacterium vaccae, Mycobacterium fortuitum и Mycobacterium scrofulaceum (см., например, Harrison's Principles of Internal Medicine, том 1, стр. 1004-1014 и 1019-1020). В предпочтительном варианте осуществления виды Mycobacterium для подвергания профилактике, лечению или диагнозу в соответствии с изобретением представляют собой Mycobacterium tuberculosis (Mtb). Последовательности антигенов из видов Mycobacterium являются легкодоступными. Например, последовательности Mycobacterium tuberculosis можно найти в Cole et al., Nature 393:537 (1998) и можно найти на интернет-сайтах, таких как поддерживаемые Wellcome Trust, институтом Сэнгера и институтом Пастера.
В некоторых вариантах осуществления терапевтическая вакцина содержит слитый полинуклеотид, слитый полипептид или композицию, как описано в публикации патентной заявки США No. 2010/0129391 (содержание которой особым образом полностью включено в данный документ посредством ссылки).
Например, в некоторых конкретных вариантах осуществления терапевтическая вакцина содержит выделенный слитый полипептид или белок или полинуклеотид, кодирующий его, содержащий комбинацию двух или более ковалентно связанных антигенов Mycobacterium tuberculosis или их иммуногенных фрагментов, где антигены выбраны из группы, состоящей из Rv0164, Rv0496, Rv2608, Rv3020, Rv3478, Rv3619, Rv3620, Rv1738, Rv1813, Rv3810, Rv2389, Rv2866, Rv3876, Rv0054, Rv0410, Rv0655, Rv0831, Rv1009, Rv1099, Rv1240, Rv1288, Rv1410, Rv1569, Rv1789, Rv1818, Rv1860, Rv1886, Rv1908, Rv2220, Rv2032, Rv2623, Rv2875, Rv3044, Rv3310, Rv3881, Rv0577, Rv1626, Rv0733, Rv2520, Rv1253, Rv1980, Rv3628, Rv1884, Rv3872, Rv3873, Rv1511 и Rv3875, и антигенов, имеющих по меньшей мере 90% идентичности с любой из вышеприведенных последовательностей, как описано в публикации патентной заявки США No. 2010/0129391.
В некоторых вариантах осуществления терапевтическая вакцина содержит выделенный слитый полипептид, содержащий (a) комбинацию антигена Rv3620 и Rv2608 видов микобактерий туберкулезного комплекса, и антигены являются ковалентно связанными, или (b) последовательности, имеющие по меньшей мере 90% идентичности с комбинацией антигенов. В некоторых вариантах осуществления терапевтическая вакцина содержит выделенный слитый полипептид, содержащий (a) комбинацию антигена Rv1813, Rv3620 и Rv2608 видов микобактерий туберкулезного комплекса, и антигены являются ковалентно связанными или (b) последовательности, имеющие по меньшей мере 90% идентичности с комбинацией антигенов. В некоторых вариантах осуществления терапевтическая вакцина содержит слитый полипептид, содержащий комбинацию антигенов микобактерий Rv2608, Rv3619, Rv3620 и Rv1813 или последовательности, имеющие по меньшей мере 90% идентичности с комбинацией антигенов. В некоторых вариантах осуществления антигены микобактерий Rv2608, Rv3619, Rv3620 и Rv1813 представляют собой антигены M. tuberculosis Rv2608, Rv3619, Rv3620 и Rv1813. В некоторых вариантах осуществления слитый полипептид содержит последовательность, приведенную в SEQ ID NO:1, или последовательность, имеющую по меньшей мере 90% идентичности с ней. В некоторых вариантах осуществления слитый полипептид содержит последовательность, приведенную в SEQ ID NO:2, или последовательность, имеющую по меньшей мере 90% идентичности с ней. В некоторых вариантах осуществления терапевтическая вакцина содержит слитый полипептид, содержащий комбинацию антигенов микобактерий Rv2608, Rv3620 и Rv 1813 или последовательность, имеющую по меньшей мере 90% идентичностис комбинацией антигенов. В некоторых вариантах осуществления антигены микобактерий Rv2608, Rv3620 и Rv1813 представляют собой антигены M. tuberculosis Rv2608, Rv3620 и Rv1813. В некоторых вариантах осуществления слитый полипептид содержит последовательность, приведенную в SEQ ID NO:3 или 4, или последовательность, имеющую по меньшей мере 90% идентичности с SEQ ID NO:3 или SEQ ID NO:4. В некоторых вариантах осуществления антиген Rv1813 содержит аминокислотную последовательность SEQ ID NO:5. В некоторых вариантах осуществления антиген Rv3620 содержит аминокислотную последовательность SEQ ID NO:6. В некоторых вариантах осуществления антиген Rv2608 содержит аминокислотную последовательность SEQ ID NO:7. В некоторых вариантах осуществления антиген Rv3619 содержит аминокислотную последовательность SEQ ID NO:8. Специалист в данной области поймет, что одна или более N-терминальных аминокислот (таких как сигнальная последовательность) может быть удалена.
В более конкретном варианте осуществления терапевтическая вакцина содержит слитый белок ID93 или полинуклеотид, кодирующий его же, который содержит четыре антигена, принадлежащих к семействам белков Mtb, ассоциированных с вирулентностью (Rv2608, Rv3619, Rv3620) или латентным состоянием (Rv1813), как описано в публикации патентной заявки США No. 2010/0129391 (особым образом полностью включенной в данный документ посредством ссылки).
В некоторых конкретных дополнительных вариантах осуществления слитый белок, например, слитый белок ID93, составлен в виде вакцины. В дополнительных конкретных вариантах осуществления терапевтическая вакцина содержит устойчивую эмульсию масло-в-воде (SE) и GLA, синтетический агонист TLR-4 (GLA), как описано в публикации патентной заявки США No. 2008/0131466 (особым образом полностью включенной в данный документ посредством ссылки). Как поймет специалист в данной области, в некоторых вариантах осуществления терапевтическая вакцина содержит выделенный полипептид, выделенный слитый полипептид или фрагмент (например, антигенный/иммуногенный участок) из видов микобактерий туберкулезного комплекса, известных в данной области. Полипептиды Mtb по изобретению, их антигенные/иммуногенные фрагменты и другие варианты могут быть приготовлены с применением общепринятых рекомбинантных и/или синтетических технологий.
В некоторых вариантах осуществления молекулу нуклеиновой кислоты или слитый белок вводят с одним или более химиотерапевтическими агентами, эффективными против инфекции M. tuberculosis. Примеры таких химиотерапевтических агентов включают, но не ограничены ими, амикацин, аминосалициловую кислоту, капреомицин, циклосерин, этамбутол, этионамид, изониазид, канамицин, пиразинамид, рифамицины (т.е., рифампицин, рифапентин и рифабутин), стрептомицин, офлоксацин, ципрофлоксацин, кларитромицин, азитромицин и фторхинолоны. Такая химиотерапия определяется оценкой лечащего врача с применением предпочтительных лекарственных комбинаций. Химиотерапевтические агенты "первой линии", применяемые для лечения инфекции M. tuberculosis, которая не является устойчивой к лекарственному средству, включают в себя изониазид, рифампицин, этамбутол, стрептомицин и пиразинамид. Химиотерапевтические агенты "второй линии", применяемые для лечения инфекции M. tuberculosis, которая продемонстрировала устойчивость к лекарственному средству по отношению к одному или более лекарственных средств "первой линии", и включают в себя, но не ограничены ими, офлоксацин, ципрофлоксацин, этионамид, аминосалициловую кислоту, циклосерин, амикацин, канамицин и капреомицин.
В некоторых вариантах осуществления терапевтическую вакцину вводят млекопитающему с активным ТБ перед, совместно с или после введения одного или более химиотерапевтических агентов, эффективных против инфекции M. tuberculosis. В некоторых вариантах осуществления химиотерапевтическое средство вводят конкурентно в то же самое время. Альтернативно, химиотерапевтическое средство вводят в пределах минут, таких как приблизительно 1, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50 минут, часов, таких как приблизительно 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21 или даже дней, таких как приблизительно 1, 2, 3, 4, 5 или 6 дней. В некоторых вариантах осуществления химиотерапевтическое средство вводят приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 недель перед терапевтической вакциной. В одном варианте осуществления молекулу нуклеиновой кислоты или слитый белок вводят приблизительно 2 недели после начала введения одного или более химиотерапевтических агентов. Один или более химиотерапевтических агентов вводят в целом в течение промежутка времени, например, в течение приблизительно 1, 2, 3 или 4 недель или приблизительно 2, 3, 4, 5, 6 или 8 месяцев или приблизительно 1 года или дольше.
В некоторых вариантах осуществления за первым введением млекопитающему с активной инфекцией ТБ терапевтической композиции для стимулирования иммунного ответа, содержащей молекулу нуклеиновой кислоты, слитый полипептид или вакцину, следует одно или более последующих введений нуклеиновой кислоты