Фармацевтическая композиция, включающая дисульфид глутатиона и глутатион дисульфид s-оксид
Иллюстрации
Показать всеГруппа изобретений относится к области фармацевтической промышленности, а именно к фармацевтической композиции (и к ее применению) для устранения дозозависимой токсичности и повышения терапевтической активности фармакологически активного соединения в терапии инфекционных и неинфекционных заболеваний, включающей дисульфид глутатиона или его фармацевтически приемлемую органическую или неорганическую соль и глутатион дисульфид S-оксида или его фармацевтически приемлемую органическую или неорганическую соль; а также к фармакологической комбинации (и к ее применению), содержащей указанную композицию и фармакологически активное соединение, выбранное из антикоагулянта, ингибитора фактора Ха, антимикробного или противовирусного средства, ингибитора кальциевых каналов; к лекарственному средству, включающему терапевтически эффективное количество указанных композиции или комбинации совместно с фармацевтически приемлемыми эксципиентами. Группа изобретений обеспечивает снижение дозозависимой токсичности и усиление эффективности различных фармакотерапевтически активных агентов. 6 н. и 17 з.п. ф-лы, 14 пр., 7 табл., 6 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к фармацевтической промышленности и к медицине, а именно к области получения лекарственных препаратов, и может быть использовано в фармакологии, медицине и ветеринарии.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Повышение терапевтической эффективности фармакологических молекул посредством оптимизации их фармакокинетики и/или фармакодинамики и/или снижения токсичности за счет химической модификации молекулы лекарственного средства и/или ее сочетанным использованием с другим химическим соединением или соединениями является одним из направлений создания лекарственных препаратов нового поколения, проявляющих свою активность в физиологически более оптимальных дозах.
В настоящее время известно вещество - окисленный глутатион (глутатион окисленный, дисульфид глутатиона, GSSG), которое представляет собой димер трипептида глутатиона, γ-глутамилцистеинилглицина, в котором две молекулы указанного трипептида соединены друг с другом ковалентной дисульфидной связью между цистеиновыми остатками. Как трипептид глутатион (глутатион восстановленный, GSH), так и его димер - GSSG являются природными метаболитами и присутствуют в тканях и биологических жидкостях людей и животных [Isabella Dalle-Donne et al. S-glutathionylation in protein redox regulation / Free Radical Biology & Medicine, 2007, V. 43, pp. 883-898; Калинина E.B. и др. Роль глутатиона, глутатионтрансферазы и глутаредоксина в регуляции редокс-зависимых процессов / Успехи биологической химии, 2014, Т. 54, с. 299-348].
Из уровня техники известно, что окисленный глутатион (GSSG) сам по себе обладает разнообразной фармакологической активностью. В частности, показана способность окисленного глутатиона усиливать продукцию широкого спектра цитокинов, контролирующих комплекс защитных реакций организма, включая противовирусное, антибактериальное, противоопухолевое, антифибротическое действие.
Так, в патенте RU 2089179 С1, опубл. 10.09.1997] и в патенте WO 9721444 А1, опубл. 19.06.1997] раскрывается использование окисленного глутатиона и фармацевтических композиций на его основе для лечения онкологических, инфекционных, иммунологических, неопластических и гематологических заболеваний, при которых целесообразна стимуляция эндогенной продукции цитокинов и гемопоэтических факторов.
В патенте RU 2206334 С1, опубл. 20.06.2003], патенте RU 2208452 С1, опубл. 20.07.2003] и патенте RU 2208453 С1, опубл. 20.07.2003] раскрывается применение фармацевтических композиций на основе окисленного глутатиона для увеличения устойчивости (резистентности) организма соответственно к тепловому воздействию окружающей среды, к повышенному давлению дыхательной газовой среды и к укачиванию.
Лекарственная форма окисленного глутатиона разрешена к использованию и оказывает иммуномодулирующее, гепатопротективное, гемопоэтическое действие, а также фармакологические действия, регулирующие окислительно-восстановительные процессы в организме [http://www.rlsnet.ru/th_index_id_10764.htm].
Из уровня техники также известно создание композитов окисленного глутатиона или его фармацевтически приемлемых солей с соединениями платины или палладия (в частности композит, состоящий из динатриевой соли окисленного глутатиона с cis-диаминодихлорплатиной), обеспечивающих регуляцию эндогенной продукции цитокинов и/или гемопоэтических факторов, а также процессов метаболизма, пролиферации, дифференцировки и апоптоза нормальных и трансформированных клеток и применяемых для лечения онкологических, инфекционных, иммунологических, гематологических, ишемических, нейродистрофических, метаболических заболеваний [патент RU 2144374 С1, опубл. 20.01.2000; патент RU 2153350 С1, опубл. 27.07.2000; патент US 6312734 В1, опубл. 06.11.2001].
Кроме того, известны комбинированные средства на основе дисульфида глутатиона.
Так, в документе [заявка на патент WO 1998030228 А1, опубл. 16.07.1998] раскрывается применение окисленного глутатиона (GSSG) одного или в комбинации с восстановленной формой глутатиона (GSH), или в комбинации с аскорбат-2-фосфатом, или в комбинации с N-ацетил-L-цистеионом для лечения вирусных инфекций гриппа.
В патенте RU 2482868 С1, опубл. 27.05.2013] описывается комбинация дисульфида глутатиона (GSSG) в виде динатриевой соли с липоевой кислотой, в виде натриевой соли и координационными соединениями, образованными палладием, медью и восстановленным глутатионом (GSH), которая обладает гипогликемизирующей, гипохолестеринемической, гиполипидемической и/или антиоксидантной активностью.
Наиболее близким аналогом является фармацевтическая композиция, представляющая собой лекарственное средство, раскрытая в патенте RU 2153351 С2, опубл. 27.07.2000, содержащая окисленный глутатион GSSG и его фармацевтически приемлемые соли в комбинации с пролонгатором, регулирующая эндогенную продукцию цитокинов и гемопоэтических факторов. В качестве пролонгаторов действия окисленного глутатиона используются аскорбиновая кислота, диметилсульфоксид, инозин(гипоксантин-9-D-рибофуранозид), цистамин(2,2'-дитиобис[этиламин]), соединения платины (например, платина-хлорид).
Недостатком указанного известного лекарственного средства, равно и всех перечисленных выше средств, является ограниченное применение в медицине, обусловленное рядом факторов. В частности, GSSG характеризуется очень коротким периодом полураспада в пределах 5-10 секунд после введения, что требует определенной подготовки и соответствующей квалификации медицинского персонала для определения точного места введения для получения искомого терапевтического эффекта препарата либо увеличения дозы и кратности введения. Частично задача решается использованием большого числа пролонгирующих соединений, как указано в RU 2153351, однако это повышает потенциальную опасность средства для пациента и требует тщательного подбора в комбинации GSSG и пролонгирующего агента. В сочетанном или последовательном применении комбинации GSSG и пролонгирующего агента в комплексной терапии с другими лекарственными средствами, дополнительно требуется учитывать схожесть фармакокинетики для получения ожидаемого терапевтического эффекта и отсутствие негативных изменений в профиле токсичности проводимой терапии. Создание комбинации GSSG и какого-либо пролонгирующего агента требует использования дополнительного технологического оборудования, введение дополнительного этапа или этапов в производстве лекарственной субстанции и соответствующей лекарственной формы, расширения перечня вспомогательных веществ. Несмотря на существующие ограничения в использовании препарата на основе окисленного глутатиона, GSSG, представляет несомненный интерес для фармакологических решений, что связано с его биологической активностью, особенностью обмена при патологически процессах, негативно влияющих на терапевтическую эффективность лекарственных средств, что снижает эффективность и безопасность терапии.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Задачей настоящего изобретения является разработка новой фармацевтической композиции, обладающей высокой эффективностью и потенцирующей активностью в отношении фармакологически активных молекул из различных фармакотерапевтических групп. В частности, задачей является оптимизация фармакодинамики и, в конечном счете, фармакодинамики GSSG для того, чтобы стало возможным использование меньших доз для получения необходимого терапевтического эффекта при его введении пациенту в этом нуждающемуся, ингаляционно, энтерально, парентерально, при наружном применении как самостоятельно, так и в сочетании с другими фармакологически активными веществами в составе единой лекарственной формы. Фармакологически активное вещество может быть выбрано из любой фармакотерапевтической группы, включая антимикробные и противовирусные препараты, антикоагулянты, ингибиторы фактора Ха; модуляторы активности ионных каналов клеточной мембраны; иные лекарственные средства для которых будет достигнута оптимизация фармакодинамики и/или фармакокинетики и/или снижение токсичности.
Как фармацевтическая композиция, так и фармацевтическая комбинация могут применяться в виде лекарственного средства, включающего дополнительно эксципиенты.
Техническим результатом данного изобретения является снижение разовой или курсовой дозы и, таким образом, снижение дозозависимой токсичности при принятой терапевтической дозе фармакологически активного вещества; усиление эффективности терапевтически активных агентов из различных фармакотерапевтических групп, соответственно снижение их разовой или курсовой дозы и, таким образом, снижение дозозависимой токсичности.
Указанный технический результат достигается за счет создания новой фармацевтической композиции, представляющей собой лекарственное средство, содержащее комбинацию дисульфида глутатиона (GSSG) или его фармацевтически приемлемой органической или неорганической соли и глутатион дисульфид S-оксида (GS(O)SG) или его фармацевтически приемлемой органической или неорганической соли, взятых в терапевтически эффективных количествах, совместно с фармацевтически приемлемыми эксципиентами и фармакологически активными молекулами из какой либо фармакотерапевтической группы, в отношении которых установлено снижение разовой или курсовой дозы и, соответственно, снижение дозозависимой токсичности.
Обычно фармакологически активное соединение выбирают из следующих фармакотерапевтических групп:
- антикоагулянты, ингибиторы фактора Ха, в частности амидин гидрохлорид;
- антимикробные и противовирусные препараты, в частности моксифлоксацин, антигенный материал антирабической вакцины, интерферона;
- модуляторы активности кальциевых каналов клеточной мембраны, в частности нифедипин; для которых будет достигнута оптимизация фармакодинамики и/или фармакокинетики и/или снижение токсичности.
Обычно количество глутатион дисульфид S-оксида составляет 0,01-10 мас. % от массы всей композиции.
Также композиция может дополнительно содержать d-металл (Me), предпочтительно платиновой группы, еще более предпочтительно платину, представленный в виде координационного(-ых) соединений, содержащих связь Me-S-глутатион.
Количество вводимого в композицию d-металла в составе координационного соединения не превышает физиологически допустимых значений для данного d-металла. Однако это значение может быть превышено в случае, когда для достижения терапевтического эффекта требуются большие количества металла, вводимого в составе координационного соединения.
Количество d-металла в композиции варьируется от 1⋅10-10 моль до 1⋅10-3 моль на 1 кг композиции. Предпочтительно 1⋅10-5 моль на 1 кг композиции.
Предлагаемая композиция может быть изготовлена в форме для наружного, ингаляционного, энтерального или парентерального введения.
Характеристика компонентов
Дисульфид глутатиона (или окисленный глутатион, GSSG) - димер трипептида глутатиона, γ-глутамилцистеинилглицина, в котором две молекулы указанного трипептида соединены друг с другом ковалентной дисульфидной связью между цистеиновыми остатками. В соответствии с настоящим изобретением дисульфид глутатиона в виде соли со щелочным или щелочеземельным металлом может быть получен любым известным из уровня техники способом [патент RU 2144374 С1, опубл. 20.01.2000].
Глутатион дисульфид S-оксида (также называемый глутатион тиосульфинат, или GS(O)SG) или сульфон, имеет следующее строение:
.
Глутатион дисульфид S-оксид характеризуется подобной окисленному глутатиону фармакокинетикой, и при этом является негативным регулятором ферментов распада окисленного глутатиона, таким образом, выступает как пролонгирующий агент GSSG, оптимизируя его фармакокинетику, потенцирует биологические эффекты окисленного глутатиона, что оптимизирует фармакодинамику GSSG и делает возможным использование меньших доз GSSG для получения необходимого терапевтического эффекта. Переход на более низкие уровни является одним из ключевых условий снижения токсичности действующего начала лекарственного средства. Таким образом, глутатион дисульфид S-оксид оптимизирует фармакокинетику, фармакодинамику, повышает безопасность использования GSSG, что в совокупности является условием оптимизации фармакоэкономических критериев при использовании комбинации глутатион дисульфид S-оксида и GSSG в терапевтической практике в сравнении с GSSG.
Молекулы дисульфида глутатиона и глутатион дисульфид S-оксида способны образовывать слабые межмолекулярные взаимодействия, такие как Ван-дер-Ваальсовы взаимодействия, с действующим началом лекарственных препаратов, оптимизируя их терапевтические свойства посредством влияния на фармакокинетику и/или фармакодинамику и/или токсичность.
«Координационные соединения» подразумевают соединения, содержащие группу ионов или нейтральных молекул, называемых лигандами, в определенном порядке размещенных (координированных) вокруг центрального атома (иона), называемого комплексообразователем
«d-металлы», «переходные металлы» и «переходные элементы» тождественны, и относятся к химическим элементам периодической системы, у которых происходит заполнение электронами d- подуровней.
«Фармацевтически приемлемые эксципиенты» представляют собой вещества, известные специалисту в данной области техники и подходящие для создания лекарственного средства, включающего предлагаемую в настоящем изобретении композицию, в форме для наружного, ингаляционного, энтерального, парентерального или др. введения. Например, в качестве эксципиентов могут использоваться любые известные фармацевтически приемлемые неорганические или органические носители, консерванты, солюбилизаторы, стабилизаторы, смачивающие вещества, эмульгаторы, подсластители, красители, корригенты, соли для регулирования осмотического давления, буферы, маскирующие агенты или антиоксиданты и другие необходимые компоненты.
«Фармацевтически приемлемые» подразумеваются соединения, которые не вызывают токсических или иных нежелательных эффектов при введении в организм пациента.
«Терапевтически эффективный агент» подразумевает любое вещество, которое используется с терапевтическими целями.
«Пациент» обозначает человек или другое млекопитающее, птицы, земноводные или рыбы, в организм которых тем или иным способом вводится композиция или ее комбинация с известным фармакологически активным соединением в частности, ингибитором фактора Ха - амидина гидрохлоридом; антимикробным препаратом - моксифлоксацином, антигенным материалом противовирусной антирабической вакцины, противовирусным средством - интерферономα; ингибитором кальциевых каналов - нифедипином.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг. 1 - Электрофореграмма препарата моноклонального антитела, растворенного в различных растворах, хранившихся при температуре 37°C. Дорожка 1 - стандарты размеров (Fermentas PageRuler™ Prestained Protein Ladder); дорожка 2 - образец 2; дорожка 3 - образец 3, дорожка 4 - образец 4, дорожка 5 - образец 1.
Фиг. 2 - Данные ВЭЖХ о структурных интермедиатах моноклонального антитела, возникающих при хранении в образцах сыворотки крови в условиях, имитирующих физиологические ((1) - образец 1; (2) - образец 2; (3) - образец 3; (4) - образец 4).
Фиг. 3 - Средние значения MHO (1) - для субстанции амидина гидрохлорида, полученные из таблицы 1, и (2) - для смеси субстанции амидина гидрохлорида с адьювантом, полученные из таблицы 2 (адъювант - композиция, включающая комбинацию дисульфид глутатиона и глутатион дисульфид S-оксида).
Фиг. 4 - Са2+ - сигналы, индуцированные АТФ (1), (3) и тапсигаргином (2), (4) в перитонеальных макрофагах в среде, содержащей ионы Са2+ (1), (2) и в бескальциевой среде (3), (4). По вертикали - концентрация Са2+ в цитозоле, нМ. По горизонтали - время в минутах
Фиг. 5 - Влияние дисульфида глутатиона на [Са2+]i в покое и Са2+-сигналы, индуцированные 200 мкМ АТФ (1, 2) и 0,5 мкМ тапсигаргина (ТГ) (3) в макрофагах, находящихся в нормальном физиологическом растворе (1) или в номинально бескальциевой среде (2), (3).
Фиг. 6 - Влияние композиции (препарата) по примеру 3 на внутриклеточную концентрацию кальция [Са2+]i в покое и Са2+-сигналы, вызванные АТФ. Препарат отменяет ингибирующий эффект селективного ингибитора кальциевых каналов - нифедипина (1), эффект самого препарата подавляется восстанавливающим агентом дитиотреитолом (ДТТ) (2).
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение поясняется конкретными примерами осуществления изобретения, которые носят иллюстрирующий характер и никоим образом не ограничивают объем заявленных притязаний.
Сокращения:
GSH - глутатион (восстановленный глутатион);
GSSG - окисленный глутатион (дисульфид глутатиона);
GSO3H - глутатионсульфоновая кислота;
GS(O)SG - глутатион дисульфид S-оксида или сульфон;
GS(O2)SG - глутатион дисульфид S-диоксида.
HPLC (ВЭЖК) - высокоэффективная жидкостная хромотография;
ПААГ - полиакриламидный гель;
SDS (ДСН) - додецилсульфат натрия.
Способы получения композиций
Способ А
К раствору натриевой соли дисульфида глутатиона, полученному из L-глутатиона (пример 2), добавляют синтезированный в соответствии с методикой (пример 1) глутатион дисульфид S-оксида. Количество глутатион дисульфид S-оксида может составлять 0.1-10 мас. % от массы всей композиции. В практическом воплощении, в частности примеры 3 и 4, количество глутатион дисульфид S-оксида составило 2% и 4% соответственно, от массы всей композиции. Предлагаемый способ позволяет контролировать содержание глутатион дисульфид S-оксида с высокой точностью.
Способ В
К полученному раствору натриевой соли глутатион дисульфида в водном растворе гидроксида натрия добавляют избыток пероксида водорода при пониженной температуре, обычно 0-5°C с целью генерации глутатион дисульфид S-оксида in situ. В одном из воплощений (пример 5) при температуре не выше +3°C добавлено 127 г 6% пероксида водорода. Количество глутатион дисульфид S-оксида составило 5% от массы всей композиции.
Композиция, полученная способом А или В, характеризуется способностью влиять на образование и стабильность дисульфидной связи в белках (примеры 5 и 12), а значит и на фолдинг белка, что позволяет формировать и стабилизировать нативную конформацию белка, т.е. конформацию, в которой белок обладает функциональной активностью, в частности на конформацию лекарственного препарата, представленного белковым продуктом моноклональным антителом, состоящим из двух тяжелых и двух легких пептидных цепей, объединенных посредством дисульфидных связей в функционально активную молекулу, обладающую терапевтической активностью (пример 5).
Композиция, полученная способом А или В, характеризуется способностью повышать экспрессию ферментов второй фазы детоксикации ксенобиотиков (пример 13), что позволяет использовать ее самостоятельно как токсикомодифицирующее средство, т.е. средство снижающее токсическое действие различных химических молекул, включая комплекс дозозависимых побочных токсических реакций при введении фармакотерапевтических средств.
Композиция, полученная способом А или В может быть использована в комбинации для изготовления лекарственных средств в сочетании с другими известными, фармакологически активными и терапевтически востребованными молекулами: в частности, антикоагулянтом, ингибитором фактора Ха - амидином гидрохлоридом (пример 8); антибиотиком - моксифлоксацином; противовирусными средствами антигенным материалом антирабической вакцины и интерферономα (примеры 9, 10, 14); ингибитором кальциевых каналов - нифедипином (пример 11), в отношении которых установлено снижение дозы и, соответственно, снижение дозозависимой токсичности.
Пример 1. Способ получения глутатион дисульфид S-оксида (сульфон) (GS(O)SG).
К раствору 100 г субстанции L-глутатиона восстановленного (GSH) в 100 мл воды при перемешивании и охлаждении до 0-5°C прикапывают 150 мл 30% раствора надуксусной кислоты в уксусной кислоте в течение 30-40 минут. После окончания прикапывания реакционную массу перемешивают при температуре не выше 5°C в течение 1 часа, после чего замораживают и лиофилизуют в течение 24 часов. Получают 110 г вещества в виде белой пены, согласно данным ВЭЖХ, содержащего смесь компонентов (40% GSO3H, 55% GS(O)SG, 5% GS(O2)SG).
Лиофилизат растворяют в 400 мл воды и проводят очистку с использованием препаративной ВЭЖХ (колонна YMC-Actus Triart Prep C18-S 50×250 мм, элюент - вода), фракции, содержащие целевое соединение с чистотой выше 95% объединяют, упаривают до объема 700 мл и лиофилизуют. Получают 42 г целевого соединения - глутатион дисульфид S-оксида (в виде смеси диастереомеров) с чистотой 95+% (HPLC).
Пример 2. Получение окисленного глутатиона (дисульфид глутатиона).
К суспензии 2760 г L-глутатиона восстановленного в 7 л воды добавляют при перемешивании 2245 г 16% раствора гидроксида натрия при температуре не выше 17°C. После полного растворения глутатиона смесь охлаждают и добавляют при перемешивании со скоростью 30-50 мл/мин 2546 г 6% пероксида водорода при температуре реакционной массы не выше +15°C. По окончании добавления пероксида полученный раствор перемешивают при заданной температуре еще 1 час. По окончании реакции (HPLC контроль) получают раствор с содержанием 2,95 кг натриевой соли дисульфида глутатиона в 11,5 л воды, который охлаждают до 3°C. Химическая чистота продукта - натриевой соли дисульфида глутатиона более 98,5% (HPLC контроль), что не требует дополнительных процедур выделения продукта.
Пример 3. Получение композиции (лекарственного средства) дисульфид глутатиона с заданным содержанием глутатион дисульфид S-оксида.
К полученной в примере 2 натриевой соли дисульфида глутатиона (2,95 кг в 11,5 л воды) при температуре 3-5°С добавляют 60 г глутатион дисульфид S-оксида, полученного в соответствии с примером 1, тщательно перемешивают в течение 5 минут, раствор оставляют на 120 мин при температуре 5°C, после чего лиофилизуют.
Пример 4. Получение композиции (лекарственного средства) дисульфид глутатиона с заданным содержанием глутатион дисульфид S-оксида.
К полученной в примере 2 натриевой соли дисульфида глутатиона (2,95 кг в 11,5 л воды) добавляют 120 г глутатион дисульфид S-оксида, полученного в соответствии с примером 1 тщательно перемешивают в течение 5 минут, раствор оставляют на 120 мин при температуре 5°С, после чего лиофилизуют.
Пример 5. Получение композиции натриевой соли дисульфид глутатиона с заданным содержанием глутатион дисульфид S-оксида
К суспензии 2760 г L-глутатиона восстановленного в 7 л воды добавляют при перемешивании 2245 г 16% раствора гидроксида натрия при температуре не выше 17°C. После полного растворения глутатиона смесь охлаждают и добавляют при перемешивании со скоростью 30-50 мл/мин 2546 г 6% пероксида водорода при температуре реакционной массы не выше +15°C. По окончании добавления пероксида полученный раствор перемешивают при заданной температуре еще 1 час. По окончании реакции (HPLC контроль) реакционную массу охлаждают до 3°C. Химическая чистота продукта - натриевой соли дисульфида глутатиона более 98,5% (HPLC контроль)
Затем при температуре не выше +3°C добавляют еще 127 г 6% пероксида водорода со скоростью 30-50 мл/мин. Выдерживают реакционную массу 1 час при температуре +3°C и лиофилизуют.
Полученная композиция содержит 95% натриевой соли дисульфида глутатиона и 4,5-5,0% натриевой соли глутатион дисульфид S-оксида (HPLC контроль), что не требует дополнительных процедур очистки продукта.
Пример 6. Получение композиции дисульфид глутатиона с заданным содержанием глутатион дисульфид S-оксида и Pt-S.
К суспензии 2760 г L-глутатиона восстановленного в 7 л воды добавляют при перемешивании 2245 г 16% раствора гидроксида натрия при температуре не выше 17°C. После полного растворения глутатиона смесь охлаждают, вносят 0,5 г цис-платины и добавляют при перемешивании со скоростью 30-50 мл/мин 2546 г 6% пероксида водорода при температуре реакционной массы не выше +15°C. По окончании добавления пероксида полученный раствор перемешивают при заданной температуре еще 1 час. По окончании реакции (HPLC контроль) получают раствор с содержанием натриевой соли дисульфида глутатиона 2,95 кг в 11,5 л воды, который охлаждают до 3°C. Химическая чистота продукта - натриевой соли дисульфида глутатиона более 98,5% (HPLC контроль), что не требует дополнительных процедур выделения продукта. Раствор охлаждают до 3°C и добавляют 60 г глутатион дисульфид S-оксида, тщательно перемешивают в течение 5 минут, раствор оставляют на 120 мин при температуре 5°С, после чего лиофилизуют.
Пример 7. Анализ фолдирующей активности композиции, полученной по примеру 5.
Состав препарата моноклонального антитела:
моноклональное антитело - 10 мг/мл
глицин - 2 мг/мл;
полисорбат 80 - 0,05 мг/мл;
натрия хлорид - 7 мг/мл;
лимонной кислоты моногидрат - 2,101 мг/мл;
вода для инъекций.
Для воспроизведения физиологических условий использовалась сыворотка крови человека, полученная с письменного добровольного согласия. Номер сыворотки в банке хранения сывороток O-17-1002.
В эксперименте по рефолдингу использовались:
Образец 1 - состав препарата моноклонального антитела в количестве 50 мкл + 1 мл сыворотки O-17-1002.
Образец 2 - состав препарата моноклонального антитела + 0,2 мМ композиции, полученной по примеру 3 в количестве 50 мкл + 1 мл сыворотки O-17-1002.
Образец 3 - состав препарата моноклонального антитела + 0,2 мМ композиции, полученной по примеру 4 в количестве 50 мкл + 1 мл сыворотки О-17-1002.
Образец 4 - состав препарата моноклонального антитела + 0,2 мМ композиции, полученной по примеру 5 в количестве 50 мкл + 1 мл сыворотки O-17-1002.
Флаконы с образцами 1 и 2 помещают на хранение при температуре 37°C. Через 24 часа флаконы извлекают из термостатов и подвергают анализу на стабильность моноклонального антитела в процессе хранения при разных температурах в условиях имитации физиологической среды человеческого организма.
Результаты исследования стабильности вначале анализируют методом электрофоретического разделения в полиакриламидном геле (ПААГ) в восстанавливающих условиях.
Электрофорез проводят в 15%-ном ПААГ в денатурирующих условиях в неоднородной (ступенчатой) буферной системе (диск-электрофорез) с использованием на стадии концентрирования образца механизма изотахофореза (ИТФ). Образцы готовят следующим способом: осаждают клетки центрифугированием и ресуспензируют в 200 мкл буфера (0,2М трис-HCl рН 7,5; 0,2М NaCl; 0,01 М ацетат натрия; 0,01 М b-меркаптоэтанол и 5% - глицерин), после чего кипятят две минуты.
Для проведения электрофореза используют систему из нескольких буферных растворов: катодного буфера - Tris base 0,1 М; Tricine 0,1 М; SDS 0,1% (замыкающий анион - трицин); анодного буфера - Tris base 0,2 М рН 8,9 (ведущий анион - Сl-). Концентрирующий гель Т=2,5-3%, разделяющий гель с Т=5-15% и С=2-5% (где Т - относительное содержание мономеров в геле, С - содержание сшивающего агента в сумме мономеров). Электрофорез клеточных лизатов проводят в денатурирующих условиях в 2% SDS.
Электрофореграмма препаратов белков (фиг. 1) была проанализирована с помощью программы ImageJ. Программа предназначена для денситометрического анализа данных различных экспериментов. В ручном режиме были размечены дорожки, затем отмечены полосы, соответствующие белкам, в рамках каждой из дорожек. Программа оценивает плотность каждой из полос за вычетом фона, что позволяет рассчитать чистоту целевого белка.
Условия ВЭЖХ для изучения структурных интермедиатов моноклонального антитела, возникающих при хранении в условиях, имитирующих физиологические.
Хроматограф Shimadzu LC-20 «Prominence»
Колонка Phenomenex «Jupiter» С18, 5 кмк, 300А, 250×4,6
Детекция при длине волны = 210 нм
Объем инъекции = 25 мкл
Скорость потока = 1.0 мл/мин
Температура колонки = 35°C
Температура ячейки детектора = 35°C
Подвижная фаза:
Элюэнт А. 30% ацетонитрил + 0,1% трифторуксусная кислота в воде
Элюэнт В. 70% ацетонитрил + 0,1% трифторуксусная кислота в воде
Время анализа = 47 мин.
Градиентная программа:
| 0-1 мин | 44% ацетонитрила |
| 1-5 мин | 48% ацетонитрила |
| 5-20 мин | 50% ацетонитрила |
| 20-30 мин | 53,4% ацетонитрила |
| 30-35 мин | 60% ацетонитрила |
| 35-37 мин | 60% ацетонитрила |
| 37-40 мин | 44% ацетонитрила |
| 40-47 мин | 44% ацетонитрила |
Полученные данные представлены на фиг. 2, которые свидетельствуют о том, что в образцах сыворотки крови, содержащих композиции, полученные по примерам 3, 4, 5 (соответственно фиг. 2 (2), фиг. 2 (3), фиг. 2 (4)), в отличие от образца, не содержащего указанные композиции (фиг. 2 (1)), отсутствует фракция моноклонального антитела с нарушенной структурой, которая неспособна распознавать ген.
Пример 8. Совместное применение композиции, содержащей дисульфид глутатиона и глутатион дисульфид S-оксид в комбинации с антикоагулянтом, ингибитором фактора Ха - амидином гидрохлоридом.
Исследуют способность композиции, полученной в соответствии с примером 3 настоящей заявки, усиливать терапевтическую эффективность фармакологически активного агента амидина гидрохлорида, который является антикоагулянтом, ингибитором фактора Ха. Тестируемую субстанцию амидина гидрохлорида (например, полученного в соответствии с примером 2 в патенте ЕА 015918 В1, опубл. 30.12.2011) или смесь субстанции амидина гидрохлорида с адъювантом (адъювант - композиция, полученная в примере 3 настоящей заявки) вводят внутривенно с помощью инсулинового шприца с иглой 30G объемом 1 мл в боковую хвостовую вену в области 1/3 ближе к основанию хвоста. Индивидуальный объем вводимой дозы для каждого животного рассчитывают, исходя из значения массы тела, и корректируют после каждого взвешивания. Введение веществ - однократное. Для внутривенного введения животным смеси субстанции амидина гидрохлорида с адъювантом готовят указанные смеси. Для этого субстанцию амидина гидрохлорида и адъювант растворяют в дистиллированной воде отдельно, а затем растворы смешивают. Раствор готовят непосредственно перед введением животным и вводят не позднее, чем через 10 минут после приготовления. Объем доз для крыс составил 0,31-0,42 мл.
Отбор крови осуществляют без наркоза из боковой хвостовой вены выше места внутривенного введения (от 1/3 до 2/3 длины хвоста), предварительно прогревая хвост крысы в течение как минимум 15 минут в водяной бане с температурой 43°C. Кровь объемом 0,36 мл отбирают иглой размером 23G в пластиковые пробирки (типа «Эппендорф»), содержащие 0,04 мл 0,11 М раствора цитрата натрия до объема 0,4 мл, таким образом, чтобы отношение раствора цитрата натрия к крови составляло 1:9. В течение 30 минут после взятия, для получения бедной тромбоцитами плазмы кровь центрифугируют 10 мин при 8000 об/мин (7000 g), плазму переносят в другую пробирку и повторно центрифугируют 10 мин при 12000 об/мин (15000 g) при 20°C. Полученную плазму в объеме 110 мкл разливают в пластиковые пробирки (типа «Эппендорф») и замораживают при -20°C. Забор осуществляют 6 раз у одной крысы.
В экспериментах использовался водорастворимый, лиофильно высушенный тромбопластин с добавлением ионов кальция, аттестованный по Международному индексу чувствительности (МИЧ) - Ренампластин (НПО «РЕНАМ»).
Принцип метода: при добавлении к цитратной плазме избытка тканевого тромбопластина и ионов кальция время образования сгустка фибрина зависело только от активности факторов внешнего и общего пути свертывания: факторы I, II, V, VII, X. Измеряют время от момента добавления к плазме тромбопластина с кальцием до момента образования фибринового сгустка.
Проведение анализа: вносят во флакон с лиофильно высушенным ренампластином 8 мл дистиллированной воды и растворяют при покачивании. Перед проведением анализа реагент прогревают при 37°C в течение 30 мин. Вносят в кювету анализатора цитратную плазму объемом 50 мкл, инкубируют при 37°C точно 1-2 минуты. Затем вносят ренампластин 100 мкл и фиксируют время свертывания в секундах на коагулогическом анализаторе Merlin МС 1 компании ABW Medizin und Technik GmbH.
Полученные результаты выражают в Международном Нормализованном Отношении (MHO):
MHO = ПОМИЧ,
где МИЧ - Международный Индекс Чувствительности Ренампластина, который должен быть указан в прилагаемом паспорте. ПО - протромбиновое отношение:
ПО=ПВБ/ ПВ100%,
где ПВБ - протромбиновое время плазмы исследуемого образца в секундах, ПВ100% - усредненное протромбиновое время для образцов, полученных перед введением субстанции для данного животного.
Результаты измерения значений исследованных показателей были усреднены по экспериментальным группам и представлены в виде М±m, где М - среднее по группе, m - стандартное отклонение. Достоверность различий между группами определяют с помощью параметрического t-критерия Стьюдента при р<0,05 при нормальном распределении выборки и непараметрического U-критерий Манна-Уитни при р<0,05 при ненормальном распределении.
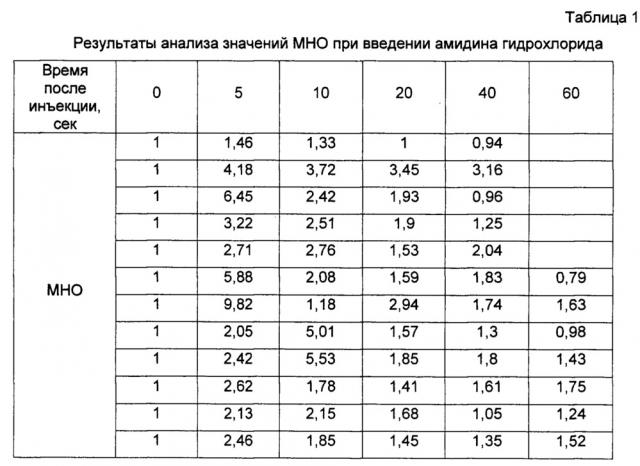
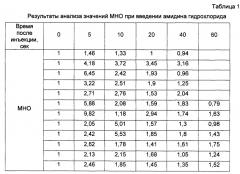
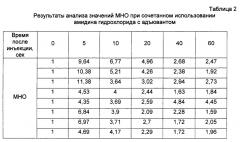
Полученные результаты представлены в таблицах 1 и 2 и на фиг. 3. В таблице 1 и на фиг. 3 (1) приведены данные, полученные для отдельно взятой субстанции амидина гидрохлорида, а в таблице 2 и на фиг. 3 (2) представлены данные, полученные для смеси субстанции амидина гидрохлорида с адъювантом.
Полученные результаты демонстрируют способность предлагаемых в настоящем изобретении композиций усиливать эффективность других терапевтически активных агентов.
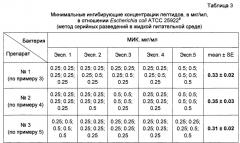
Пример 9. Исследование антимикробной активности комбинации, включающей моксифлоксацин в сочетании с композицией дисульфида глутатиона и глутатион дисульфид S-оксида.
Исследовали препараты, полученные в соответствии с примерами 3, 4, 5 настоящей заявки.
Антимикробную активность препаратов изучали в отношении грамотрицательных: Escherichia coli АТСС 25923, Pseudomonas aeruginosa АТСС 27853, клинический изолят - Acinetobacter baumannii и грамположительных бактерий: Listeria monocytogenes EGD (АТСС ВАА-679), Staphylococcus aureus АТСС 25922, MRSA АТСС 33591 - золотистый стафилококк, устойчивый к метициллину.
Микроорганизмы культивируют в течение ночи (16-18 часов) в 2,1% бульоне Мюллера-Хинтон М391 (Oxoid, Германия) при 37°C с непрерывным перемешиванием на шейкере. Затем из ночной культуры отбирают аликвоты суспензии бактерий и переносят в 15 мл свежего стерильного 2,1% бульона Мюллера-Хинтон, после чего инкубируют при 37°C на шейкере в течение 2,5-3 часов. После этого измеряют оптическую плотность (OD) полученной суспензии на спектрофотометре DU-50 (Beckman, США) при длине волны 620 нм против стерильного 2,1% бульона Мюллера-Хинтон и определяют количество колониеобразующих единиц в мл (КОЕ) по формуле: 1×OD620=2.5×108 КОЕ/мл [Protocols in antimicrobial peptides. W. Shafer Ed. Springer-Verlag New York, LLC, 7/8/1997]. Исходя из этого расчета, разводят суспензии бактерий стерильным 2,1% бульоном Мюллера-Хинтон до концентрации 1⋅105 КОЕ/мл.
Используют 96-луночные стерильные планшеты с U-образным дном (Sarstedt, Германия). Готовят двукратные серийные разведения исследуемых препаратов в среде Мюллера-Хинтон (по 8 разведений для каждого препарата в объеме 50 мкл/пробу). Далее в лунки планшетов, вносят по 50 мкл суспензии бактерий (конечная концентрация бактерии в пробах составляла 0,5⋅105 КОЕ/мл). Для каждого разведения препарата готовят по пять параллельных проб.
Планшеты с пробами инкубируют в термостате при 37°C в течение 18 часов.
Регистрацию результатов производят на следующий день. За минимальную ингибирующую концентрацию (МИК) принимают наименьшую концентрацию вещества, при которой визуально не наблюдается (полностью ингибируется) рост микроорганизмов в соответствующих лунках планшета. Окончательные результаты рассчитывают на основании данных 5 независимых экспериментов, в каждом из которых имелось по 5 параллельных проб для каждого разведения каждого из исследованных образцов.
Антимикробную активность (АМА) препаратов определяют также методом радиальной диффуз