Способ получения сложного оксида тулия и железа tmfe2o4±δ
Иллюстрации
Показать всеИзобретение относится к технологии получения сложных оксидов и может быть использовано для создания многофункциональных устройств в микроэлектронике. Способ получения сложного оксида тулия и железа TmFe2O4±δ включает приготовление смеси из оксида железа(III) и оксида тулия(III) и ее обжиг. Исходные оксиды предварительно сушат при температуре 550°C и смешивают в соотношении Fe2O3 : Tm2O3 = 1,00:0,47. Обжиг приготовленной смеси ведут при температуре 1090°C в газовой среде, состоящей из инертного газа и кислорода, при поддержании заданного значения давления кислорода в диапазоне lgPo2(атм)=(-12,3)÷(-13,1). Изобретение позволяет получить однофазный оксид тулия и железа, контролировать кислородную нестехиометрию получаемого сложного оксида. 1 з.п. ф-лы, 3 ил.
Реферат
Изобретение относится к технологии получения сложных оксидов, обладающих богатыми функциональными свойствами - сегнетоэлектрическими, ферримагнитными, высокой способностью к поглощению инфракрасного спектра излучения. Эти свойства обусловлены наличием катионов железа смешанной валентности - Fe+2 и Fe+3. Присутствие металлических катионов одного и того же элемента различной валентности определяет необычные свойства материалов, что дает возможность использования их в области многофункциональных устройств в микроэлектронике.
Известен способ получения сложных оксидов металлов VB группы периодической системы элементов Д.И. Менделеева, в котором оксид металла VB группы, например V2O5, Nb2O5 или Ta2O5, перемешивают с оксалатом щелочного металла, например Na2C2O4. Смесь помещают в платиновый тигель и нагревают в печи в вакууме 10-2-10-3 мм рт.ст. до 625-650°C 8-9 ч, затем полученный продукт охлаждают вместе с печью. Результатом является получение однофазных сложных оксидов металлов VB группы различного состава, например Na0,83V2O5, Na0,7V2O5, Na2Nb8O21, Na2Ta4O11, с содержанием металла VB группы в различных степенях окисления, например соотношение V4+/V5+составляет 0,319-0,326, Nb4+/Nb5+ - 0,01 (Патент РФ №2209769 МПК C01G 31/02, оп. 10.08.2003).
Недостатком способа является достаточно высокое давление кислорода при обжиге исходных компонентов и низкие температуры синтеза, при которых невозможно получение сложных оксидов железа и лантаноидов, например тулия.
Известен способ получения сложного оксида железа и церия, включающий приготовление смеси порошков из оксида железа(III) и оксида церия(IV), предварительно просушенных при 1000°C, обжиг полученной смеси при температуре 1000-1200°C в газовой смеси, содержащей CO2 и СО или CO2 и O2 при поддержании давления кислорода в смеси lgPo2(атм)=(-7,25)÷(-15,68) с получением сложного оксида CeFeO3 (Kitayama К., NojiriK., SugiharaT., KatsuraT. Phasee quilibriainthe Ce-O and Ce-Fe-Osystems // J. Of Solid State Chemistry. 1985. V. 56. P. 1-11).
Недостатком способа для получения по указанным условиям сложного оксида тулия и железа является применение в качестве газовой среды смеси, содержащей CO2 и СО или CO2 и O2, что может приводить к образованию посторонних фаз - карбидов и оксикарбонатов, а также присутствию в получаемых сложных оксидах окисленных фаз (Fe3O4 и TmFeO3) при высоком содержании кислорода в газовой смеси.
Наиболее близким по совокупности существенных признаков является способ получения сложных оксидов RFe2O4 (R=Tm, Yb, Lu) твердофазным методом. Технология включает 2 этапа, вначале смешивают стехиометрические количества оксидов R2O3 и Fe2O3, прессуют и нагревают до температуры 1200°C на воздухе, в течение 12 ч. На следующем этапе образцы растирают, прессуют в таблетки и проводят обжиг в атмосфере СО/CO2 в соотношении 2/3, также в течение 12 ч. Результатом является получение однофазных сложных оксидов (Blasco J., Lafuerza S., Garcia J., Subias G. Structural properties in RFe2O4 compounds (R=Tm, Yb, and Lu) // Physical Review B. 2014. V. 90. 094119).
Недостатком способа для получения по указанным условиям сложного оксида тулия и железа является высокая температура синтеза, многостадийность и длительность процесса, при невозможности контроля кислородной нестехиометрии получаемого сложного оксида.
Техническим результатом предлагаемого способа является повышение качества получаемого сложного оксида TmFe2O4±δ с заданным значением кислородного индекса.
Указанный технический результат достигается тем, что в способе получения сложного оксида тулия и железа TmFe2O4±δ, включающем приготовление смеси из оксидов железа(III) и лантаноида, обжиг полученной смеси в газовой среде, согласно изобретению в качестве оксида лантаноида используют оксид тулия(III), исходные оксиды предварительно сушат при температуре 550°C и смешивают в соотношении Fe2O3:Tm2O3=1,00:0,47, а обжиг приготовленной смеси ведут при температуре 1090°C в газовой среде, состоящей из инертного газа и кислорода, при поддержании заданного значения давления кислорода в диапазоне lgPo2(атм)=(-12,3)÷(-13,1).
Этот способ синтеза исключает любое другое взаимодействия компонентов газовой смеси с образцом, кроме кислородного обмена.
При этом в качестве газовой среды используют смесь из инертного газа, выбранного из группы, содержащей аргон, азот, и кислорода.
Проведение сушки оксидов тулия(III) и железа(III) при 550°C перед их смешиванием дополнительно обеспечивает удаление влаги из смеси оксидов, что приводит к сокращению времени, предназначенного для удаления излишков кислорода из смеси, и приведение ее в равновесие с газовой фазой.
Наличие в соединении TmFe2O4±δ катионов железа в двух степенях окисления Fe3+ и Fe2+ обусловливает для его получения проведение обжига при поддержании определенного значения кислорода в газовой смеси, состоящей из инертного газа и кислорода, в заданной пропорции. Это позволяет создать в сложном оксиде требуемое соотношение Fe2+/Fe3+ и получать образцы с варьированием величины кислородного индекса, что обеспечивает специфические служебные свойства соединения.
Предлагаемый способ осуществляют следующим образом.
Просушенные исходные оксиды тулия(III) и железа(III), взятые в следующей пропорции 1,00:0,47, смешивали и подвергали обжигу при температуре 1090°C в газовой среде, состоящей из инертного газа (аргона или азота) и кислорода, при поддержании заданного значения давления кислорода в смеси. Использование для синтеза TmFe2O4±δ смеси исходных оксидов в стехиометрической пропорции (Fe2O3:Tm2O3=1,00:0,50) приводит к получению TmFe2O4±δ и незначительного количества примеси в виде оксида тулия. Корректировка состава шихты до соотношения Fe2O3:Tm2O3=1,00:0,47 позволяет получить однофазный продукт TmFe2O4±δ.
Заявленный способ испытан в лабораторных условиях.
Расчет навесок компонентов смеси (исходных оксидов Tm2O3 и Fe2O3) для получения готового продукта планируемой массы 3 г проведен по формуле (1)
где mк - масса компонента (Tm2O3 или Fe2O3),
mп - масса продукта (TmFe2O4±δ),
k - коэффициент при компоненте,
Мк -молекулярная масса компонента,
Мп - молекулярная масса продукта.
Таким образом, масса навески Tm2O3 составила 1,57873 г, масса навески Fe2O3 - 1,39013 г.
Навески исходных оксидов тулия(III) и железа(III), просушенные при температуре 550°C до постоянной массы и взятые в указанной пропорции, смешивали и перетирали в течение часа в агатовой ступке. Из полученной смеси прессовали таблетки диаметром 10 мм на гидравлическом прессе при давлении 150 кПа/см2, которые подвергали обжигу в газовой среде, состоящей из аргона и кислорода, с контролируемым парциальным давлением кислорода при 1090°C в течение 36 часов.
Фазовый состав полученных образцов исследовался при помощи рентгенографического метода на дифрактометре Shimadzu XRD 7000С.
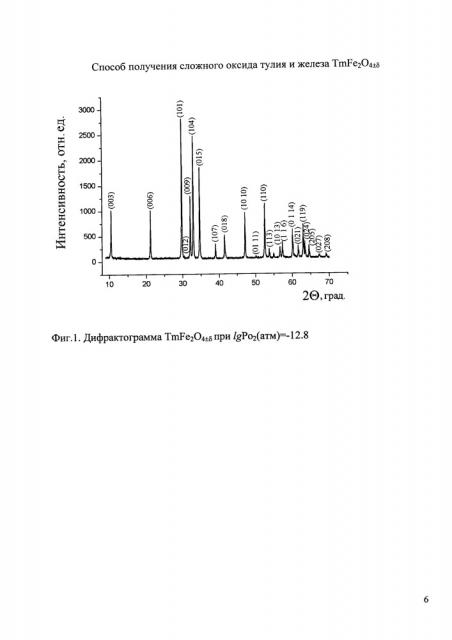
На фиг. 1 приведена дифрактограмма образца номинального состава TmFe2O4±δ, полученного в газовой смеси Ar+O2 (lgPo2(атм)=-12.8) при температуре 1090°C, на которой отсутствуют рефлексы посторонних фаз, т.е. данное давление кислорода в газовой фазе позволяет получать оксид TmFe2O4±δ в гомогенном состоянии, при этом δ=-0,009.
Предел стабильности фазы TmFe2O4±δ при температуре 1090°C ограничен значениями давлениями кислорода в интервале -12,3>lgPo2(атм)>-13,1. Дифрактограмма образца номинального состава TmFe2O4±δ, полученного в газовой смеси Ar+O2 при поддержании стабильного давления lgPo2(атм)=-12,3 (фиг. 2), показывает, что наряду с рефлексами основной фазы TmFe2O4±δ присутствуют рефлексы окисленных фаз (Fe3O4 и TmFeO3), т.е. определено равновесие на высококислородной границе области гомогенности TmFe2O4±δ, при этом δ=+0,024. В образце, синтезированном при поддержании стабильного давления lgPo2(атм)=-13,1 (фиг. 3), наряду с рефлексами основной фазы фиксируются рефлексы восстановленных фаз (Fe и Tm2O3), т.е. установлено равновесие на низкокислородной границе области гомогенности соединения TmFe2O4±δ, при этом δ=-0,084.