Способ получения высокотемпературных адсорбентов co2
Иллюстрации
Показать всеИзобретение относится к области получения высокотемпературных сорбентов диоксида углерода. Согласно способу активную фазу в виде цирконата или силиката лития формируют на поверхности носителя, представляющего собой карбид металла. Предварительно подвергнутый кислотному травлению носитель помещают в водные растворы нитратов Li и Zr или цитратного комплекса Li и гидрозоля Si (предшественников оксидов). Производят выпаривание раствора досуха при интенсивном перемешивании реакционной массы. Далее осуществляют прокаливание при 650°С в течение 6 часов. Технический результат заключается в получении сорбента, который при температуре 550°С характеризуется высокой динамической адсорбционной емкостью по СО2 (18,1-23,5% масс.) и повышенной скоростью адсорбции. Сорбент может быть полностью регенерирован в токе инертного газа при температуре до 700°С. 1 з.п. ф-лы, 3 ил., 1 табл., 6 пр.
Реферат
Изобретение относится к области химической промышленности и может быть использовано при получении высокотемпературных сорбентов СО2, и в частности при получении цирконатов и силикатов лития, нанесенных на различные носители, в т.ч. на карбиды различных металлов, такие как карбид кремния, ниобия или вольфрама.
Глобальное потребление энергии и связанные с ней выбросы углекислого газа непрерывно показывают тенденцию роста способов его утилизации в течение последних десятилетий. Существуют различные технологии разделения СО2. Наиболее изученными являются технологии выделения СО2 различными сорбентами, в т.ч. жидкими абсорбентами (моно-, ди- и триэтаноламины) или твердыми адсорбентами в виде оксидов CaO, ZnO или смешанных оксидов различных металлов, а также разделение с помощью селективных мембранам. Разнообразные дымовые газы, образующиеся при сжигании различных топлив, обычно имеют температуру от 500 до 700°С, и поэтому способ влажного разделения здесь не приемлем, поскольку он очень энергоемкий и требует охлаждения газов. В связи с этим, применение новых твердых высокотемпературных адсорбентов весьма актуально.
В настоящее время среди наиболее перспективных поглотителей [1. Iwana А.; Stephenson Н.; Ketchie С; Lapkin А. // High Temperature Sequestration of СО2 Using Lithium Zirconates // Chem. Eng. J. 2009, 146, 249-258; 2. Shan S.Y.; Jia Q. M.; Jiang L.H.; Li Q.C; Wang Y.M.; Peng J.H. Novel Li4SiO4-Based Sorbents from Diatomite for High Temperature CO2 Capture // Ceram. Int. 2013, 39, 5437-5441] рассматриваются цирконаты (Li2ZrO3) и силикаты лития (Li4SiO4). Хемосорбция СО2 протекает согласно следующим химическим реакциям:
Li2ZrO3+СО2=Li2CO3+ZrO2
Li4SiO4+СО2=Li2CO3+Li2SiO3
Другим применением таких сорбентов СО2 является их использование в традиционном паровом риформинге метана (ПРМ) с получением водородсодержащего синтез газа (смесей СО и Н2) или чистого водорода. Общеизвестно, что более высокий выход Н2 исходя из кинетики реакции ПРМ можно достичь при in-situ улавливании (хемосорбции) и снижении концентрации СО2 в реакционной смеси. Максимальная эффективность была получена с использованием СаО в качестве акцептора СО2 из-за благоприятной термодинамики, однако СаО обладает низкой термостабильностью [3. Lysikov A.I., Lukyanov B.N., Okunev A.G. // Absorption and Catalytic Conversion of Hydrocarbons: Reactors, Adsorbents and Catalysts // Chemistry for Sustainable Development. 2010. T. 18. №6. C. 603-615].
В настоящее время цирконаты и силикаты лития считаются одними из лучших сорбентов для выделения СО2 из дымовых газов, но для этого требуется высокая температура адсорбции (>500°С) и еще более высокая температура для десорбции СО2. Литературные данные по синтезу цирконатов и силикатов лития, а также таких поглотителей допированных натрием и кальцием представлены достаточно широко. Их синтез может быть осуществлен тремя способами: традиционным сплавлением солей металлов, а также более современными и перспективными методами, например, золь-гель синтезом или соосаждением прекурсоров в виде солей металлов из их растворов. В работе [4. Е. Ochoa Fernandes, Н.К. Rusten // Sorption enhanced hydrogen production by steam methane reforming using Li2ZrO3 as sorbent: Sorption kinetics and reactor simulation // Catal. Today 2005, 106, 1-4, 41-46] предложен способ синтеза Li2ZrO3 путем сплавления солей, в результате которого получают высокопористый сорбент. Однако, для получения сорбентов, нанесенных на пористые носители, этот способ неприемлем.
Использование нанокристаллических силиката лития [5. Khomane, R.B., Sharma, В.К., Saha, S., Kulkarni, B.D.// Reverse microemulsion mediated sol-gel synthesis of lithium silicate nanoparticles under ambient conditions: scope for CO2 sequestration // Chem. Eng. Sci., 2006, 61, 3415-3418], а также цирконата лития, полученного золь-гель способом, значительно снизили энергию, необходимую для адсорбции [6. Ochoa-Fernar ndez Е., Ronning М., Grande Т., Chenpp D. // Nanocrystalline lithium zirconate with improved kinetics for hightemperature СО2 capture // Chem. Mater. 2006, 18, 1383-1385]. Было установлено, что причиной этого является существенно меньший размер частиц, по сравнению с природными силикатами и цирконатами лития.
Синтезы простых ненанесенных на носители Li2ZrO3 и Li4SiO4 сорбентов осуществляют различными способами, в частности, порошкообразного Li2ZrO3 цитратным методом [патент РФ №2440298, опубл. 20.01.2012], осаждением аммиаком [7. Kwang Bok Yi & Dag Eriksen // Low Temperature Liquid State Synthesis of Lithium Zirconate and its Characteristics as a СО2 Sorbent // Separation Science and Technology, V. 41, 2006, Issue 2, P. 283-296], цитратно-мочевинным золь-гель методом [8. Q Xiao // A citrate sol-gel method to synthesize Li2ZrO3 nanocrystals with improved СО2 capture proprties // J. Mater. Chem., 2011, 21, 3838-3842] или еще более сложным цитратно-цетилтриметиламинобромидным методом [9. М. Khokhanim R.В. Khomane, В.D. Kulkarn // Sodium-doped lithium zirconate nano squares: synthesis, characterization and applications for СО2 sequestration Sol-Gel // Sci. Technol, 2012, v. 61, p. 316-320]. Недостатком всех известных способов является то, что финальная стадия прокаливания образцов для получения эффективных Li2ZrO3 и Li4SiO4 сорбентов СО2 проводится при очень высокой температуре (не ниже 900°С). В результате образуется кристаллическая фаза смешанных оксидов.
В патенте US №6271172 (опубл. 07.08.01) раскрывается способ приготовления высокотемпературного регенерируемого поглотителя на основе цирконата лития. Показано, что низкая скорость поглощения СО2 цирконатом лития увеличивается в несколько десятков раз в присутствии добавок карбонатов щелочных металлов. Причем обязательным условием промотирующего действия карбонатов является то, что они должны находиться в расплавленном состоянии. Недостатком данного типа материалов является их высокая склонность к спеканию, обусловленная тем, что при температуре выше 710°С кристаллический цирконат лития находится в расплавленном состоянии. Т.о, недостатками представленных выше традиционных способов являются использование ряда токсичных соединений: хлорида циркония или цирконила, аммиака, спиртов и брома, а также высокая температура отжига (900°С-1100°С) и длительность процесса: взаимодействие солей циркония и лития - 15 часов, отжиг - 1-6 часов, измельчение - 24 часа. Во всех случаях образцы получались мелкодисперсными, а для повышения адсорбционной емкости по СО2 в ряде случаев авторам приходилось еще и дополнительно измельчать сорбенты в шаровых мельницах до состояния порошков. Соответственно, применение таких порошковых поглотителей, тем более в комбинации с гранулированными катализаторами ПКМ имеет свои недостатки.
В обзоре [10. Лысиков А.И., Лукянов Б.Н., Окунев А.Г. // Адсорбционно-каталитическая конверсия углеводородов, сорбенты и катализаторы // Химия в интересах устойчивого развития, 2010, 18, 691-704] упоминается, что не промотированный Li2ZrO3 имеет очень низкую скорость поглощения СО2, что связано со стерическим препятствиями диффузии СО2. При хемосорбции на поверхности зерна образуется слой карбоната лития и оксида циркония, а непрореагировавший Li2ZrO3 остается недоступным в центре зерна. Установлено, что при добавлении добавок карбоната калия заметно улучшается скорость диффузии газа к ядру поглотителя, и таким образом удается обеспечить емкость систем на основе цирконатов щелочных металлов до 0,15-0,19 г-СО2/г-сорбента. При этом лучший результат 0,26-0,27 г-СО2/г-цирконата лития при его допировании солями калия достигнут в работе [11. Е. Ochoa-Fernandes, M. Ronning // Synthesis and СО2 Capture Properties of Nanocrystalline Lithium Zirconate // Chem. Mater. 2006, 18 (25), 6037-6036].
В настоящее время различные мезопористые материалы, такие как силикагели и молекулярные сита МСМ-41, широко изучаются в качестве сорбентов различных газов (азота, водорода и др.). Их высокая удельная поверхность и объем пор способствуют высокой загрузке различных оксидов и смешанных оксидов, являющихся адсорбентами СО2, в их поры. Это открывает возможность использования таких материалов в качестве носителей для адсорбентов СО2 из дымовых газов или из окружающей среды. Однако, публикаций о нанесенных уже сформированных высокоэффективных Li2ZrO3 и Li4SiO4 сорбентов СО2 на неорганические носители, в частности на двуокись титана, различные силикагели или алюмосиликаты и тем более на карбиды различных металлов не найдено. В связи с этим, разработка эффективных нетрадиционных сорбентов в виде цирконатов и силикатов лития, нанесенных на различные упомянутые выше носители, в т.ч и гранулированные, является многообещающей альтернативой из-за приемлемой кинетики удаления СО2. Кроме того, нанесенные на носители сорбенты СО2 наряду с высокой термостабильностью могут отличаться повышенной удельной поверхностью, что может привести к изменению кинетических закономерностей хемосорбции и росту адсорбционной емкости по СО2.
Наиболее близким к настоящему изобретению является способ получения допированных литием и цирконием наночастиц силикагеля, описанный в работе [12. M. Ganesh, P. Hemalatha, М.M. Peng, Н.Т. Jang // One pot synthesized Li, Zr doped porous silica nanoparticle for low temperature СО2 adsorption // Arabian Journal of Chemistry (2017) 10, p.1501-1505]. Образцы Zr-Li/SiO2 авторы получали золь-гель методом из спиртовых растворов пропиленоксидов лития и циркония с добавлением тетраэтоксисилана (C8H20O4Si). При этом формировался устойчивый гель, из которого осаждением серной кислотой формировали твердый продукт, который затем фильтровали, промывали и прокаливали при 550°С в течение 6 часов. Конечный продукт 4%Zr-3,4%Li/SiO2 с удельной поверхностью, средним диаметром и объемом пор - 962 м2/г, 2,3 нм и 0,56 см3/г, соответственно, содержал на поверхности нанодисперсного силикагеля оксиды лития и циркония. Адсорбционная способность по СО2 полученного адсорбента, измеренная при комнатной температуре составила около 5% масс, при этом полная регенерация сорбента наблюдалась уже при его прогреве до 200°С. Недостатком полученного адсорбента являлось то, что он в принципе не способен поглощать диоксид углерода при повышенных температурах (выше 200°С), что делает его непригодным для извлечения СО2 из нагретых дымовых газов и в других высокотемпературных процессах, например, ПКМ. Объяснением этому является то, что образующиеся при хемосорбции диоксида углерода поверхностные фрагменты Si-O-(СО2)Li не устойчивы при повышенной температуре.
Технической задачей настоящего изобретения являлась разработка технологически простого способа получения эффективных высокотемпературных сорбентов СО2, не подверженных спеканию, отличающихся повышенной динамической адсорбционной емкостью и скоростью поглощения СО2 при высоких (выше 500°С) температурах, при этом легко регенерируемых при температурах до 700°С.
Для достижения поставленной технической задачи предложен способ получения высокотемпературных адсорбентов СО2 в ходе нанесения лития и циркония или лития и кремния на поверхность носителя из водных растворов нитратов Li и Zr с добавлением лимонной кислоты или водного раствора цитратного комплекса Li и кремнезоля при упаривании растворов досуха с последующим прокаливанием твердого вещества при 650°С в течение 6 часов, при этом в качестве носителя использовали предварительно обработанные плавиковой кислотой нано и микро размерные частицы кристаллических карбидов металлов, таких как SiC, NbC или WC. Адсорбенты СО2 представляют собой нанесенную на носитель аморфную фазу цирконатов или силикатов лития, при этом содержание Li2ZrO3 и Li4SiO4 в адсорбентах составляет 27,6-28,5% масс, и 26,2-29,6% масс, соответственно.
Изобретение поясняется графическими изображениями, где на ФИГ. 1 представлена микрофотография сканирующей электронной микроскопии (СЭМ) образца карбида ниобия (NbC), протравленного плавиковой кислотой и используемого в дальнейшем как носитель, а на ФИГ. 2 фотография образца нанесенного 27,6%Li2ZrO3/NbC адсорбента.
На ФИГ. 3 представлены ИК спектры образца 29,5%Li2ZrO3/SiC адсорбента, полученного по примеру №1: 1- после адсорбции СО2 при 550°С в течение 1 часа; 2- после регенерации в токе азота при 650°С в течение 0,5 часа.
Осуществление изобретения.
В предлагаемом в настоящем изобретении способе получения высокотемпературных адсорбентов СО2 фазу адсорбента формировали на поверхности кристаллического носителя (карбиды различных металлов - SiC, NbC, WC) в ходе их помещения в водные растворы нитратов Li и Zr с добавлением лимонной кислоты или в водные растворы уже готового цитратного комплекса Li и гидрозоля Si (предшественников оксидов), выпаривания растворов досуха при интенсивном перемешивании реакционной массы с последующим прокаливанием при 650°С в течение 6 часов. Это является отличительной особенностью предлагаемого способа от изобретения-прототипа, где фазу оксидов лития и циркония получали одновременно с формированием наночастиц оксида кремния (условно "носитель") в ходе соосаждения оксидов с использованием золь-гель метода и органических соединений Li и Zr или Si, что делает предлагаемый в настоящем изобретении способ более простым в осуществлении.
В качестве носителей использовали производимые в промышленности для создания абразивных материалов карбиды кремния марок F120, F360 и F600 с микро размерными (10-60 мкм) частицами, или гранулированный SiC в виде пенокерамического материала, а также порошкообразные NbC и WC с нано размерными (25 и 55 нм) частицами с нехарактерной для карбидов металлов достаточно высокой удельной поверхностью (до 40 м2/г). Для удаления оксидной пленки с поверхности карбидов исходные образцы носителей подвергали кислотному травлению плавиковой кислотой. Отличительной особенностью карбидов металлов, в отличие от других носителей (TiO2, SiO2, Al2O3 или алюмосиликатов) является достаточно высокая химическая инертность. Они не имеют поверхностных функциональных групп, типа гидроксильных, или льюисовскких центров, образующихся при высокотемпературном прокаливании, что, по нашему мнению, и создает предпосылки к формированию на поверхности карбидов высокоэффективных в адсорбции фаз цирконата или силиката лития.
Предлагаемый способ нанесения Li и Zr или Si в совокупности с использованием высокодисперсных карбидных носителей позволяет синтезировать нанесенные высокотемпературные адсорбенты с высоким содержанием силикатов и цирконатов лития (до 28,5 и 29,6 масс. %, соответственно). Получаемые адсорбенты представляют собой структуры, типа ядро-оболочка, где ядром являются нано и микро размерные частицы карбидов металлов, а оболочкой - аморфная фаза поглотителей СО2 - цирконата или силиката лития.
Изобретение иллюстрируется следующими примерами, не ограничивающими его объем:
В качестве исходных носителей для получения высокотемпературных сорбентов СО2 использовали:
1. Карбид кремния (SiC) марки F120, производства "Лит. Пром. Абразив" (Украина) с размером частиц 10-20 мкм, содержание SiC не менее 97%.
2. Пенокерамический материал из карбида кремния (ПКМКК), производства фирмы "Русский катализатор" (Россия). Пенокерамический материал был изготовлен из ретикулированного пенополиуретана пористостью 10-20 ppi с пропиткой последнего шликером в виде поливинилового спирта с добавкой SiC (30 масс. %) в виде порошков марок F360 (40-60 мкм) и F600 (60-100 мкм), с последующей сушкой при 100-200°С и прокаливанием при температуре 1500°С. При термической обработке при 1500°С органический носитель полностью выгорает. Образующийся пенокерамический материал (ПКМКК) содержит более 95% SiC и имеет плотность 0,3-0,5 г/см3 и пористость 80-90%. ПКМКК размельчали и для приготовления сорбентов СО2 использовали гранулы носителя (фракцию 0,2-0,4 мм).
3. Нанопорошки NbC и WC, полученные в ИМЕТ РАН в ходе плазмохимического синтеза, со средним размером частиц 25 и 55 нм и удельной поверхностью 32 и 7 м2/г, соответственно.
Кислотное травление поверхности карбида кремния. Для удаления оксидной пленки кремния образцы исходных носителей в количестве 5,0 г помещали в раствор, содержащий 100 мл дистиллированной воды, 20 мл этилового спирта и 20 мл 40%-ной плавиковой кислоты, и перемешивали в течение 1 часа при комнатной температуре. Далее обработанные (протравленные) кислотой образцы фильтровали, промывали дистиллированной водой до рН=7,0 и сушили при 110°С в течение 2 часов. Потеря массы образцов до и после такой обработки составляла 8-15%. Далее во всех примерах по настоящему изобретению для приготовления высокотемпературных сорбентов СО2 использовали протравленные кислотой образцы карбидов металлов.
Приготовление водных растворов прекурсоров Li, Zr и Si.
Приготовление раствора Zr(NO3)4. В химическом стакане растворяли 1,39 г ZrO(NO3)2⋅H2O (Acros organics) в 100 мл дистиллированной воды с добавлением 1,35 г 65%-ной азотной кислоты до получения прозрачного раствора Zr(NO3)4.
Приготовление нитратного комплекса лития. В химическом стакане растворяли 2,98 г LiOH⋅H2O в 150 мл дистиллированной воды с добавлением 18 г безводной лимонной кислоты (С6Н8О7) до получения прозрачного цитратного комплекса лития (мольное отношение C6H8O7:литий=1,4).
Получение нанесенных на карбиды металлов образцов Li2ZrO3 адсорбентов СО2.
Пример 1. В колбу роторного испарителя - реактор (объемом 500 мл) загружали 2 г носителя - SiC, приливали полученный ранее раствор Zr(NO3)4 и перемешивали при 20°С в течение 30 минут. Затем в течение 30 минут в колбу мелкими порциями приливали 50 мл водного раствора нитрата лития, в котором содержится 0,76 г LiNO3 (Aldrich). При интенсивном перемешивании нагревали полученную суспензию до 80°С и упаривали воду наполовину. Далее в реактор добавляли 3,3 г безводной лимонной кислоты (мольное соотношение Zr:C6H8O7=l:3) и упаривали воду до сухого твердого остатка горчичного цвета. Полученный предшественник адсорбента сушили при 110°С в течение 2 часов и прокаливали при 650° в течение 6 часов с получением образца адсорбента Li2ZrO3/SiC белого цвета.
Пример 2. Образец Li2ZrO3/ПKMKK готовили по аналогии с примером 1, за исключением того, что в качестве носителя использовали ПКМКК.
Пример 3. Образец Li2ZrO3/NbC готовили по аналогии с примером 1, за исключением того, что в качестве носителя использовали NbC.
Получение нанесенных на карбиды металлов образцов Li4SiO4 адсорбентов СО2.
Пример 4. В колбу роторного испарителя - реактор (объемом 500 мл) загружали 2 г носителя - SiC, приливали полученный ранее раствор полученного ранее цитратного комплекса Li и перемешивали при 20°С в течение 1 часа. Затем в реактор приливали 5 мл кремнезоля марки "Ковелос-20" (содержание SiO2 в воде - 20% масс.) и перемешивали в течение 1 часа. Далее при интенсивном перемешивании нагревали полученную суспензию до 80°С и при этой температуре упаривали воду до сухого остатка горчичного цвета. Полученный предшественник адсорбента сушили при 110°С в течение 2 часов и прокаливали при 650° в течение 6 часов с получением образца адсорбента Li4SiO4/SiC.
Пример 5. Образец Li4SiO4/ПКМКК готовили по аналогии с примером 4, за исключением того, что в качестве носителя использовали ПКМКК.
Пример 6. Образец Li4SiO4/WC готовили по аналогии с примером 4, за исключением того, что в качестве носителя использовали WC.
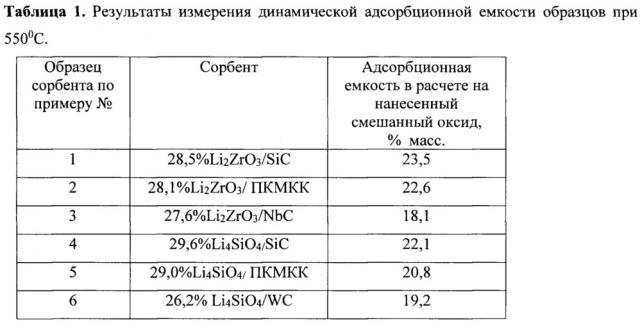
Содержание Li2ZrO3 и Li4SiO4 в полученных по примерам №1-6 образцах высокотемпературных адсорбентов СО2 представлено в таблице 1.
Измерение величины динамической адсорбции СО2. Для измерения адсорбционной емкости полученных по примерам №1-6 адсорбентов СО2 использовали проточный кварцевый реактор в виде трубки с внутренним диаметром 7 мм, в который загружали образец адсорбента (1 г). Реактор помещали в печь с электрообогревом и нагревали адсорбент в токе азота (40 мл/мин) при 550° в течение 2 часов для удаления адсорбированных примесей и стабилизации веса образца. Затем через образец нагретого до 550°С адсорбента со скоростью 40 мл/мин пропускали СО2 в течение 1 часа. Динамическую адсорбционную емкость образцов (в пересчете на массу нанесенных смешанных оксидов Li2ZrO3 и Li4SiO4) определяли по разнице веса реактора с загруженными образцами адсорбентов до и после пропускания СО2.
В ряде экспериментов после измерения величины адсорбции СО2 проводили регенерацию адсорбентов при температуре 650°С в течение 0,5 часа и при 700°С также в течение 0,5 часа при подаче в реактор азота со скоростью 40 мл/мин. Количество десорбированного СО2 определяли по разнице веса реактора с загруженным образцом до и после пропускания инертного газа.
В таблице 1 представлены результаты измерения динамической адсорбционной емкости полученных по примерам №1-6 адсорбентов.
Представленные в таблице 1 результаты свидетельствуют о получении нового класса высокоэффективных нанесенных на карбидные носители (SiC, NbC, WC) высокотемпературных адсорбентов СО2. Уже при умеренной температуре 550°С они характеризуются высокой динамической адсорбционной емкостью по СО2 (до 23,5 масс.% для нанесенных Li2ZrO3 и до 22,1 масс. % для Li4SiO4), превосходящей емкость массивных адсорбентов, и повышенной скоростью адсорбции (время адсорбции составляет всего 1 час). Полученная высокая адсорбционная емкость образцов является косвенным подтверждением формирования на поверхности носителей высокоэффективных в хемосорбции СО2 фаз цирконатов и силикатов Li, поскольку, согласно [11, 12], в отличие от простых оксидов лития и циркония, и тем более кремния, только такие кристаллические смешанные оксиды способны при 500-600°С поглощать около 20 масс. % диоксида углерода. Следует отметить, что по данным рентгено-фотоэлектронного анализа (РФА) нанесенные цирконаты и силикаты лития во всех полученных в настоящем изобретении образцах адсорбентов, в отличие от известных в литературе массивных, находятся на поверхности карбидных носителей в виде рентгеноаморфной фазы. Так, в РФА спектрах всех полученных по примерам №1-6 образцов адсорбентов не наблюдаются пики, характерные для кристаллического Li2ZrO3 и оксида циркония - ZrO2, как это наблюдали авторы в [11].
Отличительной особенностью предлагаемого способа является выбор достаточно низкой температуры (650°С) и короткого времени прокаливания (6 часов) нанесенных на карбидные носители поглотителей СО2. Достаточно мягкие условия прокаливания, по нашему мнению, являются достаточными для формирования высокоэффективных в адсорбции СО2 поверхностных смешанных оксидов в виде оболочки, где частицы карбидных носителей являются ядром. Микрофотографии СЭМ, представленные на Фиг. 1 и 2, являются подтверждением формирования оболочки нанесенной фазы Li2ZrO3 на поверхности частиц NbC, при этом визуально наблюдается изменение цвета образца от черного до белого. Следует отметить, что стадия предварительного кислотного травления поверхности карбидных носителей плавиковой кислотой является необходимой для создания высокоэффективных адсорбентов. Так, если при получении адсорбентов по примерам №1-6 пропустить эту стадию и использовать исходные нетравленые кислотой карбиды SiC, NbC и WC, то адсорбционная емкость получаемых образцов не превысит 4% масс.
Преимуществом полученных в настоящем изобретении нанесенных высокотемпературных адсорбентов, по сравнению с традиционными массивными цирконатами и силикатами лития, является возможность их быстрой регенерации при умеренных (до 700°С) температурах в токе инертного газа. Иллюстрацией этому являются ИК-спектры Li2ZrO3/SiC адсорбента, полученного по примеру №1, представленные на Фиг.3. Так, в спектре образца (кривая 1) после адсорбции 23,5 масс.% СО2 (табл. 1) наблюдаются интенсивные полосы поглощения (п.п.) при 1493 и 1434 см-1, характерные образованию Li2CO2. Эти п.п.существенно уменьшают свою интенсивность в ИК-спектре образца после регенерации в токе азота при 650°С в течение 0,5 часа (кривая 2). Это свидетельствует о быстрой частичной регенерации адсорбента уже при 650°С, температуре, которая всего на 100°С выше температуры адсорбции СО2. Если дополнительно выдержать образец в токе азота при 700°С в течение еще 0,5 часа, то эти п.п.вообще исчезают из спектра, что свидетельствует о полной регенерации адсорбента уже при 700°С. Повторная адсорбция СО2 приводит к практически полному воспроизведению результатов. Динамическая адсорбционная емкость образца 28,5% Li2ZrO3/SiC, измеренная нами во 2-ом цикле адсорбции СО2, составила 23,3% масс.
Т.о., полученные в настоящем изобретении адсорбенты способны при 550°С и атмосферном давлении поглощать до 23,5 масс.% СО2, при этом полностью регенерироваться (десорбировать СО2) в потоке инертного газа при 700°С в течение 0,5-1 часа.
Изобретение соответствует критерию «новизна», так как в известной научно-технической и патентной литературе по получению высокотемпературных сорбентов СО2 отсутствует такой существенный признак, характеризующий предлагаемое изобретение, как получение регенерируемых, нанесенных на носители цирконатов и силикатов лития, где в качестве носителя используются наноразмерные порошки карбидов NbC и WC, а также микроразмерные порошки или гранулированный SiC.
Изобретение также соответствует критерию «изобретательский уровень», так как достижение полученной нами высокой адсорбционной емкости по СО2 (18,1-23,5%) являлось неочевидным, поскольку согласно литературным данным [11, 12] такая высокая емкость характерна только массивным кристаллическим силикатам и цирконатам лития, дополнительно допированным добавками оксидов других щелочных или щелочноземельных металлов (К или Са). Неочевидным было также то, что при использовании в качестве носителей нано и микро размерных частиц карбидов с низкой удельной поверхностью (до 40 м2/г) можно будет получить адсорбенты с таким высоким (25-30% масс.) содержанием активных в адсорбции СО2 аморфных фаз Li2ZrO3 и Li4SiO4.
Дополнительно следует отметить, что использование в качестве носителей NbC, WC, и ряда других карбидов, которые, согласно патенту РФ №2573508 (опубл. 20.01.2016 г.), можно быстро нагреть под воздействием микроволнового излучения до высоких температур (500-900°С), открывает перспективу нового нетрадиционного способа подвода тепла для адсорбентов, а также перспективу использования таких нанесенных адсорбентов в СВЧ активированных адсорбционных и каталитических процессах.
1. Способ получения высокотемпературных адсорбентов СО2, представляющих собой смешанные оксиды лития и циркония или кремния, включающий контактирование предшественников оксидов в растворах, соосаждение оксидов с образованием осадка твердого вещества и его прокаливание, отличающийся тем, что адсорбенты СО2 получают путем нанесения лития и циркония или лития и кремния на поверхность носителя из водных растворов нитратов Li и Zr с добавлением лимонной кислоты или водного раствора цитратного комплекса Li и кремнезоля при упаривании растворов досуха с последующим прокаливанием твердого вещества при 650°С в течение 6 часов, при этом в качестве носителя используют предварительно обработанные плавиковой кислотой нано- и микро- размерные частицы кристаллических карбидов металлов, выбранных из SiC, NbC или WC.
2. Способ по п. 1, отличающийся тем, что полученный адсорбент представляет собой нанесенную на носитель аморфную фазу цирконата или силиката лития, при этом содержание Li2ZrO3 и Li4SiO4 в адсорбенте составляет 27,6-28,5 или 26,2-29,6% масс., соответственно.