Способ хранения клеточных культур в суспензии
Иллюстрации
Показать всеИзобретение относится к биологии и медицине и может быть использовано при хранении клеточных культур. Для криоконсервации используют контейнер с регулируемым объемом и возможностью его герметизации, при этом осуществляют вывод атмосферного газа из внутреннего объема контейнера и последующий ввод объема суспензионной клеточной культуры. Затем в объем контейнера вводят инертный газ при одновременном увеличении объема контейнера до величины, обеспечивающей выбранное соотношение между объемом культуры и объемом инертного газа, размещенных в контейнере. Регулировку объема контейнера осуществляют штоком, снабженным поршнем. Культуру с газом перемешивают в выбранном объеме контейнера при температуре от +4 до +25°С в течение от 10 мин до 2 часов. Далее клеточную суспензию, насыщенную газом, перемещают в более компактный контейнер, с возможностью его герметизации или суспензию оставляют в контейнере с регулируемым объемом. Затем идентифицируют контейнер и помещают его в морозильную камеру с температурой от -80°С до -130°С. Способ криосохранения суспензионной клеточной культуры обеспечивает качество и жизнеспособность клеточных культур при одновременном снижении затрат на криоконсервацию клеток. 15 з.п. ф-лы, 1 табл., 3 ил.
Реферат
Область техники
Изобретение относится к биологии и медицине и может быть использовано при криоконсервации клеточных суспензий человека, используемых в качестве лечебных препаратов.
Уровень техники
Длительное хранение жизнеспособного биологического материала является необходимым элементом многих технологий в области биологии, медицины, сельского хозяйства. Наиболее длительные сроки хранения биообъектов обеспечивают технологии криоконсервации - способ глубокого замораживания биологических объектов с сохранением их жизнеспособности. Для дальнейшего совершенствования методов криоконсервации необходимо устранить повреждающие факторы, воздействующие на биологические структуры во время замораживания-оттаивания. Одно из направлений используемое в технических решениях связано с использованием инертных газов для повышения выживаемости клеток при криоконсервации.
Известен способ криоконсервации, который включает насыщение клеток в пластикатном контейнере «Компопласт 300», помещенном в металлический криобароконтейнер, инертным газом ксеноном под давлением 0,6 атм в течение 20 мин в условиях комнатной температуры +21±2°C с последующим удалением избытка газа и извлечением из металлического контейнера, замораживанием биообъекта до -28°С в этиловом спирте и перемещением в электроморозильник на -80°С. Размораживание биообъекта осуществляется в водяной ванне 39±1,5°С в течение 1,5 мин [1].
Известен способ консервации биоматериала, включающий размещение биоматериала в стерильной емкости, удаление воздуха из емкости и ее последующую герметизацию, обработку биоматериала в закрытой среде в емкости со смотровым окном ксеноном и последующее охлаждение биоматериала при постоянном визуальном мониторинге состояния биоматериала. Обработку биоматериала производят ксеноном 90-99,999% степенью чистоты до величины давления в 7-9 атм., а последующее охлаждение биоматериала ведут до температуры не более +5°С, но не менее -10°С.[2].
Одно из технических решений описано в патенте РФ №2433173 [3]. В качестве криопротектора при криоконсервации смеси клеток с культуральной средой используют химически чистый газ ксенон - Хе состава 99.999%, а криоконсервацию проводят путем продувки газом Хе до насыщения смеси клеточной культуры (суспензии клеток) в среде DMEM (Sigma), помещенных в открытых пластиковых криопробирках, причем продувку Хе проводят при атмосферном давлении на ледяной бане при 0°С в течении 10-20 мин, после чего криопробирки объемом 2 мл со смесью ММСК насыщенной ксеноном закрывают и помещают в криоконтейнер, который погружают в морозильник типа Sanyo для контролируемого замораживания до -70-85°С со скоростью охлаждения 1°С в минуту и до образования монолита смеси культуральной среды с криопротектором Хе и далее для длительного хранения в хранилище с жидким азотом для последующего использования. Недостатком данного технического решения является возможность снижения воспроизводимости результатов криоконсервации за счет неконтролируемого процесса продувки ксеноном суспензии клеток из-за малой площади открытой поверхности суспензии, поскольку суспензия размещена в криопробирках объемом 2 мл.
В патенте США № US 7129035 [4] раскрыто техническое решение, в котором криоконсервируют фрагменты ткани органов млекопитающих используя барботирование инертными газами раствора, в котором размещены образцы ткани для криоконсервации. Барботирование раствора инертными газами, в том числе азотом, аргоном или гелием осуществляют для удаления растворенного кислорода из раствора. К недостатку данного способа криоконсервации относится то, что микропузырьки газа при барботировании могут повреждать клетки, предназначенные криоконсервации.
Технической задачей изобретения является разработка надежного способа криоконсервации клеточных суспензий, повышающего качество и жизнеспособность клеточных культур при одновременном снижении затрат на криоконсервацию клеток.
Технический результат состоит в увеличении жизнеспособности клеток за счет мягкого перемешивания суспензии с использованием шейкера в контейнере, обеспечивающем выбранное соотношение между объемом культуры и объемом инертного газа размещенных в контейнере.
Сущность изобретения
Поставленная задача решается тем, что в новом способе криосохранения суспензионной клеточной культуры в среде инертного газа после помещения клеточной культуры в подходящую для криоконсервации культуральную среду с добавлением классических криопротекторов или без них, осуществляют ввод суспензионной клеточной культуры в контейнер с регулируемым объемом. На первом этапе осуществляют вывод атмосферного газа из внутреннего объема контейнера затем вводят суспензию клеточной структуры, затем в объем контейнера вводят легкий инертный газ при одновременном увеличении объема контейнера до величины, обеспечивающей выбранное соотношение между объемом культуры и объемом легкого инертного газа, размещенных в контейнере. При этом регулировку объема контейнера осуществляют штоком снабженным поршнем. Далее выдерживают культуру с газом в выбранном объеме контейнера при температуре от +4 до +25°С в течение от 10 мин до 2 часов при мягком перемешивании на шейкере, идентифицируют и помещают контейнер в морозильную камеру с температурой от 80°С до -130°С.
В другом варианте после выдерживания суспензии клеток в атмосфере легкого инертного газа суспензию перемещают в более компактную тару, не содержащую излишнего объема газа: криопробирки, паетты, пакеты, контейнеры.
Следующий аспект изобретения состоит в том, что соотношение объемов суспензионной культуры и объема инертного газа составляет от 0,01 до 0,1
Другой аспект изобретения состоит в том, что инертный газ, выбирают из группы, состоящей из: гелия, аргона и элегаза (гексафторид серы), криптона, ксенона.
Другой аспект изобретения состоит в том, что контейнер выполнен в форме шприца, с объемом от 1 до 5 мл, который выполнен из термостойкой пластмассы и содержит линии градуировки объема.
Перечень чертежей
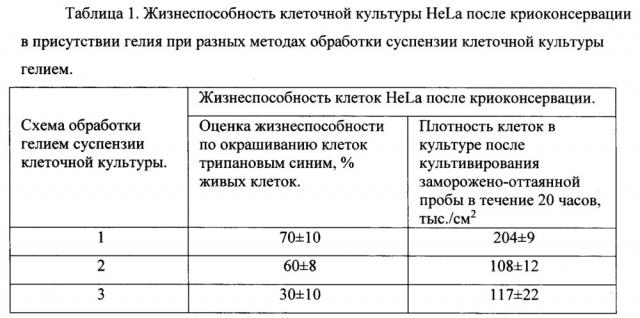
Фиг. 1. Жизнеспособность клеток HeLa после криоконсервации в присутствии различных газов без применения классических криопротекторов. Где: А) Количество живых клеток сразу после размораживания, протестированное окрашиванием трипановым синим; Б) Развитие культуры клеток после криоконсервации, оцененное по плотности клеточной культуры через сутки культивирования.
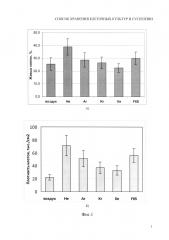
Фиг. 2. Данные приведенные на фиг. 2А и фиг. 2Б показывают жизнеспособность клеток HeLa после криоконсервации в присутствии 10% глицерина и газов гелия, неона и атмосферного воздуха (К). Где: А) Количество живых клеток сразу после размораживания, протестированное окрашиванием трипановым синим; Б) Развитие культуры клеток после криоконсервации, оцененное по плотности клеточной культуры через сутки культивирования.
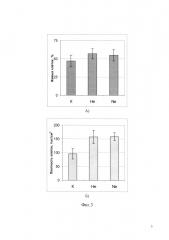
Фиг. 3. Данные приведенные на фиг. 3А и фиг. 3Б показывают жизнеспособность фибробластов NCTCL929 после криоконсервации в присутствии 3% глицерина и насыщением культуры газами гелием, неоном или под воздействием атмосферного воздуха (К). Где: А) Количество живых клеток сразу после размораживания, протестированное окрашиванием трипановым синим; Б) Пролиферативная активность замороженно-оттаянных клеток, оцененная по плотности клеток через сутки культивирования.
Описание изобретения
В процессе изучения влияние насыщения клеточной суспензии инертными газами (гелий, аргон, криптон, ксенон и гексофторид серы) на выживаемость клеток при криоконсервации было обнаружено, что значительное влияние на результат имеет природа газа и способ насыщения газом клеточной суспензии.
Насыщение клеточной суспензии тяжелыми инертными газами (аргоном, криптоном, ксеноном), в том числе часто используемым в биологии аргоном имеет менее выраженный благоприятный эффект или, в отдельных случаях, даже негативное влияние на выживаемость клеток в процессе криоконсервации. Обнаружено, что наиболее благоприятный эффект наблюдается при насыщении суспензии легкими инертными газами: гелием, неоном. Гелий и неон - это легкие газы, имеющие низкую растворимость в воде и водных растворах. Эти газы обладают еще одним интересным свойством - способностью растворяться во льду [5, 6]. При этом коэффициент растворимости во льду даже выше, чем растворимость в воде при той же температуре. То есть если все прочие газы при кристаллизации воды «выдавливаются» в окружающий незамерзший раствор и далее, в процессе вымораживания воды, образуют микропузыри газа, нарушающие структуру замерзающего раствора, то гелий и неон встраиваются в лед без нарушения его структуры. Это способствует тому, что растворы, насыщенные гелием или неоном, при замерзании будут обладать более однородной структурой и содержать меньше механических дефектов.
При этом существенное значение имеет способ насыщения суспензии газом. Насыщение газом методом барботажа (или «промывка» газом) оказывает повреждающее действие на клетки и снижает выживаемость клеточных суспензий в процессе криоконсервации. Мы связываем это с двумя факторами - повреждение клеток газовыми пузырьками в процессе промывки неконтролируемость остаточных концентраций атмосферных газов после окончания процедуры промывки легкими инертными газами. При выдерживании клеточной суспензии в атмосфере легкого инертного газа фиксированного объема происходит насыщение суспензии инертным газом без повреждений клеток и при этом в суспензии остается достаточная остаточная концентрация кислорода и углекислого газа, обеспечивающая оптимальные условия для выживания клеток в процессе криоконсервации. При этом оптимальные концентрации кислорода и углекислого газа обеспечиваются без использования газовых смесей и соответствующего специализированного оборудования.
С другой стороны, помещение клеток в криопротектирующий раствор, заранее насыщенный газом, также имеет более низкую результативность по сравнению с предлагаемой технологией насыщения легкими инертными газами клеточной суспензии (см. пример 4). Очевидно, преднасыщение криопротектирующего раствора инертным газом не обеспечивает оптимального соотношения концентраций инертного газа и физиологических газов (кислорода, углекислого газа).
Согласно изобретению, увеличить воспроизводимость криоконсервации при одновременном расширении возможности применения размороженных клеток после криоконсервации возможно при использовании контейнеров с регулируемым объемом, например, контейнеров, содержащих шток и поршень с помощью которых можно точно установить объем используемого газа при прочих равных условиях.
Из уровня техники известно использование шприцев в качестве контейнеров при криоконсервировании клеточных суспензий. В международной заявке на изобретение № WO 2016019108 приведено описание устройства для применения в качестве крио-шприца и крио контейнера для хранения клеток в жидком азоте и возможности осуществления клеточной терапии. Компоненты устройства выполнены из материала, выдерживающего низкие температуры, например, пластика. Однако это устройство не предназначено для сохранения в нем кроме клеточной суспензии дополнительных газов [7].
В международной заявке на изобретение № WO 2015194872 в качестве контейнера для клеточной терапии и хранения клеточной суспензии при низких температурах используют шприц, но в технологии криосохранения отсутствует смена газовой фазы внутри контейнера при подготовке к криоконсервации. Кроме этого токсичные криопротекторы, в составе суспензии для криоконсервации, заменены на смесь, в состав которой дополнительно входят сахара [8].
Было найдено, что выполнить условия воспроизведения технологии возможно при использовании контейнеров в виде одноразовых шприцев, которые состоят из прозрачного цилиндра, штока-поршня, уплотняющего кольца-манжеты. Например, на основе трехкомпонентного одноразового шприца с линиями градуировки объема. Благодаря наличию резиновой манжеты на поршне, а также за счет покрытия поршня и внутренней полости цилиндра шприца силиконовой смазкой, скольжение поршня шприцев осуществляется без рывков и обеспечивает плавность и точность установки внутреннего объема шприца. Данные качества шприца имеют особенно большое значение при точном дозировании клеточной суспензии и величины объема инертного газа. Кроме этого после разморозки шприца клеточная суспензия готова к введению в млекопитающее при клеточной терапии, так как шприц комплектуется стерильной иглой с колпачком, через которую вводят клеточную суспензию и выбранный газ.
Обычно шприц упаковывается после изготовления с надетой иглой, тем самым исключается попадание волокон упаковочной бумаги на детали шприца и иглу. Герметичное соединение иглы и шприца исключает потери инертного газа при подготовке клеточной среды к замораживанию. При изготовлении каждый шприц одноразового использования упакован в индивидуальную стерильную полиэтиленовую упаковку. Все детали шприцов изготовлены из полипропилена медицинского назначения, тем самым обеспечивается приспособленность данных шприцов для работы с различными клеточными средами, а также проходит дополнительную стерилизацию [7]. Объем контейнера составляет от 1 до 20 мл, предпочтительно 2 мл. Соотношение объемов суспензионной культуры и объема инертного газа составляет от 0,01 до 0,25. Предпочтительно соотношение объемов суспензионной культуры и объема инертного газа составляет 0,15. Для насыщения клеточной культуры газом используют давление газа от 1 до 5 атмосфер. Для насыщения культуры клеток используют инертные газы, входящие в группу, состоящую из гелия, неона, аргона, элегаза (гексафторид серы). Предпочтительно использовать легкие инертные газы неон и гелий.
Клеточную культуру с газом в выбранном объеме контейнера выдерживают при температуре от +4 до +25°С в течение от 10 мин до 2 часов при мягком перемешивании на шейкере. Затем клеточную суспензию, насыщенную газом, перемещают в более компактный контейнер, с возможностью его герметизации или суспензию оставляют в контейнере с регулируемым объемом. На заключительном этапе идентифицируют контейнер, размещая на нем на внешней поверхности этикетку с кодом, выбранным из группы, состоящей: из штрих-кода, бар-кода, двухмерного кода и помещают контейнер в морозильную камеру с температурой от -80°С до -130°С.
Результаты эксперимента по криоконсервации культуры клеток насыщенной инертными газами приведены в примерах, которые включают, но не ограничивают типов клеточных суспензий и типов инертных газов, используемых при криоконсервации.
Данный способ криоконсервации несмотря на простоту и последующую доступность в практике применения для медицины содержит оригинальность технического решения и неизвестен из доступных литературных источников, что свидетельствует о соответствии заявляемого изобретения критерию "новизна" и "изобретательский уровень".
Примеры.
Пример 1. Получение культуры клеток для криоконсервации.
Клети HeLa культивировали в стандартных условиях в среде у DMEM (High glucose) с добавлением 10% фетальной бычьей сыворотки (FBS), 100 Ед/мл пенициллина и 100 мкг/мл стрептомицина. Дезинтеграцию монослоя для получения суспензии клеток осуществляли раствором 0,05% трипсина/EDTA (Gibco), проводили подсчет концентрации клеток в полученной суспензии с помощью камеры Горяева. Затем клетки осаждали и ресуспендировали DMEM (High glucose) с добавлением 10% фетальной бычьей сыворотки (FBS) из расчета конечной концентрациии 1 млн. клеток в мл. раствора.
Пример 2. Криоконсервация клеток линии HeLa без применения классических криопротекторов с предварительным насыщением культуры клеток инертными газами.
Для насыщения газами и последующей криоконсервации использовали стандартные одноразовые шприцы объемом 2 мл. В шприц набирали 0,5 мл суспензии клеток, изгоняли излишки воздуха, подсоединяли к источнику газа, объем газа около 2,5 мл и закрывали кончик шприца герметичным наконечником. Суспензию клеток насыщали 2 часа при комнатной температуре (20°С) при мягком покачивании на шейкере Laboratory shaker type 358S (Poland). После насыщения газом шприцы в горизонтальном положении помещали в морозильную камеру с температурой -130°С. В таких условиях охлаждение суспензии от 20°С до -100°С происходит со скоростью около 2°/мин. Применение шприцов при криоконсервации в газовой атмосфере позволяет за счет свободного хода поршня избежать образовани пониженного давления при температурном сжатии газов и вакуума при сжижении ксенона и гексафторида серы, используемых в эксперимпенте. Размораживание проводили в водяной бане 37°С в течение 2 мин. (скорость размораживания ≈60°/мин). В качестве контроля замораживали аналогичную суспензию клеток без воздействия специальной газовой среды.
Жизнеспособность клеточной культуры после криоконсервации оценивали по окрашиванию трипановым синим непосредственно после размораживания, а также по профилеративной активности клеток в течение 16 часов после размораживания. Подсчет клеток, окрашенных трипановым синим осуществляли на автоматическом счетчике клеток Countess II FL. (США). Для контроля способности клеток к развитию и пролиферации помещали 0,45 мл суспензии клеток в ячейку 6-луночного планшета, добавляли 2 мл среды ДМЕМ с 10% FBS и антибиотиками и помещали в инкубатор при температуре 37°С и атмосфере с 5% СО2 на 5 часов. Через 5 часов проводили замену среды. Через 16 часов инкубирования оценивали визуально состояние клеточной культуры по морфологии клеток и подсчитывали количество клеток с помощью счетчика клеток Genetic Clone Select (США).
Результаты эксперимента по криоконсервации суспензии клеток HeLa, насыщенной инертными газами, входящими в группу, состоящую из гелия, аргона, элегаза (гексафторид серы), криптона, ксенона приведены на фиг. 1. Данные приведенные на фиг. 1А и фиг 1Б показывают жизнеспособность клеток HeLa после криоконсервации в присутствии различных газов без применения классических криопротекторов. На фиг. 1А приведены данные по количеству живых клеток сразу после размораживания, протестированное окрашиванием трипановым синим. На фиг. 1Б) показаны данные по развитию культуры клеток после криоконсервации суспензии клеток насыщенной разными типами газов, оцененное по плотности клеточной культуры через сутки культивирования.
Как видно из диаграмм, гелий значительно повышал выживаемость клеток в процессе криоконсервации. Ксенон и криптон практически не оказали положительного эффекта на выживаемость клеток. Аргон и гексафторид серы оказывали положительное влияние на выживаемость клеток, но положительный эффект этих газов уступает воздействию гелия.
Пример 2. Криоконсервация клеток линии HeLa с 10% глицерином под воздействием гелия.
Культивирование проводили способом аналогичным примеру 1 за исключением среды криоконсервирования. После дезинтеграции монослоя и центрифугирования клетки ресуспендировали в среде у DMEM (High glucose) с добавлением 10% FBS и 10% глицерина. Криоконсервацию клеток проводили способом аналогичным примеру 2. Результаты эксперимента представленые на фиг. 2 показывают жизнеспособность клеток HeLa после криоконсервации в присутствии 10% глицерина и газов гелия, неона и атмосферного воздуха (К). На фиг. 2А представлено количество живых клеток сразу после размораживания, протестированное окрашиванием трипановым синим. На фиг. 2Б показаны результаты развития культур клеток после криоконсервации, оцененное по плотности клеточной культуры через 16 часов культивирования.
Как видно из диаграмм, представленных на фиг. 2 насыщение суспензии клеток гелием или неоном незначительно сказывалась на целостности мембран заморожено/оттаянных клеток (окрашивание трипановым синим, фиг. 2А), но существенно улучшала их способность к пролиферации и росту (фиг. 2Б).
Пример 3. Криоконсервация фибробластов NCTCL929 с 3% глицерином под воздействием гелия, неона и атмосферного воздуха,,
В эксперименте использовали фибробластов NCTCL929. Культивирование и криоконсервацию клеток проводили аналогично описанному в примере 1, за исключением среды криоконсервирования. После дезинтеграции монослоя и центрифугирования клетки ресуспендировали в среде у DMEM (High glucose) с добавлением 10% FBS и 3% глицерина. Дальнейшие процедуры проводили как описано в примерах 1 и 2.
Результаты эксперимента, представленые на фиг. 3, показывают жизнеспособность фибробластов NCTCL929 после криоконсервации в присутствии 3% глицерина и насыщением газами гелием, неоном и под воздействием атмосферного воздуха (К). Где: А) Количество живых клеток сразу после размораживания, протестированное окрашиванием трипановым синим; Б) Развитие культуры клеток после криоконсервации, оцененное по плотности клеточной культуры через сутки культивирования.
Как видно из диаграмм, представленных на фиг. 3 насыщение суспензии клеток гелием или неоном незначительно сказывалась на целостности мембран заморожено-оттаянных клеток (окрашивание трипановым синим, фиг. 3А), но существенно улучшала их способность к пролиферации и росту (фиг. 3Б).
Пример 4. Сравнение предлагаемого метода насыщения гелием суспензии клеток HeLa и метода предобработки гелием криозащитной среды перед суспендированием клеток.
Культуру клеток HeLa культивировали и подготавливали к замораживанию аналогично приведенному в примере 1. Затем ресуспендировали клетки либо в 2 мл стандартной среды ДМЕМ с 10% FBS, либо в среды ДМЕМ с 10% FBS, предобработанной гелием. Предобработка заключалась в вакуумировании среды в течение 1 часа с последующим промыванием среды гелием в течение 30 мин. Использовали три варианта: 1) Ресуспендирование клеток в стандартной среде, затем выдержка суспензии в течение 1 часа в атмосфере гелия при 20°С согласно схеме, приведенной в примере 1; 2) Ресуспендирование клеток в криозащитной среде, предобработанной гелием, кратковременная выдержка в течение 3х минут без контакта с атмосферным воздухом, затем замораживание; 3) Ресуспендирование клеток в криозащитной среде, предобработанной гелием, выдерживание суспензии клеток в течение 1 часа в атмосфере гелия при 20°С по схеме, аналогичной приведенной в примере 1, затем замораживание. Замораживание и размораживание осуществляли аналогично описанному выше в примерах. Результаты эксперимента представлены в табл. 1.
Промышленная применимость
Заявляемое изобретение может быть выполнено из известных материалов с помощью известных средств, что позволяет сделать вывод о соответствии заявляемого изобретения критерию патентоспособности «промышленная применимость». Применение технологии обеспечивает более эффективную сохранность клеточных суспензий. Предложенный способ криоконсервирования прост в реализации, обладает воспроизводимостью и найдет широкое применение при криоконсервации клеток и в медицинской практике.
Источники информации
1. Полежаева Т.В. и др. СПОСОБ КРИОКОНСЕРВИРОВАНИЯ ЛЕЙКОЦИТОВ С КСЕНОНОМ. Патент РФ №2543534 (10.03.2015).
2. Пономарев А.И. СПОСОБ КОНСЕРВАЦИИ БИОМАТЕРИАЛА. Патент РФ №2 577 996 (20.03.2016).
3. Макеев О.Г. СПОСОБ КРИОКОНСЕРВАЦИИ МУЛЬТИПАТЕНТНЫХ МЕЗЕНХИМАЛЬНЫХ СТРОМАЛЬНЫХ КЛЕТОК. Патент РФ №2433173 (10.11.2011).
4. GOLDSTEIN S., HAMBY J. Radical retardant cryopreservation solutions. Патент США № US 7129035 (2006-10-31).
5. Намиот А.Ю. Растворимость газов в воде. М. «Недра» 1991, 167 с.
6. Косяков В.И., Шестаков В.А. Моделирование фазовых равновесий в системах вода-гелий и вода-неон. Журн. физ. химии. 2002. Т. 76. №5, с. 815-819.
7. GARZA L.A. et al. CRYOSYRINGE DESIGNED FOR STERILE LIQUID NITROGEN FREEZING, QUICK THAWING AND INJECTION OF CELLULAR SLURRIES. Международная заявка № WO 2016019108 (2016-02-04).
8. Jeon S., Kim Y.H. Cell Therapy Preparation Inducing the Release of Cellular Substances for Tissue Regeneration Международная заявка № WO 2015194872 (2015-12-30).
9. ШПРИЦЫ 3-х компонентные, http://chetp.ru/articles/meditsinsikie-raskhodnye-materialy/Odnorazovye-shpritsy.
1. Способ криосохранения суспензионной клеточной культуры, размещенной в контейнере, в среде инертного газа, отличающийся тем, что используют контейнер с регулируемым объемом и возможностью его герметизации, при этом осуществляют вывод атмосферного газа из внутреннего объема контейнера и последующий ввод объема суспензионной клеточной культуры, затем в объем контейнера вводят инертный газ при одновременном увеличении объема контейнера до величины, обеспечивающей выбранное соотношение между объемом культуры и объемом инертного газа, размещенными в контейнере, при этом регулировку объема контейнера осуществляют штоком, снабженным поршнем, далее перемешивают культуру с газом в выбранном объеме контейнера при температуре от +4 до +25°С в течение от 10 мин до 2 часов, при этом суспензию, насыщенную газом, перемещают в более компактный контейнер, с возможностью его герметизации или суспензию оставляют в контейнере с регулируемым объемом, затем контейнер помещают в морозильную камеру с температурой от -80°С до -130°С.
2. Способ по п. 1, отличающийся тем, что инертный газ выбирают из группы, состоящей из: гелия, неона, аргона, элегаза (гексафторид серы), криптона, ксенона.
3. Способ по п. 2, отличающийся тем, что в клеточную культуру вводят легкие инертные газы, входящие в группу, состоящую из неона, гелия.
4. Способ по п. 1, отличающийся тем, что соотношение объемов суспензионной культуры и объема инертного газа составляет от 0,01 до 0,1.
5. Способ по п. 1, отличающийся тем, что соотношение объемов суспензионной культуры и объема инертного газа составляет 0,05.
6. Способ по п. 1, отличающийся тем, что перемешивание объемов культуры с газом в объеме контейнера осуществляют шейкером.
7. Способ по п. 1, отличающийся тем, что давление инертного газа составляет до 5 атмосфер.
8. Способ по п. 1, отличающийся тем, что давление инертного газа равно атмосферному давлению.
9. Способ по п. 1, отличающийся тем, что контейнер выполнен на основе шприца.
10. Способ по п. 1, отличающийся тем, что контейнер выполнен на основе трехкомпонентного одноразового шприца с линиями градуировки объема.
11. Способ по п. 1, отличающийся тем, что шприц снабжен штоком, поршнем, уплотняющим кольцом, иглой с колпачком.
12. Способ по п. 1, отличающийся тем, что объем контейнера составляет от 1 до 5 мл.
13. Способ по п. 1, отличающийся тем, что емкость контейнера составляет 2 мл.
14. Способ по п. 1, отличающийся тем, что культуру с газом перемешивают в объеме контейнера при температуре от +4°С до +25°С.
15. Способ по п. 1, отличающийся тем, что температура морозильной камеры составляет -80°С.
16. Способ по п. 1, отличающийся тем, что выход контейнера, через который осуществляют ввод или вывод клеточной культуры или газа, закрывают колпачком или краном.