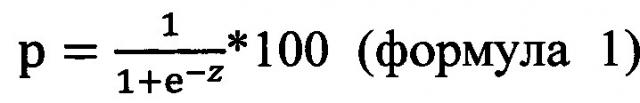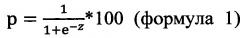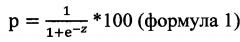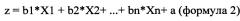Способ оценки риска прогрессирования интраэпителиальной цервикальной неоплазии и развития рака шейки матки на основе определения уровней мрнк генов человека
Иллюстрации
Показать всеИзобретение относится к области медицины, в частности к гинекологии. Предложен способ оценки риска прогрессирования цервикальной интраэпителиальной неоплазии. Измеряют уровень экспрессии мРНК генов человека MKI67, CDKN2A, CCNB1, BIRC5, AURKA, ESR1, PGR, BCL2, ВАХ, BAG1, NDRG1, PTEN, CD68, SCUBE, PTGS2 в образцах из мест поражений. Полученные в ходе реакции значения подставляют в формулу. Если значение р менее или равно пороговому значению (р≤cut-off), делают заключение об отсутствии риска прогрессирования цервикальной интраэпителиальной неоплази. Если значение р>cut-off, делают заключение о высоком риске прогрессирования цервикальной интраэпителиальной неоплазии. Изобретение позволяет оценить вероятность риска прогрессии цервикальной интраэпителиальной неоплазии и последующей малигнизации. 2 ил., 2 пр.
Реферат
1. Область техники.
Изобретение относится к области медицины (в частности, гинекологии и онкологии), а также к области науки (в частности, генетики и молекулярной биологии) и может быть использовано для оценки риска прогрессирования цервикальной интраэпителиальной неоплазии с целью выбора метода профилактики неоплазии и последующего рака шейки матки, выбора метода лечения и оценки эффективности проводимой терапии.
2. Уровень техники.
Цервикальная интраэпителиальная неоплазия (ЦИН) представляет собой заболевание шейки матки, сопровождающееся морфологическими изменениями тканей шейки матки, которые характеризуются интенсивным, патологическим размножением клеток с признаками атипии. Постепенно эти нарушенные клеточные элементы становятся основой будущей (возможной) опухоли шейки матки. Дисплазия шейки матки не имеет выраженных клинических признаков и не может быть определена во время осмотра врачом. Диагноз может быть поставлен только на основании данных цитологического и гистологического исследования. В настоящее время рекомендуется использовать классификацию ВОЗ, согласно которой цервикальная интраэпителиальная неоплазия имеет 3 степени.
1. CIN 1 (дисплазия слабой степени) характеризуется невыраженными изменениями строения эпителия с умеренной пролиферацией клеток базального слоя. Характерными признаками является наличие морфологических признаков папилломавирусной инфекции - койлоцитоз и дискератоз. Эти изменения не должны охватывать более одной трети толщины эпителиального пласта, начиная от базальной мембраны. Это создает условия для затрудненной диагностики, поскольку забор материала для цитологического исследования во время скрининговых исследований не во всех случаях может быть большим по объему и глубине.
2. CIN 2 (дисплазия средней степени) имеет более выраженные морфологические изменения. При этом поражается половина толщины эпителиального слоя, начиная от базальной мембраны.
3. CIN 3 (дисплазия тяжелой степени) характеризуется поражением более двух третей эпителиального пласта. Морфологические изменения весьма выражены. Для данной стадии характерно появление патологических митозов, а также наличие огромных гиперхромных ядер клеток.
Установлено, что разные стадии цервикальной интраэпителиальной неоплазии являются единым процессом развития рака шейки матки. При этом CIN 1 и CIN 2 представляют собой взаимно переходящие друг в друга процессы, поскольку существуют доказательства, что в ходе лечения возможен регресс опухолеобразования.
Патологичесий процесс напрямую связан с активностью вируса папилломы человека. Тем не менее, само по себе наличие высокоонкогенного типа вируса не является достаточным прогностическим маркером, особенно у молодых сексуально активных женщин ввиду высокой вероятности самопроизвольной элиминации вируса. Хотя бы раз в жизни 80-90% всех сексуально-активных людей заражаются HPV. При этом в 80% случаев вирус элиминируется из организма в течение 2-х лет и не имеет клинического значения. Поэтому ВПЧ-тестирование, являющееся на сегодня наиболее частым предиктором развития рака шейки матки, признано неинформативным у молодых женщин и не проводится до 30 лет.
В то же время поражения, характерные для CIN 1, могут быть обусловлены не только папилломавирусной инфекцией. Причины многообразны. Это могут быть и инфекционно-воспалительные процессы, вызванные различными урогенитальными инфекциями, и дистрофические процессы в шейке матки и состояния, связанные с недостаточностью уровня эстрогенов.
Сегодня существует три варианта лечения цервикальной интраэпителиальной неоплазии: 1) немедленное лечение, 2) активное лечение и 3) вариант выжидательной тактики. К сожалению, до настоящего времени не выделены надежные молекулярно-генетические предикторы, на основании которых можно было бы с высокой прогностической значимостью предсказать развитие процесса от спонтанной регрессии до прогрессии в рак, что существенно затрудняет развитие профилактического направления и дифференцированных подходов к ведению больных.
Основная задача диагностического метода должна состоять в том, чтобы научиться выделять из огромной когорты пациенток с CIN1 и CIN2 и ВПЧ-инфицированных женщин тех, кто действительно находится в зоне высокого риска прогрессии опухолеобразования и развития рака шейки матки. Особенно актуален поиск маркеров, не связанных с наличием вируса папилломы человека.
Базируясь на современных знаниях о генетической регуляции внутриклеточных процессов можно утверждать, что маркерами высокого риска неопластической трансформации при предраковых поражениях шейки матки может быть огромное число молекулярно-генетических факторов, отражающих функциональное состояние генома. В настоящее время для оценки функционального состояния генома используют микрочиповые технологии, позволяющие определять уровень (относительную концентрацию в клетке) мРНК тысяч и сотен генов. Однако в силу высокой стоимости подобных исследований этот метод пока не получил широкого распространения в клинической практике. По аналогии с другими внутриклеточными процессами можно предположить, что для эффективной оценки риска развития опухоли может оказаться достаточным исследования 5-6 генетических маркеров из различных «физиологических» групп генов.
Измеряя экспрессионный профиль отдельных генов человека сравнительно недорогим методом ПЦР «в реальном времени», можно по уровню представленности транскриптов этих (маркерных) генов, дать прогноз развития заболевания и оценить вероятность риска прогрессии цервикальной интраэпителиальной неоплазии и последующей малигнизации.
На момент подачи заявки из открытых источников было известно о следующих близких аналогах.
- Способ прогнозирования варианта развития цервикальной интраэпителиальной неоплазии шейки матки I степени (ЦИН I) (патент РФ №2409322) от 20.01.2011. Для прогнозирования варианта развития цервикальной интраэпителиальной неоплазии I степени (ЦИН I) определяют экспрессию P16ink4(CDKN2A). Дополнительно оценивают кольпоскопическую картину с использованием индекса Reid, системы Coppleson, определяют степень распространенности койлоцитоза в биоптате. Оценку исследуемых показателей проводят с помощью прогностических коэффициентов (ПК). При кольпоскопическом индексе Reid 0-2 балла значение ПК=-3, 3 балла - ПК=+2, 4 балла - ПК=+1. При регистрации значащих кольпоскопических картин по Coppleson ПК=+2, незначащих - ПК=-2. При наличии распространенного койлоцитоза ПК=+4, при его отсутствии ПК=-1. При уровне цитоплазматической метки P16ink4α 1-10% ПК=-4, при уровне P16ink4α 11-50% - ПК-2, при уровне P16ink4α, равном 51% и более, - ПК=+5. Суммируют прогностические коэффициенты, и если сумма прогностических коэффициентов достигает конечного значения со знаком "+", выносят решение о риске неблагоприятного варианта развития ЦИН I и рекомендуют хирургическое лечение шейки матки, при достижении порога со знаком "-" - о благоприятном варианте развития ЦИН I и рекомендуют консервативное ведение пациентки. Способ позволяет определить вариант развития ЦИН I для обоснованного осуществления врачебной тактики при лечении данного заболевания.
- Способ прогнозирования предраковых заболеваний шейки матки у женщин с папилломавирусной инфекцией (патент РФ №2310197), от 10.11.2007. Способ состоит в том, что серийные срезы слизистой оболочки шейки матки женщин с папилломавирусной инфекцией исследуют иммуногистохимическим методом: обрабатывают по стрептавидин-биотиновомупероксидазному методу и инкубируют с антителами к антигену ядер пролиферирующих клеток - PCNA и к ингибитору апоптоза BCL-2. Определяют митотический индекс, апоптозный индекс (АИ), индекс метки PCNA (ИМ PCNA) и индекс метки BCL-2 (ИМ BCL-2), после чего рассчитывают коррелятивный индекс пролиферации (КИП) по формуле: КИП=Митотический индекс (ИМ PCNA (ИМ BCL - 2/АИ. Если у больных с цервикальной интраэпителиальнй неоплазией I степени значение КИП превышает 114,0, то предполагают высокую вероятность перехода заболевания в стадию цервикальной интраэпителиальной неоплазии II степени, а если значение КИП превышает 208,0, предполагают высокую вероятность перехода заболевания в стадию цервикальной интраэпителиальной неоплазии III степени или развития онкологической патологии шейки матки. Использование способа позволяет осуществить раннюю диагностику продолжения опухолевого роста и скорректировать индивидуальное лечение.
Описанные способы основаны на методах иммуногистохимического анализа с использованием поликлональных антител, не обеспечивающих высокую специфичность анализа, либо высокоспецифичных дорогостоящих зарубежных моноклональных антител. Результаты анализа в значительной степени зависят от квалификации врача-лаборанта и являются субъективными. Помимо этого в первом приведенном аналоге учитываются результаты кольпоскопии и степень распространенности койлоцитоза в биоптате.
В отличие от представленных аналогов предлагаемый способ основан на использовании метода обратной транскрипции и полимеразной цепной реакции и комплексно позволяет оценить функциональное состояние эпителия цервикального канала: степень пролиферации клеток и регуляции клеточного цикла (MKI67, CDKN2A, CCNB1, BIRC5, AURKA, SCUBE), уровень апоптоза (BCL2, В АХ, BAG1, NDRG1, PTEN), синтеза простагландинов (PTGS2), рецепторный аппарат к половым гормонам (ESR1, PGR) и иммунокомпетентных клеток (CD68).
3. Описание изобретения.
Предложен способ оценки риска прогрессирования цервикальной интраэпителиальной неоплазии по уровню транскриптов генов пролиферации и регуляции клеточного цикла (MKI67, CDKN2A, CCNB1, BIRC5, AURKA, SCUBE), апоптоза (BCL2, ВАХ, BAG1, NDRG1, PTEN), рецепторного аппарата (ESR1, PGR, CD68) и циклооксигеназы PTGS2, в образцах из мест поражений.
Уровень представленности транскриптов определяют любым пригодным для этого методом, например методом обратной транскрипции с последующей ПЦР «в реальном времени», методом микроматричного анализа или методом высокопроизводительного секвенирования (NGS).
Полученные значения уровней представленности транскриптов используют для расчета риска прогрессирования цервикальной интраэпителиальной неоплазии, например, по формуле
,
где р - риск прогрессирования цервикальной интраэпителиальной неоплазии;
z - значение регрессионной функции, определяется по формуле
,
где X1…Xn - уровень представленности мРНК отдельных генов или индекс их соотношения;
b1…bn - регрессионные коэффициенты;
а - константа.
Если значение р менее или равно пороговому значению (p≤cut-off), делают заключение об отсутствии риска прогрессирования цервикальной интраэпителиальной неоплазии; если значение p>cut-off, делают заключение о высоком риске прогрессирования цервикальной интраэпителиальной неоплазии. Пороговое значение определяют на основе экспериментальных данных с помощью ROC-анализа.
4. Реализация изобретения
Взятие материала из локусов с поражениями осуществляют путем соскобов, биопсии или во время оперативного вмешательства. Фрагменты тканей толщиной не более 0,3-0,5 мм или образцы клеток помещают в пластиковую пробирку объемом 1,5 мл, в которую предварительно внесено 500 мкл стандартной транспортной среды (например: IntactRNA, Евроген, Россия, кат № NL001), обрабатывают и хранят согласно Инструкции производителя. Выделение РНК проводят любым стандартным методом, например согласно Инструкции к Комплекту реагентов для выделения РНК и ДНК «ПРОБА-НК/ПРОБА-НК-ПЛЮС» (ЗАО "НПФ ДНК-Технология", Россия, регистрационное удостоверение № ФСР 2010/08867 от 21.09.2010 г, ТУ 9398-035-46482062-2009). Полученные препараты РНК желательно сразу использовать для постановки реакции обратной транскрипции.
Обратную транскрипцию проводят любым стандартным методом, например, согласно Инструкции к набору реагентов с использованием AMV-обратной транскриптазы (Fermentas, Литва, кат № ЕР0641) в комплектации с 5 х буфером для обратной транскрипции (состав: 250 mM Tris-HCl (рН 8.5 at 25°С), 40 mM MgCl2, 150 mM KCl, 5 mM DTT). В состав ОТ-смеси входят дНТФ в конечной концентрации 0,2 мМ каждого и смесь случайных гексамеров в конечной концентрации 0,5 рМ.
Для определения уровня представленности мРНК исследуемых генов используют стандартный метод ПЦР «в реальном времени» в стандартных условиях с праймерами, специфичными к последовательностям определяемых РНК. Обычно праймеры для ПЦР-амплификации подбирают с учетом структуры генов с целью исключения коамплификации геномной ДНК, чтобы избежать необходимости использования стадии обработки образцов ДНКазой. Например, можно использовать следующий подход: на конечный объем реакционной смеси 35 мкл состав реакционной смеси: 66 мМ трис-HCl, рН 8,8, 16,6 мМ аммония сульфат, 0,01% Tween-20, 0,001% желатин, 3 мМ хлористый магний, по 250 мкМ каждого из дНТФ по 12.5 пмоль каждого праймера и зонда, 0,8 единиц Taq-полимеразы.
Для повышения чувствительности и специфичности реакции желательно использовать «горячий» старт, который обеспечивается либо использованием Taq-полимеразы, активируемой при высокой температуре, либо методикой приготовления реакционной смеси, состоящей из двух слоев, разделенных слоем парафина. Нижний слой содержит дНТФ, праймеры и зонд, верхний - матрицу и Taq-полимеразу. Смешение слоев и превращение их в реакционную смесь происходит только при плавлении парафина, что исключает неспецифический отжиг праймеров на ДНК-мишени при начальном прогреве пробирки.
Проявку накопления продуктов реакции проводят с помощью флуоресцентно-меченых олигонуклеотидов (зондов) или интекалирующих красителей. Соотношение уровней представленности транскриптов можно рассчитывать с помощью метода ΔCq.
Риск прогрессирования цервикальной интраэпителиальной неоплазии определяется по формуле
,
где р - риск прогрессирования цервикальной интраэпителиальной неоплазии;
z - значение регрессионной функции, определяется по формуле
;
X1…Xn - уровень экспрессии мРНК генов или индекс соотношения уровня экспрессии генов;
b1…bn - регрессионные коэффициенты;
а-константа.
Примеры использования изобретения
Пример 1. В ходе исследования 225 образцов переходного эпителия цервикального канала женщин репродуктивного возраста без поражений эпителия шейки матки (n=45), с HSIL (n=55), LSIL (n=50), РШМ (n=19) и ВПЧ-носительством (n=56) был исследован весь спектр исследуемых генов.
В группе женщин с РШМ по сравнению с образцами контрольной группы была повышена экспрессия мРНК генов CDKN2A в 10,9 (р=1,7×10-5), MKI67 в 10,3 (1,6×10-8), BIRC5 в 4,4 (р=1,0×10-4), CCNB1 в 4,2 (р=1,0×10-4), AURKA в 2,6 (р=0,025) раза и снижена экспрессия мРНК генов PTEN в 1,4 (р=0,0014), ВАХ в 1,9 (р=0,016), BAG1 в 2 (р=0,0075), SCUBE в 2,5 (р=0,025), PTGS2 в 2,5 (р=2,5×10-4), BCL2 в 3,6 (р=2,2×10-4), ESR1 в 24,3 (р=3,2×10-4), PGR в 25,7 (р=3,2×10-5) раз (фиг. 1).
При сравнении образцов женщин контрольной группы и группы с РШМ путем статистического анализа (метод бинарной логистической регрессии) выбраны наиболее информативные маркеры неопластической транформации и предложен способ оценки риска прогрессирования цервикальной интраэпителиальной неоплазии путем определения соотношения представленности транскриптов [MKI67]/[PGR] и [CDKN2A]/[BCL2].
Риск прогрессирования цервикальной интраэпителиальной неоплазии определяли по формуле 1.
Уравнение регрессии имело вид
,
где [MKI67]/[PGR] - индекс соотношения уровней экспрессии мРНК генов MKI67 и PGR,
[CDKN2A]/[BCL2] - индекс соотношения уровней экспрессии мРНК генов CDKN2A и BCL2.
На основании полученной функции для каждого образца был рассчитан риск прогрессирования цервикальной интраэпителиальной неоплазии по формуле 1. Для определения критического значения вероятности (точка cutoff) был выполнен ROC-анализ. Площадь под ROC-кривой составила AUC=0,975±0,025, р=2,4×10-9, что позволило оценить модель как отличную. Пороговое значение функции в точке cut-off составило 57%. Образцы, где рассчитанный риск был больше порогового значения, оценивались как имеющие риск прогрессирования цервикальной интраэпителиальной неоплазии Чувствительность и специфичность предложенной модели в области порогового значения составила 94,7% и 100.
Результаты рассчитанных значений функции приведены на фиг. 2. Все пациентки контрольной группы были определены в свою группу. В группу высокого риска прогрессирования цервикальной интраэпителиальной неоплазии эпителия шейки матки попали 29 женщин: 5 (8.9%) - из группы ВПЧ-носительства, 9 (18%) - из группы LSIL, 15 (27.3%) - из группы HSIL.
С точки зрения прогнозирования риска прогрессирования цервикальной интраэпителиальной неоплазии для нас интерес представляли 5 пациенток из групп ВПЧ-носительства, 9 (18%) - из группы LSIL, в связи с чем они были обследованы в динамике через 6 и 12 месяцев. Обследование включало цитологическое исследование мазков с шейки матки, определение ВПЧ и расширенную кольпоскопию.
В группе ВПЧ-носительства с высоким риском прогрессирования цервикальной интраэпителиальной неоплазии через 12 месяцев у всех пациенток ВПЧ сохранялся, т.е. наблюдалась персистенция ВПЧ с вирусной нагрузкой более 5 lg/100 тыс. клеток. Во всех случаях цитологический диагноз изменился на более неблагоприятный: ASCUS у 20%, LSIL - 80% (р<0,05), при кольпоскопии ухудшений не было ни в одном случае. Таким образом, молекулярно-генетические маркеры могут рассматриваться как ранние предикторы прогнозирования прогрессирования цервикальной интраэпителиальной неоплазии.
В группе LSIL с высоким риском прогрессирования цервикальной интраэпителиальной неоплазии через 12 месяцев ВПЧ выявлялся у всех пациенток, при цитологическом исследовании диагноз LSIL сохранился у 6 (66,6%), изменился на более неблагоприятный - HSIL у 3(33,3%) (р<0,05). Не нормальная кольпоскопическая картина (плотный АБЭ, грубая пунктация) была у 4 (44,4%).
У пациенток группы ВПЧ-носительства, которые не попали в группу высокого риска, элиминация ВПЧ произошла в 24 (54,5%) случаев и только в 20 (45,5%) случаях ВПЧ сохранялся, цитологические заключения были нормальными.
У пациенток группы LSIL, которые не попали в группу высокого риска, через 12 мес.диагноз LSIL сохранился у 16 (39%), у остальных 25 (61%) - цитологические заключения были нормальными. В 21 (51,2%) случаях ВПЧ был сохранен, у 1(2,4%) пациентки выявлен другой тип ВПЧ. В даннойгруппе элиминация ВПЧ произошла в 20 (50%) случаев. Согласно данным ряда исследователей ВПЧ элиминируется самостоятельно в среднем в течение 2,5 лет. По результатам цитологии и кольпоскопии ухудшения не было выявлено ни в одной из этих групп низкого риска.
Таким образом, только у пациенток группы риска наблюдалось развитие и прогрессирование цервикальной интраэпителиальной неоплазии.
Пример 2. Пациентка Б., 32 года. Первичный визит: обнаружен ВПЧ 33 типа, вирусная нагрузка 6,1 lg копий вируса в образце; цитологическое заключение LSIL; нормальная кольпоскопическая картина.
По данным клинико-лабораторных параметров риск прогрессирования цервикальной интраэпителиальной неоплазии легкой степени, вычисленный в соответствии с формулами 1 и 3, по данным соотношения транскриптов [MKI67]/[PGR] и [CDKN2A]/[BCL2], был высоким и составил 98 баллов. В связи этим она была обследована в динамике через 6 и 12 месяцев. Обследование включало цитологическое исследование мазков с шейки матки, определение ВПЧ и расширенную кольпоскопию.
Через 6 и 12 мес у пациентки сохранялась персистенция ВПЧ с вирусной нагрузкой более 5 копий вируса в образце; цитологическое заключение через 12 мес изменилось на более неблагоприятное - HSIL, при расширенной кольпоскопии наблюдался плотный АБЭ с пунктацией исходящий из цервикального канала. Пациентке была произведена прицельная биопсия шейки матки, гистологически верифицирована цервикальная интраэпителиальная неоплазия шейки матки тяжелой степени. Пациентке была своевременно произведена конизация шейки матки, и таким образом, предотвращено развитие рака шейки матки.
Представленный клинический пример показывает, что у пациентки с высоким уровнем экспрессии мРНК генов MKI67, CDKN2A и выраженным снижением уровня экспрессии мРНК генов BCL2, PGR, был дан прогноз прогрессирования неопластического процесса шейки матки еще до развития клинических признаков. Таким образом, при уровнях интегрального критерия р выше порогового значения следует сокращать интервалы динамического наблюдения или отдавать предпочтение более доказательным методам диагностики - биопсии шейки матки с гистологическим исследованием материала, что способствует своевременному началу лечения и получению удовлетворительных результатов.
СПИСОК ЛИТЕРАТУРЫ
1. Baak JP, Mutter GL, Robboy S, van Diest PJ, Uyterlinde AM, Orbo A, Palazzo J, Fiane B, Løvslett K, Burger C, Voorhorst F, Verheijen RH. The molecular genetics and morphometry-based endometrial intraepithelial neoplasia classification system predicts disease progression in endometrial hyperplasia more accurately than the 1994 World Health Organization classification system. Cancer. 2005 Jun 1; 103 (11): 2304-12.
2. Clark TJ, Neelakantan D, Gupta JK. The management of endometrial hyperplasia: an evaluation of current practice. Eur J Obstet Gynecol Reprod Biol 2006; 125 (2): 259-64.
3. Espindola D, Kennedy KA, Fischer E.G. Management of Abnormal Uterine Bleeding and the Pathology of Endometrial Hyperplasia. Obstet Gynecol Clin N Am 2007; 34: 717-737.
4. Kimberly H. Allison, Elizabeth Tenpenny, Susan D. Reed, Elizabeth M. Swisher, Rochelle L. Garica. Immunohistochemical Markers in Endometrial Hyperplasia: Is There a Panel With Promise? A Review Appl Immunohistochem Mol Morphol Volume 16, Number 4, July 2008.
5. Steinbakk A, Gudlaugsson E, Aasprong OG, et al. Molecular biomarkers in endometrial hyperplasias predict cancer progression. Am J Obstet Gynecol 2011; 204.
6. James V. Lacey Jr., Victoria M. Chia, Endometrial hyperplasia and the risk of progression to carcinoma, Maturitas 63 (2009) 39-44.
7. Walboomers, J.M., et al., Human papillomavirus is a necessary cause of invasive cervical cancer worldwide. J Pathol, 1999. 189 (1): p. 12-9.
Описание фигур
Фиг. 1. Профиль представленности мРНК функциональных генов в мазках переходного эпителия цервикального канала женщин с РШМ относительно здорового контроля. По оси «х» перечислены гены. Значение медианы уровня экпрессии мРНК в контрольной группе принято за 1 о.е. По оси «у» отложено значение медианы уровня экспрессии мРНК в группе с РШМ (данная величина показывает во сколько раз количество мРНК выше, чем в контрольной группе). Столбцы, направленные вверх, свидетельствуют о повышении экспрессии, вниз - о понижении.
Фиг. 2. Экспериментально полученные значения функции для мазков цервикального канала женщин с РШМ, HSIL, LSIL, ВПЧ-носительством и здорового контроля. По оси «у» отложены значения функции, по оси «х» - группа исследования.
Способ оценки риска прогрессирования цервикальной интраэпителиальной неоплазии, характеризующийся тем, что измеряют уровень экспрессии мРНК генов человека MKI67, CDKN2A, CCNB1, BIRC5, AURKA, ESR1, PGR, BCL2, ВАХ, BAG1, NDRG1, PTEN, CD68, SCUBE, PTGS2 в образцах из мест поражений и полученные в ходе реакции значения уровней мРНК подставляют в формулу
,
где р - риск прогрессирования цервикальной интраэпителиальной неоплазии;
z - значение регрессионной функции, определяют по формуле
z=b1*Х1+b2*Х2+…+bn*Xn+а,
где X1…Xn - уровень экспрессии мРНК генов или индекс соотношения уровня экспрессии генов;
b1…bn - регрессионные коэффициенты;
а - константа;
при этом если значение р менее или равно пороговому значению (р≤cut-off), делают заключение об отсутствии риска прогрессирования цервикальной интраэпителиальной неоплази; если значение р>cut-off, делают заключение о высоком риске прогрессирования цервикальной интраэпителиальной неоплазии; пороговое значение определяют на основе экспериментальных данных с помощью ROC-анализа.