Катод для электролиза и способ его изготовления, и электролитическая ячейка для электролиза
Иллюстрации
Показать всеИзобретение относится к катоду для электролиза, содержащему проводящую подложку и слой катализатора на этой подложке, содержащий рутений. При этом в этом слое катализатора при измерении методом рентгеновской фотоэлектронной спектроскопии отношение максимальной интенсивности пика рутения 3d 5/2, возникающего между 281,4 эВ и 282,4 эВ, к максимальной интенсивности пика рутения 3d 5/2, возникающего между 280,0 эВ и 281,0 эВ, составляет 0,45 или более. Причем слой катализатора содержит: в качестве второго компонента, по меньшей мере один или более элементов, выбранных из группы: неодим, прометий, самарий, европий, гадолиний, тербий и диспрозий; в качестве третьего компонента, по меньшей мере один или более элементов, выбранных из группы: марганец, железо, кобальт, цинк, галлий, сера и свинец, причем количество элемента (элементов) второго компонента составляет 0,01 моль или более и менее чем 1 моль относительно 1 моль рутения, а количество элемента (элементов) третьего компонента составляет 0,01 моль или более и менее чем 1 моль относительно 1 моль рутения. Также изобретение относится к электролитической ячейке и способу изготовления катода. Катод обладает низким водородным перенапряжением и стойкостью к обратному току при остановке электролиза. 3 н. и 10 з.п. ф-лы, 17 пр., 2 табл., 10 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0001] Настоящее изобретение относится к катоду, применяемому для электролиза воды или водных растворов соединений щелочного металла, в частности, к катоду для электролиза, пригодному в качестве электрода для выделения водорода, и способу его изготовления, а также к электролитической ячейке для электролиза.
УРОВЕНЬ ТЕХНИКИ
[0002] Катод для выделения водорода применяют для электролитического получения водорода, хлора, едкого натра и т.п. посредством электролиза воды или водных растворов соединений щелочных металлов (обычно хлоридов щелочных металлов). В электрохимической промышленности снижение электропотребления, особенно, снижение напряжения электролиза является важной проблемой. В последние годы, в качестве способа электролиза водных растворов хлоридов щелочных металлов, таких как водный раствор хлорида натрия, в основном применяют способ с ионообменной мембраной и до настоящего времени выполнили различные исследования. При практическом проведении электролиза в дополнение к теоретически рассчитанному напряжению, необходимому для электролиза хлорида натрия, требуется перенапряжение анодной реакции (выделение хлора), перенапряжение катодной реакции (выделение водорода), напряжение вследствие сопротивления ионообменной мембраны, и напряжение, обусловленное межэлектродным расстоянием между анодом и катодом. Когда из этих напряжений обратили внимание на перенапряжение из-за электродной реакции, то в качестве анода для получения хлора разработали электрод на основе благородного металла, известный под названием DSA (Dimensionally Stable Anode - нерасходуемый анод); в этом электроде хлорное перенапряжение значительно снижено - до 50 мВ или менее.
[0003] С другой стороны, и для катода, предназначенного для выделения водорода, в последние годы с точки зрения экономии энергии, потребовался катод с низким водородным перенапряжением и большим сроком службы. До сих пор в качестве катода для выделения водорода использовали малоуглеродистую сталь, нержавеющую сталь и никель. Кроме того, применительно к катодам для выделения водорода исследовали методы активации поверхности с целью снижения водородного перенапряжения и по этим методам были оформлены многочисленные патентные заявки. Примеры катализаторов для катодов для выделения водорода включают никель, оксид никеля, сплав никеля с оловом, комбинацию активированного угля и оксида, оксид рутения и платину. Слои катализатора, содержащие эти катализаторы, формируют методом электроосаждения сплава, методом нанесения дисперсионного композиционного покрытия, термическим разложением, термическим напылением и за счет комбинации этих методов.
[0004] В Патентной литературе 1 (выложенная патентная заявка Японии № 2000-239882) на проводящей подложке формируют слой катализатора, состоящий из соединения на основе лантаноида и соединения платиновой группы, и таким образом изготавливают катод, имеющий низкое перенапряжение. В Патентной литературе 2 (выложенная патентная заявка Японии № 2008-133532) на проводящую подложку наносят нитрат рутения и лантановую соль карбоновой кислоты, а затем обжигают на воздухе, формируя слой катализатора, и таким образом придают этому слою долговременную стабильность даже при эксплуатации с высокой плотностью тока. В Патентной литературе 3 (выложенная патентная заявка Японии № 2008-240001) на слое катализатора формируют слой, поглощающий водород, и таким образом повышают эффективность генерации водорода.
Список литературы
Патентная литература
[0005] Патентная литература 1: выложенная патентная заявка Японии № 2000-239882.
Патентная литература 2: выложенная патентная заявка Японии № 2008-133532.
Патентная литература 3: выложенная патентная заявка Японии № 2008-240001.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Технические проблемы
[0006] Как описано выше, с целью снижения расхода электроэнергии предпринимали различные попытки и предлагали различные катоды для выделения водорода. Однако, не были разработаны катоды для выделения водорода, имеющие достаточно низкое водородное перенапряжение, обладающие стойкостью к обратному току при остановке электролиза, и имеющие стабильный слой катализатора.
[0007] Настоящее изобретение предназначено для решения описанных выше проблем, и цель настоящего изобретения заключается в предоставлении катода для электролиза, обладающего низким водородным перенапряжением и стойкостью к обратному току при остановке электролиза, а также в предоставлении способа изготовления этого катода, и электролитической ячейки для электролиза.
Решение проблем
[0008] Настоящее изобретение заключается в следующих пунктах.
[1] Катод для электролиза, содержащий проводящую подложку и слой катализатора на этой подложке, содержащий элемент рутений, где в этом слое катализатора при измерении методом рентгеновской фотоэлектронной спектроскопии отношение максимальной интенсивности пика рутения 3d 5/2, возникающего между 281,4 эВ и 282,4 эВ, к максимальной интенсивности пика рутения 3d 5/2, возникающего между 280,0 эВ и 281,0 эВ, составляет 0,45 или более.
[2] Катод для электролиза в соответствии с п.[1], в котором в слое катализатора при измерении методом рентгеновской дифракции отношение интенсивности пика оксида рутения в плоскости с индексами Миллера (101), наблюдаемой в области угла 2θ=35°, к интенсивности пика оксида рутения в плоскости с индексами Миллера (110), наблюдаемой в области угла 2θ=28°, составляет 1,5 или менее.
[3] Катод для электролиза в соответствии с п.[1] или [2], в котором проводящая подложка содержит никель.
[4] Катод для электролиза в соответствии с любым из пп.[1]-[3], в котором слой катализатора содержит в качестве второго компонента по меньшей мере один или более элементов, выбранных из группы: неодим, прометий, самарий, европий, гадолиний, тербий и диспрозий.
[5] Катод для электролиза в соответствии с любым из пп.[1]-[4], в котором количество элемента (элементов) этого второго компонента составляет 0,01 моль или более и менее чем 1 моль относительно 1 моль рутения.
[6] Катод для электролиза в соответствии с п.[5], в котором слой катализатора содержит в качестве третьего компонента по меньшей мере один или более элементов, выбранных из группы: марганец, железо, кобальт, цинк, галлий, сера и свинец.
[7] Катод для электролиза в соответствии с любым из пп.[1]-[6], в котором количество элемента (элементов) этого третьего компонента составляет 0,01 моль или более и менее чем 1 моль относительно 1 моль рутения.
[8] Катод для электролиза в соответствии с любым из пп.[4]-[7], в котором в слое катализатора по меньшей мере один из второго компонента и третьего компонента представлен оксидом или гидроксидом.
[9] Катод для электролиза в соответствии с любым из пп.[1]-[8], в котором рутений, содержащийся в слое катализатора, представлен оксидом рутения или гидроксидом рутения.
[10] Катод для электролиза в соответствии с любым из пп.[1]-[9], в котором количество рутения, нанесенного на подложку, составляет 1-20 г/м2.
[11] Электролитическая ячейка для воды или водного раствора хлорида щелочного металла, содержащая катод для электролиза в соответствие с любым из пп.[1]-[10].
[12] Способ изготовления катода для электролиза, в котором слой катализатора формируют на проводящей подложке посредством:
стадии нанесения, на которой на проводящую подложку наносят жидкость покрытия, содержащую рутений в качестве первого компонента, по меньшей мере один или более элементов, выбранных из группы: неодим, прометий, самарий, европий, гадолиний, тербий и диспрозий в качестве второго компонента, и по меньшей мере один или более элементов, выбранных из группы: марганец, железо, кобальт, цинк, галлий, сера и свинец в качестве третьего компонента;
стадии формирования пленки, на которой формируют пленку покрытия за счет сушки этой жидкости покрытия;
стадии термического разложения, на которой эту пленку покрытия подвергают нагреванию и термическому разложению.
[13] Способ изготовления катода для электролиза в соответствии с п.[12], в котором
первый компонент, содержащийся в жидкости покрытия, является по меньшей мере одним компонентом из группы: соль азотной кислоты, динитродиамминовый комплекс, нитрозил нитрат, хлорид и соль уксусной кислоты;
второй компонент является по меньшей мере одним компонентом из группы: соль азотной кислоты, хлорид и соль уксусной кислоты;
и
третий компонент является по меньшей мере одним компонентом из группы: соль азотной кислоты, хлорид и соль уксусной кислоты.
[14] Способ изготовления катода для электролиза в соответствии с п.[12] или [13], в котором стадию нанесения покрытия, стадию формирования пленки и стадию термического разложения повторяют два или более раз.
[15]Способ изготовления катода для электролиза в соответствии с любым из пп.[12]-[14], в котором стадию термического разложения проводят при температуре от 350°С или выше и до менее чем 600°С.
[16] Способ изготовления катода для электролиза в соответствии с любым из пп.[12]-[15], в котором перед стадией термического разложения проводят предварительный обжиг при температуре от 100°С или выше и менее чем 350°С в течение 1-60 минут.
[17]Способ изготовления катода для электролиза в соответствии с любым из пп.[12]-[16], в котором на стадии формирования пленки сушку жидкости покрытия проводят при температуре 100°С или ниже.
ПОЛЕЗНЫЕ ЭФФЕКТЫ ИЗОБРЕТЕНИЯ
[0009] В соответствии с настоящим изобретением предоставлен катод для электролиза, пригодный для электролиза воды или водного раствора соединения щелочного металла, обладающий низким водородным перенапряжением и стойкостью к обратному току при остановке электролиза, и способ изготовления этого катода, а также электролитическая ячейка для электролиза, оснащенная этим катодом.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
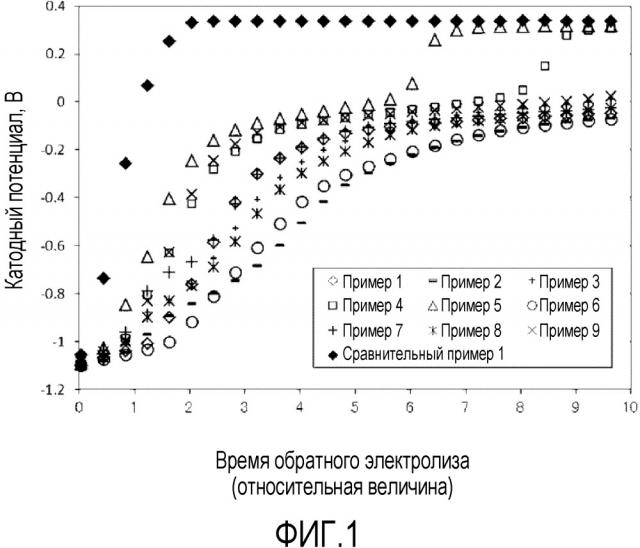
[0010] Фигура 1. На фиг.1 представлен график, показывающий характеристики увеличения катодного потенциала в тесте по приложению обратного тока катода для выделения водорода в Примерах и Сравнительном примере.
Фигура 2. На фиг.2 представлен график, показывающий характеристики увеличения катодного потенциала в тесте по приложению обратного тока катода для выделения водорода в других Примерах и другом Сравнительном примере.
Фигура 3. На фиг.3 представлена диаграмма, показывающая спектр рентгеновской фотоэлектронной спектроскопии (РФС) Примеров и Сравнительного примера 1.
Фигура 4. На фиг.4 представлена диаграмма, показывающая спектр РФС других Примеров и Сравнительного примера 1.
Фигура 5. На фиг.5 представлена диаграмма, показывающая спектр РФС других Примеров и Сравнительного примера 4.
Фигура 6. На фиг.6 представлена диаграмма, показывающая спектр РФС других Примеров и Сравнительного примера 4.
Фигура 7. На фиг.7 представлены рентгеновские дифрактограммы Примеров и Сравнительного примера 1.
Фигура 8. На фиг.8 представлены рентгеновские дифрактограммы других Примеров и Сравнительного примера 1.
Фигура 9. На фиг.9 представлены рентгеновские дифрактограммы Примеров и Сравнительного примера 4.
Фигура 10. На фиг.10 представлены рентгеновские дифрактограммы других Примеров и Сравнительного примера 4.
ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
[0011] Авторы настоящего изобретения обнаружили, что в катоде, имеющим слой катализатора, содержащий рутений (элемент Ru) и обладающий, при измерении методом РФС, отношением интенсивности пика Ru 3d 5/2, возникающего между 281,4 эВ и 282,4 эВ, к интенсивности пика Ru 3d 5/2, возникающего между 280,0 эВ и 281,0 эВ, 0,45 или более, стойкость к обратному току высокая, а водородное перенапряжение низкое. В настоящей заявке «отношение интенсивности пика Ru 3d 5/2, возникающего между 281,4 эВ и 282,4 эВ, к интенсивности пика Ru 3d 5/2, возникающего между 280,0 эВ и 281,0 эВ» означает отношение, рассчитанное из «[максимальная интенсивность пика (отсчетов в секунду) между 281,4 эВ и 282,4 эВ]/[максимальная интенсивность пика (отсчетов в секунду) между 280,0 эВ и 281,0 эВ]» (здесь и далее указанное отношение иногда называется как «первое отношение интенсивностей»).
[0012] Считается, что изменение первого отношения интенсивностей вызвано изменением электронного состояния рутения. Полагают, что пик между 280,0 эВ и 281,0 эВ обусловлен оксидом рутения. С другой стороны, полагают, что пик между 281,4 эВ и 282,4 эВ обусловлен оксидом рутения в электронном состоянии, отличном от электронного состояния для пика оксида рутения, возникающего между 280,0 эВ и 281,0 эВ, или обусловлен гидроксидом рутения. Детальный принцип пока еще не определен, однако причина увеличения водородного перенапряжения, как полагают, заключается в более высокой активности катализатора электрода в реакции образования водорода для рутения в электронном состоянии, показывающим пик между 281,4 эВ и 282,4 эВ, по сравнению с активностью катализатора электрода для рутения в электронном состоянии, показывающим пик между 280,0 эВ и 281,0 эВ. Кроме того, причина повышения стойкости к обратному току, как полагают, заключается в повышенном количестве электричества, требуемом для окисления рутения при протекании обратного тока, что обусловлено более восстановленным состоянием рутения в электронном состоянии, показывающим пик между 281,4 эВ и 282,4 эВ, по сравнению рутением в электронном состоянии, показывающим пик между 280,0 эВ и 281,0 эВ. В результате, как полагают, повышается стойкость к обратному току.
[0013] В общем считается, что реакция образования водорода вследствие электролитического восстановления воды протекает за счет комбинации следующих схем (I)-(III) реакций:
[0014]
Схема (I) реакции: H2O+e- → H⋅+OH-
Схема (II) реакции: 2H⋅ → H2
Схема (III) реакции: H⋅+H2O+e- → H2+OH-
[0015] Рассмотрим следующие два пути: последовательная реакция, состоящая из реакции, выраженной схемой (I), и реакции, выраженной схемой (II), или последовательная реакция, состоящая из реакции, выраженной схемой (I), и реакции, выраженной схемой (III). Для снижения водородного перенапряжения необходимо поддерживать лимитирующую реакцию. Неясно, какая из схем (I), (II) и (III) является стадией, лимитирующей скорость реакции, однако считается, что рутений в электронном состоянии, показывающим пик между 281,4 эВ и 282,4 эВ, по сравнению с рутением в электронном состоянии, показывающим пик между 280,0 эВ и 281,0 эВ, поддерживает реакцию, служащую в качестве лимитирующей стадии, и таким образом снижает водородное перенапряжение. Обнаружено, что когда первое отношение интенсивностей составляет 0,45 и более, то на поверхности катализатора образуется большее количество гидроксида рутения, который, как полагают, в значительно степени способствует активности катализатора. В связи с этим установлено, что добавление второго компонента и третьего компонента способствует стабильному образованию гидроксида рутения на поверхности катализатора и формированию особого слоя катализатора, проявляющего низкое водородное перенапряжение.
[0016] С точки зрения описанного выше, в настоящем варианте осуществления, при измерении методом РФС отношение максимальной интенсивности пика Ru 3d 5/2, возникающего между 281,4 эВ и 282,4 эВ, к максимальной интенсивности пика Ru 3d 5/2, возникающего между 280,0 эВ и 281,0 эВ, составляет 0,45 или более, предпочтительно 0,6 или более и более предпочтительно 0,8 или более. Верхний предел отношения максимальных интенсивностей пиков рутения 3d 5/2 составляет предпочтительно 5 или менее, более предпочтительно 4 или менее и еще более предпочтительно 3 или менее. Максимальная интенсивность каждого из пиков рутения 3d 5/2 при РФС может быть измерена тем же методом, что и в описанных ниже Примерах.
[0017] Кроме того, обнаружено, что водородное перенапряжение низкое, а стойкость к обратному току высокая в катоде со слоем катализатора, содержащим оксид рутения, показывающий при измерении методом рентгеновской дифракции меньшую величину интенсивности пика оксида рутения в плоскости с индексами Миллера (101) по сравнению с интенсивностью пика оксида рутения в плоскости с индексами Миллера (110). В данном случае, ссылаясь на Карту №431027 JCPDS (Объединенный комитет по порошковым дифракционным стандартам), дифракционную линию плоскости с индексами Миллера (110) наблюдали под углом 28°, а дифракционную линию плоскости с индексами Миллера (101) наблюдали под углом 35°. Как полагают, даже для одного и того же кристалла оксида рутения разные ориентации кристалла влияют на состояние поглощения водорода, степень поглощения водорода и т.п. поверхностью кристалла оксида рутения; поэтому считается, что ориентация кристалла вовлечена в снижение водородного перенапряжения и повышение стойкости к обратному току.
[0018] С точки зрения описанного выше, в настоящем варианте осуществления при измерении методом рентгеновской дифракции отношение (здесь и далее это отношение иногда называют как «второе отношение интенсивностей») интенсивности пика оксида рутения в плоскости с индексами Миллера (101), наблюдаемой в области угла 2θ=35°, к интенсивности пика оксида рутения в плоскости с индексами Миллера (110), наблюдаемой в области угла 2θ=28°, составляет 1,5 или менее, более предпочтительно 1,48 или менее, и еще более предпочтительно 1,30 или менее. Кроме того, нижний предел второго отношения интенсивностей составляет предпочтительно 0,30 или более, более предпочтительно 0,50 или более и еще более предпочтительно 0,60 или более. В данной заявке «отношение интенсивности пика оксида рутения в плоскости с индексами Миллера (101), наблюдаемой в области угла 2θ=35°, к интенсивности пика оксида рутения в плоскости с индексами Миллера (110), наблюдаемой в области угла 2θ=28°» означает отношение, рассчитанное из [интенсивность пика (число импульсов) оксида рутения в плоскости с индексами Миллера (101), наблюдаемой в области угла 2θ=35°]/[интенсивность пика (число импульсов) оксида рутения в плоскости с индексами Миллера (110), наблюдаемой в области угла 2θ=28°]. Отношение (второе отношение интенсивностей) между соответствующими интенсивностями пиков может быть измерено тем же методом, что и в описанных ниже Примерах.
[0019] С точки зрения описанного выше, катод для электролиза в вариантах осуществления настоящего изобретения содержит проводящую подложку и содержащий рутений слой катализатора на этой подложке, где в слое катализатора при измерении методом РФС отношение максимальной интенсивности пика Ru 3d 5/2, возникающего между 281,4 эВ и 282,4 эВ, к максимальной интенсивности пика Ru 3d 5/2, возникающего между 280,0 эВ и 281,0 эВ, составляет 0,45 или более.
Кроме того, в слое катализатора в других вариантах осуществления настоящего изобретения при измерении рентгеновской дифракции отношение интенсивности пика оксида рутения в плоскости с индексами Миллера (101), наблюдаемой в области угла 2θ=35°, к интенсивности пика оксида рутения в плоскости с индексами Миллера (110), наблюдаемой в области угла 2θ=28° может быть установлено на уровне 1,5 или менее.
Эти катоды для электролиза имеют низкое водородное перенапряжение и высокую стойкость к обратному току при остановке электролиза; таким образом, расход слоя катализатора в процессе электролиза оказывается небольшим и эти катоды для электролиза можно эксплуатировать в течение длительного периода времени. К тому же, эти катоды можно успешно применять в качестве электродов для электролиза, например в электролитических ячейках с нулевым промежутком.
[0020] Примеры материалов, пригодных в качестве проводящей подложки включают, не имея особых ограничений: никель, никелевый сплав или нержавеющую сталь. Однако, учитывая тот факт, что железо и хром вымываются при использовании нержавеющей стали в щелочном водном растворе высокой концентрации, а электропроводность нержавеющей стали составляет около 1/10 электропроводности никеля, никельсодержащая подложка является предпочтительной в качестве проводящей подложки.
[0021] Форма проводящей подложки особенно не ограничена и может быть выбрана в зависимости от назначения. Примеры применимых проводящих подложек включают, без особых ограничений: пористые пластины, просечно-вытяжные листы и плетеные сетки, изготовленные за счет переплетения никелевых проволок. Применительно к форме проводящей подложки существуют подходящие технические условия, соответствующие расстоянию между анодом и катодом в электролитической ячейке. Примеры применимой формы подложки включают, без особых ограничений: пористые пластины и просечно-вытяжные листы для анода и катода, имеющих конечное расстояние между ними; и плетеные сетки, изготовленные за счет плетения тонких проволок, для так называемых электролитических ячеек с нулевым промежутком с ионообменными мембранами и электродами, находящимися в контакте один с другим.
[0022] В проводящей подложке настоящего варианта осуществления предпочтительно ослабляют остаточные напряжения в процессе обработки путем отжига этой подложки в окислительной атмосфере. Предпочтительно на поверхности проводящей подложки с целью повышения адгезии к слою катализатора, нанесенного на эту поверхность, формируют неровности с помощью стальной сетки, алюминиевого порошка и т.п., а также увеличивают площадь поверхности за счет обработки кислотой.
[0023] Слой катализатора, нанесенный на проводящую подложку, содержит рутений. Этот элемент может присутствовать в виде соединения рутения в слое катализатора; примеры применимого соединения рутения включают оксид рутения и гидроксид рутения. Слой катализатора можно сформировать, например, путем нанесения жидкости покрытия, содержащей рутений, на проводящую подложку с последующей, при необходимости, сушкой или термическим разложением нанесенной жидкости. Как описано выше, рутений в жидкости покрытия может содержаться в виде соединения рутения.
[0024] Соединением рутения, применимым в качестве компонента жидкости покрытия для формирования слоя катализатора, может быть, например, любая форма соли азотной кислоты, динитродиамминовый комплекс, нитрозил нитрат, хлорид и соль уксусной кислоты; например, с точки зрения простоты термического разложения удобно использовать соль азотной кислоты. Концентрация металла в соединении рутения особенно не ограничена, но предпочтительно составляет от 10 г/л до 200 г/л, а более предпочтительно от 50 г/л до 120 г/л с точки зрения толщины нанесения слоя покрытия за один цикл нанесения.
[0025] Слой катализатора в дополнение к рутению может также содержать другие компоненты, например, соединение редкоземельного элемента или соединение, включающее другие элементы (третий элемент). Соединением редкоземельного элемента и третьим элементом в слое катализатора, может быть, например, любая форма соли азотной кислоты, хлорид и соль уксусной кислоты; например, с точки зрения простоты термического разложения удобно использовать соль азотной кислоты. При использовании серы можно применять серосодержащее соединение, такое как соль серной кислоты, например, сульфат натрия, сульфид, такой как сульфид аммония, или серосодержащее органическое соединение, такое как тиомочевина.
[0026] Слой катализатора включает, например, рутений в качестве первого компонента, и дополнительно может включать в качестве второго компонента по меньшей мере один или более элементов, выбранных из группы: Nd, Pm, Sm, Eu, Gd, Tb и Dy. Слой катализатора может также включать дополнительно в качестве третьего компонента по меньшей мере один или более элементов, выбранных из группы: Mn, Fe, Co, Zn, Ga, S и Pb. В слое катализатора компоненты с первого по третий могут сплавляться один с другим; например, в этом слое второй компонент и третий компонент могут образовывать твердый раствор с первым компонентом, содержащим рутений. Кроме того, при содержании второго и третьего компонентов в слое катализатора эти компоненты могут присутствовать в форме оксидов или гидроксидов в этом слое.
[0027] Обычно в процессе реакции выделения водорода при электролизе хлорида натрия потенциал катода сохраняется приблизительно на уровне -1,2 В (относительно стандартного электрода Ag/AgCl). Однако, при остановке электролиза и протекании обратного тока через катод на катоде развивается окислительная реакция и потенциал катода повышается. На этом катоде различные окислительные реакции протекают преимущественно в порядке возрастания окислительно-восстановительного потенциала (редокс-потенциала). Например, когда применяется никелевая подложка, поверхность которой покрыта слоем катализатора, содержащим рутений, в первую очередь приблизительно при -1,0 В (относительно Ag/AgCl) протекает реакция (1) окисления водорода, поглощенного на катоде. Затем, приблизительно при -0,9 В (относительно Ag/AgCl) протекает реакция (2) окисления никеля (поверхности никелевой подложки). После этого приблизительно при -0,1 В (относительно Ag/AgCl) протекает реакция (3) окисления и вымывания рутения, который является компонентом слоя катализатора.
[0028] Таким образом, реакция (3) окисления и вымывания рутения, являющегося компонентом слоя катализатора, не начинается при протекании обратного тока, но начинается после окончания реакции (1) окисления и реакции (2) окисления веществ, обладающих пониженными редокс-потенциалами. В связи с этим, повышение удельной поверхности слоя катализатора также усиливает, например, реакцию (1) окисления и реакцию (2) окисления, каждая из которых обладает пониженным редокс-потенциалом по сравнению с рутением слоя катализатора, в результате чего замедляется рост потенциала катода и, следовательно, может быть увеличен период времени до реакции (3) окисления и вымывания рутения.
[0029] Считается, что оксид (оксиды) по меньшей мере одного или более элементов, выбранных из группы: Nd, Pm, Sm, Eu, Gd, Tb и Dy, применимый в качестве описанного выше второго компонента, обладает эффектом изменения электронного состояния рутения и снижения водородного перенапряжения, а также эффектом повышения стойкости к обратному току за счет восстановления до гидроксида в процессе гидролиза для выделения водорода в водном растворе гидроксида натрия с одновременным изменением формы кристаллов в игольчатую, а также подавления отделения от подложки соединения рутения, служащего в качестве катализатора, и увеличения площади поверхности. Когда этот второй компонент в слое катализатора, а именно, по меньшей мере один или более элементов, выбранных из группы: Nd, Pm, Sm, Eu, Gd, Tb и Dy, содержится в количестве 0,01 моль или более относительно 1 моль рутения, то облегчается удерживание соединения рутения, практически не происходит физическое отделение этого соединения, проявляется эффект снижения напряжения электролиза и может быть обеспечена достаточная стойкость к обратному току. С другой стороны, если количество второго компонента менее 1 моль, то в слое покрытия, образовавшемся вследствие термического разложения, оксиды, не обладающие каталитической активностью, не покрывают полностью поверхность соединения рутения, поэтому образуется катод, имеющий низкое напряжение электролиза.
[0030] В жидкой смеси (жидкости покрытия) для формирования такого слоя катализатора, с точки зрения получения большего эффекта в слое катализатора (слое покрытия), образовавшемся в результате термического разложения компонентов указанной жидкости покрытия, а именно с точки зрения снижения водородного перенапряжения и предотвращения расхода рутения, количество по меньшей мере одного или более элементов (второго компонента), выбранных из группы: Nd, Pm, Sm, Eu, Gd, Tb и Dy в жидкости покрытия составляет предпочтительно 0,01 моль или более и менее чем 1 моль, более предпочтительно 0,02 моль или более и менее чем 1 моль, и еще более предпочтительно 0,05 моль или более и менее чем 0,5 моль относительно 1 моль рутения. Содержание второго компонента даже более предпочтительно 0,05 моль или более и менее чем 0,25 моль относительно 1 моль рутения.
[0031] С точки зрения снижения водородного перенапряжения и предотвращения расхода рутения содержание по меньшей мере одного или более элементов (второго компонента), выбранных из группы: Nd, Pm, Sm, Eu, Gd, Tb и Dy в слое катализатора составляет предпочтительно 0,01 моль или более и менее чем 1 моль, и более предпочтительно 0,02 моль или более и менее чем 1 моль относительно 1 моль рутения. Еще более предпочтительно содержание второго компонента составляет 0,05 моль или более и 0,5 моль или менее относительно 1 моль рутения. Даже более предпочтительно содержание второго компонента составляет 0,05 моль или более и 0,25 моль или менее относительно 1 моль рутения.
[0032] Когда содержание по меньшей мере одного или более элементов (третий компонент), применимого в качестве третьего компонента, выбранного из группы: Mn, Fe, Co, Zn, Ga, S и Pb, в слое катализатора составляет 0,01 моль или более относительно 1 моль рутения, то проявляется эффект снижения напряжения электролиза благодаря изменению электронного состояния рутения и обеспечивается достаточная стойкость к обратному току за счет увеличения площади поверхности. С другой стороны, когда содержание третьего компонента составляет менее 1 моль, то оксид (оксиды) по меньшей мере одного или более элементов, выбранного из группы: Mn, Fe, Co, Zn, Ga, S и Pb, не покрывают поверхность соединения рутения и в результате образуется катод, имеющий низкое напряжение электролиза.
[0033] В жидкой смеси (жидкости покрытия) для формирования такого слоя катализатора, с точки зрения получения большего эффекта в слое катализатора (слое покрытия), образовавшемся в результате термического разложения компонентов указанной жидкости покрытия, а именно с точки зрения снижения водородного перенапряжения и предотвращения расхода рутения, содержание по меньшей мере одного или более элементов (третьего компонента), выбранных из группы: Mn, Fe, Co, Zn, Ga, S и Pb в жидкости покрытия находится предпочтительно в диапазоне 0,01 моль или более и менее чем 1 моль, более предпочтительно в диапазоне 0,02 моль или более и менее чем 1 моль, и еще более предпочтительно в диапазоне 0,05 моль или более и 0,5 моль или менее, и даже еще более предпочтительно в диапазоне 0,05 моль или более и 0,25 моль или менее относительно 1 моль рутения.
[0034]С точки зрения снижения водородного перенапряжения и предотвращения расхода рутения содержание по меньшей мере одного или более элементов (третьего компонента), выбранных из группы: Mn, Fe, Co, Zn, Ga, S и Pb в слое катализатора составляет предпочтительно 0,01 моль или более и менее чем 1 моль, и более предпочтительно 0,02 моль или более и менее чем 1 моль, и еще более предпочтительно 0,05 моль или более и 0,5 моль и менее относительно 1 моль рутения. Содержание третьего компонента наиболее предпочтительно 0,05 моль или более и 0,25 моль или менее относительно 1 моль рутения.
[0035] Все оксиды Nd, Pm, Sm, Eu, Gd, Tb и Dy, которые можно добавлять в качестве второго компонента, а также оксиды Mn, Fe, Co, Zn, Ga, S и Pb, которые можно добавлять в качестве третьего компонента, могут образовывать оксиды, имеющие валентность ниже 4. Можно полагать, что в связи с этим, когда описанные выше вторые и третьи компоненты используют в слое катализатора вместе с рутением, оксиды упомянутых элементов присутствуют вокруг рутения, поэтому рутений, находящийся на границе раздела с добавленными элементами, ограничен в образовании полностью четырехвалентных оксидов и в результате валентность рутения как компонента катализатора частично изменяется. Применительно к катоду для электролиза по настоящему варианту осуществления можно считать вероятным, что в результате реакции лимитирующей стадии, протекающей под действием рутения, снижается водородное перенапряжение.
[0036] В настоящем варианте осуществления катод для электролиза может быть изготовлен методом изготовления электрода для электролиза, при котором на проводящей подложке формируют слой катализатора, применяя следующие стадии: стадию нанесения на эту подложку жидкости покрытия, содержащей рутений в качестве первого компонента, по меньшей мере один или более элементов выбранных из группы: Nd, Pm, Sm, Eu, Gd, Tb и Dy в качестве второго компонента и по меньшей мере один или более элементов выбранных из группы: Mn, Fe, Co, Zn, Ga, S и Pb в качестве третьего компонента; при необходимости, стадию формирования пленки покрытия за счет сушки жидкости покрытия; и стадию термического разложения, которую проводят путем нагревания и термического разложения этой пленки покрытия.
[0037] Стадия нанесения заключается в нанесении жидкости покрытия, содержащей по меньшей мере рутений, на проводящую подложку. Примеры жидкости покрытия включают смесь, содержащую рутений, по меньшей мере один или более элементов, выбранных из группы: Nd, Pm, Sm, Eu, Gd, Tb и Dy в качестве второго компонента и по меньшей мере один или более элементов выбранных из группы: Mn, Fe, Co, Zn, Ga, S и Pb в качестве третьего компонента. Комбинация из первого, второго и третьего компонентов в жидкости покрытия особенно не ограничена, но может быть комбинацией, в которой первый компонент жидкости покрытия является по меньшей мере одним компонентом, выбранным из группы: соль азотной кислоты, динитродиамминовый комплекс, нитрозил нитрат, хлорид и соль уксусной кислоты, второй компонент жидкости покрытия является по меньшей мере одним компонентом, выбранным из группы: соль азотной кислоты, хлорид и соль уксусной кислоты, а третий компонент жидкости покрытия является по меньшей мере одним компонентом, выбранным из группы: соль азотной кислоты, хлорид и соль уксусной кислоты.
[0038] В качестве метода нанесения жидкости покрытия для формирования слоя катализатора, такой как жидкую смесь, содержащую рутений, по меньшей мере один или более элементов, выбранных из группы: Nd, Pm, Sm, Eu, Gd, Tb и Dy в качестве второго компонента, и по меньшей мере один или более элементов выбранных из группы: Mn, Fe, Co, Zn, Ga, S и Pb в качестве третьего компонента, на проводящую подложку, можно соответствующим образом использовать, например, следующие методы: метод окунания, при котором проводящую подложку окунают в жидкость покрытия; метод нанесения жидкости покрытия с помощью кисти, метод нанесения покрытия валиком, когда жидкость покрытия наносят за счет пропитки губчатого валика этой жидкостью, и электростатический метод, при котором жидкость покрытия и проводящую подложку заряжают зарядами противоположных знаков и распыляют эту жидкость, и другие методы. Из этих методов нанесения метод нанесения валиком и электростатический метод можно рассматривать как наиболее подходящие для применения с точки зрения производительности и возможности равномерного нанесения жидкости покрытия на поверхность электрода.
[0039] Стадия формирования пленки это стадия, на которой формируют пленку покрытия путем сушки жидкости покрытия. Температура сушки жидкости покрытия на этой стадии особенно не ограничена, но предпочтительно составляет, например 100°С или ниже, а более предпочтительно от 30 до 100°С. Кроме того, длительность сушки особенно не ограничена, но может быть установлена, например, от 5 до 60 минут.
[0040] Как описано выше, в процессе формирования слоя катализатора, после нанесения жидкости покрытия на проводящую подложку (после стадии нанесения), эту жидкость сушат при температуре от 30 до 100°С в течение от 5 до 60 минут (стадия формирования пленки), а затем предпочтительно подложку с высушенной жидкостью покрытия помещают в обжиговую печь, нагретую до температуры 350°С или выше и менее чем 600°С, и высушенную жидкость покрытия подвергают термическому разложению (стадия термического разложения). На этой стадии пленку покрытия, сформированную на проводящей подложке на стадии формирования пленки, подвергают нагреву и термическому разложению. В настоящем описании «термическое разложение» означает реакцию, способствующую разложению солей металлов на металлы и газообразные вещества в процессе нагревания пленки покрытия. Хотя зависит от атмосферы, но в кислородсодержащей атмосфере многие металлы имеют склонность, связываясь с кислородом, образовывать оксиды.
[0041] На стадии термического разложения с целью стимулирования разложения жидкости покрытия для формирования слоя катализатора, такой как смеси, содержащей рутений, по меньшей мере один или более элементов, выбранных из группы: Nd, Pm, Sm, Eu, Gd, Tb и Dy в качестве второго компонента, и по меньшей мере один или более элементов выбранных из группы: Mn, Fe, Co, Zn, Ga, S и Pb в качестве третьего компонента, температура разложения предпочтительно находится в диапазоне 350°С или выше