Способ получения специфических антигенных препаратов из клинически значимых дрожжевых грибов
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к иммунологии, и может быть использовано для получения специфического белоксодержащего антигенного препарата из клинически значимых дрожжевых грибов. Для этого осуществляют культивирование дрожжей Candida albicans, либо Geotrichum candidum, либо Rhodotorula mucilaginosa, либо Cryptococcus neoformans, либо Trichosporon cutaneum в жидкой синтетической питательной среде. Затем клетки отделяют центрифугированием и фильтрацией, а бесклеточную культуральную жидкость лиофилизируют, стандартизуют по концентрации белка и используют в иммунохимических реакциях для определения уровня специфических антител к данным возбудителям микозов. Проводят анализы методами преципитации, ИФА с сыворотками крови пациентов с кандидамикозом. Перед стандартизацией дополнительно культуральную жидкость освобождают от полисахаридов и гликопротеинов путем многократного замораживания-оттаивания и проводят молекулярную фильтрацию через молекулярный фильтр с диаметром пор 100 кДа. О специфичности полученного антигенного препарата делают вывод при одном из условий, что: фракции антигенов с молекулярной массой ниже 100 кДа из видов дрожжей Candida albicans, либо Geotrichum candidum, либо Rhodotorula mucilaginosa, либо Cryptococcus neoformans, либо Trichosporon cutaneum взаимодействуют только с гомологичными сыворотками больных кандидамикозом, но не взаимодействует с сыворотками больных кандидамикозом другого рода дрожжевых грибов; уровни специфических антител к антигенному препарату у пациентов выше, чем в контрольной группе пациентов без кандидамикоза. Использование данного изобретения позволяет получить специфические белоксодержащие препараты из нескольких родов клинически значимых дрожжевых грибов, что дает возможность определить уровень специфических сывороточных и эпителиальных иммуноглобулинов при дифференциальной диагностике микозов и микоаллергозов. 1 з.п. ф-лы, 3 ил., 3 табл., 3 пр.
Реферат
Изобретение относится к области лабораторной диагностики, медицинской иммунологии и микробиологии и предназначено для определения уровня специфических антител различных классов в клинических образцах сыворотки крови и различных секретов посредством взаимодействия действия данных образцов со специфическими антигенными препаратами, получаемыми из культур клинически значимых дрожжевых грибов. Данный подход позволяет получить препараты, содержащие специфические белоксодержащие антигенные субстанции клинических дрожжевых грибов, и определить уровень специфических антител к Candida albicans, Cryptococcus neoformans, Rhodotorula mucilaginosa, Trichosporon cutaneum и Geotrichum candidum как маркера состояния гуморального иммунитета и глубины инфекционного процесса.
В последние десятилетия наблюдается интенсивное развитие клинической микологии, поскольку на фоне растущего числа вторичных иммунодефицитных состояний и антибиотикотерапии все более широкое распространение получают заболевания, ассоциированные с грибковой, в частности, дрожжевой микрофлорой. Основные усилия медицинских микологов традиционно сосредоточены на наиболее известных возбудителях микозов - Candida albicans и Cryptococcus neoformans [Mayer, F.L. et al., 2013 - https://integrity.thomson-pharma.com/integrity/xmlxsl/PK_BGR_LIST.xml_backgrounder?p_id=29#REF2103714; Cogliati, M., 2013 - https://integrity.thomson-pharma.com/integrity/xmlxsl/PK_BGR_LIST.xml_backgrounder?p_id=30#REF2123483], в то время как, с каждым годом все новые представители микобиоты переходят из разряда сапротрофов или симбионтов в разряд оппортунистов [Yapar, N., 2014 - https://integrity.thomson-pharma.com/integrity/xmlxsl/PK_BGR_LIST.xml_backgrounder?p_id=29#REF2150148]. В течение 15 лет нами собрана коллекция изолятов, среди которых физиолого-биохимическими и молекулярными методами идентифицировано 7 родов клинически значимых дрожжевых грибов [Арзуманян В.Г., 2002].
Средой обитания этих дрожжей являются все виды эпителия, в том числе - кожа. В норме на коже обитают дрожжи рода Malassezia, а в вагинальном тракте и кишечнике - некоторые виды рода Candida. У иммунокомпрометированных носителей многие виды дрожжей ассоциированы с фунгемиями, а некоторые - с аллергомикозами. Роль дрожжей в провокации аллергических заболеваний достоверно установлена пока лишь для трех наиболее известных видов - Candida albicans, Saccharomyces cerevisiae и Malassezia furfur. С сенсибилизацией к этим видам связаны такие заболевания, как бронхиальная астма, аллергический бронхолегочный микоз, атонический дерматит и аллергический ринит. Реже в этих нозологических формах могут принимать участие также дрожжи родов Geotrichum, Trichosporon и Rhodotorula.
Определение защитных антител различных классов (иммуноглобулинов) является традиционным подходом при диагностике инфекционных заболеваний, поскольку именно с уровнем антител связывают наличие и степень заболевания. Качественная диагностика фунгемий и аллергомикозов предполагает наличие панели высокоспецифичных и стандартизованных дрожжевых антигенов. На данный момент в России не производят препараты антигенов (аллергенов) из дрожжей. За рубежом коммерческий способ получения аллергенов заключается в деструкции клеток дрожжей [Savolainen J. et al., Allergy. 53(4):359-66,1998; Kosonen J. et al, Experimental Dermatology, V. 14, P. 551, 2005; Dojnov B. et al, J. Clinical Laboratory Analysis. 21(6):406-12, 2007]. В результате этого экстракт обогащается неспецифическими маннановыми компонентами, ответственными за перекрестную антигенную реактивность между различными родами дрожжей, что приводит к ложноположительным результатам диагностики. Перспективными считаются рекомбинантные методы получения аллергенов [Zargari A. et al, J. Allergy & Clin. Immunology. - 1999. - V. 103. - N5(1). - P. 877-884; Elguezabal N. et al, Mycopathologia 2005, Volume 160, Issue 2, pp 97-109], однако, они являются дорогостоящими и не обеспечивают полного набора специфических белков.
Наиболее важными в антигенном отношении являются поверхностные компоненты клеток дрожжей, поскольку именно поверхность микробной клетки является той материей, которая непосредственно взаимодействует с клетками и антителами иммунной системы хозяина [Mochon А.В. et al, PLoS Pathogens. 6(3):e1000827, 2010]. Метод выделения поверхностных белков путем экстракции клеток детергентом был апробирован нами на дрожжах Malassezia, а специфичность полученного препарата была установлена иммунологическими методами на сыворотках больных атопическим дерматитом [Арзуманян В.Г. с соавт., Бюллетень эксперим. биологии и медицины", 2000 - N11 - С. 548-551]. Применение данного метода к прочим клиническим дрожжам показало, что получаемые препараты не являются высокоспецифичными, поскольку при обработке клеток детергентом нарушается целостность мембраны цитоплазмы, и в экстракт попадают перекрестно реагирующие белки.
Наиболее близким аналогом заявленного изобретения является метод, который более совершенен за счет использования не клеточной биомассы, а внеклеточной культуральной жидкости, что значительно повысило специфичность получаемых препаратов [Arzumanian V.G. et al, Biochem. Physiol., 2013, 2:3 - http://dx.doi.org/10.4172/2168-9652.1000116].
Однако для дальнейшего повышения специфичности требовалось удалить высокомолекулярные полисахариды и гликопротеины, которые, наряду с поверхностными белками, слущиваются с поверхности клеток при культивировании. Для этого после стадии лиофилизации культуральной жидкости мы ввели еще стадию многократного замораживания-оттаивания, при котором полисахариды постепенно уходят в осадок, а также стадию фильтрования через молекулярный фильтр с диаметром пор 100 кДа.
Задачей изобретения является способ получения специфических белоксодержащих антигенных препаратов, позволяющий достоверно определить уровень специфических антител к нескольким родам клинически значимых дрожжевых грибов.
Техническим результатом изобретения является возможность получить специфические белоксодержащие препараты из нескольких родов клинически значимых дрожжевых грибов (Candida, Cryptococcus, Geotrichum, Trichosporon и Rhodotorula, вместо обычных двух - Candida и Cryptococcus), что позволяет определить уровень специфических сывороточных и эпителиальных иммуноглобулинов при дифференциальной диагностике микозов и микоаллергозов.
К техническому результату заявленного способа также относятся: удаление основного количества полисахаридов и следовых количеств полисахаридов.
Указанные задача и технический результат решаются способом получения специфических белоксодержащих антигенных препаратов из клинически значимых дрожжевых грибов, заключающимся в том, что в качестве образца осуществляют культивирование дрожжей Candida albicans в жидкой синтетической питательной среде, затем клетки отделяют центрифугированием и фильтрацией, а бесклеточную культуральную жидкость лиофилизируют, стандартизуют по концентрации белка и используют в иммунохимических реакциях для определения уровня специфических антител к данным возбудителям микозов, проводя анализы методами преципитации, ИФА с сыворотками крови пациентов с кандидамикозом, отличающийся тем, что перед стандартизацией дополнительно культуральную жидкость освобождают от полисахаридов и гликопротеинов путем многократного замораживания-оттаивания и проводят молекулярную фильтрацию через молекулярный фильтр с диаметром пор 100 кДа, причем о специфичности полученных антигенных препаратов делают вывод при одном из условий, что:
- фракции антигенов с молекулярной массой ниже 100 кДа из прочих видов дрожжей не взаимодействовали ни с одной из сывороток больных кандидамикозом;
- уровни специфических антител к антигенному препарату у пациентов в среднем или в разы выше, чем в контрольной группе;
белковые фракции антигенов ниже 100 кДа из нескольких родов клинически значимых дрожжевых грибов взаимодействуют только со своими (т.е. гомологичными) сыворотками, но не взаимодействуют с прочими сыворотками.
Данные антигенные препараты получают также из дрожжей Geotrichum candidum, либо Rhodotorula mucilaginosa, либо Cryptococcus neoformans, либо Trichosporon cutaneum. Получаемые антигены используют в реакциях с секретами эпителиальных тканей. Удаление основного количества полисахаридов достигают за счет применения дополнительной стадии многократного замораживания-оттаивания, а использование дополнительной стадии фильтрования через молекулярный фильтр с диаметром пор 100 кДа позволяет проводить удаление следовых количеств полисахаридов.
Осуществление изобретения
Способ был реализован для разных типов иммунологических реакций. Ниже показаны апробированные примеры реализации способа.
Пример 1. Реакция преципитации в геле агарозы.
В пластиковые чашки Петри диаметром 4 см вносили по 2 мл расплавленного раствора 1% агарозы и после застывания делали пробойником лунки - одну в центре и 3 радиальных.
Для реакции преципитации все антигенные препараты уравнивали по белку до концентрации 3 мг/мл и с помощью нитроцеллюлозной мембраны разделяли на 2 фракции по молекулярному весу: <100 кДа и >100 кДа. В центральную лунку каждой чашки вносили по 10 мкл растворов дрожжевых антигенов.
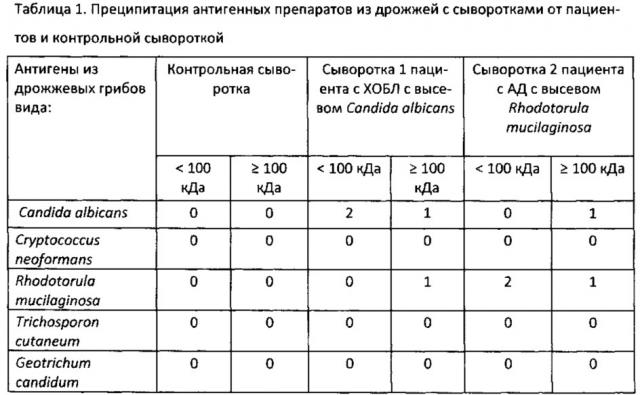
Сыворотку 1 получали от пациента в возрасте 67 лет с хронической обструктивной болезнью легких (ХОБЛ), у которого отмечена обильная обсемененность мокроты грибами Candida albicans. Сыворотку 2 получали от пациента, больного атопическим дерматитом (АД), в возрасте 6 лет, у которого отмечена обильная обсемененность лихенифицированной кожи дрожжевыми грибами Rhodotorula mucilaginosa. Контрольная сыворотка была получена от мужчины в возрасте 24 лет, не страдающего микозом и микоаллергозом. Сыворотки разводили в 40 раз и по 10 мкл вносили в радиальные лунки. Чашки с агарозой инкубировали при комнатной температуре в течение 19 часов, после чего учитывали результаты. За 0 принимали отсутствие полосы преципитации, за 1 - наличие слабой полосы преципитации, за 2 - наличие интенсивной полосы преципитации. Результаты взаимодействия приведены в таблице 1.
Из данных таблицы можно заключить, что:
- белковые фракции антигенов из Candida albicans и Rhodotorula mucilaginosa взаимодействовали только со своими (гомологичными) сыворотками, но не взаимодействовали с прочими двумя сыворотками; это свидетельствует о специфичности полученных белковых антигенов;
- гликопротеиновые (выше 100 кДа) фракции антигенов из Candida albicans и Rhodotorula mucilaginosa взаимодействовали как со своей сывороткой, так и с сывороткой больного - носителя Rhodotorula, но не взаимодействовали с контрольной сывороткой; это свидетельствует о наличии перекрестов на уровне полисахаридной фракции;
- обе фракции антигенов из прочих видов дрожжей не взаимодействовали ни с одной из сывороток, что свидетельствует о специфичности полученных антигенных препаратов.
Пример 2. Иммуноферментный анализ.
Сыворотки пациентов 1 группы получали от 6 человек с ХОБЛ в возрасте 67-73 года, у которых имелась значительная обсемененность мокроты грибами Candida albicans. Сыворотки пациентов 2 группы получали от 6 больных АД в возрасте 6-27 лет без высева грибов с поверхности кожи. Контрольные сыворотки получали от 6 женщин в возрасте 24-68 лет, не страдающих микозами и микоаллергозами.
Антигенные препараты фракции <100 кДа разводили до концентрации белка 10 мкг/мл в карбонат-бикарбонатном буфере pH 9,6 и в ячейки плоскодонной планшеты вносили по 100 мкл этих растворов, после чего инкубировали 1 час при 37 градусах и ночь в холодильнике. Утром планшеты трижды промывали с фосфатно-солевым буфером (ФСБ) и вносили по 100 мкл сывороток, разведенных в соответствующее число раз в ФСБ, после чего инкубировали 1 час при 37 градусах и трижды промывали ФСБ. Затем вносили по 100 мкл конъюгата (анти-IgG человека фирмы «Sigma») в разведении 1:400 и инкубировали 1 час при 37 градусах, промывали трижды с ФСБ и вносили по 100 мкл ТМБ. Через 15 мин реакцию останавливали, внося в ячейки по 50 мкл 2 н HCl. Оптическую плотность (ОП) измеряли на спектрофотометре при длине волны 450 нм.
Примеры типичных зависимостей оптической плотности (уровня антител) от разведения сывороток приведены на Фиг. 1-Фиг. 3.
На Фиг. 1 показан ИФА с сывороткой пациента с ХОБЛ с высевом C. albicans*
*абсцисса - кратность разведения сыворотки, ордината - ОП 450.
На Фиг. 2 показан ИФА с сывороткой пациента с АД с высевом R. mucilaginosa.
На Фиг. 3 показан ИФА с контрольной сывороткой.
Из них видно, что все три сыворотки содержали антитела к антигенному препарату из C. albicans, однако, при значительных разведениях сывороток - в 500-1000 раз - имели место значительные различия в уровнях ОП. Сыворотка пациента с АД, у которого высевались грибы R. mucilaginosa, содержала заметно более высокие уровни антител к этим грибам, чем две другие сыворотки.
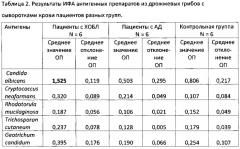
Далее приводятся усредненные данные по 18 сывороткам, которые проверяли методом ИФА при разведении в 500 раз.
Из данных таблицы 2 можно сделать следующие выводы:
- уровень IgG-антител к Candida albicans у пациентов с ХОБЛ, являющихся носителями этих дрожжей, в 2-3 раза превышает таковой в группах, где обследуемые не были носителями, что свидетельствует о специфичности полученных антигенных препаратов;
- уровень IgG-антител к Candida albicans в группе пациентов с ХОБЛ в 4-8 раз превышает таковой к остальным грибам в данной группе, что также может свидетельствовать в пользу специфичности полученных препаратов;
- наличие IgG-антител к Candida albicans в сыворотках всех групп обследованных можно объяснить более частыми контактами людей с данным видом грибов.
Важно отметить, что обсемененность мокроты дрожжами C. albicans в изученной группе пациентов с ХОБЛ значительно коррелировала с уровнем IgG-антител к этим грибам - коэффициент корреляции r=0,629.
Пример 3. Дот-блот анализ.
Образцы вагинального отделяемого (ВО) получали от 6 пациенток с острым первичным вульвовагинальным кандидозом (ВВК) в возрасте от 22 до 37 лет; контрольная группа состояла из 6 женщин такого же возраста без симптомов ВВК. Образцы собирали с помощью тампонов OBI "normal", которые затем элюировали точным объемом дистиллированной воды, полученный элюат фильтровали через мембранный фильтр с диаметром пор 0,22 мкм (удаление микрофлоры), фильтрат лиофильно высушивали, растворяли в минимальном объеме воды и использовали для дот-блот анализа. Антиген С.albicans с содержанием белка 1 мг/мл наносили на нитроцеллюлозную мембрану с размером пор 0,2 мкм фирмы Whatman по 0,8 мкл в точку, высушивали и отмывали ФР + Tween-20 (0,1%) и 3 раза дистиллированной водой. Затем мембраны с дотами инкубировали 30 мин с 80 мкл блокирующего раствора (ЗФР с 10% сыворотки крупного рогатого скота), после чего к ним добавляли по 20 мкл образцов ВО. Инкубировали в течение ночи.
По окончании инкубации жидкость удаляли, мембраны промывали, как описано выше и добавляли по 100 мкл конъюгатов в блокирующем растворе. Конъюгаты: при определении s-IgA - мышиные моноклональные антитела к s-IgA человека, конъюгированные с пероксидазой, в разведении 1:250; при определении IgG - мышиные моноклональные антитела к IgG человека, конъюгированные с пероксидазой, в разведении 1:5000. Инкубировали 1 час. По окончании инкубации жидкость удаляли, лунки с мембранами промывали, как описано выше. Затем обрабатывали проявляющим раствором, содержащим перекись водорода, ТМБ и преципитирующий реагент. Проявляли 15-20 мин. Уровни антител в ВО выражали в баллах в зависимости от яркости получаемого пятна: отсутствие пятна - 0 баллов, слабое пятно - 1 балл, и т.д. до 5 баллов.
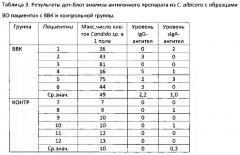
Результаты представлены в таблице 3.
Кроме уровней IgG и slgA антител в таблице имеются данные по максимальному наблюдаемому в микроскоп числу клеток Candida sp. в неокрашенном мазке в одном поле зрения при увеличении ×1750.
По результатам таблицы 3 можно заключить:
- уровни специфических антител к антигенному препарату из C. albicans в ВО у пациенток с ВВК в среднем значительно выше, чем в контрольной группе, что может свидетельствовать в пользу специфичности полученного препарата;
- уровни специфических антител к антигенному препарату из C. albicans коррелируют с обсемененностью вагины этими грибами.
1. Способ получения специфического белоксодержащего антигенного препарата из клинически значимых дрожжевых грибов, заключающийся в том, что осуществляют культивирование дрожжей Candida albicans, либо Geotrichum candidum, либо Rhodotorula mucilaginosa, либо Cryptococcus neoformans, либо Trichosporon cutaneum в жидкой синтетической питательной среде, затем клетки отделяют центрифугированием и фильтрацией, а бесклеточную культуральную жидкость лиофилизируют, стандартизуют по концентрации белка и используют в иммунохимических реакциях для определения уровня специфических антител к данным возбудителям микозов, проводя анализы методами преципитации, ИФА с сыворотками крови пациентов с кандидамикозом, отличающийся тем, что перед стандартизацией дополнительно культуральную жидкость освобождают от полисахаридов и гликопротеинов путем многократного замораживания-оттаивания и проводят молекулярную фильтрацию через молекулярный фильтр с диаметром пор 100 кДа, причем о специфичности полученного антигенного препарата делают вывод при одном из условий, что:
- фракции антигенов с молекулярной массой ниже 100 кДа из видов дрожжей Candida albicans, либо Geotrichum candidum, либо Rhodotorula mucilaginosa, либо Cryptococcus neoformans, либо Trichosporon cutaneum взаимодействуют только с гомологичными сыворотками больных кандидамикозом, но не взаимодействует с сыворотками больных кандидамикозом другого рода дрожжевых грибов;
- уровни специфических антител к антигенному препарату у пациентов выше, чем в контрольной группе пациентов без кандидамикоза.
2. Способ по п. 1, отличающийся тем, что получаемые антигены используют в реакциях с секретами эпителиальных тканей.