Способ определения истинной поверхности электролитических осадков платины, осажденных на углеродсодержащий электрод, методом инверсионной вольтамперометрии
Иллюстрации
Показать всеИзобретение относится к электрохимии, а именно к исследованию и анализу материалов путем определения электрохимических параметров при вольтамперометрических измерениях, и может быть использовано при оценке поверхности электродов, модифицированных платиной, а также поверхности высокоразвитых микро- и нанопористых катализаторов с осадками этого металла. Способ определения истинной поверхности электролитических осадков платины, осажденных на углеродсодержащий электрод, методом инверсионной вольтамперометрии заключается в том, что проводят электроокисление ионов ртути (II) с концентрацией 10 мг/дм3 на поверхность углеродсодержащего электрода в постояннотоковом режиме из растворов 1 М HCl при потенциале ЕЭ -0,8 В в течение 180 с и скорости изменения потенциала W 0,08 В/с. Затем регистрируют ток пика электроокисления ртути с поверхности углеродсодержащего электрода Id, наблюдаемый при потенциале +0,1 В х.с.э., и определяют поверхность углеродсодержащего электрода без осадка платины S0. Вносят добавки ионов платины (IV) в диапазоне концентраций от 0,03 до 0,15 мг/дм3, проводят электроокисление ионов платины (IV) в присутствии 10 мг/дм3 ионов ртути (II) при потенциале ЕЭ -0,8 В в течение 180 с и скорости изменения потенциала W 0,08 В/с. Регистрируют значения площади под пиками электроокисления ртути из двух бинарных осадков с платиной Q2, наблюдаемых в диапазоне потенциалов от +0,3 до +0,6 В. Строят график зависимости площади под пиком электроокисления ртути с поверхности углеродсодержащего электрода Q1 от концентрации ионов платины (IV). Методом экстраполяции графика находят предельное значение Q0 и определяют истинную поверхность электролитических осадков платины по определенной формуле, а поверхность углеродсодержащего электрода без осадка платины определяют из предложенного выражения. Технический результат изобретения заключается в определении истинной поверхности осадков платины при различной степени заполнения ими поверхности углеродсодержащего электрода. 1 з.п. ф-лы, 3 ил., 1 табл.
Реферат
Изобретение относится к электрохимии, а именно к исследованию и анализу материалов путем определения электрохимических параметров при вольтамперометрических измерениях, и может быть использовано при оценке поверхности электродов, модифицированных платиной, а также поверхности высокоразвитых микро- и нанопористых катализаторов с осадками этого металла.
Известен способ определения истинной поверхности Au-, Pd-, Pt-, Rh-электродов по пикам электроокисления адсорбированного кислорода методом циклической вольтамперометрии или хронопотенциометрии [Трассата С., Петрий О.А. // Электрохимия. 1993. Т. 29. №4. - С. 557]. Регистрацию анодных вольт-амперных кривых проводят в 1 н. растворе H2SO4 в потенциодинамическом режиме в интервале изменения потенциала Е от +0,5 до +1,6 В при различных скоростях изменения потенциала W от 0,01 до 0,50 В/с. Строят зависимости тока I от времени t, интегрируют полученные значения и определяют заряд QO, соответствующий монослойной адсорбции кислорода при данном заполнении поверхности электрода. Кислород адсорбируется в области непосредственно перед его выделением моноатомным слоем в количестве, относящемся к количеству атомов металла на поверхности электрода как 1:1. Истинную поверхность электродов определяют по формуле:
S=QO/QSO,
где QO - заряд, соответствующий монослойной адсорбции кислорода при данном заполнении поверхности электрода, Кл;
QSO - заряд, соответствующий насыщенному заполнению поверхности атомами адсорбированного кислорода, Кл/см2.
Воспроизводимость этого способа падает по мере роста сродства металла к кислороду. На практике такой способ используют, в основном, для электродов из золота.
Известен способ определения истинной поверхности Pt-, Rh-, Ir- и Ni-электродов по пикам электроокисления адсорбированного водорода методом анодной вольтамперометрии или хронопотенциометрии [Gilman S. // J. Phys. Chem. 1967. V 67. P. 78; J. Electroanalyt. Chem. 1964. V. 7. P. 382], выбранный в качестве прототипа. Регистрацию анодных вольт-амперных кривых проводят в 4 н. растворе H2SO4 в потенциодинамическом режиме в интервале изменения потенциала Е от -0,65 до +0,55 В при различных скоростях изменения потенциала W от 0,1 до 0,3 В/с. Строят зависимости тока I от времени t, интегрируют полученные значения и определяют заряд QH, соответствующий монослойной адсорбции водорода при данном заполнении поверхности электрода. На одном атоме металла Pt-, Rh-, Ir- и Ni адсорбируется один атом водорода. Истинную поверхность электрода определяют по формуле:
где QSH - заряд на единицу площади, зависящий от концентрации атомов на поверхности.
Для поликристаллической платины поверхностная концентрация атомов равна 1,31⋅1015 см-2, что соответствует заряду QSH=0,21 Кл/см2. Ожидаемая ошибка определения истинной поверхности составляет до 10%.
Определение конечной точки адсорбции монослоя водорода этим способом сложно, так как иногда происходит перекрывание областей адсорбции кислорода и водорода. Кроме того, высота и положение вольт-амперных пиков зависят от природы электролита вследствие возможной соадсорбции ионов.
Техническая проблема, решаемая с помощью предлагаемого изобретения, заключается в создании способа определения истинной поверхности электролитических осадков платины, осажденных на углеродсодержащий электрод, методом инверсионной вольтамперометрии, который позволяет определить истинную поверхность осадков платины при различной степени заполнения ими поверхности углеродсодержащего электрода.
Предложенный способ определения истинной поверхности электролитических осадков платины, осажденных на углеродсодержащий электрод, методом инверсионной вольтамперометрии заключается в том, что проводят электроокисление ионов ртути (II) с концентрацией 10 мг/дм3 на поверхность углеродсодержащего электрода в постояннотоковом режиме из растворов 1 М HCl при потенциале ЕЭ -0,8 В в течение 180 с и скорости изменения потенциала W 0,08 В/с. Затем регистрируют ток пика электроокисления ртути с поверхности углеродсодержащего электрода Id, наблюдаемый при потенциале +0,1 В х.с.э., и определяют поверхность углеродсодержащего электрода без осадка платины S0. Вносят добавки ионов платины (IV) в диапазоне концентраций от 0,03 до 0,15 мг/дм3, проводят электроокисление ионов платины (IV) в присутствии 10 мг/дм3 ионов ртути (II) при потенциале ЕЭ -0,8 В в течение 180 с и скорости изменения потенциала W 0,08 В/с. Регистрируют значения площади под пиками электроокисления ртути из двух бинарных осадков с платиной Q2, наблюдаемых в диапазоне потенциалов от +0,3 до +0,6 В. Строят график зависимости площади под пиком электроокисления ртути с поверхности углеродсодержащего электрода Q1 от концентрации ионов платины (IV). Методом экстраполяции графика находят предельное значение Q0 и определяют истинную поверхность электролитических осадков платины по формуле:
Поверхность углеродсодержащего электрода без осадка платины определяют из выражения:
где Id - ток пика электроокисления ртути с поверхности углеродсодержащего электрода, наблюдаемый при потенциале 0,1 В х.с.э, А;
R - универсальная газовая постоянная, Дж/(моль⋅К);
T - температура, К;
D0 - справочное значение коэффициента диффузии ионов ртути (II) в растворе, см2/с;
W - скорость изменения потенциала, В/с;
z - число электронов ртути;
F - постоянная Фарадея, Кл/моль;
с0 - концентрация ионов ртути(II) в растворе, моль/см3.
Для определения истинной поверхности электролитических осадков платины используют процесс селективного электроокисления ртути (II) из двух бинарных осадков с платиной. Заряд, пошедший на электроокисление ртути из бинарных осадков с платиной, пропорционален истинной поверхности электролитического осадка платины. В отличие от прототипа используют углеродсодержащий электрод с электролитическими осадками платины, истинная поверхность которых изменяется в зависимости от концентрации ионов платины (IV).
В отличие от прототипа высота и положение анодных вольтамперометрических пиков электроокисления ртути из двух бинарных осадков с платиной не зависят от возможной соадсорбции ионов раствора на поверхности электролитического осадка.
Кроме того, в предложенном способе не важно, образуется ли монослойный электролитический осадок на поверхности углеродсодержащего электрода или этот осадок представляет собой полислойную структуру.
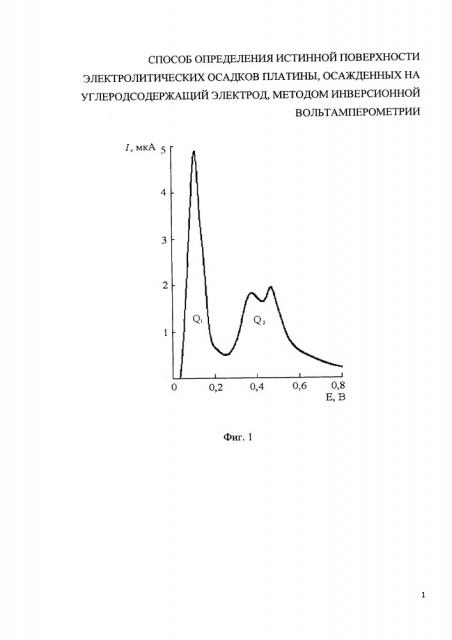
На фиг. 1 представлена анодная вольт-амперная кривая с пиками электроокисления ртути с поверхности углеродсодержащего электрода (Епа=+0,1 В) и селективного электроокисления ртути из двух бинарных осадков с платиной (Епа от +0,3 до +0,6 В).
На фиг. 2 показана зависимость площади под пиком электроокисления ртути из двух бинарных осадков с платиной Q2 от концентрации ионов платины (IV) CPt(IV) в растворе.
На фиг. 3 представлена зависимость площади под пиком электроокисления ртути с поверхности углеродсодержащего электрода Q1 от концентрации ионов платины (IV) CPt(IV) в растворе с предельным значением Q0.
В таблице 1 представлены результаты определения истинной поверхности электролитических осадков платины, осажденных на углеродсодержащий электрод, по пикам электроокисления ртути из двух бинарных осадков с платиной.
Пример. 10 мл фонового электролита 1М HCl поместили в кварцевый стаканчик, добавили аттестованный раствор ионов Hg(II) 0,01 мл из 1000 мг/дм3 (концентрация ионов ртути(II) CHg=10 мг/дм3). Запись анодных вольт-амперных кривых проводили в постояннотоковом режиме на вольтамперометрическом анализаторе ТА-4 при потенциале ЕЭ -0,8 В в течение 180 с и скорости изменения потенциала W 0,08 В/с, регистрируя ток пика электроокисления ртути с поверхности углеродсодержащего электрода Id, наблюдаемый при потенциале +0,1 В х.с.э. Затем провели расчет поверхности углеродсодержащего электрода без осадка платины S0 по формуле:
Вносили пять добавок стандартного образца ионов Pt(IV) по 0,03 мл из 1 мг/дм3 (концентрация ионов платины(IV) CPt от 0,03 до 0,15 мг/дм3). Проводили электроокисление ионов платины(IV) в присутствии 10 мг/дм3 ионов ртути(II) при потенциале ЕЭ -0,8 В в течение 180 с и скорости изменения потенциала W 0,08 В/с, регистрируя значения площади под пиками электроокисления ртути из двух бинарных осадков с платиной Q2, наблюдаемых в диапазоне потенциалов от +0,3 до +0,6 В (фиг. 1). Зависимость значений площади под пиками электроокисления ртути из двух бинарных осадков с платиной Q2 от концентрации ионов платины (IV) CPt(IV) в растворе представлены на фиг. 2.
Затем построили график зависимости площади под пиком электроокисления ртути с поверхности углеродсодержащего электрода Q1 от концентрации ионов платины (IV) CPt(IV) в растворе. Методом экстраполяции графика находили предельное значение Q0 равное 98 мкКл (фиг. 3). Истинную поверхность электролитических осадков платины определили по формуле 2. Результаты определения истинной поверхности электролитических осадков платины по пикам селективного электроокисления ртути из двух бинарных осадков платины с ртутью представлены в таблице 1.
Оценку правильности определения провели путем сравнения полученных значений истинной поверхности электролитических осадков платины со значениями, полученными способом-прототипом.
1. Способ определения истинной поверхности электролитических осадков платины, осажденных на углеродсодержащий электрод, методом инверсионной вольтамперометрии, заключающийся в том, что проводят электроокисление ионов ртути (II) с концентрацией 10 мг/дм3 на поверхность углеродсодержащего электрода в постояннотоковом режиме из растворов 1 М HCl при потенциале ЕЭ -0,8 В в течение 180 с и скорости изменения потенциала W 0,08 В/с, регистрируют ток пика электроокисления ртути с поверхности углеродсодержащего электрода Id, наблюдаемый при потенциале +0,1 В х.с.э., определяют поверхность углеродсодержащего электрода без осадка платины S0, вносят добавки ионов платины (IV) в диапазоне концентраций от 0,03 до 0,15 мг/дм3, проводят электроокисление ионов платины (IV) в присутствии 10 мг/дм3 ионов ртути (II) при потенциале ЕЭ -0,8 В в течение 180 с и скорости изменения потенциала W 0,08 В/с, регистрируют значения площади под пиками электроокисления ртути из двух бинарных осадков с платиной Q2, наблюдаемых в диапазоне потенциалов от +0,3 до +0,6 В, строят график зависимости площади под пиком электроокисления ртути с поверхности углеродсодержащего электрода Q1 от концентрации ионов платины (IV), методом экстраполяции графика находят предельное значение Q0, определяют истинную поверхность электролитических осадков платины по формуле
.
2. Способ по п. 1, отличающийся тем, что поверхность углеродсодержащего электрода без осадка платины определяют по формуле
,
где Id - ток пика электроокисления ртути с поверхности углеродсодержащего электрода, наблюдаемый при потенциале 0,1 В х.с.э, А;
R - универсальная газовая постоянная, Дж/(моль⋅К);
Т - температура, К;
D0 - справочное значение коэффициента диффузии ионов ртути (II) в растворе, см2/с;
W - скорость изменения потенциала, В/с;
z - число электронов ртути;
F - постоянная Фарадея, Кл/моль;
с0 - концентрация ионов ртути (II) в растворе, моль/см3.