Ингибирующие моноклональные антитела против фактора xii/xiia и их применения
Иллюстрации
Показать всеГруппа изобретений относится к медицине и касается моноклонального антитела против фактора XII/XIIa или его антигенсвязывающего фрагмента, аффинность связывания с фактором XIIa-бета человека которого в 2 раза больше аффинности связывания с фактором XII человека и которое способно полностью ингибировать амидолитическую активность фактора XIIa человека. Группа изобретений также касается моноклонального антитела против фактора XII/XIIa или его антигенсвязывающего фрагмента, которое ингибирует амидолитическую активность фактора XIIa-альфа на 50% больше в случае применения в молярном соотношении FXIIa-альфа к антителу 1:0,2. Группа изобретений также касается фармацевтической композиции для профилактики или лечения состояния, связанного с FXII/FXIIa, содержащей указанное антитело. Группа изобретений обеспечивает ингибирование активированного FXIIa, но не снижение уровня FXII в крови. 11 н. и 14 з.п. ф-лы, 16 ил., 14 табл., 10 пр.
Реферат
Изобретение относится к ингибирующим антителам против фактора XII/FXIIa и способам их применения.
Фактор XII (фактор Хагемана) является сывороточным гликопротеидом с молекулярной массой примерно 80 кД. Кроме автоактивации при воздействии отрицательно заряженных поверхностей, фактор XII дополнительно активируется калликреином посредством протеолитического расщепления с образованием альфа-фактора XIIa, который в свою очередь затем преобразуется, например, под действием трипсина, в бета-фактор XIIa (FXIIa-β). Альфа-фактор XIIa состоит из N-концевой тяжелой цепи молекулярной массой около 50 кД, которая содержит контактный связывающий домен, и C-концевой легкой цепи с молекулярной массой около 28 кД, которая содержит каталитический центр. Тяжелая и легкая цепи связаны дисульфидной связью. FXIIa-β представляет собой активную форму FXII около 30 кД, состоящую из полной легкой цепи и фрагмента 2000 Д тяжелой цепи, связанных дисульфидной связью.
Повреждение стенок сосудов запускает мгновенную адгезию и агрегацию тромбоцитов с последующей активацией системы свертывания плазмы и образованием содержащих фибрин кровяных сгустков, которые закрывают место повреждения. Такие явления являются ключевыми для ограничения посттравматической потери крови, но также могут закупоривать пораженные заболеванием кровеносные сосуды, приводя к ишемии и инфаркту жизненно важных органов. В каскадной модели свертывание крови происходит благодаря серии реакций, в которые вовлечена активация зимогенов за счет ограниченного протеолиза, завершающаяся образованием тромбина, который превращает фибриноген плазмы в фибрин и активирует тромбоциты. В свою очередь, прилипшие к коллагену или фибрину тромбоциты усиливают образование тромбина на несколько порядков величин за счет экспонирования прокоагулянтных фосфолипидов (главным образом, фосфатидилсерина) на их наружной поверхности, что стимулирует сборку и активацию комплексов протеаз коагуляции, и благодаря прямому взаимодействию между рецепторами тромбоцитов и факторами свертывания.
Существует два сходящихся пути коагуляции, которые запускаются либо внешними (стенка сосуда), либо внутренними (переносимыми кровью) компонентами сосудистой системы. «Внешний» путь инициируется комплексом плазменного фактора VII (FVII) с интегральным мембранным белком тканевого фактора (ТФ), важным кофактором свертывания, который отсутствует на люминальной поверхности, но в высокой степени экспрессируется в субэндотелиальных слоях сосуда, и который становится доступным или высвобождается в результате повреждения ткани. ТФ, экспрессированный в циркулирующих микровезикулах, также может вносить вклад в распространение тромба за счет поддержания образования тромбина на поверхности активированных тромбоцитов. «Внутренний» или контактный путь активации инициируется, когда фактор XII (FXII, фактор Хагемана) контактирует с отрицательно заряженными поверхностями в реакции, в которую вовлечены высокомолекулярный кининоген и плазменный калликреин. FXII может быть активирован макромолекулярными компонентами субэндотелиального матрикса, такими как гликозаминогликаны и коллагены, сульфатиды, нуклеотиды, полифосфаты и другие растворимые полианионы, или нефизиологическим материалом, таким как стекло или полимеры. Одним из наиболее мощных контактных активаторов является коалин, и такая реакции служит в качестве механистической основы для главного клинического теста свертываемости, определения активированного частичного тромбопластинового времени (АЧТВ), благодаря которому измеряют способность к коагуляции по «внутреннему» пути. В реакциях, стимулируемых тромбоцитами, активированный FXII затем активирует FXI до FXIa и затем FXIa активирует фактор IX. Комплекс FVIIIa, где такой FVIIIa был ранее активирован следами FXa и/или тромбина, и FIXa (теназный комплекс) затем активирует FX.
Несмотря на высокий потенциал в отношении индукции свертывания крови in vitro, (пато-)физиологическое значение FXII-запускаемого внутреннего пути коагуляции подвергается сомнению в связи с тем фактом, что наследственные недостаточности FXII, а также высокомолекулярного кининогена и плазменного калликреина не связаны с геморрагическими осложнениями. Вместе с данными о том, что люди и мыши, у которых отсутствуют компоненты внешнего пути, такие как ТФ и FVII, страдают тяжелыми кровотечениями, такие факты привели к современной гипотезе о том, что прекращение кровотечения in vivo требует исключительно наличия внешнего каскада (Mackman, N. 2004. Role of tissue factor in hemostasis, thrombosis, and vascular development. Arterioscler. Thromb. Vase. Biol. 24, 1015-1022).
При патологических состояниях каскад коагуляции может быть активирован ненадлежащим образом, что затем приводит к образованию гемостатических пробок внутри кровеносных сосудов. При этом сосуды могут быть закупорены и кровоснабжение дистальных органов может быть ограничено. Такой процесс известен как тромбоз, и если тромб эмболизирует, то процесс называют тромбоэмболией, которая связана с высокой смертностью. Кроме того, применение протезных устройств, которые контактируют с кровью, сильно ограничено из-за активации внутреннего каскада коагуляции. В некоторых случаях подходящее покрытие поверхности протезного устройства позволяет избежать указанной проблемы, но может мешать его функционированию в другом. Примерами таких протезных устройств являются гемодиализаторы, аппараты искусственного кровообращения, сердечные клапаны, сосудистые стенты и постоянные катетеры. В случаях использования таких устройств вводят антикоагулянты, такие как гепарин, чтобы предотвратить образование фибрина на поверхности. Однако некоторые пациенты не переносят гепарин, который может вызывать индуцируемую гепарином тромбоцитопению (HIT), приводящую к агрегации тромбоцитов и опасному для жизни тромбозу. Кроме того, недостатком, присущим всем антикоагулянтам, применяемым в клинике, является повышенный риск серьезных случаев кровотечения. Таким образом, существует большая потребность в новых типах антикоагулянтов, которые не связаны с такими осложнениями и которые можно применять на больных пациентах или применять в схеме профилактики/терапии с целью предотвращения тромбоза без повышенного риска кровотечений.
В течение более пятидесяти лет известно, что недостаточность фактора свертывания XII не связана с повышенным спонтанными или связанными с повреждениями геморрагическими осложнениями (Ratnoff OD and Colopy JE 1955. A familial hemorrhagic trait associated with a deficiency of a clot-promoting fraction of plasma. J. Clin. Invest. 34: 602-613). Действительно, несмотря на простое выявление по патологическому значению, измеряемому в АЧТВ-тесте (клинический тест на свертываемость, который направлен на внутренний путь коагуляции), люди с недостаточностью FXII не страдают от отклоняющегося от нормы кровотечения, даже во время больших хирургических процедур (Colman RW. Hemostasis and Thrombosis. Basic principles & clinical practice (eds. Colman RW, Hirsch J, Mader VJ, Clowes AW, & George J) 103-122 (Lippincott Williams & Wilkins, Philadelphia, 2001)). Напротив, недостаточность FXII была связана с повышенным риском тромбоза вен (Kuhli C et al. 2004. Factor XII deficiency: a thrombophilic risk factor for retinal vein occlusion. Am. J. Ophthalmol. 137:459-464; Halbmayer WM et al. 1993. Factor XII (Hageman factor) deficiency: a risk factor for development of thromboembolism. Incidence of FXll deficiency in patients after recurrent venous or arterial thromboembolism and myocardial infarction. Wien. Med. Wochenschr. 143:43-50). Исследования и описания клинических случаев, подтверждающие такое предположение, относятся к показательному случаю недостаточности FXII у Джона Хагемана, который умер от эмболии легких. Гипотеза о том, что недостаточность FXII связана с повышенным риском протромботического состояния, была подвергнута сомнению при недавней повторной оценке нескольких описаний клинических случаев, в исходных сообщениях о которых связывали недостаточность FXII с тромбозом (Girolami A et al. 2004. The occasional venous thromboses seen in patients with severe (homozygous) FXll deficiency are probably due to associated risk factors: A study of prevalence in 21 patients and review of the literature. J. Thromb. Thrombolysis 17:139-143). В большинстве случаев авторы идентифицировали сопутствующие наследственные или приобретенные протромботические факторы риска в сочетании с недостаточностью фактора FXII, которые могут быть ответственны за тромботическое явление, независимо от FXII. Наиболее обширные эпидемиологические исследования с использованием хорошо охарактеризованных пациентов (Koster T. et al. 1994, John Hageman's factor and deep-vein thrombosis: Leiden thrombophilia Study. Br. J. Haematol. 87: 422-424) и семей с недостаточностью FXII (Zeerleder S et al. 1999. Reevaluation of the incidence of thromboembolic complications in congenital factor XII deficiency - a study on 73 subjects from 14 Swiss families. Thromb. Haemost. 82:1240-1246) показали, что не существует корреляции недостаточности FXII и какого-либо про- или антитромботического риска. Неожиданно и в отличие от распространенного мнения специалистов в данной области было обнаружено, что управляемый фактором XII внутренний путь коагуляции вовлечен в образование тромбов артерий in vivo, но не является необходимым для нормального тканеспецифичного гемостаза (Renne T et al. 2005. Defective thrombus formation in mice lacking factor XII. J. Exp. Med. 202:271-281; Kleinschnitz C et al. 2006. Targeting coagulation factor XII provides protection from pathological thrombosis in cerebral ischemia without interfering with hemostasis. J. Exp. Med. 203, 513-518; WO2006066878). Неожиданно такие результаты помещают фактор XII в центральное положение в процессе патологического тромбообразования. Следовательно, вещества, способные мешать и блокировать активацию FXII или активность FXII, могут быть подходящими для блокирования патологического тромбообразования артерий и его клинических последствий.
В WO2006066878 предлагается применение антител против FXII/FXIIa или применение ингибиторов FXII/FXIIa. В качестве возможных ингибиторов были предложены антитромбин III (AT III), ингибитор ангиотензинпревращающего фермента, ингибитор C1, апротинин, ингибитор альфа-I-протеазы, противоболевое средство ([(S)-l-карбокси-2-фенилэтил]карбамоил-L-Arg-L-Val-аргиналь), Z-Pro-Pro-альдегиддиметилацетат, DX88 (Dyax Inc., 300 Technology Square, Cambridge, MA 02139, USA; описанные в: Williams A. and Baird LG.2003. DX-88 и HAE: a developmental perspective. Transfus. Apheresis Sci. 29: 255-258), лейпептин, ингибиторы пролилолигопептидазы, такие как Fmoc-Ala-Pyr-CN, ингибитор трипсина кукурузы, мутанты ингибиторов трипсина поджелудочной железы быка, экотин, антикоагулянтный белок желтоперой камбалы, ингибитор-V трипсина Cucurbita maxima, включая изоингибиторы Curcurbita maxima и хамадарин (который раскрыт в lsawa H et al. 2002. A mosquito salivary protein inhibits activation of the plasma contact system by binding to factor XII and high molecular weight kininogen. J. Biol. Chem. 277:27651-27658).
Идеальный ингибитор FXII/FXIIa в качестве терапевтического средства - хотя и будет проявлять высокую ингибирующую активность по отношению к FXII/FXIIa - не будет увеличивать риск кровотечения, будет неиммуногенным и его нужно будет вводить так мало, насколько это возможно - в идеале только один раз. Низкомолекулярные ингибиторы, подобные Z-Pro-Pro-альдегиддиметилацетату, будут иметь только очень короткое время полужизни после введения, таким образом, будут требовать многократных инъекций, или их нужно будет разработать в перорально доступных формах медленного высвобождения и затем также назначать постоянно в течение длительного периода времени. Белки плазмы человека, подобные ингибитору C1, на первый взгляд удовлетворял бы всем требованиям, обладая относительно высокой ингибирующей активностью по отношению к FXII/FXIIa, при этом не повышая риск кровотечения, являясь неиммуногенным, так как представляет собой белок человека, а также имея достаточно продолжительное время полужизни в плазме. В настоящее время неожиданно было обнаружено, что в модели тромбоза in vivo ингибитор C1 в качестве основного кандидата на роль ингибитора FXII/FXIIa человека не может быть успешно использован для предотвращения окклюзии. Другой предлагаемый ингибитор FXII/FXIIa из плазмы человека, а именно ингибитор AT III, по меньшей мере, не может удовлетворять второму требованию, так как риск кровотечения может быть повышен (Warren BL et al. 2001. Caring for the critically ill patient. High-dose antithrombin Ill in severe sepsis: a randomized controlled trial. JAMA 286:1869-1878).
В WO2008098720A1 предлагается применение ингибитора сериновых протеаз типа Казаля, инфестина или его доменов, или модифицированных ингибиторов сериновых протеаз типа Казаля, основанных на гомологах инфестина, в качестве ингибиторов FXII/FXIIa. Разработан выбранный из такой подгруппы рекомбинантный инфестин-4, слитый с альбумином человека для увеличения времени полужизни (rHA-инфестин-4), проявляющий высокую ингибирующую активность по отношению к FXII/FXIIa. Кроме того, такое вещество проявляло антитромботическую эффективность, не нарушая (физиологический) гемостаз, при этом имея подходящее время полужизни после слияния с альбумином человека (Hagedorn et al. 2010. Factor XIIa Inhibitor Recombinant Human Albumin Infestin-4 Abolishes Occlusive Arterial Thrombus Formation Without Affecting Bleeding. Circulation. 121:1510-1517). Однако, хотя иммуногенность была снижена во время разработки, все еще остается риск иммунных ответов у человека. Кроме того, еще более длительное время полужизни может давать дополнительные полезные эффекты. Таким образом, очевидно, что еще существует необходимость в улучшенном лекарственном средстве для лечения и/или профилактики тромбоза и сходных расстройств. Таким образом, целью настоящего изобретения является удовлетворение такой потребности. Кандидатом для такого улучшенного лекарственного средства является улучшенное анти-FXII/FXIIa-антитело с ингибирующей активностью.
Были раскрыты антитела к фактору XII. Pixley et al. (J. Biol. Chem. (1987) 262, 10140-10145) описали моноклональное антитело B7C9 к фактору XII человека. Такое антитело блокировало опосредованную поверхностью коагулянтную активность, но не амидолитическую активность фактора XIIa. Small et al. (Blood (1985), 65, 202-210) раскрыли моноклональное антитело к фактору XII человека, которое предотвращало активацию фактора XII, но не коагулянтную или амидолитическую активность активированного FXII (FXIIa). Nuijens et al. (J. Biol. Chem. (1989) 264, 12941-12949) раскрыли моноклональные антитела F1 и F3, которые ингибировали коагулирующую активность, но не амидолитическую активность FXII. В WO8911865 предлагаются моноклональные антитела, полученные против легкой цепи FXII (B6F5, C6B7, D2E10). Такие антитела ингибируют коагулирующую активность, но дают только частичное ингибирование амидолитической активности FXIIa. В WO9008835 описано получение моноклонального антитела, которое избирательно связывает FXIIa-β по сравнению с FXII, и описана разработка иммуноанализа, который позволяет специфично выявлять FXIIa-β в крови. Из примера 7 в WO9008835 ясно, что антитело не ингибирует амидолитическую активность FXIIa. В WO9117258 описано лечение сепсиса анти-FXII-антителом OT-2, которое связывается с нативным FXII в плазме и ингибирует активацию контактной системы в плазме, а также амидолитическую активность FXIIa.
Целью настоящего изобретения была разработка улучшенного антитела, которое, проявляя высокую ингибирующую активность по отношению к FXIIa, не будет повышать риск кровотечения, не будет иммуногенным и будет иметь длительное время полужизни. Так как FXII имеет мультидоменную структуру, включающую домены типа фибронектина и EGF-подобные домены (обзор в публикации Stavrou and Schmaier (2010) Thromb. Res., 125: 210-215), полагали, что FXII должен обладать дополнительными важными физиологическими функциями в дополнение к его роли в качестве FXIIa, т.е., в качестве фермента после активации. Новые исследования показали, что FXII вносит вклад в пролиферацию и рост клеток, которые приводят к ангиогенезу (обзор в публикации Schmaier and LaRusch (2010) Thromb. Haemost., 104: 915-918). Таким образом, чтобы не мешать указанным (и может быть другим неизвестным до настоящего времени) функциям FXII, терапевтическое антитело против FXII/FXIIa, предпочтительно, должно обладать более высокой аффинностью по отношению к FXIIa, например, по отношению к FXIIa-β, по сравнению с FXII.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Таким образом, один из аспектов изобретения относится к моноклональному антителу против фактора XII/FXIIa или его антигенсвязывающему фрагменту, которые имеют больше чем в 2 раза более высокую аффинность связывания с фактором XIIa-бета, чем с фактором XII человека, и которые способны ингибировать амидолитическую активность фактора XIIa человека. Другой аспект изобретения относится к моноклональному антителу против фактора XII/XIIa или его антигенсвязывающему фрагменту, которые ингибируют фактор XIIa-альфа человека более чем на 50% в случае применения в молярном соотношении FXIIa-альфа к антителу 1:0,2.
Предпочтительно, антитело или его антигенсвязывающий фрагмент обладает одним или несколькими из следующих признаков:
- связывает FXII/FXIIa мыши;
- уровень связывания антитела с полипептидом, содержащим последовательность SEQ ID NO:2 или ее соответствующий фрагмент, где (a) остаток аспарагина в положении 398 последовательности SEQ ID NO:2 заменен лизином; или (b) остаток изолейцина в положении 438 последовательности SEQ ID NO:2 заменен аланином, ниже, чем уровень связывания белка с соответствующим полипептидом, содержащим последовательность SEQ ID NO:2 или ее соответствующий фрагмент без указанной замены;
- содержит вариабельную область тяжелой цепи (vH), которая более чем на 85% идентична последовательности SEQ ID NO:4;
- содержит вариабельную область легкой цепи (vL), которая более чем на 85% идентична последовательности SEQ ID NO:5;
- содержит CDR1 тяжелой цепи, которая по меньшей мере на 80% идентична последовательности SEQ ID NO:6, и/или CDR2 тяжелой цепи, которая по меньшей мере на 60% идентична последовательности SEQ ID NO:7, и/или CDR3 тяжелой цепи, которая по меньшей мере на 80% идентична последовательности SEQ ID NO:9;
- содержит CDR1 легкой цепи, которая по меньшей мере на 50% идентична последовательности SEQ ID NO:11, и/или CDR2 легкой цепи SEQ ID NO:12 и/или CDR3 легкой цепи с последовательностью A-X1-W-X2-X3-X4-X5-R-X6-X7, где X1 может быть A или S, X5 может быть L или V, другие Xn могут представлять собой любую аминокислоту (SEQ ID NO:14);
- связывает фактор XIIa-бета человека с KD лучше чем 10-8 М;
- конкурирует с инфестином, в частности, с инфестином-4, за связывание с фактором XIIa-бета человека;
- является IgG человека или его вариантом, предпочтительно, IgG4 человека или его вариантом.
Другим аспектом изобретения является нуклеиновая кислота, кодирующая антитело или его антигенсвязывающий фрагмент согласно изобретению.
Еще одним аспектом изобретения является вектор, содержащий нуклеиновую кислоту, кодирующую антитело или его антигенсвязывающий фрагмент согласно изобретению, функционально связанную с подходящей промоторной последовательностью.
Следующим аспектом изобретения является клеточная линия или дрожжевая клетка, содержащая вектор согласно изобретению.
Другим аспектом изобретения является способ получения антитела или его антигенсвязывающего фрагмента согласно изобретению, включающий культивирование клеточной линии или дрожжевой клетки согласно изобретению в подходящих условиях, чтобы экспрессировать антитело или его антигенсвязывающий фрагмент, и очистку антитела или его антигенсвязывающего фрагмента из надосадка культуры.
Еще одним аспектом изобретения является антитело или его антигенсвязывающий фрагмент для медицинского применения.
Следующим аспектом изобретения является антитело или его антигенсвязывающий фрагмент для применения с целью профилактики и/или лечения расстройства, выбранного из группы, состоящей из венозного, артериального или капиллярного тромбообразования, тромбообразования в сердце, тромбообразования во время и/или после контакта крови человека или животного с искусственными поверхностями, тромбоэмболии, за счет предотвращения образования и/или стабилизации тромбов и, следовательно, трехмерного внутрилюминального роста тромбов или за счет профилактики и/или лечения внутрилюминальных тромбов; интерстициального заболевания легких, воспаления, неврологического воспалительного заболевания, активации комплемента, фибринолиза, ангиогенеза и заболеваний, связанных с FXII/FXIIa-индуцированным образованием кинина или FXII/FXIIa-опосредованной активацией комплемента. Еще одним аспектом изобретения является антитело или его антигенсвязывающий фрагмент для применения при лечении внутрилюминальных тромбов у человека или животного, связанных с расстройством, выбранным из группы, состоящей из венозного, артериального или капиллярного тромбообразования, тромбообразования в сердце, тромбообразования во время и/или после контакта крови человека или животного с искусственными поверхностями, тромбоэмболии; интерстициального заболевания легких, воспаления, неврологического воспалительного заболевания, активации комплемента, фибринолиза, ангиогенеза и заболеваний, связанных с FXII/FXIIa-индуцированным образованием кинина или FXII/FXIIa-опосредованной активацией комплемента. Предпочтительно, венозным или артериальным тромбообразованием является инсульт, инфаркт миокарда, тромбоз глубоких вен, тромбоз воротной вены, тромбоз почечных вен, тромбоз яремных вен, тромбоз церебральных венозных синусов, синдром Бадда-Киари или болезнь Педжета-Шреттера. Предпочтительно, заболевания, связанные с FXII/FXIIa-индуцированным образованием кинина, выбраны из группы, состоящей из наследственного ангионевротического отека, бактериальных инфекций легких, трипаносомных инфекций, гипотонического шока, панкреатита, болезни Шагаса, суставной подагры, артрита, диссеминированного внутрисосудистого свертывания (DIC) и сепсиса.
Предпочтительно, интерстициальным заболеванием легких является фибропролиферативный и/или идиопатический фиброз легких.
Предпочтительно, тромбообразование происходит во время и/или после контакта крови человека или животного с искусственными поверхностями во время и/или после медицинской процедуры, осуществляемой на указанном человеке или животном, и указанное антитело или его антигенсвязывающий фрагмент вводят до и/или во время и/или после указанной медицинской процедуры и, кроме того,
(i) искусственную поверхность подвергают воздействию по меньшей мере 80% объема крови индивида, и искусственная поверхность имеет площадь по меньшей мере 0,2 м2, или
(ii) искусственная поверхность представляет собой емкость для сбора крови вне организма индивида, или
(iii) искусственная поверхность представляет собой стент, клапан, внутрилюминальный катетер или систему для внутреннего вспомогательного перекачивания крови.
Следующим аспектом изобретения является медицинское устройство, покрытое антителом или его антигенсвязывающим фрагментом согласно изобретению, при этом устройство представляет собой аппарат искусственного кровообращения, систему экстракорпоральной мембранной оксигенации для оксигенации крови, устройство для вспомогательного перекачивания крови, устройство для диализа крови, устройство для экстракорпоральной фильтрации крови, контейнер для применения при сборе крови, внутрилюминальный катетер, стент, искусственный клапан сердца и/или комплектующие любого из указанных устройств, включая трубку, канюлю, центробежный насос, клапан, порт и/или отводящее устройство.
Другой аспект изобретения относится к антителу или его антигенсвязывающему фрагменту для применения с целью введения пациенту, подвергаемому медицинской процедуре, при этом медицинская процедура включает осуществление контакта по меньшей мере с одной из следующих частей организма:
(a) сердцем;
(b) по меньшей мере одним кровеносным сосудом, выбранным из: аорты, дуги аорты, сонной артерии, коронарной артерии, бранхиоцефальной артерии, вертебробазилярной системы кровообращения, внутричерепных артерий, почечной артерии, артерии печени, брыжеечной артерии и/или кровеносного сосуда артериальной системы, расположенной краниально по отношению к сердцу,
(c) венозным кровеносным сосудом, если пациент имеет известный дефект перегородки;
и при этом медицинская процедура включает высвобождение по меньшей мере одного эмбола, по меньшей мере, в один из указанных кровеносных сосудов в организме, что может приводить к ишемии по меньшей мере в одном органе-мишени, и введение антитела или его антигенсвязывающего фрагмента до, во время и/или после медицинской процедуры.
Другой аспект изобретения относится к антителу или его антигенсвязывающему фрагменту для применения с целью профилактики или лечения состояния, связанного с повышенной проницаемостью сосудов, в частности, с повышенной проницаемостью сосудов сетчатки, включая прогрессирующую ретинопатию, угрожающее потерей зрения осложнение ретинопатии, макулярный отек, непролиферативную ретинопатию, пролиферативную ретинопатию, отек сетчатки, диабетическую ретинопатию, гипертоническую ретинопатию и травму сетчатки.
Другой аспект изобретения относится к фармацевтической композиции, содержащей антитело или его антигенсвязывающий фрагмент согласно изобретению.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фигура 1: Конкурентный ELISA анти-FXIIa-фагов с использованием ингибитора амидолитической активности FXIIa инфестина-4. Концентрации конкурирующего агента (rHA-Inf4) показаны на оси X. Фиксированные концентрации экспрессируемого фагом Fab-антитела или инфестина-4 (pTacInf4), используемых в анализе, определяли с помощью ELISA с титрованием фагов.
Фигура 2: Зависимое от концентрации ингибирование амидолитической активности FXIIa человека моноклональным антителом 3F7 в виде полностью человеческого IgG4. Моноклональное антитело против рецептора GCSF человека C1.2 (полностью человеческий IgG4) использовали в качестве негативного контроля и rHA-инфестин в качестве позитивного контроля для анализа.
Фигура 3: Стоп-матрицы тяжелой цепи 3F7, используемые для созревания аффинности. CDR-области заштрихованы серым, и положения аминокислот в каждой библиотеке, которые были рандомизированы, обозначены «x».
Фигура 4: Стоп-матрицы легкой цепи 3F7, используемые для созревания аффинности. CDR-области заштрихованы серым, и положения аминокислот в каждой библиотеке, которые были рандомизированы, обозначены «x».
Фигура 5: Зависимое от концентрации ингибирование амидолитической активности FXIIa человека моноклональными антителами 3F7 и OT-2.
Фигура 6: A: Выравнивание каталитических доменов FXII мыши, крысы и человека и идентификация остатков, которые образуют каталитическую триаду (*), и мутации, введенные (!) для идентификации потенциального эпитопа антитела 3F7. B: Вестерн-блот, показывающий связывание 3F7 с различными мутантами.
Фигура 7: Степень окклюзии при FeCl3-индуцированном тромбозе после обработки мАт 3F7 (n = 5-25/группу).
Фигура 8: Влияние мАт 3F7 на АЧТВ (n = 5-25/группу; среднее ± SD).
Фигура 9: Влияние мАт 3F7 на ПТВ (n = 5-25/группу; среднее ± SD).
Фигура 10: Влияние мАт 3F7 на FXIIa-активность (n = 5-25/группу; среднее + SD).
Фигура 11: Влияние мАт 3F7 на время до гемостаза. Данные представлены в виде средних значений (+SD). Статистика: p > 0,05 (критерий Краскела-Уоллиса). N = 10/группу.
Фигура 12: Влияние мАт 3F7 на общую потерю крови. Данные представлены в виде средних значений (+SD). Статистика: p > 0,05 (критерий Краскела-Уоллиса). N = 10/группу.
Фигура 13: Влияние мАт 3F7 на время до гемостаза. Горизонтальные линии представляют медианные значения. Статистика: p > 0,05 (критерий Краскела-Уоллиса). N = 10/группу.
Фигура 14: Влияние мАт 3F7 на общую потерю крови. Горизонтальные линии представляют медианные значения. Статистика: p > 0,05 (критерий Краскела-Уоллиса). N = 10/группу.
Фигура 15: Сравнение АЧТВ OT-2, мАт 3F7 и вариантов мАт 3F7 с созревшей аффинностью.
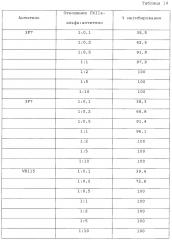
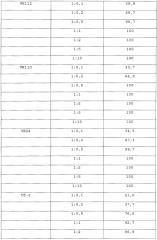
Фигура 16: Сравнение ингибирования фактора XIIa-альфа человека разными антителами.
Список последовательностей
SEQ ID NO:1: последовательность FXII человека
SEQ ID NO:2: последовательность FXII мыши
SEQ ID NO:3: последовательность FXII крысы
SEQ ID NO:4: последовательность vH 3F7
SEQ ID NO:5: последовательность vL 3F7
SEQ ID NO:6: CDR1 тяжелой цепи (HCDR1) 3F7
SEQ ID NO:7: CDR2 тяжелой цепи (HCDR2) 3F7
SEQ ID NO:8: CDR2 тяжелой цепи 3F7 с изменением
SEQ ID NO:9: CDR3 тяжелой цепи (HCDR3) 3F7
SEQ ID NO:10: CDR3 тяжелой цепи 3F7 с изменением
SEQ ID NO:11: CDR1 легкой цепи (LCDR1) 3F7
SEQ ID NO:12: CDR2 легкой цепи (LCDR2) 3F7
SEQ ID NO:13: CDR3 легкой цепи (LCDR3) 3F7
SEQ ID NO:14: CDR3 легкой цепи 3F7 с изменением
SEQ ID NO:15: стоп-матрица тяжелой цепи 3F7 H1
SEQ ID NO:16: смесь олигонуклеотидных мутагенных тримеров 3F7 H1
SEQ ID NO:17: стоп-матрица тяжелой цепи 3F7 H2
SEQ ID NO:18: смесь олигонуклеотидных мутагенных тримеров 3F7 H2
SEQ ID NO:19: стоп-матрица тяжелой цепи 3F7 H3.1
SEQ ID NO:20: смесь олигонуклеотидных мутагенных тримеров 3F7 H3.1
SEQ ID NO:21: стоп-матрица тяжелой цепи 3F7 H3.2
SEQ ID NO:22: смесь олигонуклеотидных мутагенных тримеров 3F7 H3.2
SEQ ID NO:23: стоп-матрица легкой цепи 3F7 L1
SEQ ID NO:24: смесь олигонуклеотидных мутагенных тримеров 3F7 L1
SEQ ID NO:25: стоп-матрица легкой цепи 3F7 L3.1
SEQ ID NO:26: смесь олигонуклеотидных мутагенных тримеров 3F7 L3.1
SEQ ID NO:27: стоп-матрица легкой цепи 3F7 L3.2
SEQ ID NO:28: смесь олигонуклеотидных мутагенных тримеров 3F7 L3.2
SEQ ID NO:29: CDR2 тяжелой цепи VR119
SEQ ID NO:30: CDR2 тяжелой цепи VR112
SEQ ID NO:31: CDR2 тяжелой цепи VR115
SEQ ID NO:32: CDR2 тяжелой цепи VR110
SEQ ID NO:33: CDR2 тяжелой цепи VR107
SEQ ID NO:34: CDR2 тяжелой цепи VR108
SEQ ID NO:35: CDR2 тяжелой цепи VR103
SEQ ID NO:36: CDR2 тяжелой цепи VR101
SEQ ID NO:37: CDR2 тяжелой цепи VR109
SEQ ID NO:38: CDR2 тяжелой цепи VR99
SEQ ID NO:39: CDR3 тяжелой цепи VR149
SEQ ID NO:40: CDR3 тяжелой цепи VR167
SEQ ID NO:41: CDR3 тяжелой цепи VR148
SEQ ID NO:42: CDR3 тяжелой цепи VR159
SEQ ID NO:43: CDR3 тяжелой цепи VR160
SEQ ID NO:44: CDR1 легкой цепи VR24
SEQ ID NO:45: CDR1 легкой цепи VR06
SEQ ID NO:46: CDR1 легкой цепи VR16
SEQ ID NO:47: CDR1 легкой цепи VR05
SEQ ID NO:48: CDR1 легкой цепи VR12
SEQ ID NO:49: CDR1 легкой цепи VR10
SEQ ID NO:50: CDR1 легкой цепи VR14
SEQ ID NO:51: CDR1 легкой цепи VR17
SEQ ID NO:52: CDR3 легкой цепи VR31
SEQ ID NO:53: CDR3 легкой цепи VR29
SEQ ID NO:54: CDR3 легкой цепи VR27
SEQ ID NO:55: CDR3 легкой цепи VR39
SEQ ID NO:56: CDR3 легкой цепи VR46
SEQ ID NO:57: CDR3 легкой цепи VR41
SEQ ID NO:58: CDR3 легкой цепи VR38
SEQ ID NO:59: CDR3 легкой цепи VR58
SEQ ID NO:60: CDR3 легкой цепи VR62
SEQ ID NO:61: CDR3 легкой цепи VR53
SEQ ID NO:62: CDR3 легкой цепи VR52
SEQ ID NO:63: CDR3 легкой цепи VR63
SEQ ID NO:64: Праймер для секвенирования CH1 Rev
SEQ ID NO:65: праймер для секвенирования pLacPCRfw
SEQ ID NO:66: праймер для секвенирования wt GIII stump rev
SEQ ID NO:67: праймер для секвенирования KpaCLfwd
SEQ ID NO:68: праймер для секвенирования LdaCLfwd
SEQ ID NO:69: праймер для секвенирования PUCrev
SEQ ID NO:70: праймер для секвенирования 3254
SEQ ID NO:71: праймер для секвенирования Seq CL lambda
SEQ ID NO:72: праймер для секвенирования Seq CH1
SEQ ID NO:73: последовательность vH VR115
SEQ ID NO:74: последовательность vH VR112
SEQ ID NO:75: последовательность vL VR24
SEQ ID NO:76: последовательность vH VR110
SEQ ID NO:77: последовательность vH VR119
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения была разработка улучшенного антитела, которое, проявляя высокую ингибирующую активность по отношению к FXIIa, не будет повышать риск кровотечения, будет неиммуногенным и будет иметь длительное время полужизни.
Таким образом, один из аспектов изобретения относится к моноклональному антителу против фактора XII/FXIIa или его антигенсвязывающему фрагменту, которое имеет больше чем в 2 раза более высокую аффинность связывания с фактором XIIa человека, предпочтительно, с фактором XIIa-бета человека, чем с фактором XII человека и которое способно полностью ингибировать амидолитическую активность фактора XIIa человека.
Другим аспектом изобретения является антитело или его антигенсвязывающий фрагмент, которое имеет больше чем в 2 раза более высокую аффинность связывания с фактором XIIa человека, предпочтительно, с фактором XIIa-бета человека, чем с фактором XII человека, и которое способно полностью ингибировать амидолитическую активность фактора XIIa человека и которое конкурирует с антителом, содержащим последовательности SEQ ID NO:4 и 75, экспрессированные в виде IgG4, за связывание с FXII/FXIIa.
Предпочтительно, антитело или его антигенсвязывающий фрагмент имеет больше чем в 3 раза, более предпочтительно, больше чем в 4 раза, еще более предпочтительно, больше чем в 5 раз, больше чем в 6 раз, больше чем в 8 раз, больше чем в 10 раз, больше чем в 12 раз, больше чем в 14 раз, больше чем в 16 раз, наиболее предпочтительно, больше чем в 18 раз более высокую аффинность связывания с фактором XIIa человека, предпочтительно, с фактором XIIa-бета человека, чем с фактором XII человека.
Предпочтительно, антитело или его антигенсвязывающий фрагмент полностью ингибирует амидолитическую активность FXIIa в концентрации меньше 100 нМ, более предпочтительно, меньше 50 нМ, еще более предпочтительно, меньше 40 нМ или даже меньше 30 нМ. Предпочтительно, антитело или его антигенсвязывающий фрагмент полностью ингибирует в концентрации от 1 пМ до 100 нМ, более предпочтительно, в концентрации от 5 пМ до 50 нМ. Предпочтительно, анализ амидолитической активности FXIIa осуществляют, как описано в примере 1(5).
Другой аспект изобретения относится к моноклональному антителу против фактора XII/FXIIa или его антигенсвязывающему фрагменту, которое ингибирует фактор XIIa-альфа, предпочтительно, фактор XIIa-альфа человека, более чем на 40%, предпочтительно, более чем на 50%, еще более предпочтительно, более чем на 60% при использовании в молярном соотношении FXIIa-альфа к антителу 1:0,2. Альтернативно, антитело или его антигенсвязывающий фрагмент ингибирует фактор XIIa-альфа, предпочтительно, фактор XIIa-альфа человека, более чем на 80%, предпочтительно, более чем на 85%, более предпочтительно, более чем на 90% в случае молярного соотношения FXIIa-альфа к антителу 1:0,5; наиболее предпочтительно, антитело или его антигенсвязывающий фрагмент осуществляет полное ингибирование FXIIa-альфа в случае молярного соотношения 1:0,5. Предпочтительно, антитело или его антигенсвязывающий фрагмент имеет аффинность по отношению к FXIIa человека, которая, по меньшей мере, сравнима с аффинностью антитела 3F7, раскрытого в настоящем описании.
Предпочтительно, антитело или его антигенсвязывающий фрагмент связывает FXII/FXIIa мыши; более предпочтительно, уровень связывания антитела с полипептидом, содержащим последовательность SEQ ID NO:2 или ее соответствующий фрагмент, где (a) остаток аспарагина в положении 398 последовательности SEQ ID NO:2 заменен лизином; или (b) остаток изолейцина в положении 438 последовательности SEQ ID NO:2 заменен аланином, ниже, чем уровень связывания белка с соответствующим полипептидом, содержащим последовательность SEQ ID NO:2 или ее соответствующий фрагмент без указанной замены. Соответствующий фрагмент полипептида SEQ ID NO:2 содержит каталитический центр; примерами являются легкая цепь, FXIIa-бета, FXIIa-альфа или полный FXII.
Предпочтительно, антитело или его антигенсвязывающий фрагмент содержит вариабельную область тяжелой цепи (vH), которая больше чем на 85% идентична последовательности SEQ ID NO:4, более предпочтительно, больше чем на 88%, 90%, 92%, 93%, 94%, 95%, 96%, 97%, еще более предпочтительно, на 98% или даже на 99% идентична последовательности SEQ ID NO:4. Предпочтительными вариантами осуществления изобретения являются антитела или их антигенсвязывающие фрагменты, содержащие вариабельную область тяжелой цепи с последовательностью SEQ ID NO:4, 73, 74, 76 или 77.
Предпочтительно, антитело или его антигенсвязывающий фрагмент содержит вариабельную область легкой цепи (vL), которая больше чем на 85% идентична последовательности SEQ ID NO:5, более предпочтительно, больше чем на 88%, 90%, 92%, 93%, 94%, 95%, 96%, 97%, еще более предпочтительно, на 98% или даже на 99% идентична последовательности SEQ ID NO:5. Предпочтительными вариантами осуществления изобретения являются антитела или их антигенсвязывающие фрагменты, содержащие вариабельную область легкой цепи с последовательностью SEQ ID NO:5 или 75.
Предпочтительными вариантами осуществления изобретения являются антитела или их антигенсвязывающие фрагменты с областью vH, описанной выше, в сочетании с областью vL, которая описана выше. Наиболее предпочтительными являются антитела со следующими сочетаниями vH/vL:
(a) область vH SEQ ID NO:4 в сочетании с областью vL SEQ ID NO:5 или SEQ ID NO:75;
(b) область vH с любой из последовательностей SEQ ID NO:4, 73, 74, 76 или 77 в сочетании с областью vL SEQ ID NO:5.
Предпочтительно, антитела или их антигенсвязывающие фрагменты содержат CDR1 тяжелой цепи, которая по меньшей мере на 80% идентична последовательности SEQ ID NO:6, предпочтительно, CDR1 тяжелой цепи SEQ ID NO:6 и/или CDR2 тяжелой цепи, которая по меньшей мере на 60% идентична последовательности SEQ ID NO:7 и/или CDR3 тяжелой цепи, которая по меньшей мере на 80% идентична последовательности SEQ ID NO:9. Более предпочтительно, CDR2 тяжелой цепи имеет последовательность GIX1X2X3X4X5X6TVYADSVKG (см. SEQ ID NO:8), где X1 означает R, N или D, X2 означает P, V, I или M, X3 означает S, P или A, X4 означает G, L, V или T, X5 может быть любой аминокислотой, предпочтительно, X5 означает G, Y, Q, K, R, N или M, и X6 означает T, G или S, и/или CDR3 тяжелой цепи имеет последовательность ALPRSGYLX1X2X3X4YYYYALDV (см. SEQ ID NO:10), где X1 означает I, M или