Способ определения стадии грибовидного микоза
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к дерматовенерологии, и может быть использовано для определения стадии грибовидного микоза. Сущность способа: у больного проводят биопсию кожи из очага поражения, затем проводят иммуногистохимические исследования с использованием моноклональных антител CD3, CD4, CD8 и Ki67 путем компьютерной морфометрии, затем усредняют данные показатели и рассчитывают суммарную удельную значимость иммунопозитивности указанных моноклональных антител по формуле: F=0,75⋅Х1+1,9⋅Х2+2,99⋅Х3+10,53⋅Х4+0,22, где F - суммарная удельная значимость иммунопозитивности моноклональных антител CD3, CD4, CD8 и Ki67; X1 - среднее значение объемной доли позитивной окраски CD3; Х2 - среднее значение объемной доли позитивной окраски CD4; Х3 - среднее значение объемной доли позитивной окраски CD8; Х4 - среднее значение объемной доли позитивной окраски Ki67; 0,75; 1,9; 2,99; 10,53 и 0,22 - поправочные коэффициенты. При значении F от 0,220 до 1,969 диагностируют ранние I-IIA стадии, а при значении F от 1,970 до 4,973 - поздние IIВ-III стадии грибовидного микоза. Изобретение обеспечивает повышение объективности и точности диагностирования стадии грибовидного микоза. 8 ил., 5 табл.
Реферат
Изобретение относится к медицине, а именно к дерматовенерологии, и может быть использовано для определения стадии грибовидного микоза, наиболее часто встречаемой нозологической разновидности первичных кожных лимфом.
Грибовидный микоз (ГМ) - форма первичной эпидермотропной Т-клеточной лимфомы кожи, характеризующаяся пролиферацией малых и средних Т-лимфоцитов с наличием церебриформных ядер и сопровождающаяся этапностью развития клинических проявлений в виде пятен, бляшек и опухолей [1, 2, 3]. Согласно рекомендациям Международного общества по лимфомам кожи и Европейской организации по изучению и лечению рака (ISLE-EORTC) выделяют ранние и поздние стадии развития ГМ (таблица 1). Определение стадии ГМ базируется на 4 характеристиках злокачественного процесса: Т - tumor (лат.) - «опухоль», N - nodus (лат.) - «узел», М - metastasis (лат.) - «перемещение» - наличие метастазов, В - blood «кровь» (анг.). Когда описывают стадию ГМ, под каждой буквой указывают число - оно характеризует морфологические элементы (пятна, папулы, бляшки, опухоли) и распространенность кожных проявлений, вовлечение в патологический процесс лимфатических узлов, внутренних органов и крови.
где
T1 - ограниченные пятна, папулы, и/или бляшки, покрывающие <10% кожного покрова,
Т2 - пятна, папулы, и/или бляшки, покрывающие >10% кожного покрова,
Т3 - один или более узлов (≥1 см в диаметре),
Т4 - сливающаяся эритема, покрывающая ≥80% поверхности тела,
N0 - нет увеличения периферических лимфатических узлов, их биопсия не требуется,
N1 - периферические лимфатические узлы увеличены; гистопатология Dutch grade 1 или NCILN0-2,
N2 - периферические лимфатические узлы увеличены; гистопатология Dutch grade 2 или NCILN3,
N3 - периферические лимфатические узлы увеличены; гистопатология Dutch grade 3-4 или NCILN4, клон-позитивны или негативны,
М0 - нет вовлечения внутренних органов,
М1 - вовлечение внутренних органов (с уточнением органа и морфологическим подтверждением).
В0 - отсутствие значительного вовлечения крови: атипичные (Сезари) клетки составляют ≤5% лимфоцитов периферической крови,
B1 - умеренное вовлечение крови: атипичные (Сезари) клетки составляют >5% лимфоцитов периферической крови,
В3 - значительное вовлечение крови: ≥1000/μL клеток Сезари с позитивным клоном.
Особенно сложной задачей для практикующего врача является дифференциальная диагностика перехода ранних стадий ГМ в поздние, так как между IIA и IIB стадиями заболевания в классификации очень много общего и при отсутствии изменения периферических лимфоузлов (N0-2), вовлечения крови (В0-1) и внутренних органов (М0), кардинальным отличием IIB стадии заболевания является появление хотя бы одного узла на коже. В тоже время, при почти одинаковой инфильтрации и размерах морфологических элементов на коже больного отсутствуют объективные критерии различия «бляшки» и «узла». Поэтому своевременная диагностика и правильное установление стадии развития ГМ являются приоритетными задачами дерматовенеролога и гематолога (онколога), поскольку имеют принципиальное значение при выборе оптимальной тактики лечения больного и определяют долгосрочный прогноз' заболевания. Так, терапия ранних (I-IIA) стадий ГМ предусматривает консервативный подход с постепенным наращиванием потенциала лечебных методов и технологий от тактики «наблюдай и жди» и наружной терапии топическими глюкокортикостероидами до применения ретиноидов, интерферона-α, метотрексата, ультрафиолетового облучения спектра В (311 нм), ПУВА-терапии и локальной лучевой терапии, тогда как, осуществление специализированной медицинской помощи больным с поздними (IIB-III) стадиями ГМ в учреждениях онкогематологического профиля предусматривает уже «агрессивный» подход с применением арсенала системной химиотерапии, биологических препаратов, электронно-лучевой терапии и аллогенной трансплантации гемопоэтических стволовых клеток [1, 2, 4].
Диагностический процесс при ГМ предусматривает ряд логически связанных этапов, сочетающих оценку анамнеза и клинических проявлений заболевания, анализ данных морфологических и иммуногистохимических (ИГХ) исследований, фиксирующих наличие злокачественной лимфоидной (клональной) пролиферации в коже. Проведение только гистоморфологических исследований биоптата кожи позволяет установить диагноз ГМ на ранних стадиях заболевания лишь в 16% случаев, тогда как Применение иммуноморфологического исследования клеток лимфоидного инфильтрата повышает возможность диагностики ГМ до 90% случаев. Поэтому иммуногистохимические исследования биоптата кожи считаются «золотым стандартом» диагностики ГМ, на что указывают клинические рекомендации Европейских стран и России [1, 2, 4, 5].
Анализ результатов иммуногистохимических исследований биоптата кожи в диагностике ГМ проводится на основании оценки позитивности определенных маркеров опухолевых клеток - антигенов кластеров дифференцировки (CD) на поверхности лимфоцитов. При этом врач-патоморфолог, анализирующий иммуногистохимические реакции, использует описательные и качественные приемы оценки выраженности окрашивания маркеров с применением критериев «отрицательная/положительная реакция».
Тем не менее, в литературе встречаются и усовершенствованные методики, направленные на объективизацию способа оценки иммуногистохимических маркеров с использованием критериев и балльной шкалы в зависимости от процента окрашивания опухолевых клеток (полуколичественные методы). Методика с использованием критериев предполагает следующие условные (субъективные) оценки: «0» - отсутствие окрашивания или окрашивание менее 10% опухолевых клеток с любой интенсивностью; «1+» - слабое неполное мембранное окрашивание более 10% опухолевых клеток; «2+» - от слабого до умеренного окрашивания всей цитоплазматической мембраны более 10% опухолевых клеток; «3+» - сильное окрашивание всей цитоплазматической мембраны более 10% опухолевых клеток [6].
Из числа полуколичественных методов оценки ИГХ-маркеров одним из наиболее широко применяемых в онкомаммологии и гинекологии является расчет диагностических баллов по Allred D.C. Данная методика суммарной бальной оценки состоит из двух разделов, где раздел «а» - доля окрашенных опухолевых клеток от 0 до 5 баллов (0 баллов - отсутствие окрашивания; 1 балл - количество окрашенных клеток >0, но меньше 1/100; 2 балла - от >1/100 до 1/10; 3 балла - от >1/10 до 1/3; 4 балла - от >1/3 до 2/3; 5 баллов - от >2/3 до 1); раздел «б» - оценка интенсивности окраски опухолевых клеток (от 0 до 3 баллов). Далее вычисляется суммарный балл, состоящий из доли и интенсивности окраски изучаемых клеток, однако, определение процента и интенсивности окрашивания ИГХ-маркеров также продолжает основываться на субъективной оценке исследователя [7, 8].
В отечественной практике Сыдиковым А.А., Заславским Д.В. и соавторами для анализа результатов иммуногистохимических реакций был использован полуколичественный метод, где экспрессия исследуемого маркера расценивалась как слабая «+» при наличии окрашенных гранул в 1-50 клетках, умеренная «++» - в 51-100 клетках, и резко выраженная «+++» - в 101 и более клетках, в четырех полях зрения, также основанный на субъективной оценке данных врачом-патоморфологом [9].
Известен патент на изобретение, выполненный Поповым Ю.В., Бурыкиной П.Н. и соавторами в 2015 году, где для оценки результатов иммуногистохимических реакции у пациенток с миомой матки был использован 6-балльный полуколичественный метод: отсутствие иммуноокрашенных клеток - 0 баллов; менее 5% иммуноокрашенных клеток - 0,5 балла, менее 20% иммуноокрашенных клеток - 2 балла; от 20 до 40% окрашенных клеток - 4 балла; и более 40% окрашенных клеток - 6 баллов [10].
Описанные качественные и полуколичественные приемы оценки выраженности окрашивания клеток маркерами не лишены субъективной составляющей врача-патоморфолога, в связи с этим, использование методов количественной оценки результатов иммунофенотипирования клеток позволит объективизировать диагностический процесс, что соотносится с современными критериями доказательной медицины, своевременностью и точностью верификации диагноза.
Наиболее близким по существу к рассматриваемой проблеме является метод количественной оценки пролиферативной активности лимфоцитов в коже больных ГМ, разработанный Жуковым А.С., Белоусовой И.Э., Хайрутдиновым В.Р. и соавторами, с использованием системы компьютерного анализа микроскопических изображений, состоящей из светооптического микроскопа, цифровой камеры и персонального компьютера с интегрированным программным обеспечением «Морфология 5.2» [11].
Указанный метод был использован для оценки пролиферативной активности лимфоцитов в коже у 18 больных ГМ, группу которых составили 9 больных с I стадией, 7 больных со II стадией и 2 больных с III стадией заболевания. В каждом случае проводился анализ по 3 полям зрения при увеличении 200, выбранных с учетом наибольшей позитивности исследуемых клеток. Данный метод позволил авторам получить статистически значимые различия в относительной площади экспрессии CD3 и Ki67 клеток в дерме у больных ГМ в зависимости от стадии заболевания (7,16±0,31 и 18,8±0,61 - при ГМ I стадии, 0,39±0,21 и 0,89±0,18 - при ГМ II+III стадии соответственно).
Недостатками указанного метода является следующее:
- в проведенных авторами исследованиях были объединены в одну группу больные со II и III стадиями ГМ, тогда как, именно нахождение статистических различий в позитивности лимфоцитов кожи при IIA и IIB стадиях развития онкопроцесса имеет принципиальное значение для определения дальнейшей тактики лечения больного и прогноза заболевания;
- в данной работе был использован автоматизированный анализ позитивной окраски лишь двух иммуномаркеров CD3 и Ki67, то есть была проведена оценка только общей популяции всех зрелых Т-лимфоцитов и их пролиферативной активности, тогда как при развитии первичных лимфом кожи патогенетически значимым является изучение дисбаланса между пролиферирующими лимфоцитами и процессами их апоптоза, в чем участвуют CD8 цитотоксические клетки, в том числе с продукцией Granzyme В,
- не были изучены субпопуляции Т-лимфоцитов в дерме, а именно Т-хелперная субпопуляция лимфоцитов (CD4+), соотношение хелперно-индукторной субпопуляции лимфоцитов и супрессорно-цитотоксической (CD4+/CD8+),
- данный метод применим только для научного изучения диагностической значимости пролиферативной активности лимфоцитов эпидермиса и дермы у больных грибовидным микозом и бляшечным парапсориазом, тогда как дифференциальная диагностика между IIA и IIB стадиями ГМ важна в практическом смысле и определяет подходы к терапии и степень ее «агрессивности».
Задачей изобретения является разработка способа определения стадии ГМ на основании количественной оценки позитивности иммуногистохимических маркеров биоптата кожи.
Технический результат, который будет достигнут от использования данного изобретения заключается в повышении объективности и точности диагностирования стадии ГМ.
Технический результат достигается тем, что в способе определения стадии грибовидного микоза, включающем проведение у больного биопсии кожи из очага поражения, проведение иммуногистохимических исследований с использованием моноклональных антител CD3 и Ki67, их количественную оценку и установление на этом основании стадии заболевания, для исследований дополнительно используют моноклональные антитела CD4 и CD8, определяют значения объемных долей позитивного окрашивания моноклональными антителами CD3, CD4, CD8 и Ki67 путем компьютерной морфометрии, затем усредняют данные показатели и рассчитывают суммарную удельную значимость иммунопозитивности данных антител по формуле:
F=0,75⋅X1+1,9⋅X2+2,99⋅X3+10,53⋅X4+0,22,
где
F - суммарная удельная значимость иммунопозитивности указанных моноклональных антител,
X1 - среднее значение объемной доли позитивной окраски CD3,
Х2 - среднее значение объемной доли позитивной окраски CD4,
Х3 - среднее значение объемной доли позитивной окраски CD8,
Х4 - среднее значение объемной доли позитивной окраски Ki67,
0,75; 1,9; 2,99; 10,53 и 0,22 - поправочные коэффициенты.
При значении F от 0,220 до 1,969 диагностируют ранние (I-IIA) стадии, а при значении F от 1,970 до 4,973 - поздние (IIB-III) стадии ГМ.
Сущность изобретения состоит в реализованном в формуле изобретения подходе к диагностике стадий ГМ, учитывающим объективный вклад каждого из оцениваемых показателей в общую результирующую диагностики, позволяющую дифференцировать ранние и поздние стадии заболевания.
Из анализа научно-технической и патентной литературы заявляемой совокупности используемых моноклональных антител CD3, CD4, CD8 и Ki67 для оценки стадии грибовидного микоза по предлагаемой формуле нами не выявлено, что позволяет сделать выводы о соответствии заявляемого технического решения критериям «новизна» и «изобретательский уровень».
В клинике ГБУ СО «УрНИИДВиИ» с целью улучшения процесса диагностики ГМ и объективизации результатов иммуногистохимических исследований были изучены имиджи биоптатов кожи 36 человек: 30 больных ГМ I, II и III стадий, 6 - контрольной группы (здоровые лица). Диагноз ГМ у каждого больного был установлен на основании анамнеза, клинической картины, результатов патоморфологического, иммуногистохимического и морфометрического методов исследования.
Изобретение поясняется фиг. 1-8, где
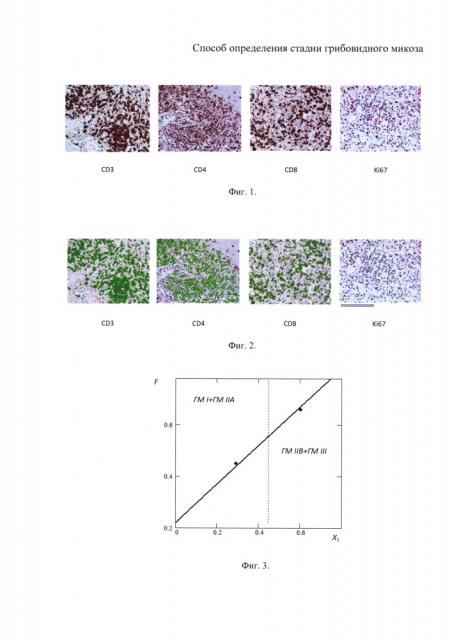
на фиг. 1 показаны исходные оцифрованные изображения биоптата кожи больного ГМ с наличием позитивного окрашивания CD3, CD4, CD8 и Ki67 МКА;
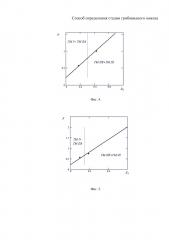
на фиг. 2 - автоматизированная обработка изображений иммунофенотипирования биоптата кожи больного ГМ с точным выделением иммунопозитивных Т-лимфоцитов: CD3, CD4, CD8 и Ki67 (зеленый цвет) в дермальном инфильтрате, увеличение 400;
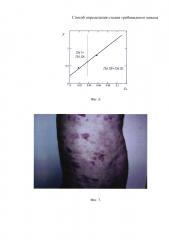
на фиг. 3 - распределение значений функции F от значений доли позитивной окраски иммуномаркера CD3 у всех групп больных;
на фиг. 4 - распределение значений функции F от значений доли позитивной окраски иммуномаркера CD4 у всех групп больных;
на фиг. 5 - распределение значений функции F от значений доли позитивной окраски иммуномаркера CD8 у всех групп больных;
на фиг. 6 - распределение значений функции F от значений доли позитивной окраски иммуномаркера Ki67 у всех групп больных;
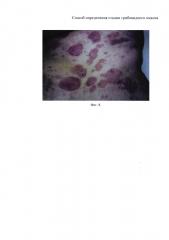
на фиг. 7 - больной К., пятна и бляшки на коже туловища;
на фиг. 8 - больной Г., пятна и бляшки на коже.
Изобретение осуществляется следующим образом.
Иммунофенотипирование объектов исследования проводили в стандартных условиях на аппарате для иммуногистохимии Bond-maX LEICA (Германия) с использованием парафиновых срезов толщиной 4 мкм.
Патоморфологические и морфометрические исследования выполнены с использованием аппаратно-программного комплекса, состоящего из светового микроскопа для медико-биологических исследований Axio Imager М2, цифровой камеры AxioCam MRc 5 и специальной программы ZEN 2012 для ввода изображений, проведения измерений и документирования (ZEISS, Германия). Также в составе данного комплекса использованы персональный компьютер Intel Core i5-3570 3.4 GHz и автоматизированная система анализа изображений «SIAMS Photolab» (Россия, свидетельство об утверждении типа средства измерений RU.C.31.058.A, №40862 от 28.07.2015 г., срок действия до 28.07.2020 г.).
Обработка изображений в системе «SIAMS Photolab» производится в цепочке взаимосвязанных ячеек, содержащих исходный имидж, результаты промежуточных этапов обработки, конечное обработанное изображение и результаты измерений в виде чисел, графиков и гистограмм. В системе предусмотрена генерация отчетов формата MS Word и экспорт изображений, числовых и текстовых данных в наиболее распространенные форматы.
Использование модуля колорометрической оценки результатов иммуногистохимических реакций системы анализа изображений «SIAMS Photolab» позволило получить квантифицированную оценку площади иммунопозитивности маркеров и объективизировать процесс диагностики ГМ.
В дерме больных ГМ на стандартной площади срезов кожи нами изучены параметры позитивности моноклональных антител (МКА) CD3, CD4, CD8, Ki67 и Granzyme В. Для данных исследований использованы по 5 имиджей в каждом наблюдении.
Результаты исследований поясняются с фиг. 1-8.
Примеры исходных оцифрованных изображений биоптата кожи больного ГМ с наличием позитивного окрашивания CD3, CD4, CD8 и Ki67 МКА представлены на фиг. 1.
Обработка оцифрованных изображений иммуногистохимических реакций у больных ГМ в системе анализа изображений «SIAMS Photolab» проводилась в несколько этапов: 1 - предобработка и первичное выделение маски, 2 - разделение масок, 3 - пороговая сегментация, 4 - измерение исследуемых объектов.
На завершающем этапе обработки изображений предусматривалось их контрастирование и более точное выделение определенным цветом измеряемых иммунопозитивных объектов с помощью функции пороговой сегментации (фиг. 2).
В результате автоматизированных измерений выделенных на изображениях объектов по каждому из 5 исследуемых имиджей определялись следующие параметры (в мкм2):
1. Проанализированная площадь гистологического среза кожи.
2. Занимаемая площадь позитивного окрашивания иммуномаркером.
3. Объемная доля позитивного окрашивания иммуномаркером.
На основании обработки 5 имиджей формируется заключительный отчет по выполненному исследованию, содержащий гистограмму распределения объемных долей и таблицу формата MS Word с включением следующих данных:
1. Число проанализированных полей.
2. Проанализированная площадь гистологического среза кожи (мкм2).
3. Занимаемая площадь позитивного окрашивания иммуномаркером (мкм2).
4. Объемная доля позитивного окрашивания иммуномаркером.
5. Средняя объемная доля позитивного окрашивания иммуномаркером.
6. Среднеквадратичное отклонение объемной доли позитивного окрашивания иммуномаркером.
Предварительный анализ данных показал значительную вариабельность площади позитивной окраски иммуномаркерами в дерме у больных при стадийном развитии ГМ.
Для построения модели определения стадии заболевания исходными данными являлись значения площади позитивной окраски иммуномаркерами в дерме у больных ГМ. На основании фактических данных, полученных в результате заполнения стандартизованных карт, была создана электронная база данных в формате таблиц программы Microsoft Excel.
Дальнейшая разработка модели определения стадии ГМ осуществлялась в несколько этапов.
На первом этапе методом вероятностного анализа было проведено выявление нетипичных представителей для каждой из групп исследуемых больных ГМ, присутствие которых в выборке могло существенным образом исказить результаты анализа [12].
Произведен пересчет полученных фактических данных площади позитивной окраски иммуномаркерами в дерме у больных ГМ в безразмерные величины (доля площади иммуномаркеров xi). Для этого находилось отношение площади иммуномаркера Sим данного вида к общей площади среза Sср по формуле: xi= Sим/Sср.
Далее определяли основные статистические характеристики значений доли площади иммуномаркеров: среднее значение , среднеквадратичное отклонение (СКО) Sx, ошибка выборки данных Δx для одного больного и одного иммуномаркера. Расчет производится по стандартным формулам вариационной статистики:
, , Δx=t⋅Sx,
где xi - доля площади иммуномаркера в выборке данных данного пациента с определенной стадией заболевания, N - количество срезов одного иммуномаркера у данного пациента, t - коэффициент Стьюдента.
Вычисления проводились при уровне значимости р=0,001 и р=0,01.
* - p<0,00 при сравнении между группами больных ГМ.
** - р<0,001 при сравнении между группами больных ГМ.
При обобщении данных таблицы 2, было отмечено, что изучение иммуноморфологических характеристик клеток дермального инфильтрата в биоптате кожи у больных ГМ продемонстрировало закономерные изменения их популяционного состава в динамике прогрессирования заболевания. Как видно из представленной таблицы 2, в группе больных с поздними (IIB-III) стадиями ГМ наблюдалось достоверное увеличение количества всех зрелых Т-лимфоцитов (CD3+) и Т-хелперной субпопуляции лимфоцитов (CD4+), хелперно-индукторной субпопуляции лимфоцитов над супрессорно-цитотоксической (CD4+/CD8+) при сопоставлении с аналогичными показателями дермального инфильтрата у больных ранними (I-IIA) стадиями заболевания. Кроме этого было обнаружено, что у больных ГМ в IIB-III стадии показатели объемной доли позитивности Ki67 (0,053±0,004) в 2,9 раза превышали аналогичные показатели у больных I-IIA стадиями заболевания, что свидетельствовало о высокой пролиферативной активности исследованных клеток дермального инфильтрата при поздних стадиях заболевания. В исследуемых группах больных ГМ отсутствовали изменения позитивной экспрессии Granzyme В+ на клетках инфильтрата и отмечалась недостоверная тенденция к увеличению количества Т-цитотоксической субпопуляции лимфоцитов (CD8+) при развитии последующих стадий заболевания.
На втором этапе нами был проведен расчет коэффициентов корреляций изучаемых клинико-лабораторных показателей у всех больных ГМ для выявления разнонаправленных векторов у пациентов, входящих в одну группу. Были выявлены разнонаправленные векторы значений площади позитивного окрашивания иммуномаркерами у больных ГМ (таблица 3).
В соответствии с данными таблицы 3, у больных ГМ обнаружены сильные положительные корреляционные параллели между количеством CD3 и CD4, CD3 и CD8, CD3 и Ki67, CD4 и Ki67, CD4 и CD8. Согласно методам доказательной статики обнаружена линейная зависимость между CD3, CD4 и Ki67. Количество Т-хелперной субпопуляции лимфоцитов (CD4) и показатель пролиферативной активности исследованных клеток дермального инфильтрата (Ki67) не имели существенной корреляционной связи с маркером апоптоза (Granzyme В).
Методами нелинейной динамики [13, 14] определялись пороговые значения объемной доли позитивности ИГХ маркеров биоптата кожи у больных ГМ в зависимости от стадии заболевания (таблица 4).
* - p<0,01 при сравнении между группами больных ГМ.
** - р<0,001 при сравнении между группами больных ГМ.
На третьем этапе все отобранные информативные признаки приняли участие в выработке «решающих правил» диагностики. При помощи процедуры пошагового отбора переменных удалось снизить размерность «решающего правила» при сохранении максимальной правильности распознавания образов. Согласно таблицам 3 и 4, выделены четыре базисных показателя (CD3, CD4, CD8 и Ki67), которые максимально характеризуют векторную динамику стадийного развития заболевания.
Методом наименьших квадратов с учетом пороговых значений показателей были построены линейные функции F от объемной доли позитивной окраски иммуномаркерами CD3, CD4, CD8 и Ki67 у больных ГМ (фиг. 3-6).
На фиг. 3 показано распределение значений функции F от значений доли позитивной окраски иммуномаркера CD3 у всех групп больных (точками обозначены данные по CD3 из таблицы 2).
На фиг. 4 показано распределение значений функции F от значений доли позитивной окраски иммуномаркера CD4 у всех групп больных (точками обозначены данные по CD4 из таблицы 2).
На фиг. 5 показано распределение значений функции F от значений доли позитивной окраски иммуномаркера CD8 у всех групп больных (точками обозначены данные по CD8 из таблицы 2).
На фиг. 6 показано распределение значений функции F от значений доли позитивной окраски иммуномаркера Ki67 у всех групп больных (точками обозначены данные по Ki67 из таблицы 2).
Регрессионным анализом и методом наименьших квадратов с учетом пороговых значений показателей была построена результирующая линейная функция F от объемной доли позитивной окраски иммуномаркерами (моноклональными антителами) CD3, CD4, CD8 и Ki67 у больных ГМ для определения стадии заболевания:
F=0,75⋅Х1+1,9⋅Х2+2,99⋅Х3+10,53⋅Х4+0,22,
где
F - суммарная удельная значимость иммунопозитивности указанных моноклональных антител,
X1 - среднее значение объемной доли позитивной окраски CD3,
Х2 - среднее значение объемной доли позитивной окраски CD4,
Х3-среднее значение объемной доли позитивной окраски CD8,
Х4 - среднее значение объемной доли позитивной окраски Ki67,
0,75; 1,9; 2,99; 10,53 и 0,22 - поправочные коэффициенты.
Поправочные коэффициенты удельной значимости перед переменными X1, Х2, Х3, Х4 и коэффициент 0,22 в функции F были подобраны экспериментальным путем.
В результате для каждой стадии ГМ были получены следующие значения функции F:
ГМ I-IIA (ранние стадии): 0,220≤F≤1,969;
ГМ IIB-III (поздние стадии): 1,970≤F≤4,973.
Данные значения интервалов были получены с уровнем значимости р<0,05.
Способ осуществляется следующим образом:
1. После подписания больным информированного согласия на исследование проводится инцизионная биопсия кожи на участке с наиболее выраженными клиническими проявлениями дерматоза.
2. По стандартным методикам изготавливаются парафиновые блоки и гистопрепараты кожи, выполняется ИФТ с использованием панели МКА, рекомендованной для диагностики ГМ [1].
3. Выполняется оцифровка изображений и отбор 5 имиджей для количественных исследований по критерию максимального содержания в них иммунопозитивных лимфоцитов.
4. Проводится автоматизированная обработка каждого из 5 исследуемых изображений в системе «SIAMS Photolab» с вычислением значений средних объемных долей позитивного окрашивания моноклональных антител CD3, CD4, CD8 и Ki67.
5. Для определения стадии ГМ у больного рассчитывается суммарная удельная значимость и значение каждого из исследуемых иммуномаркеров, подставив в уравнение значения соответствующих признаков по формуле:
F=0,75⋅Х1+1,9⋅Х2+2,99⋅Х3+10,53⋅Х4+0,22,
где X1 - среднее значение объемной доли позитивной окраски CD3, Х2 - среднее значение объемной доли позитивной окраски CD4, Х3 - среднее значение объемной доли позитивной окраски CD8, Х4 - среднее значение объемной доли позитивной окраски Ki67.
6. Сравнив между собой полученное значение переменной F у конкретного больного и пороговые значения обучающей выборки, делается заключение о наличии у больного соответствующей стадии ГМ.
Клинико-диагностическая апробация заявленного способа определения стадии ГМ:
Описываемый способ определения стадии заболевания нами был применен в клинике ГБУ СО «УрНИИДВиИ» у 30 больных ГМ. В таблице 5 приведены данные сопоставления правильности определения стадии заболевания у больных ГМ заявленным способом с экспертной оценкой и патоморфологической верификацией.
Примечание: группа I - больные ГМ I-IIA ст. (ранние стадии), группа II - больные ГМ IIB-III ст. (поздние стадии).
Как следует из представленной таблицы 5, совпадение результатов проведенных тестов на обучающей выборке (когорта больных с ранее установленным и верифицированным диагнозом и стадиями ГМ) с экспертной оценкой и патоморфологической верификацией диагноза у больных свидетельствует о специфичности разработанного нами способа определения стадии ГМ и разделения на ранние и поздние стадии. Достоверность подобного разделения больных ГМ на стадии заболевания составила в среднем 97,3%, причем 100% достоверность была зафиксирована у больных ГМ IIB-III ст., а 94,73% - при ранних стадиях заболевания (I-IIA ст.).
В качестве иллюстрации применения способа определения стадии ГМ у больных приводим следующие клинические наблюдения.
Больной К., 1973 г. рождения, поступил в клинику ГБУ СО «УрНИИДВиИ» для уточнения диагноза с жалобами на распространенные пятна и бляшки на коже туловища и конечностей, сопровождающиеся периодическим зудом, покалыванием и стягиванием кожи. Болеет в течение 4 лет, когда впервые заметил единственное пятно на коже левого плеча. Через год в связи с появлением многочисленных пятен на коже туловища и верхних конечностей впервые обратился к дерматологу по месту жительства. Для уточнения заболевания дважды амбулаторно проводились стандартные гистологические исследования кожи, больной находился под наблюдением дерматолога с диагнозом бляшечный парапсориаз, назначались Н1 антигистаминные препараты, наружно - топические глюкокортикостероиды. Сезонности обострений заболевания не отмечал, а на фоне инсоляции наблюдалось усиление окраски пятен и появление умеренного зуда. За предыдущий год отмечает прогрессирование заболевания - усиление кожного зуда и появление новых бляшек на коже, часть из которых была наиболее инфильтрирована.
Анамнез жизни, аллергоанамнез и профессиональный маршрут у больного без особенностей. Наследственность по кожным заболеваниям и онкопатологии не отягощена. При общем осмотре патологических отклонений по системам и органам не выявлено. Подмышечные лимфатические узлы диаметром до 1,5-2 см, мягкие, безболезненные и подвижные при пальпации. Физиологические отправления в норме.
Локальный статус: кожный процесс имеет распространенный характер. На коже плеч, предплечий, груди, живота, спины и правого бедра присутствуют розовато-красные пятна и умеренно инфильтрированные бляшки диаметром до 3,5 см, округлой формы, с четкими границами и шероховатой поверхностью. На поверхности бляшек отсутствует рост волос, имеются экскориации с точечными геморрагическими корочками. Кроме этого, на коже правой половины живота имеются 4 округлых высыпания, максимально возвышающихся над уровнем кожи, которые за счет своей выраженной инфильтрации не позволяют их отнести к бляшками или опухолями. Дермографизм белый (фиг. 7).
Лабораторные данные. Общий анализ крови: Hb - 139 г/л, эр. - 4,7×1012/л, лейк. - 8,5×109/л, нейтр. - 5,4×109/л, эоз. - 0,2×109/л, лимф. - 2,2×109/л, мон. - 0,5×109/л, СОЭ - 14 мм/ч. В общем анализе мочи, биохимической гепатограмме и иммунограмме отклонений не выявлено. Комплекс серологических реакций к Treponema pallidum отрицательный. Антитела к ВИЧ, гепатитам В и С не обнаружены.
Патоморфологическое исследование биоптата кожи больного: Эпидермис неравномерно гиперплазирован, с. гиперкератозом и небольшим акантозом. В верхних отделах дермы присутствуют полосовидные эпидермотропные инфильтраты из лимфоидных клеток малого и среднего размера. Дермоэпидермальная граница нечеткая, с формированием небольших единичных скоплений в эпидермисе типа микроабсцессов Потрие.
Иммуногистохимическое исследование биоптата кожи больного: опухолевый инфильтрат имеет Т-клеточный иммунофенотип: клетки экспрессируют CD3, CD4 и CD8; В-лимфоциты (CD20) - в виде единичных скоплений среди опухолевых клеток.
Иммуногистохимические препараты биоптата кожи больного были подвергнуты морфометрии с использованием компьютерной программы «SIAMS-Photolab», вычисленные показатели составили: среднее значение объемной доли позитивной окраски CD3=0,263, среднее значение объемной доли позитивной окраски CD4=0,152, среднее значение объемной доли позитивной окраски CD8=0,078, среднее значение объемной доли позитивной окраски Ki67=0,017.
Для определения у больного стадии ГМ указанным способом в уравнение были подставлены значения соответствующих признаков:
F=0,75⋅0,263+1,9⋅0,152+2,99⋅0,078+10,53⋅0,017+0,22.
У данного больного было получено значение F=1,118, что при сравнении с обучающей выборкой имело числовые параметры, характерные для ранней стадии ГМ (0,220 ≤ F≤ 1,969).
На основании анамнеза, клинической картины, данных гистологического и иммуногистохимического методов исследования биоптата кожи и результатов, полученных заявленным способом, больному был установлен окончательный диагноз: первичная лимфома кожи, грибовидный микоз, IIА стадия (T2N1M0B0).
Больной Г., 1950 г. рождения, поступил в клинику ГБУ СО «УрНИИДВиИ» с жалобами на распространенные высыпания на коже предплечий, груди, живота и спины, сопровождающиеся периодическим интенсивным зудом и стягиванием кожи. Болеет в течение 6 лет, когда впервые возникли пятна на коже правого предплечья. В течение последующих нескольких лет обращал внимание на постепенное появление аналогичных пятен на коже туловища. Наблюдался у дерматовенеролога по месту жительства с диагнозом крупнобляшечный парапсориаз, где в результате проводимой терапии (Н1-антигистаминные средства, десенсибилизирующая терапия, наружно - топические глюкокортикостероиды) больной отмечал кратковременное улучшение в виде исчезновения зуда высыпаний. За предыдущие 5-6 месяцев отметил ухудшение течения заболевания - появление новых пятен и усиление кожного зуда, в связи с чем был госпитализирован в отделение хронических дерматозов ГБУ СО «УрНИИДВиИ.
Анамнез жизни, аллергоанамнез и профессиональный маршрут у больного без особенностей. Наследственность по кожным заболеваниям и онкопатологии не отягощена. При общем осмотре патологических отклонений по системам и органам не выявлено. Подмышечные и паховые лимфатические узлы диаметром до 1,5-2,0 см, мягкие, безболезненные и подвижные при пальпации. Физиологические отправления в норме.
Локальный статус: непораженные участки кожных покровов физиологической окраски, нормальной влажности и тургора. Видимые слизистые влажные, физиологической окраски. Кожный процесс имеет распространенный характер, поражены - грудь, живот, спина, плечи и предплечья. На коже груди, живота, предплечий и поясничной области имеются многочисленные пятна бледно-красного цвета, диаметром до 2-3 см, с четкими границами, без шелушения и экскориаций. На коже живота и спины присутствуют округлые бляшки, кирпично-красного цвета, диаметром до 6 см, с точечными геморрагическими корочками в местах экскориаций. На поверхности бляшек отсутствует рост волос, имеются единичные трещинки в местах физиологических складок кожи и незначительное мелкопластинчатое шелушение. На коже левой половины живота имеются 2 наиболее инфильтрированных образования, округлой формы, диаметром 1,8 см и 2,5 см, насыщенно-красного цвета, с гладкой поверхностью, которые по своей морфологии и размерам не позволяют их отнести либо к бляшкам, либо к опухолям. Дермографизм белый (фиг. 8).
Лабораторные данные. Общий анализ крови: Hb - 146 г/л, эр. - 4,86×1012/л, лейк. - 8,1×109/л, нейтр. - 2,8×109/л, эоз. - 0,3×109/л, лимф. - 2,0×109/л, мон. - 0,4×109/л, СОЭ - 10 мм/ч. В общем анализе мочи и иммунограмме отклонений не выявлено. В биохимической гепатограмме - повышение общего билирубина до 24,3 мкмоль/л. Комплекс серологических реакций к Treponema pallidum отрицательный. Антитела к ВИЧ, гепатитам В и С не обнаружены.
Патоморфологическое исследование биоптата кожи больного: в дерме присутствует плотный, полосовидный, эпидермотропный инфильтрат из лимфоидных клеток разных размеров, «размывающий» дермоэпидермальную границу и проникающий в эпидермис, в котором прослеживается очаговая деструкция. Определяются микроабсцессы Потрие. Митотическая активность клеток достаточно высокая.
Иммуногистохимические препараты биоптата кожи больного были подвергнуты морфометрии с использованием компьютерной программы «SIAMS-Photolab», вычисленные показатели составили: среднее значение объемной доли позитивной окраски CD3=0,606, среднее значение объемной доли позитивной окраски CD4=0,56, среднее значение объемной доли позитивной окраски CD8=0,24, среднее значение объемной доли позитивной окраски Ki67=0,059.
Для определения у больного стадии ГМ указанным способом в уравнение были подставлены значения соответствующих признаков:
F=0,75⋅0,606+1,9⋅0,56+2,99⋅0,24+10,53⋅0,059+0,22.
У данного больного было получено значение F=3,07, что при сравнении с обучающей выборкой имело числовые параметры, характерные для поздних стадий ГМ (1,970≤F≤4,973).
На основании анамнеза, клинической картины, результатов патоморфологического, иммуногистохимического и морфометрического методов исследования биоптата кожи и данных, полученных заявленным способом, больному Г. был установлен окончательный диагноз: первичная лимфома кожи, грибовидный микоз, IIB