Способ оценки силы межмолекулярных взаимодействий в модельной системе "функционализированная полистироловая микросфера-функционализированное стекло" методом оптической ловушки
Иллюстрации
Показать всеИзобретение относится к области иммунохимии и биомеханики и может быть использовано при изучении силы межмолекулярных взаимодействий в системах «антиген-антитело», «лиганд-рецептор» с использованием оптического пинцета. Способ количественной характеристики межмолекулярного взаимодействия в модельной системе «функционализированная полистироловая микросфера – функционализированная стеклянная подложка» методом оптической ловушки включает функционализацию поверхности микросфер липополисахаридом и поверхности стеклянной подложки молекулами антител методом аминомодификации, процедуру калибровки оптического пинцета, процедуру пошагового вертикального подведения и последующего отведения пьезостолика в противоположном направлении с шагом 50 нм для регистрации силы отрыва микросферы от поверхности стеклянной подложки и статистическую обработку данных по регистрации сил отрыва. Изобретение позволяет достигнуть высокой воспроизводимости в сочетании с экспрессностью определения сил отрыва на основе метода оптической ловушки. 3 ил., 1 табл., 4 пр.
Реферат
Изобретение относится к области иммунохимии и биомеханики. Настоящее изобретение может быть использовано при изучении силы межмолекулярных взаимодействий в системах «антиген-антитело», «лиганд - рецептор» и др. с использованием оптического пинцета.
Интерес к подобного рода исследованиям обусловлен возможностью изучения молекулярных механизмов иммунохимического взаимодействия, например, молекул антигенов и антител, фиксированных на твердой фазе (здесь - на полистироле или стекле), что может быть использовано, в частности, при разработке новых средств профилактики и лечения инфекционных заболеваний.
Среди микромеханических методов, используемых в современной экспериментальной биологии, особое место занимают атомно-силовая микроскопия (АСМ) и метод оптической ловушки - последний был реализован в оптическом (лазерном) пинцете [Svoboda, K., Block S.M. Biological applications of optical forces // Ann. Rev. Biophys. Struct. - 2009. - Vol. 23. - 247-285]. В основе работы этого прибора лежит использование лазерного луча определенной мощности для удерживания диэлектрических микрообъектов и осуществления манипуляций с ними. Использование данного методического подхода позволило изучить многие биологические процессы (реакции матричного синтеза, взаимодействия в системах «белок -нуклеиновая кислота», «белок - белок») на молекулярном уровне. В последнее время метод оптической ловушки активно применяется в микробиологии, позволяя проводить манипуляции как непосредственно с микробными клетками, так и с поверхностными структурами возбудителей (пилями и др.).
Известен способ оценки силовых взаимодействий между поверхностью полистироловых микросфер, функционализированных липополисахаридом двух штаммов Escherichia coli, и тремя неорганическими субстратами - обычной слюдой, а также слюдой, модифицированной полистиролом и аминогруппами [Lu Q et al. Understanding the molecular interactions of lipopolysaccharides during E. coli initial adhesion with a surface forces apparatus // Soft Matter. - 2011. - Vol. 7. - P. 9366-9379]. Авторами исследования для оценки сил взаимодействия был выбран метод оценки сил поверхностного взаимодействия (surface force apparatus).
Недостатком данного способа является относительно низкая чувствительность, обеспечивающая минимально определяемую силу на уровне 1 нН, в то время как, согласно другим исследованиям, проведенным с использованием ACM [Targosz М. et al. Influence of macrophage activation on their capacity to bind bacterial antigens studied with atomic force microscopy // Nanomedicine. - 2006. - Vol. 2. - P. 82-88] или оптического пинцета [Sieben С. et al. Influenza virus binds its host cell using multiple dynamic interactions // PNAS. - 2012. - V. 109. - P. 13626-13631], специфическому взаимодействию в системе «лиганд - рецептор» соответствуют силы в несколько десятков-сотен пиконьютон (пН). Авторы указывают на то, что описанный способ позволяет оценить степень адгезии двух разнородных поверхностей, однако оптический пинцет обеспечивает в такого рода исследованиях чувствительность определения силы связи. Следует отметить также, что в рамках предложенного способа не оговариваются критерии контакта указанных поверхностей, а также длительность задержки микросфер вблизи субстрата и воспроизводимость метода.
Известен также способ оценки сил взаимодействия между поверхностью клеток Staphylococcus aureus и иммобилизованными полистироловыми микросферами, функционализированными внеклеточными матриксными белками - фибронектином и фибриногеном на основе оптического пинцета [Simpson K.Н. et al. Measurement of adhesive force between individual Staphylococcus aureus MSCRAMMs and protein-coated surfaces by use of optical tweezers // Journal of Bacteriology. - 2003. - Vol. 185, No. 6. - P. 2031-2035]. В соответствии с процедурой способа, адгезированную к подложке полистироловую микросферу большого диаметра (10 мкм), модифицированную одним из двух матриксных белков, перемещали в горизонтальной плоскости с помощью пьезостолика к удерживаемой в фокусе луча клетке S. aureus до момента соприкосновения объектов. Спустя 10 секунд после остановки пьезостолика его отводили в противоположном направлении, постепенно увеличивая мощность лазера до тех пор, пока не будет зафиксирован отрыв прокариоцита от микросферы. Значение мощности лазера, достаточное для разрыва связи, пересчитывали в силу по заранее построенному калибровочному графику на основе оценки силы вязкого трения микрообъекта.
Основным недостатком данного технического решения является то, что предварительно не были определены или указаны условия процедуры подведения и отведения пьезостолика, в частности, в работе не указана скорость смещения, а также то, носит ли эта процедура пошаговый характер или осуществляется с постоянной скоростью. Кроме того, не приводятся критерии детектирования физического контакта между объектами, что потенциально может снижать воспроизводимость методики. Пересчет значений мощности, при которых наблюдался отрыв микробных клеток от микросфер, в значения силы отрыва осуществлялся на основе предшествующего расчета выталкивающей силы ловушки при перемещении микрообъекта в жидкости. Однако предложенная методика калибровки не учитывает параметр жесткости ловушки, что в итоге не обеспечивает получение аналогичных результатов при использовании оптических пинцетов других моделей.
В качестве аналога можно привести способ оценки сил связывания клеток Escherichia coli с поверхностью подложки из золота, модифицированной молекулами маннозы посредством триэтиленгликольтиоловых «сшивок» [Liang M.N. et al. Measuring the forces involved in polyvalent adhesion of uropathogenic Escherichia coli to mannose-presenting surfaces // Proc. Natl Acad. Sci. U.S.A. - 2000. - Vol. 97. - P. 13092-13096]. В этом случае методика регистрации силовых характеристик такого взаимодействия включает следующие этапы: функционализация металлической подложки алкантиоловыми и этиленгликольтиоловыми производными маннозы посредством химического «сшивания»; культивирование двух штаммов Е. coli с последующим пассивным осаждением микробных клеток на поверхность маннозного монослоя; инверсия (переворачивание) подложки; отрыв прокариоцита от поверхности подложки с помощью оптической ловушки; подведение той же клетки к поверхности монослоя с последующим отведением; обработка полученных данных и вычисление сил отрыва.
Общими существенными признаками описанного аналога и предлагаемого решения являются использование горизонтальной абиотической поверхности в качестве одного из компонентов модельной системы, а также подведение второго компонента (бактерии) по оси OZ к поверхности монослоя с последующим отрывом от нее.
Метод предназначен для изучения взаимодействия цельных микробных клеток с функционализированными монослоями, что не позволяет оценивать силы взаимодействия между отдельными молекулами. Недостатком данного технического решения является также отсутствие достоверных критериев физического контакта сближаемых объектов, не указаны также такие важные параметры, как характер подведения (ступенчатый или равномерный), частота или скорость перемещения пьезостолика с подложкой, а также длительность взаимодействия объектов, от которых зависит определяемая сила отрыва. Манипуляции с использованием оптической ловушки проводятся после инверсии металлической подложки, что, по-видимому, связано с необходимостью расположения фокуса ловушки снизу относительно слоя металла, однако необходимость осуществления данной стадии, равно как и ее описание, авторами не приводятся. Также следует отметить, что, по имеющимся данным, осуществление манипуляций с живыми бактериями, находящимися в фокусе лазерного луча с λ<1000 нм, нежелательно ввиду возможности фотоповреждения биообъектов [Neuman K.С. et al. Characterization of photodamage to Escherichia coli in optical traps // Biophys. J. - 1999. - Vol. 77. - 2856-2863; Rasmussen M.B. et al. Optical tweezers cause physiological damage to Escherichia coli and Listeria bacteria // Appl. Environ. Microb. - 2008. - Vol. 74. - P. 2441-2446]. Для пересчета минимальной мощности луча, достаточной для разрыва связи между бактерией и подложкой, в приведенном способе используется выведенная ранее зависимость стоксовой силы, действующей на смещающийся в жидкости микрообъект (бактерию или микросферу сопоставимого с ней диаметра), от мощности лазера. При этом не указывается соответствующее значение жесткости (втягивающей силы) ловушки, что не позволяет унифицировать метод и использовать его на других моделях оптических пинцетов.
Наиболее близким к заявленному техническому решению является способ оценки сил связи в системе «функционализированная полистироловая микросфера-эукариоцит» [Способ количественной оценки силы связывания функционализированной полистироловой микросферы с эукариоцитом линии J-774 на основе метода оптической ловушки: пат. 2604191 Рос. Федерация: C12Q 1/02, G01N 33/53, A61B 10/00 / А.А. Бывалов, В.Л. Кононенко, И.В. Конышев, С.Г. Литвинец, Е.А. Мартинсон]. Согласно разработанному способу адгезированные к поверхности стеклянной подложки (дну чашки «Fluorodish») жизнеспособные макрофаги линии J774 с помощью пьезостолика подводили к полистироловым микросферам, функционализированным липополисахаридом Yersinia pseudotuberculosis и удерживаемым в фокусе лазерного луча, до момента физического контакта объектов. Подведение осуществляли в горизонтальной плоскости в ручном режиме с шагом 50 нм. В качестве критериев контакта предлагается рассматривать формирование высокоамплитудных однонаправленных скачков на хронограмме, соответствующих пошаговому перемещению пьезостолика, и предшествующее им увеличение амплитуды броуновских смещений микросферы. Через 1 секунду после остановки пьезостолик отводили в автоматическом режиме со скоростью 100 нм/с до момента разрыва сформировавшейся связи, силу которой вычисляли программно с учетом коэффициента жесткости оптической ловушки, определяемого в ходе предшествующей опыту калибровки.
Данный способ близок по основным стадиям реализации к предлагаемому в настоящем изобретении. Вместе с тем, использование живых эукариоцитов, являющихся динамической живой системой, позволяет дать лишь интегральную характеристику взаимодействия функционализированных микросфер с их поверхностью без возможности оценки силы связи между отдельными молекулами. Кроме того, реализация заявляемого технического решения, включающего вертикальное сближение двух исследуемых объектов, которое обеспечивает экспрессность способа, невозможна при изучении эукариоцитов методом оптической ловушки ввиду резкого падения мощности лазера после его прохождения через тело клетки и, как следствие, невозможности манипуляции микросферой.
Задачей, на решение которой направлено заявляемое изобретение, является разработка воспроизводимого экспрессного способа определения силы межмолекулярных взаимодействий с использованием оптической ловушки. Данная задача решается за счет обоснования алгоритма осуществления разработанного способа. Технический результат заявляемого решения заключается в достижении высокой воспроизводимости в сочетании с экспрессностью определения сил отрыва на основе метода оптической ловушки.
Указанный технический результат достигается за счет применения разработанной последовательности действий:
1) приготовление целевых препаратов, в нижеприведенных примерах - моноклональных антител (МКАт) и липополисахарида (ЛПС);
2) функционализация стеклянных подложек МКАт с использованием метода аминомодификации, а также полистироловых микросфер ЛПС с помощью пассивной сенсибилизации;
3) калибровка оптического пинцета;
4) подведение стеклянной подложки к полистироловой микросфере с шагом 50 нм до их соприкосновения, регистрируемого по характерным изменениям хронограммы сигнала квадрантного фотодетектора (КвФД);
5) отведение пьезостолика с функционализированной стеклянной подложкой от функционализированной полистироловой микросферы после их контакта в течение 1 секунды с шагом 50 нм до разрыва связи, индицируемого по резкой инверсии сигнала КвФД;
6) статистическая обработка данных по регистрации сил отрыва.
Высокая воспроизводимость, а также экспрессность способа достигаются за счет использования горизонтально расположенной стеклянной подложки, равномерно покрытой целевыми молекулами, и функционализированной полистироловой микросферы при их вертикальном подведении-отведении, что отменяет необходимость предварительного выбора точки соприкосновения двух объектов. Тем самым обеспечивается возможность осуществления большего числа циклов подведения и отведения с регистрацией большего числа разрывов связи в единицу времени.
Между совокупностью существенных признаков заявляемого способа и достигаемым техническим результатом существует причинно-следственная связь, поскольку исключение из процедуры измерений любой из указанных выше манипуляций не позволяет получить заявляемый результат.
Возможность практического осуществления разработанного способа обосновываются нижеприведенными примерами, основанными на использовании в качестве иммуноспецифических компонентов - сенситинов бактериального ЛПС и МКАт.
Пример 1. Функционализация стеклянной подложки (А) и полистироловых микросфер (Б) целевыми препаратами
А. Асцитные жидкости, содержащие МКАт к О-боковым цепям ЛПС бактерий Yersinia pseudotuberculosis 1b (далее обозначены «МКАт2») и к белковому эпитопу наружной мембраны данного микроорганизма (далее обозначены «МКАт7» - отрицательный контроль) получали согласно описанной ранее методике [Byvalov A.A. et al. Immunochemical activity of the Yersinia pseudotuberculosis B-antigen // Molecular Genetics, Microbiology and Virology. - 2015. - Vol. 30. - N 2. - P. 93-100]. Препараты иммуноглобулинов выделяли из соответствующих асцитных жидкостей осаждением сульфатом аммония [Моноклональные антитела. Под ред. Р.Г. Кеннета, Т. Дж. Мак-Керна, К.Б. Бехтол. Пер. с англ. Е.Д. Айнгорн. М., Медицина. - 1983. С. 397].
Поверхность дна чашек «Fluorodish» функционализировали препаратами антител на основе метода аминомодификации [Лиманская Л.А., Лиманский А.П. Компактизация единичных молекул суперспиральной ДНК, адсорбированных на аминослюде // Биоорганическая химия. - 2006. - Т. 32, №5. - С. 1-17] с незначительными модификациями. Препараты антител МКАт 2 и 7 (отрицательный контроль) в концентрации ~3 мг/ мл предварительно центрифугировали при 15000 g в течение 30 мин, после чего переносили супернатанты в чистые пробирки. Чашки «Fluorodish» (Tokio Boecke, Япония) диаметром 35 мм со стеклянным дном выдерживали в течение 1.5 ч в атмосфере чистого аргона в парах триэтиламина (Реахим, Россия) и 3-аминопропилтриэтоксисилана (Sigma Aldrich, США) (объемное соотношение двух последних компонентов 1:3). По окончании инкубации на поверхность стекла чашек наносили последовательно 30 мкл 0.46%-ного раствора N-гидроксисукцинимида (Sigma Aldrich, США) в фосфатном буферном растворе (ФБР, рН 7.2-7.5), затем 900 мкл ФБР, 0.6 мкл неразведенного N-(3-диметиламинопропил)-N'-этилкарбодиимида (Sigma Aldrich, США) и 100 мкл цельных центрифугированных препаратов МКАт2 или МКАт7.
В качестве второго отрицательного контроля использовали чашки «Fluorodish» с внесенным на последней стадии (вместо антител) раствором 1%-ного бычьего сывороточного альбумина (БСА) в ФБР в объеме 100 мкл. Тщательно перемешивали содержимое чашек, выдерживали их в течение 18 часов при температуре +4°C, после чего пятикратно промывали стерильным ФБР, добавляли натрия азид до конечной концентрации 0.01% и хранили при температуре +4°C.
Для верификации факта функционализации антителами использовали покровные стекла размером 4×4 мм, которые предварительно выдерживали в смеси 19%-ной серной кислоты и 33%-ного пероксида водорода (1:1) 1 ч. Трижды промывали стекла бидистиллированной водой, осушали их фильтровальной бумагой и полностью погружали в 96%-ный этиловый спирт на 5 минут, после чего повторно помещали на фильтровальную бумагу до полного высыхания спирта. Дальнейшая последовательность действий по функционализации стекол идентична описанной выше для чашек. Функционализированные стекла помещали в лунки плоскодонного планшета и заливали 100 мкл ФБР для иммунохимического подтверждения факта функционализации.
Методика твердофазного иммуноферментного анализа (ТИФА). После трехкратной отмывки промывочным раствором (ФБР с 0.05% Твина-20) в лунки со стеклами добавляли по 100 мкл блокирующего буфера (1% БСА в ФБР с Твином-20). Выдерживали на шейкере (+37°C, 290 об/мин) в течение 1 ч, после чего лунки однократно промывали. Добавляли в каждую лунку по 100 мкл козьего антимышиного конъюгата (Sigma Aldrich, США) в рабочем разведении, выдерживали 1 ч на термошейкере и трехкратно промывали лунки. Затем вносили по 100 мкл субстрата на основе о-фенилендиамина и выдерживали планшет в темном месте в течение 30 мин. Реакцию останавливали внесением 50 мкл 1%-ного раствора серной кислоты. Учет результатов производили на микропланшетном ридере Anthos 2020» (Labtec, Австрия) при λ=492 нм.
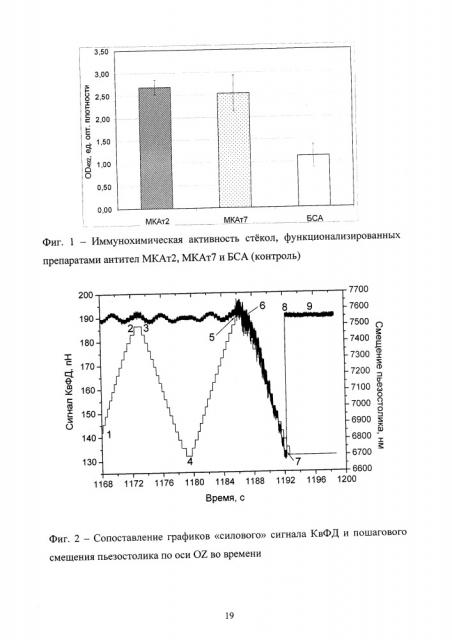
По результатам ТИФА показано, что значения OD492 для стекол, обработанных двумя типами антител, превосходят таковые для указанного выше контроля (БСА) в 2.38 (МКАт2) и 2.24 (МКАт7) раза. Таким образом, наличие достоверных различий в иммунохимической активности стекол, функционализированных антителами по сравнению с контрольным образцом, обработанным БСА, подтверждает факт их функционализации иммуноглобулинами (Фиг. 1).
Б. ЛПС выделяли из биомассы клеток бактерий Y. pseudotuberculosis водно-фенольным методом по Вестфалю (Westphal О., Jann K. Bacterial lipopolysaccharides extraction with phenol-water and further applications of the procedure // Methods Carbohydr. Chem. - 1965. - V. 5. - P. 83-91). Перед функционализацией полистироловых микросфер препарат ЛПС центрифугировали при 13000 g в течение 20 мин для освобождения от крупномолекулярных комплексов. Отбирали супернатант, содержащий ~1 мг/ мл ЛПС, переносили его в чистую пробирку, смешивали с суспензией полистироловых микросфер (d=1 мкм) (Polysciences Inc., США) в объемном соотношении 2:1 и инкубировали на термошейкере (+37°C, 290 об/мин). После центрифугирования в том же режиме ресуспендировали осадок в 1%-ном растворе БСА в ФБР с добавлением 0.05% твина-20 и вновь инкубировали на термошейкере в течение 1 ч. Осадок, полученный после повторного центрифугирования, однократно отмывали в ФБР и ресуспендировали в ФБР с 0.01% натрия азида до конечной концентрации микросфер ~0.25% (вес/объем).
Пример 2. Определение момента физического контакта полистироловой микросферы и стеклянной подложки
Измерения сил отрыва функционализированных полистироловых микросфер от поверхности макрофагов выполнены методом лазерного пинцета с помощью прибора NanoTracker™ (JPK Instruments AG, Германия). В приборе использован инвертированный микроскоп Nikon Eclipse с объективом 60×, NA=1.2 и лазер с длиной волны 1064 нм для формирования оптической ловушки и регистрации смещений захваченной микросферы. Коэффициент жесткости ловушки для полистироловой микросферы диаметром 1 мкм составляет 0.05-0.40 пН/нм, в зависимости от мощности лазера, регулируемой в пределах 0.20-1.45 Вт. Измерение коэффициента чувствительности КвФД, регистрирующего смещения микросферы, а также коэффициента жесткости ловушки производится в автоматическом режиме на основе регистрации частотного спектра броуновских смещений микросферы в ловушке.
Непосредственно перед экспериментом в чашку «Fluorodish», функционализированную одним из белковых препаратов, добавляли 2-4 мкл суспензии препарата функционализированных полистироловых микросфер. Перед подведением столика с установленной чашкой к микросфере производили калибровку прибора. Для этого микросферу захватывали лазерным лучом на расстоянии не менее чем 5-6 мкм от дна чашки, после чего изменяли мощность луча таким образом, чтобы значение коэффициента жесткости, определяемое программно для оси OZ, составляло 0.24-0.25 пН/нм. Значение коэффициента чувствительности КвФД при этом составляло 9-11 мВ/нм.
Условия проведения всех экспериментов были одинаковы:
а) первоначальное расстояние между микросферой и поверхностью стеклянной подложки определялось визуально и составляло 2-3 мкм;
б) направление подведения и отведения - вертикальное;
в) шаг подведения пьезостолика при ручном режиме - 50 нм;
г) скорость подведения - 2-3 шага в секунду;
д) время задержки пьезостолика после контакта объектов - 1 секунда;
е) скорость отведения пьезостолика - 3 шага пьезостолика по 50 нм в секунду;
ж) частота оцифровки сигнала КвФД - 1000 Гц.
Для определения момента наступления физического контакта поверхности микросферы и стеклянной подложки устанавливали фокус луча на расстоянии не менее 2 мкм от верхней границы стеклянной подложки. Затем поступательно перемещали пьезостолик с шагом 50 нм вертикально вверх по направлению к удерживаемой микросфере, возвращая его в исходное положение по мере прохождения расстояния, большего предыдущего на 50 нм. Согласно исходному предположению, физический контакт двух твердых поверхностей должен сопровождаться отчетливыми изменениями на хронограмме. В рамках настоящего примера было показано, что физический контакт двух объектов предваряется постепенным нарастанием амплитуды «шума», регистрируемым на хронограмме, а непосредственно момент соприкосновения индицируется по формированию первого скачка в ответ на разовое смещение пьезостолика. Для подтверждения факта соприкосновения в последующих опытах столик смещали еще на 100 нм (два шага по 50 нм), наблюдая два дополнительных скачка сигнала. Косвенным подтверждением корректности сформулированного критерия служит тот факт, что первый фиксируемый отрыв микросферы от стеклянной подложки наблюдался только после индикации первого скачка сигнала, но не ранее (показано на Фиг. 2 - сопоставление графиков «силового» сигнала КвФД и пошагового смещения пьезостолика по оси OZ во времени, где: 1-4 - первый цикл подведения-отведения (нет контакта); 4-9 - второй цикл подведения-отведения (есть контакт); 1-2 - сближение пьезостолика и микросферы; 2-3 - задержка пьезостолика в отсутствие контакта (~1 с); 3-4 - отведение пьезостолика; 4-5 - повторное сближение пьезостолика и микросферы; 5 - точка индикации контакта стеклянной подложки и микросферы; 5-6 - задержка пьезостолика в условиях контакта (~1 с); 6-7 - вторичное отведение пьезостолика в условиях контакта; 7 - точка разрыва связи; 7-8 - индицированный отрыв; 9 - фоновый сигнал КвФД). Из представленной хронограммы видно, что контакт двух поверхностей, произошедший в точке «1186.0 с», приводит к усилению амплитуды колебаний микросферы и индицируется по формированию первого скачка сигнала. Отведение пьезостолика, начатое на 1187.0 с, приводит к постепенному выходу микросферы из луча (изменение сигнала КвФД в интервале от 1187.0 до 1192.4 с) и, наконец, к разрыву сформировавшейся связи, сопровождающемуся резким скачком сигнала. С помощью датчика перемещения пьезостолика фиксировали пройденное им расстояние с точностью 50 нм, сохраняя сведения об этом в исходных файлах системы. В процессе сближения микросферы с пьезостоликом и отведения последнего также регистрировали и записывали в память компьютера зависимость сигнала КвФД от времени.
Анализ формы хронограмм сигнала позволяет сформулировать два основных критерия идентификации момента соприкосновения исследуемых объектов:
1) появление на хронограмме сигнала серии резких однонаправленных скачков повышенной амплитуды при пошаговом подведении пьезостолика (Фиг. 2);
2) нарастание амплитуды броуновских смещений микросферы, предшествующее проявлению первого признака.
Пример 3. Определение величины силы связи между функционализированными полистироловой микросферой и стеклянной подложкой.
Все настройки прибора, а также последовательность действий в процессе подведения микросферы к стеклянной подложке идентичны использованным в примере 2. После регистрации трех последовательных однонаправленных скачков сигнала КвФД, которые достоверно свидетельствуют о смещении микросферы из центра луча на расстояние 100- 150 нм, столик останавливали, выдерживали паузу в 1 секунду и запускали процедуру отведения путем непрерывного нажатия клавиши перемещения пьезостолика по оси OZ в интерфейсе программы. При таком режиме отведения частота смещения пьезостолика составляла 3 шага в секунду.
Контакт двух объектов помимо регистрируемого отрыва микросферы может приводить к необратимому связыванию микросферы со стеклянной подложкой, что свидетельствует о недостаточности развиваемой жесткости ловушки для разрыва возникшей связи. Вторым крайним вариантом может являться отсутствие регистрируемого отрыва (т.н. «нулевой» опыт) - в таком случае на хронограммах не обнаруживается резкого скачкообразного изменения сигнала, характерного для опытов, сопровождающихся отрывом микросферы, и кривые подведения и отведения выглядят симметричными. Приведенная ниже таблица иллюстрирует процент встречаемости исходов опытов по группам сравнения. Жесткость ловушки была выбрана таким образом, чтобы процент опытов, сопровождавшихся регистрацией отрыва, был близок к 50%.
Положительными считали такие опыты, исходом которых является обнаруживаемое резкое скачкообразное изменение сигнала, соответствующее очень быстрому разрыву связи, возникшей между микросферой и стеклянной подложкой. При последующей обработке сигнала учитывались только опыты с зарегистрированными силами разрыва связи не менее 4 пН.
Пример 4. Количественная характеристика распределения сил отрыва функционализированных полистироловых микросфер от функционализированной стеклянной подложки.
Характеризуя связи между исследуемыми макромолекулами, можно предполагать как специфический, так и неспецифический характер возникающих взаимодействий. В связи с этим массивы зарегистрированных сил отрыва полистироловых микросфер, функционализированных ЛПС Y. pseudotuberculosis, от стеклянных подложек, модифицированных антителами двух типов (МКАт2, МКАт7) и нейтральным белком (БСА), анализировали путем вычисления средних, а также построения гистограмм распределения и их аппроксимации по функции оценки ядерной плотности вероятности (kernel density estimation). Статистическая обработка данных проводилась с использованием пакетов программ «Statistica 12» и «MatLab 7».
Приведенная таблица иллюстрирует вычисленные средние значения сил отрыва для трех использованных вариантов взаимодействия. Статистически значимы (для р=0.99) различия между массивами «МКАт2» и «МКАт7», а также между «МКАт2» и «БСА». Данный факт вместе с представленными на Фиг. 3 аппроксимирующими гистограммы кривыми указывает на возможность регистрации специфических взаимодействий в области сил в области 50 пН. В диапазоне сил от 0 до 40-50 пН, по-видимому, наблюдаются преимущественно взаимодействия, носящие неспецифический характер.
Таким образом, предлагаемое изобретение позволяет воспроизводимо оценивать методами молекулярной силовой спектроскопии силу связи между функционализированной стеклянной подложкой и функционализированной полистироловой микросферой.
Примечания:
NO - опыты, в которых после контакта микросферы и стеклянной подложки между ними не формировалась связь;
NI - опыты, в которых контакт микросферы и стеклянной подложки приводил к необратимому вязыванию;
NR - опыты, в которых после контакта микросферы и стеклянной подложки наблюдался видимый на хронограмме отрыв;
NT - опыты с подтвержденными по итогам программной обработки отрывами;
NF - опыты с неподтвержденными по итогам программной обработки отрывами;
nT - число опытов с достоверно подтвержденными отрывами;
Ntot - общее число опытов (подведений и отведений) в рамках данной серии.
Способ количественной оценки силы межмолекулярного взаимодействия в модельной системе «функционализированная полистироловая микросфера - функционализированная стеклянная подложка» методом оптической ловушки, включающий приготовление целевых препаратов для функционализации полистироловых микросфер липополисахаридом и стеклянных подложек, функционализацию полистироловых микросфер липополисахаридом с помощью пассивной сенсибилизации и стеклянных подложек, калибровку оптического пинцета, подведение стеклянной подложки к полистироловой микросфере с шагом 50 нм до их соприкосновения, регистрируемого по характерным изменениям хронограммы сигнала квадрантного фотодетектора, отведение пьезостолика с функционализированной стеклянной подложкой от функционализированной полистироловой микросферы после их контакта в течение 1 секунды с шагом 50 нм до разрыва связи, индицируемого по резкой инверсии сигнала квадрантного фотодетектора, статистическую обработку данных по регистрации сил отрыва, отличающийся тем, что горизонтальная стеклянная подложка функционализируется молекулами антител с использованием метода аминомодификации, подведение горизонтальной стеклянной подложки к функционализированной липополисахаридом полистироловой микросфере и отведение от нее производится вертикально, что позволяет воспроизводимо и экспрессно оценивать силу межмолекулярных взаимодействий в системе «антиген-антитело» методом силовой спектроскопии.