Средство для коррекции десинхроноза, вызванного нарушением светового режима
Иллюстрации
Показать всеИзобретение относится к медицине и касается средства для коррекции десинхроноза, вызванного нарушением светового режима, содержащего композицию синергетически действующих компонентов: дельта-сон индуцирующий пептид с последовательностью Trp-Ala-Gly-Gly-Asp-Ala-Ser-Gly-Glu, высокоочищенный биологически активный комплекс, извлеченный из пантов северных оленей методом экстракции и гидролиза, дипептид карнозин и аминокислота глицин при массовом соотношении 1:(1-10000):(1-10000):(1-10000) соответственно. Изобретение обеспечивает быструю адаптацию организма при смене светового режима в условиях повышенной физической нагрузки. 2 з.п. ф-лы, 1 пр., 4 табл.
Реферат
Изобретение относится к области медицины, в частности к фармацевтической промышленности, и предназначено для коррекции десинхроноза, вызванного нарушением светового режима. Десинхроноз у человека возникает при быстром перемещении в широтном направлении, сменной работе (особенно в ночные часы), при нахождении в условиях арктического дня или ночи, искусственном увеличении светового дня, а также при воздействии различных факторов как химической, так и физической природы [1]. Все вышеперечисленные факторы уже сами являются стрессорными и частое их воздействие приводит к дезадаптации организма, развитию хронического стресса (к рассогласованию работы центральной нервной системы (ЦНС) и нарушению деятельности основных систем организма) [2]. Для разработки патогенетически обоснованных методов и средств коррекции, а также профилактики последствий десинхроноза необходимо понимание многочисленных механизмов, участвующих в развитии десинхроноза. Важной компонентой в механизме развития десинхроноза является транскрипционно-трансляционная обратная петля. Ее основой являются транскрипционные факторы BMAL1 и CLOCK, которые активируют транскрипцию генов Perl и Cryptochrome (CRY1-2) через связывание с Е-box промотерным элементом. В результате синтезируются соответствующие белки Per и Cry, которые транслоцируются в ядро клетки, где блокируют свое собственное образование. В результате концентрация Per и Cry-белков в цитоплазме клетки уменьшается, что снова приводит к «разблокированию» и активации генов, которые начинают производить новые порции белков. Так обеспечивается цикличность работы часовых генов [3]. Так же хорошо известно, что на эндогенном уровне управление циркадианными колебаниями («циркадианный pacemaker») находится в супрахиазматических ядрах гипоталамуса. Супрахиазматические ядра (СХЯ) являются главными генераторами циркадных ритмов у млекопитающих, управляют выделением мелатонина в эпифизе и синхронизируют работу всех прочих компонентов «биологических часов» организма. Активность нейронов СХЯ изменяется периодически в течение суток и подстраивается под внешние световые сигналы (смену дня и ночи), обеспечивая организм оптимальным условием функционирования [4]. Изменение светового режима нарушает эндогенный суточный ритм, подавляет ночную секрецию мелатонина и снижает его концентрацию в крови. Последствия десинхроноза у человека проявляются ухудшением памяти, внимания, значительным снижением работоспособности, бессонницей, усталостью, раздражительностью, депрессией, головными болями, неврозами, стойким нарушением сна, а также в резком скачке уровня социально-значимых заболеваний нервной, сердечно-сосудистой, эндокринной и репродуктивной систем [5].
Большие надежды в лечении десинхроноза возлагались на мелатонин и препараты на его основе. Установлено, что он эффективен на системном, тканевом, клеточном и субклеточном уровнях, препятствуя старению и раку. На системном уровне мелатонин снижает продукцию гормонов, способствующих этим процессам, стимулирует иммунный надзор, предупреждает развитие метаболического синдрома. Одновременно подавляется продукция свободных радикалов кислорода и активируется антиоксидантная защита. Мелатонин тормозит пролиферативную активность клеток и повышает уровень апоптоза в опухолях, но уменьшает его в нервной системе, угнетает активность теломеразы. На генетическом уровне он подавляет действие мутагенов и кластогенов, а также экспрессию онкогенов [6]. Применение эпифизарного гормона угнетает канцерогенез у животных и при обычном световом режиме, и при постоянном освещении. Это позволяет считать мелатонин универсальным эндогенным адаптогеном, поддерживающим баланс организма на определенном уровне и способствующим адаптации к непрерывно меняющимся условиям окружающей среды и локальным воздействиям на организм.
В настоящее время во многих странах выпускаются препараты мелатонина, которые зарегистрированы в качестве лекарств или как биологически активные добавки.
Известна фармацевтическая композиция для профилактики и лечения депрессивных состояний и нарушения сна, описанная в патенте №2475235, 2011 г., (патентообладатель ООО "ЭР ЭНД ДИ ФАРМА" (RU) (7), которая в качестве активного вещества содержит N-ацетил-5-метокситриптамин (мелатонин) в следующем соотношении компонентов, мг: селективный ингибитор обратного захвата серотонина (СИОЗС) - 10-30 мг, мелатонин - 3-8 мг. Фармацевтическая композиция обеспечивает лечение депрессивных заболеваний с дополнительными терапевтическими качествами: способностью облегчить засыпание и устранить нарушения сна, восстанавливать циркадианные и сезонные ритмы.
Однако использование мелатонина для коррекции биоритмов при сменной работе зависит от ее характера, освещенности и особенностей данного субъекта. Вопросы о необходимости приема гормона, его дозы и времени решаются в каждом случае индивидуально с обязательным учетом уровня мелатонина (до и после применения) в плазме крови или моче, что требует дополнительных временных и финансовых затрат. Кроме того, синтетический мелатонин, используемый в лекарственных средствах, является гормоном (в плазме крови человека от 50-100 пг/мл) и бесконтрольное использование препарата, повышающее его концентрацию в организме в десятки раз по сравнению с естественным ночным уровнем, может нарушить цикл сон-бодрствование, вызвать общую эндокринную недостаточность из-за неадекватного и чрезмерного торможения гормонов гипофиза, что приведет к ухудшению здоровья. У данного средства имеется еще ряд недостатков: головная боль, утренняя сонливость, отеки, ограничение деятельности, требующей повышенной концентрации внимания, во время приема препарата, симптомы диспепсии и ряд противопоказаний (выраженные нарушения функции почек, аутоиммунные заболевания, лейкемия, беременность).
Среди многочисленных лекарственных препаратов, применяемых в настоящее время в медицинской практике для коррекции десинхронозов, нарушений ритма сон-бодрствование, широко используются препараты растительного происхождения в различных комбинациях и поливитамины.
Известно средство хронобиологической коррекции и способ хронобиологической коррекции, выбранные в качестве прототипа (см. патент №2317822, 2004 г., Е.П. Воликов, Т.Г. Гороховская, Ю.Ю. Гичев.) (8), состоящее из двух комплексов - утреннего и вечернего. Утренний комплекс включает растительные компоненты мягкого тонизирующего и биостимулирующего действия и комплекс растительных адаптогенов, вечерний комплекс включает растительные компоненты мягкого успокаивающего и седативного действия и стимулирующие восстановление клеточных ресурсов. Кроме того, утренний и вечерний комплексы включают витамины, минеральные вещества, антиоксиданты и специфические биологически активные вещества, направленные на коррекцию специфических органных или системных нарушений, развивающихся вследствие хронического десинхроноза.
Однако недостатком данного средства является недостаточная эффективность его, а также неспецифическое воздействие на десинхроноз, наличие противопоказаний к применению тонизирующих средств (гипертония, острые инфекционные заболевания и др.), кроме того, применение вечернего комплекса средства сопряжено с седативным действием.
Технической задачей, на решение которой направлено заявленное изобретение, является создание эффективного препарата для коррекции десинхроноза, вызванного нарушением светового режима.
Поставленная цель достигается за счет того, что средство для коррекции десинхроноза, вызванного нарушением светового режима, содержит композицию синергетически действующих компонентов: дельта-сон индуцирующий пептид с последовательностью Trp-Ala-Gly-Gly-Asp-Ala-Ser-Gly-Glu, высокоочищенный биологически активный комплекс, извлеченный из пантов северных оленей методом экстракции и гидролиза, дипептид карнозин и аминокислоту глицин, при массовом соотношении 1:(1-10000):(1-10000):(1-10000) соответственно. Средство для коррекции десинхроноза предназначено для сублингвального или интраназального применения.
Соотношение компонентов в препарате может варьироваться. Наиболее эффективным является соотношение дельта-сон индуцирующий пептид с последовательностью Trp-Ala-Gly-Gly-Asp-Ala-Ser-Gly-Glu : экстракт из пантов северных оленей : дипептид карнозин : глицин = 1:100:100:100. Сущностью данного решения является то, что заявленная композиция состоит из веществ ранее вместе не применяемых, но обладающих в таком сочетании эффектом инициировать механизмы адаптации, которые позволяют предотвратить развитие десинхроноза, вызванного нарушением светового режима.
Подобная комбинация компонентов в препарате позволяет получить эффект синергии. Дельта-сон индуцирующий пептид (ДСИП) с последовательностью Trp-Аlа-Gly-Gly-Asp-Ala-Ser-Gly-Glu обладает широким мультифункциональным действием и относится к классу нейропротекторов с мощным адаптогенным, стресспротективным и антиоксидантным действием. ДСИП - это короткоживущий пептид, синтезируется в клетках мозга, активно транспортируется через гематоэнцефалический барьер, в организме человека присутствует в свободном и связанном виде. Были выявлены значительные суточные колебания уровня ДСИП в мозге, плазме крови животных и человека. Максимальное содержание ДСИП у человека выявлено в вечернее время. У больных с бессонницей, с депрессией уровень ДСИП снижен до 80%. Многочисленные данные указывают на участие ДСИП в организации циркадных ритмов, а также на взаимодействие ДСИП и мелатонина. Основным механизмом действия ДСИП является предупреждение гибели нейронов (за счет возмещения дефицита пептида в организме), возникающей при различных стрессовых состояниях, токсических воздействиях, старении организма. Модулирующее влияние ДСИП на ЦНС реализуется через классические нейромедиаторные системы: адренергические, серотонин - и ГАМК-ергические (9).
ДСИП может стабилизировать нейроны самых древних структур мозга (лимбико-ретикулярной системы). Стабилизируя нейроны подкорковых структур, ДСИП тем самым способствует стабилизации нейроэндокрино-иммунологического каскада (таким образом уменьшает проявления как системного стресса, так и психоэмоционального). Кроме того, ДСИП обладает антиоксидантным действием и связано оно с мощным подавлением самой функции образования свободных радикалов в клетках головного мозга. Нейропротекторное действие ДСИП осуществляется путем предупреждения гипервозбуждения нейронов в процессе нормальных адаптивных реакций, предотвращая их саморазрушение по механизму эксайтотоксичности.
Следующим компонентом препарата является сильный природный адаптоген - высокоочищенный экстракт из пантов северных оленей, извлеченный методом экстракции и гидролиза с использованием современного оборудования. Экстракт представляет собой биологически активный комплекс с содержанием органических веществ: прежде всего пептидов, нейропептидов, факторов роста нервов, аминокислот и минеральных компонентов (10).
Все биологически активные вещества из пантов оленей можно отнести к четырем группам.
К первой группе веществ относятся пептиды. Пептиды являются регуляторами различных биохимических процессов, транспортируют ионы и низкомолекулярные вещества, защищают организм от токсичных элементов, обладают противострессорным действием, влияют на процесс обучения и запоминания, регулируют сон, снимают боль. В экстракте из пантов северных оленей обнаружены фактор роста нервов (NGF) и цилиарный нейротрофический фактор (CNTF). Фактор роста нервов (ФРН) необходим для нормального роста, созревания, а также поддержания жизнедеятельности нейронов центральной и переферической нервной системы. ФРН обладает нейротрофическими свойствами, показывает модулирующее влияние на иммунную и нейроэндокринную системы. Цилиарный нейротрофический фактор (ЦНТФ) рассматривается как ключевой фактор дифференцировки для развивающихся нейронов и глиальных клеток. ЦНТФ обеспечивает трофику и участвует в защите поврежденных нейронов.
Ко второй группе биологически активных веществ относятся аминокислоты. Из 20 аминокислот преобладают глицин, аланин, пролин, валин, лейцин. Из незаменимых аминокислот в основном присутствуют треонин, лизин, лейцин, фенилаланин и изолейцин. Аминокислоты являются важнейшими компонентами белков, ферментов, и других биологически активных веществ.
К третьей группе веществ следует отнести минеральные компоненты, которые в виде хелатных и ионных комплексов проявляют высокую биологическую активность. В экстрактах содержится до 30 макро- и микроэлементов. Важными макроэлементами представлены кальций, натрий, железо, фосфор, калий. В препаратах из пантов оленей обнаружены такие микроэлементы, как магний, марганец, медь, цинк. Известно, что магний и марганец участвуют в процессах внутриклеточного обмена, защищают сердечную мышцу от гипоксии и структурных повреждений. Многообразие макро- и микроэлементов в экстрактах оказывает положительное воздействие на процессы дыхания, сердечно-сосудистую систему.
К четвертой группе биологически активных веществ из пантов оленей следует отнести нуклеиновые кислоты.
Третьим компонентом заявленного препарата является дипептид карнозин, состоящий из двух аминокислот (аланина и гистидина). В больших концентрациях дипептид карнозин обнаружен в тканях мозга, сердца, скелетной мускулатуры, меньше в хрусталике. Дипептид карнозин обладает свойствами антиоксиданта и способен подавлять свободнорадикальные реакции путем инактивации активных форм кислорода и продуктов перекисного окисления липидов, а также свойствами мембранопротектора - оказывает защитные действия на мембранные структуры митохондрий. Дипептид карнозин является природным стимулятором мышечной активности; обладает ярковыраженными антиоксидантными, геропротекторными свойствами, повышает устойчивость организма к тяжелым физическим и психоэмоциональным нагрузкам, восстанавливает сократительную активность сердца при длительном ишемическом состоянии (11).
Последний компонент глицин (аминоуксусная кислота) относится к заменимым аминокислотам, входит в состав многих белков и биологически активных соединений, легко усваивается организмом. Глицин обладает выраженным антиоксидантным, антитоксическим и ГАМК-эргическим действием. Глицин является нейромедиатором и регулятором метаболических процессов в тканях мозга человека, нормализует процессы защитного торможения в центральной нервной системе. Глицин проявляет антистрессовые и антитоксические действия, повышает адаптивные и защитные силы организма, снижает психоэмоциональное напряжение, агрессивность, конфликтность, уменьшает вегетососудистые расстройства, повышает умственную работоспособность, концентрацию внимания, способность к обучению, нормализует деятельность иммунной системы, снижает токсическое влияние лекарственных средств.
Таким образом, в заявляемое средство для предотвращения неблагоприятных проявлений десинхроноза, вызванного нарушением светового режима, входят вещества, обладающие адаптогенным, ноотропным, антиоксидантным, стресспротективным действием и обеспечивающие их мощный синергетический эффект на основные патогенетические механизмы повреждения. Наиболее предпочтителен сублингвальный или интраназальный путь введения препарата, что обеспечивает попадание препарата в центральную нервную систему и максимально быструю и эффективную доставку компонентов в различные структуры мозга.
Для подтверждения эффективности предлагаемой комбинации веществ (дельта-сон индуцирующего пептида, экстракта из пантов северных оленей, дипептида карнозина и глицина) были проведены экспериментальные исследования на лабораторных животных.
Эксперимент проводился на беспородных крысах - самцах весом 180-200 г, полученных из специализированного питомника, находящегося в пос. Рапполово Ленинградской области. Животных разместили в изолированных секциях сроком на 3 дня для адаптации к новым условиям, затем они были переведены в экспериментальные секции. До эксперимента все крысы были здоровы, находились в одинаковых условиях содержания, ухода и кормления.
Все условия содержания и ухода за животными и их кормление (включая качество корма и питьевой воды) соответствовали установленным ветеринарным санитарно-гигиеническим правилам, не оказывали влияния на результаты исследования. Экспериментальные работы проводились согласно принципам гуманного отношения к животным в соответствии с «Международными рекомендациями по проведению медико-биологических исследований с использованием животных», «Правилами проведения работ с использованием экспериментальных животных» и «Правилами лабораторной практики в Российской Федерации» (Приказ Минздрава РФ №267 «Об утверждении правил лабораторной практики» от 19.06.2003).
Всех животных разделили на интактных и опытных. Первая часть эксперимента длилась 21 день.
Интактная группа - это крысы, находившиеся при обычном освещении и не подвергавшиеся никаким воздействиям на протяжении всего эксперимента.
Опытная группа - это крысы, находившиеся при обычном освещении и подвергавшиеся физическим нагрузкам - ежедневной тренировке на тредбане (в течение 15 мин, скорость 21 м/с).
После 21 дня эксперимента животные интактной и опытной групп были подвергнуты контрольному тестированию на тредбане (в течение 15 мин, скорость 26 м/с).
После контрольного тестирования эксперимент продолжался еще 7 дней в условиях смоделированного десинхроноза, сопряженного с физическими нагрузками и изменением светового режима. Для этого опытная группа была разделена на несколько подгрупп, которые продолжали ежедневно тренироваться на тредбане, но у них были разные условия содержания и тренировок (при обычном освещении, в условиях световой депривации и в условиях темновой депривации), и одни подгруппы получали фармподдержку в виде заявленного средства, далее «Препарат», а другие - нет:
- контрольная подгруппа ДН находилась при обычном освещении, подвергалась физическим нагрузкам, не получала «Препарат»;
- подгруппа НН1 находилась в условиях световой депривации, подвергалась физическим нагрузкам, не получала «Препарат»;
- подгруппа НН2 находилась в условиях световой депривации, подвергалась физическим нагрузкам и получала в качестве препарата фармподдержки «Препарат» (150 мкг/кг подъязычно);
- подгруппа ДД1 находилась в условиях темновой депривации, подвергалась физическим нагрузкам, не получала «Препарат»;
- подгруппа ДД2 находилась в условиях темновой депривации, подвергалась физическим нагрузкам и получала в качестве препарата фармподдержки «Препарат» (150 мкг/кг подъязычно);
Таким образом, во второй части эксперимента все подгруппы опытных животных, находясь в разных условиях содержания, продолжали тренировочные забеги на тредбане (в течение 15 мин, скорость 21 м/с) в течение 7 дней. Животные подгрупп ДН, НН1 и ДД1 не получали фармподдержки, животным подгрупп НН2 и ДД2 ежедневно вводился «Препарат» (150 мкг/кг подъязычно). На 8 день эксперимента во всех подгруппах опытных животных были проведены контрольные забеги на тредбане (в течение 15 мин, скорость 26 м/с).
Регистрируемые показатели:
1. Активность бега на тредбане на 21 день тренировки и на 8 день после моделирования десинхроноза.
2. Биохимические анализы крови: активность модуляторов метаболического обмена (рецепторы, активируемые пероксисомными пролифераторами PPARγ), фосфоенол пируваткарбоксикиназа (ФЕПКК), Na, K -АТФаза (аденозинтрифосфатаза).
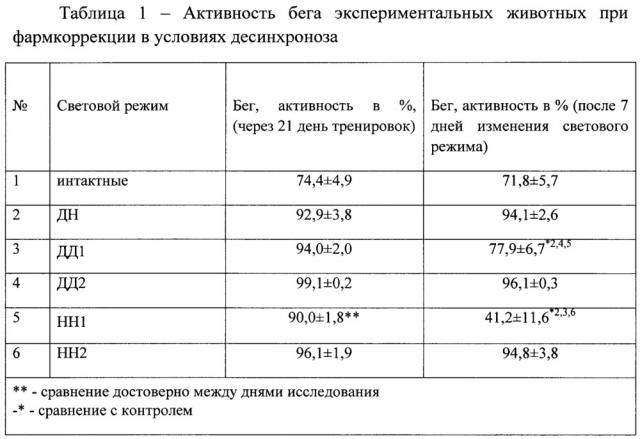
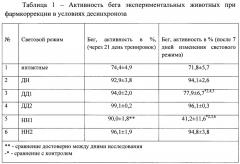
В таблице 1 представлены результаты тестирования экспериментальных животных на тредбане.
Проведенный эксперимент показал, что, несмотря на то, что крысы являются хронорезистентными животными, через 1 неделю экспериментального десинхроноза наблюдается значительное снижение физической работоспособности. Так, у животных, находящихся в условиях темновой депривации, активность бега достоверно снизилась на 17,1%, а в условиях световой депривации - на 54,3%.
Фармакологическая коррекция посредством «Препарата» приводила к увеличению активности бега до уровня контрольных животных и к фоновым показателям экспериментальных групп. Более эффективным оказалось воздействие препарата в условиях световой депривации.
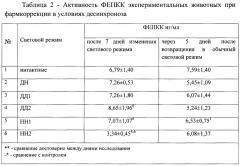
Следующей задачей исследования явилось изучение активности ключевого фермента глюконеогенеза фосфоенолпируваткарбоксикиназы (ФЕПКК) в условиях экспериментального десинхроноза, сопряженного с физическими нагрузками. Результаты эксперимента приведены в Таблице 2.
Активность ФЕПКК определяли в сыворотке крови экспериментальных животных через 7 суток после изменения светового режима.
В результате проведенного исследования выявлено, что активность ФЕПКК в сыворотке крови экспериментальных животных, находившихся при постоянном освещении и не получавших фармкоррекции, возрастала на 35% по сравнению с контрольной группой, находившейся при естественном освещении.
Подобная тенденция наблюдалась у животных, находившихся в условиях световой депривации без фармакологической коррекции. Применение «Препарата» вызвало изменение активности фермента противоположной направленности. Так, в группе, находившейся при постоянном освещении, наблюдалось нарастание активности ФЕПКК на 61% по сравнению с контролем. В группе, находившейся в условиях темноты, применение «Препарата» вызвало достоверное снижение активности фермента на 39% (p≤0,05).
Учитывая известное влияние глюкокортикоидов на активность ФЕПКК, полученные результаты подтверждают участие оси «гипоталамус-гипофиз-надпочечники» в адаптации организма при смене светового режима. Анализ парадоксального ответа изменения активности ФЕПКК на введение «Препарата» в разных световых режимах указывает на участие также эпифиза в процессах энергообмена клетки.
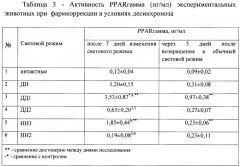
Исследование активности рецепторов, активируемых пероксисомными пролифераторами (PPARγ) показало, что в группе ДД1 происходило достоверное повышение данного показателя в 2,9 раза по сравнению с группой ДН. Активность PPARγ в группе НН1 не отличалась от контрольной группы ДН.
Введение «Препарата» снижало активность PPARγ в группах НН2 и ДД2 соответственно в 10,1 и 1,9 раза по сравнению с группой ДН.
Результаты проведенного исследования по изменению активности PPARгамма (нг/мл) экспериментальных животных при фармкоррекции в условиях десинхроноза представлены в Таблице 3.
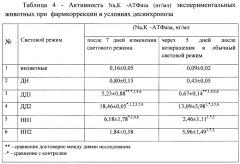
Исследование активности Na,K -АТФазы показало, что в группе ДД1 происходило достоверное повышение данного показателя в 6,5 раза по сравнению с группой ДН, а в группе НН1 в 7,7 раза.
Введение «Препарата» достоверно повышало активность фермента в группе ДД2 в 23,1 раза по сравнению с группой ДН, а в группе НН2 повышение было статистически недостоверным.
Результаты проведенного исследования по изменению активности Na,K -АТФазы (нг/мл) экспериментальных животных при фармкоррекции в условиях десинхроноза представлены в Таблице 4.
Анализ полученных экспериментальных данных показал, что применение «Препарата» вызывало увеличение физической работоспособности животных, находившихся в состоянии десинхроноза. Обратная зависимость в группе НН2 между повышением работоспособности и снижением активности ФЕПКК демонстрирует снижение стрессорного компонента после введения «Препарата» и нормализацию гормонального обмена гипофиз-адреналовой системы. Повышение показателя PPARγ, регулирующего энергетический метаболизм, в группах ДД1 и НН1 свидетельствует о повышенных потребностях в энергии организма, находящегося в условиях десинхроноза. Применение «Препарата» приводило к нормализации данного маркера, что может свидетельствовать об оптимальном уровне энергетического метаболизма.
Представленные результаты доказывают, что заявленное средство для коррекции десинхроноза, состоящее из пептида дельта-сна, высокоочищенного экстракта пантов северных оленей, дипептида карнозина и глицина, способствует быстрой адаптации организма (крыс) при смене светового режима в условиях повышенной физической нагрузки и является ключевым звеном целенаправленной коррекции дизрегуляторных нарушений при десинхронозах.
Список литературы
1. Щукин А.И. Хронофизиологические аспекты сменного труда / А.И. Щукин // Хронобиология и хрономедицина. - М.: Триада-Х, 2000. - С. 402-429.
2. Виноградова И.А., Анисимов В.Н. Световой режим Севера и возрастная патология. - Петрозаводск: ПетроПресс, 2012. - 128 с.
3. Анисимов В.Н. Мелатонин роль в организме, применение в клинике. СПб.: Издательство «Система», 2007. 40 с.
4. McClung СА. Circadian genes, rhythms and the biology of mood disorders. Pharmacol Ther 2007; 114: 222-32.
5. Анисимов В.Н. Роль светового режима и мелатонина в развитии возрастной патологии // Медлайн-Экспресс, 2010. №1 (205). С. 53-56.
6. Wright КР Jr, Rogers NL. Endogenous versus exogenous effects of melatonin. In: Pandi-Perumal SR, Cardinali DP, eds. Melatonin: from molecules to therapy. New York: Nova Science Publishers, 2007: 547-69.
7. Патент №2475235, 2011 г., (патентообладатель ООО "ЭР ЭНД ДИ ФАРМА" (RU).
8. Патент №2317822, 2004 г., Е.П. Воликов, Т.Г. Гороховская, Ю.Ю. Гичев.
9. Белых А.Е., Бобынцев И.И. Дельта-сон индуцирующий пептид: отдельные биологические эффекты и механизмы их развития // Курский научно-практический журнал «Человек и его здоровье», 2016. №1. С. 79-94.
10. Осинцев Н.С., Осинцев С.Н. Целебные силы пантов. Калуга: Издательство «Манускрипт», 2004. 154 с.
11. Ярыгина Е.Г., Прокопьева В.В., Бохан Н.А., Окислительный стресс и его коррекция карнозином «Успехи современного естествознания», 2015. №4. С. 106-113.
1. Средство для коррекции десинхроноза, вызванного нарушением светового режима, содержащее композицию синергетически действующих компонентов: дельта-сон индуцирующий пептид с последовательностью Trp-Ala-Gly-Gly-Asp-Ala-Ser-Gly-Glu, высокоочищенный биологически активный комплекс, извлеченный из пантов северных оленей методом экстракции и гидролиза, дипептид карнозин и аминокислота глицин при массовом соотношении 1:(1-10000):(1-10000):(1-10000) соответственно.
2. Средство для коррекции десинхроноза по п. 1, отличающееся тем, что средство предназначено для сублингвального применения.
3. Средство для коррекции десинхроноза по п. 1, отличающееся тем, что средство предназначено для интраназального применения.