Белково-пептидный комплекс, повышающий жизнеспособность фолликулов в яичниках млекопитающих
Иллюстрации
Показать всеИзобретение относится к биотехнологии, в частности репродуктивной биологии, и может найти применение в медицине, фармакологии и ветеринарии. Белково-пептидный комплекс получают из ткани яичников коров экстракцией в водно-солевом растворе при температуре +4-5°C, выделением из экстракта после обработки сульфатом аммония методом обращенно-фазовой ВЭЖХ с использованием хроматографа высокого давления. Комплекс содержит пептиды с молекулярными массами 1000-8000 Да и белок, представляющий собой бычий сывороточный альбумин gi|1351907 с молекулярной массой 66690 Да, при массовом соотношении пептиды:белок, составляющем (1):(1-5). Предлагаемый белково-пептидный комплекс обеспечивает повышение жизнеспособности фолликулов в яичниках млекопитающих при концентрации общего белка 10-9 мг/мл, не обладает аллергенными, мутагенными и сенсибилизирующими свойствами и не проявляет токсичности. 2 ил., 4 табл., 13 пр.
Реферат
Изобретение относится к биотехнологии, в частности репродуктивной биологии, а именно к биологически активному белково-пептидному комплексу (БПК), выделенному из яичников коров, который содержит пептиды с молекулярными массами 1000-8000 Да и бычий альбумин сыворотки крови с молекулярной массой 66690 Да и способен в низких дозах соответствующих диапазону концентраций 10-8-10-15 мг/мл, повышать жизнеспособность фолликулов в яичниках млекопитающих, что способствует восстановлению процесса созревания фолликулов и нормального функционирования яичников.
Настоящее изобретение может найти применение в медицине, фармакологии и ветеринарии в качестве средства для профилактики и лечения нарушений репродуктивной функции у млекопитающих, в частности человека, связанных с неправильным развитием фолликулов и нарушением овуляторных циклов в яичниках.
В современном мире, в частности в России, очень остро стоит проблема бесплодия среди населения и сельскохозяйственных животных. На понижение уровня репродуктивного потенциала мужских и женских половых органов могут оказывать влияние множество факторов, начиная от частых стрессовых ситуаций и заканчивая плохой экологической обстановкой. Согласно статистическим данным, нарушения репродуктивной функции чаще всего наблюдаются у женщин (В. Baranski, Effects of the workplace on fertility and related reproductive outcomes. Environ Health Perspect. 1993, 101 (Suppl 2), 81-90).
Причинами бесплодия у женщин могут быть как патологии репродуктивной системы женщины, так и заболевания организма в целом. Наиболее распространенной причиной женского бесплодия, наблюдаемой в 35-40% случаев, является нарушение процесса овуляции (выхода яйцеклетки из созревшего фолликула в яичнике), что связано с дисфункцией желез внутренней секреции. Еще одну большую группу пациентов составляют женщины с расстройствами менструального цикла (недостаточность лютеиновой фазы или ановуляторные циклы) в результате нарушений в ходе процесса фолликулогенеза. (W. Foster, М. Neal, Е. Younglai, Endocrine disrupters and ovarian function. International Congress Series 1266. 2004, 126-132).
Фолликулогенезом называется созревание фолликулов яичника, его структурной единицы, представляющей собой плотно упакованную оболочку из соматических клеток, которая содержит незрелую яйцеклетку (ооцит). Основная функция фолликула заключается в защите яйцеклетки от внешних факторов на всех стадиях процесса ее формирования. Процесс фолликулогенеза включает в себя непрерывную трансформацию ряда мелких первичных фолликулов в крупные фолликулы, готовые к овуляции, которые частично возникают во время менструального цикла. Считается, что кора женского яичника во время его эмбрионального развития содержит свое максимальное количество фолликулов: от 4 до 5 миллионов в среднем случае, но отдельные пиковые популяции варьируются от 6 до 7 миллионов (W.H.B. Wallace, T.W. Kelsey. Human ovarian reserve from conception to the menopause. PLoS ONE, 2010, 5, 1: 1-9). Эти примордиальные фолликулы содержат незрелые ооциты. С момента начала полового созревания в женском организме начинается процесс трансформации примордиальных фолликулов в первичные, что сопровождается изменением формы окружающих фолликул гранулезных клеток. (J. Fortune, R. Cushman, С.Wahl, S. Kito. The primordial to primary follicle transition. Mol Cell Endocrinol. 2000, 163, (1-2): 53-60). Первичные фолликулы имеют рецепторы для связывания фолликулостимулирующего гормона (ФСГ), но они не зависят от гонадотропина до следующей (антральной) стадии, однако, присутствие ФСГ ускоряет рост фолликулов in vitro (R. Vandenhurk, M. Bevers, J. Beckers. In-vivo and in-vitro development of preantral follicles. Theriogenology. 1997, 47: 73-82). Рост и развитие первичных фолликулов также зависит от экспрессии факторов роста и дифференцировки, таких как сосудистый эндотелиальный фактор роста (VEGF) и Фактор-9 роста и дифференцировки (GDF-9) (V.R. М.О. Gastal, J.R. Figueiredo, E.L. Gastal. In vitro culture of bovine preantral follicles: a review. Reprod Biol Endocrinol. 2014, 12:78). Формирование заполненной жидкостью полости, называемой «антрумом», рядом с ооцитом обозначает переход на стадию вторичного (антрального) фолликула. Вторичный фолликул гистологически и структурно характеризуется полностью выращенным ооцитом, окруженным блестящей оболочкой, приблизительно девятью слоями гранулезных клеток, базальной пластинкой, внутренней и наружной оболочками, капиллярной сеткой и наличием полости. В третичном фолликуле полностью формируется основная структура зрелого фолликула, и новые клетки не обнаруживаются. Хорошо выделяется яйценосный бугорок со зрелой яйцеклеткой. Гранулезные клетки продолжают делиться, что сопровождается увеличением объема полости. Третичные фолликулы могут достигать огромных размеров. Основным фактором запуска и развития процесса фолликулогенеза является эндокринная система (К.Ю. Боярский. Молекулярные основы фолликулогенеза. Пробл. Репродукции, 2006, 4: 26-37).
Стимуляция роста и развития вторичных фолликулов является важным фактором в процессе фолликулогенеза для созревания третичного фолликула и последующего выхода созревшей яйцеклетки из яичника (овуляции). Именно вторичные фолликулы готовы к процессу овуляции через один менструальный цикл.
Успешное зачатие и развитие эмбриона является результатом многих реакций и межклеточных взаимодействий, в которых яичник и фолликулярный резерв яичника играют основную роль. Известно, что с возрастом наблюдается рост числа поврежденных фолликулов и сокращение резерва пула фолликулов у млекопитающих (G. Cruz, D. Fernandois, А.Н. Paredes. Ovarian function and reproductive senescence in the rat: role of ovarian sympathetic innervation. Reproduction, 2017, 153, 59-68). Показано, что к 30 годам у женщин сохраняется только 10% фолликулов, не вступивших в стадию роста, от числа фолликулов, сформировавшихся при рождении, и это число с каждым годом неуклонно снижается (W.H.B. Wallace, T.W. Kelsey. Human ovarian reserve from conception to the menopause. PLoS ONE, 2010, 5, 1:1-9).
Тем не менее, в последнее время появились данные о возобновлении появления фолликулов яичников из зародышевых стволовых клеток костного мозга и периферической крови) в постнатальном яичнике мыши (J. Johnson et al. Oocyte generation in adult mammalian ovaries by putative germ cells in bone marrow and peripheral blood. Cell, 2005, 122 (2): 303-315; J. Johnson et al. Germline stem cells and follicular renewal in the postnatal mammalian ovary. Nature, 2004, 428 (6979): 145-150). Исследования, пытающиеся воспроизвести эти результаты, продолжаются в настоящее время.
Для решения проблемы улучшения репродуктивной функции самок млекопитающих, в частности человека, перспективными могут быть вещества эндогенного происхождения, которые стимулируют жизнеспособность клеток и тканей половых органов млекопитающих, и не вызывают неблагоприятных реакций в отдельных тканях и организме в целом.
Известен ряд средств, в том числе белковой и пептидной природы, улучшающих репродуктивную функцию млекопитающих, в частности человека.
Известно средство для профилактики и лечения женского бесплодия, представляющее собой гормон гонадотропина, который обладает фолликулостимулирующим действием (Патент RU 2059412, A61K 35/22, опубл. 10.05.1996). Для лечения используют подкожные инъекции альфа- (111 аминокислот) и бета-субъединиц (112 аминокислот) гонадотропина, выделенных из постменопаузной мочи пациенток. Недостатками указанного средства является длительность лечения, достигающая нескольких недель или даже месяцев, и большая вероятность возникновения местной аллергии у пациента из-за наличия примесей в используемом препарате.
Известна фармацевтическая композиция, обеспечивающая фолликулогенез и созревание фолликулов без гиперстимуляции яичников, которая содержит фолликулостимулирующий гормон (FSH) и хорионные гонадотропины (hCG) (патент RU №2332228, МПК A61K 38/24, 2008). Данная композиция обладает стимулирующим фолликулогенез действием за счет различных соотношений FSH и hCG. Так как возможно поэтапное регулирование количества FSH и hCG в зависимости от стадии фолликулогенеза, может быть обеспечено прохождение овуляции без гиперстимуляции яичников. Недостатком данного фармакологического препарата является сложность и длительность процедуры индивидуального подбора соотношения FSH и hCG для каждого пациента, а также достаточно высокая его стоимость.
Известно средство, выделенное из яичников животных, восстанавливающее репродуктивную функцию (патент РФ №2056853, МПК A61K 35/54, опубл. 1996), которое содержит полипептиды с молекулярной массой 1000-10000 Да и большое количество (до 70%) веществ не белковой природы, извлекаемых вместе с пептидами. Вещества небелковой природы не проявляют искомой биологической активности, что определяет низкую активность выделенного средства. Кроме того, метод оценки биологического действия, использованный в данном техническом решении, не позволяет выявить механизм биологического действия средства и степень его влияния на репродуктивную функцию: в патенте продемонстрировано лишь изменение продолжительности репродуктивного цикла при воздействии данного средства (патент РФ №2056853, МПК A61K 35/54, опубл. 1996).
Известно средство, нормализующее репродуктивную функцию у женщин (патент РФ №2303454, МПК A61К 35/54, А61Р 15/08, опубл. 2007), представляющее собой препарат для парентерального введения в виде биологически активного пептидного комплекса, выделенного из яичников телят или свиней. Показано наличие в данном препарате низкомолекулярных пептидных фракций с молекулярной массой от 70 до 712 Да, и отсутствие в нем высокомолекулярных фракций. К недостаткам данного изобретения можно отнести отсутствие идентификации пептидов, входящих в состав указанного комплекса, а также биологическое тестирование, проведенное на органотипической культуре яичников крыс in vitro, в котором отсутствуют данные по определению фенотипа пролиферирующих и мигрирующих клеток из эксплантата, что не позволяет проанализировать механизм биологического действия данного пептидного комплекса. В формуле изобретения указан диапазон активных концентраций описанного пептидного комплекса, составляющий 2,5-2,9 мг/мл. Кроме того, в патенте не имеется данных, указывающих на тканеспецифический характер биологической активности данного комплекса.
Известно фармакологическое средство «Эндоферин», которое является близким аналогом заявляемого белково-пептидного комплекса (https://www.vidal.by/poisk_preparatov/endoferin.html), представляющее собой комплекс белков, выделенный из яичников крупного рогатого скота (КРС), содержащий в качестве стабилизатора бычий сывороточный альбумин с молекулярной массой около 66 кДа и биологически активный белок суперсемейства TGF-β с иммунологической специфичностью ингибина βА с молекулярной массой около 56 кДа. Данный препарат рекомендован для лечения эндомитриоза и аденомиоза, как основных причин бесплодия у женщин. К недостаткам данного препарата можно отнести наличие побочных эффектов: увеличение показателей постимплантационной гибели плодов и ускорение оссификации костного скелета. В связи с этим беременность является противопоказанием к применению данного препарата. Кроме того, отсутствуют данные онкогенного потенциала, а его иммуногенный потенциал полностью не изучен, в связи с чем не исключается возможность аллергических реакций при его применении. Также не рекомендуется совместное применение эндоферина с антигормональными средствами и иммуностимуляторами. Информации о механизме биологического действия препарата в описании не имеется.
Таким образом, в литературе отсутствуют сведения о веществах, включая вещества белково-пептидной природы, которые оказывают влияние на жизнеспособность фолликулов в яичниках млекопитающих.
Задачей изобретения является создание эффективного средства, повышающего жизнеспособность фоликуллов в яичниках млекопитающих, получаемого из веществ природного происхождения.
Задача решается белково-пептидным комплексом, выделенным из яичников коров, включающим пептиды с молекулярными массами 1000-8000 Да и белок, представляющий собой бычий сывороточный альбумин gi|1351907 с молекулярной массой 66690 Да, при массовом соотношении пептиды : белок, составляющем (1):(1-5), обеспечивающим повышение жизнеспособности фолликулов в яичниках млекопитающих, который является эффективным при разведении в фармацевтически приемлемом носителе и/или разбавителе до концентрации общего белка от 10-8 до 10-15 мг/мл, предпочтительно 10-9 мг/мл. Заявляемый БПК характеризуется отсутствием токсичности, совместимостью с другими препаратами и отсутствием негативных побочных эффектов.
Технический результат - создание нетоксичного средства, повышающего жизнеспособность фолликулов в яичниках млекопитающих, получаемого из доступного природного сырья, которое является эффективным при введении использовании в низких дозах.
Существенным преимуществом заявляемого изобретения является то, что в качестве вещества, повышающего жизнеспособность фолликулов в яичниках млекопитающих, используется высокоочищенный БПК, выделенный из яичников коров, и проявляющий биологическое действие в сверхнизких дозах при разведении в водном фармацевтически приемлемом носителе и/или разбавителе до концентрации общего белка от 10-8 до 10-15 мг/мл, предпочтительно 10-9 мг/мл. Применение БПК приводит к повышению жизнеспособности фолликулов в яичниках млекопитающих и восстановлению нормального функционирования тканей яичника.
Заявляемый БПК содержит полученные из ткани яичников коров пептиды с молекулярными массами 1000-8000 Да и бычий сывороточный альбумин gi|1351907 с молекулярной массой 66690 Да, характеризующийся аминокислотной последовательностью N-концевого мотива: DTHKSEIAHRFKDLGE. Соотношение пептидов и белка в составе выделенного БПК составляет от 1:1 до 1:5.
Показано, что у заявляемого БПК отсутствуют аллергенные, сенсибилизирующие и иммунотоксические свойства, БПК не обладает мутагенным действием и потенциальной канцерогенной активностью. Исследования показали, что БПК не обладает эмбриотоксическим и тератогенным действием, не оказывает влияния на общее физическое развитие потомства, его двигательную активность и эмоциональное состояние, а также на скорость возникновения сенсорно-двигательных рефлексов.
Изобретение иллюстрируется следующими фигурами и примерами:
Фиг. 1. Диаграмма значений параметра Δ, отражающего количество живых (А) и нежизнеспособных (Б) фолликулов в контрольной и опытной группах и в нативной ткани яичника. Параметр рассчитывается по формуле Δх=Nx/100, где Nx - число фолликулов каждой группы, подсчитанное на ста различных гистологических срезах.
Фиг. 2. Диаграмма значений параметров ΔI, ΔII и ΔIII, характеризующих среднее количество живых первичных (А), вторичных (Б) и третичных (В) фолликулов в контрольной и опытной группах и в нативной ткани, соответственно, где ΔI=NI/100, NI, NII, NIII - число первичных, вторичных и третичных фолликулов, подсчитанное на ста различных гистологических срезах, соответственно.
Пример 1. Способ получения белково-пептидного комплекса из яичников крупного рогатого скота. В работе используют яичники половозрелых коров, полученные при забое крупного рогатого скота на мясокомбинатах Подмосковья. Ткани яичников нарезают на небольшие фрагменты, размером 1,5-2,0 см2, для экстрагирования помещают в раствор следующего состава: 0,15 М NaCl, 2,5×10-3 М KСl, 2×10-3 М CaCl2, 1×10-3 М HEPES. Экстракцию проводят в течение 3-х часов при температуре +4°C. Полученный экстракт фильтруют, центрифугируют при 3000 g в течение 30 мин. К охлажденному раствору тканевого экстракта постепенно добавляют сухой сернокислый аммоний при постоянном перемешивании до образования насыщенного раствора соли (на каждые 100 мл раствора экстракта добавляют 78 г соли). Суспензию белков оставляют на 72 час при +4°C, после чего центрифугируют при 12000 g в течение 30 минут. Собирают фракции супернатанта и осадка. Фракцию супернатанта длительно (8-10 суток) диализуют против дистиллированной воды, а фракцию осадка - против буферного раствора (0,01 М Tris, рН 7,4) до полного удаления ионов сульфата аммония. Присутствие в растворе ионов аммония определяют качественной реакцией с реактивом Несслера. Полученные после диализа фракции супернатанта и осадка далее концентрируют, используя роторный вакуумный испаритель, при температуре не выше 40°C. Концентрацию белка во всех фракциях и на всех стадиях очистки и исследования определяют спектрофотометрически (Р. Досон, Д. Эллиот, У. Эллиот, К. Джонс. Справочник биохимика М. Мир, 1991). Затем фракцию осадка яичников КРС (100 мл) разделяют методом обращенно-фазовой ВЭЖХ на колонке Kromasil С4 (4,6×250 мм) с использованием хроматографа высокого давления Agilent 1200 (США). Элюцию осуществляют в градиенте концентрации ацетонитрила (0-60%) в 0,1%-ной трифторуксусной кислоте (рН 2,2) со скоростью 1 мл/мин в течение 60 мин. Детекцию проводят при 280 и 214 нм. Собирают фракцию с временем удерживания 57,3 мин., из нее в вакуумном испарителе удаляют ацетонитрил и трифторуксусную кислоту и растворяют в физиологическом водно-солевом растворе.
Пример 2. Определение состава и структуры выделенного и очищенного белково-пептидного комплекса. ВЭЖХ-фракцию с временем удерживания 57,3 мин, полученную из экстракта яичников КРС, исследуют методом MALDI TOF масс-спектрометрии на времяпролетном масс-анализаторе UltraFlex 2 (Braker Daltonic, Германия) с использованием в качестве матрицы α-циано-4-гидроксикоричной кислоты. Получают масс-спектрометрический сигнал, соответствующий молекулярной массе 66690 Да. Также данную фракцию анализируют методом электрофореза в 15%-ном полиакриламидном геле в денатурирующих условиях (U.K. Laemmli. Cleavage of Structural Proteins during the Assembly of the Head of Bacteriophage T4. Nature, 1970, 227, 680-685). Из геля вырезают полосу, соответствующую молекулярной массе примерно в 66000 Да. Проведенный триптический гидролиз белка в геле с последующим масс-спектрометрическим исследованием продуктов гидролиза показывает, что выделенный белок с молекулярной массой около 66690 Да представляет собой белок семейства альбуминов млекопитающих под номером gi|1351907 в базе данных SwissProt. Методом Эдмана устанавливают частичную N-концевую аминокислотную последовательность этого белка (DTHKSEIAHRFKDLGE), которая имеет 100%-ную гомологию с N-концевой последовательностью зрелой молекулы бычьего сывороточного альбумина (БСА).
ВЭЖХ-фракцию со временем удерживания 57,3 минуты собирают и подвергают денатурации в буфере, содержащем 6 М GuHCl, 300 мМ NaCl, 3 мМ ЭДТА, для идентификации пептидных компонентов. Инкубация в данном буфере проводится в течение 24 часов при температуре 45°C. После завершения инкубации полученный раствор снова подвергают разделению с помощью метода обращенно-фазовой ВЭЖХ на колонке Kromasil С4 в условиях, аналогичным в примере 1. Полученные гидрофильные ВЭЖХ-фракции анализируют MALDI TOF масс-спектрометрией в аналогичных условиях, как и при анализе ВЭЖХ-фракции со временем удерживания 57,3 минуты. При анализе гидрофильных фракций фиксируют масс-спектрометрические сигналы, соответствующие молекулярным массам от 1000 до 8000 Да..
Пример 3. Получение растворов различной концентрации высокоочищенного БПК, выделенного из яичников коров. В качестве раствора БПК используют ВЭЖХ-фракцию со временем удерживания 57,3 минуты, выделенную из ткани яичников коров (описана в Примере 2) с концентрацией по белку 100±10 мкг/мл. Из данного раствора отбирают 100 мкл и вносят в 900 мкл дистиллированной воды, встряхивают полученный раствор 15 раз. Из полученного раствора опять отбирают 100 мкл и вносят в 900 мкл дистиллированной воды в другой флакон, интенсивно встряхивая образовавшийся раствор 15 раз. Данную процедуру повторяют еще 4 раза. В конечный раствор добавляют хлорид кальция до его конечной концентрации 1 мМ и в этом случае получают раствор БПК с концентрацией общего белка, соответствующей 10-6 мг/мл.
Отбирают отдельную аликвоту полученного раствора БПК с концентрацией общего белка 10-6 мг/мл и повторяют аналогичную процедуру разбавления и встряхивания еще 6 раз до получения раствора БПК с концентрацией общего белка, соответствующей 10-12 мг/мл. В конечный раствор добавляют хлорид кальция до его конечной концентрации 1 мМ.
Пример 4. Влияние БПК, выделенного из яичников коров, на выживаемость фолликулов при роллерном органотипическом культивировании яичников крысы. Для проведения эксперимента по изучению специфической активности БПК разрабатывают модель роллерного органотипического культивирования яичников крысы. Изучают растворы БПК, соответствующие различным концентрациям белка в растворе: от 10-8 до 10-15 мг белка/мл (процедура приготовления описана в Примере 3).
Декапитируют 15 крыс линии Wistar под эфирным наркозом, яичники вырезают, очищают от прилегающих тканей. Пять яичников фиксируют в растворе Буэна сразу же после вырезания для изучения гистологии нативной ткани. Для культивирования используют питательную среду 199, которая содержит 10% эмбриональной телячьей сыворотки («HyClone», США) и 1% антибиотика/антимикотика («Sigma», Германия), которую стерилизуют, пропуская через мембранные фильтры GV с диаметром пор 0,22 мкм («Millipore», США). В каждый флакон опытной группы (всего 5 флаконов) добавляют культуральную среду и раствор БПК в различных концентрациях (приготовленные, как описано в Примере 3) и помещают в каждый флакон по одному яичнику. В первый флакон опытной группы к 6 мл культуральной среды добавляют 60 мкл раствора БПК в концентрации, соответствующей 10-6 мг/мл белка до конечной концентрации БПК 10-8 мг/мл в растворе. Во второй флакон опытной группы к 6 мл культуральной среды добавляют 6 мкл раствора БПК в концентрации, соответствующей 10-6 мг/мл белка до конечной концентрации БПК 10-9 мг/мл в растворе. В третий флакон опытной группы к 6 мл культуральной среды добавляют 0,6 мкл раствора БПК в концентрации, соответствующей 10-6 мг/мл белка до конечной концентрации БПК 10-10 мг/мл в растворе. В четвертый флакон опытной группы к 5,4 мл культуральной среды добавляют 0,6 мл раствора БПК в концентрации, соответствующей 10-12 мг/мл белка до конечной концентрации БПК 10-13 мг/мл в растворе. В пятый флакон опытной группы к 6 мл культуральной среды добавляют 6 мкл раствора БПК в концентрации, соответствующей 10-12 мг/мл белка до конечной концентрации БПК 10-15 мг/мл в растворе. Во флаконы контрольной группы (5 флаконов) добавляют по 1 яичнику к 6 мл культуральной среды. Культивирование проводят при температуре 37°C в течение 5 суток. Используют роллер RM5 («Assistant», Германия) со скоростью вращения 35 об/мин. Затем яичники фиксируют в растворе Буэна, готовят стандартные гистологические срезы. Окраска парафиновых срезов (толщина 7 мкм) гистологических образцов гематоксилин-эозином. Изучение полученных гистологических препаратов, подсчет числа фолликулов на срезах и фотофиксацию изображений проводят с помощью микроскопа Olympus (VANOX, АНВТ3) и цифровой камеры Olympus (U-PMTVC, Япония).
Для оценки биологического действия раствора БПК применяют метод прямого подсчета живых и нежизнеспособных фолликулов и общего числа фолликулов на парафиновых срезах ткани яичников животных опытной и контрольной группах, а также нативной ткани яичников. Живые фолликулы визуально можно определить по выраженному ядру ооцита, находящегося внутри фолликула и структурированному слою гранулезных клеток. Нежизнеспособные фолликулы характеризуются отсутствием ядра ооцита либо наличием его фрагментов, а также нечеткой формой из-за отделения гранулезных клеток от блестящей оболочки ооцита.
Первичные фолликулы визуально характеризуются небольшим по размеру ядром ооцита, 1 слоем гранулезных клеток и отсутствием полости. Вторичные фолликулы выделяются более крупным размером ядра ооцита, наличием полости и несколькими слоями гранулезных клеток. Третичные фолликулы (граафовы пузырьки) хорошо идентифицируются визуально благодаря крупному размеру ядра ооцита, большому размеру полости и наличию в полости фолликула яйценосного бугорка, в котором находится ооцит.
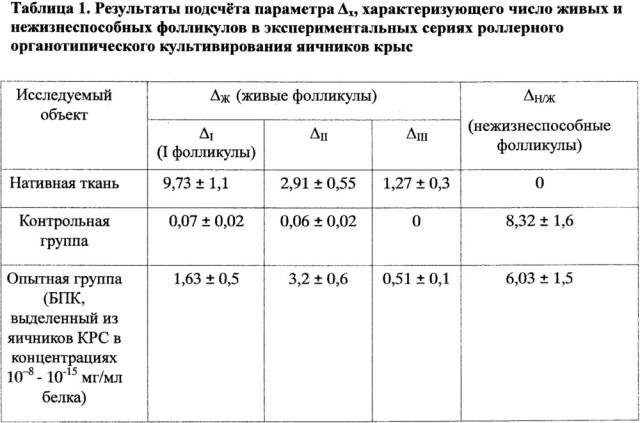
Результаты подсчета фолликулов приведены в таблице 1. Для удобства сравнения данные для фолликулов, определенных в яичниках крыс всех экспериментальных серий, приводятся в виде параметра Δ, который рассчитывается по формуле:
Δх=Nx/100, где Nx - число фолликулов, подсчитанное на ста гистологических срезах: NI - число первичных фолликулов; NII - число вторичных фолликулов; NIII - число третичных фолликулов (граафовы пузырьки); ΔН/Ж - число нежизнеспособных фолликулов.
Графические данные подсчета фолликулов приведены на фигурах 1 и 2. Результаты эксперимента обрабатывают методами вариационной статистики по t-критерию Стьюдента. Полученные результаты (число живых и нежизнеспособных фолликулов в нативной ткани, а также в контрольной и опытной группах) являются статистически достоверными (р<0,05).
Важно подчеркнуть, что в нашем случае роллерное органотипическое культивирование яичников крысы проводится in vitro, что исключает возможность активации и воздействия эндокринной системы, в частности, гипоталамо-гипофизарных факторов, на процесс поддержания жизнеспособности и развития фолликулов на разных стадиях их созревания. Предполагается, что существенное улучшение выживаемости фолликулов в яичниках опытной группы по сравнению с контрольной группой (количественно представлено на Фиг. 1, А), может происходить за счет активации стволовых зародышевых клеток, которая происходит при добавлении в культуральную среду БПК, выделенного из ткани яичников коров. Необходимо также отметить, что при роллерном типе культивирования тканей происходит дополнительное активирование клеточных источников регенерации тканей взрослых особей.
В результате проведенного авторами роллерного органотипического культивирования яичников крысы наиболее ярко выражено воздействие БПК, выделенного из ткани яичников коров, на количество жизнеспособных вторичных фолликулов (Фиг. 2, Б). Ранее уже было показано, что в культуре ткани яичников in vitro примордиальные фолликулы способны развиваться до стадии первичных и вторичных фолликулов, но этот процесс протекал недостаточно эффективно (V.R. М.О. Gastal, J.R. Figueiredo, E.L. Gastal. In vitro culture of bovine preantral follicles: a review. Reprod Biol Endocrinol. 2014, 12:78). Наблюдают большое число созревших и жизнеспособных вторичных фолликулов в опытной группе при добавлении заявляемого БПК. Именно вторичные фолликулы становятся вовлеченными в процесс овуляции и дают созревшие яйцеклетки через один менструальный цикл, в то время как слишком большое число первичных фолликулов потенциально приводит к их ускоренной повышенной атрезии на следующей стадии созревания, а третичных фолликулов - к гиперовуляции (R. Cortvrindt, J. Smitz. In vitro follicle growth: achievements in mammalian species. Reprod Domest Anim, 2001, 36: 3-9). Данный факт указывает на то, что выделенный БПК не только повышает жизнеспособность фолликулов, но положительно влияет и на процесс их созревания, что чрезвычайно важно для нормального развития у млекопитающих процессов оогенеза, фолликулогенеза, овуляции и, как следствие, возможности правильного зачатия, формирования и развития эмбриона.
Пример 5. Получение растворов различных концентраций белково-пептидного комплекса, выделенного из яичников коров, для исследования его безопасности. В качестве раствора белково-пептидного комплекса используют ВЭЖХ-фракцию со временем удерживания 57,3 минуты, выделенную из ткани яичников коров (описана в Примере 2) с концентрацией по белку 100±10 мкг/мл. Во флакон, содержащий 0,1 мл водного раствора БПК, добавляют 0,9 мл 0,9%-ного раствора NaCl и интенсивно встряхивают 25 раз. Отбирают 0,1 мл образовавшегося раствора в следующий флакон и добавляют 0,9 мл 0,9%-ного раствора NaCl, встряхивают 25 раз. Данную процедуру повторяют 15 раз, получая таким образом растворы белково-пептидного комплекса с 10-кратным последовательным разбавлением от 1 до 15 степени. В экспериментах по изучению безопасности раствора БПК, выделенного из яичников коров, были исследованы его разведения в концентрациях, соответствующих значениям 10-3; 10-5 - 10-15 мг/мл. Растворы стерилизуют путем пропускания через стерильные мембранные фильтры GV с диаметром пор 0,22 мкм («Millipore», США).
Исследования безопасности БПК, выделенного из яичников КРС, проводят на кроликах породы «Шиншилла», морских свинках, крысах Wistar и белых беспородных мышах. Животные получены из питомника «Крюково», согласно паспорту молодые, половозрелые. Их содержат в стандартных металлических клетках по 5 особей (кролики содержатся индивидуально). Для кормления используют гранулированный комбинированный корм и свежие овощи. Доступ к воде и корму свободный. Освещение вивария искусственное, температура воздуха 18-22°C. До начала испытаний все животные проходят двухнедельный карантин. В целях стандартизации, перед началом опыта, животных не кормят в течение суток. Результаты эксперимента обрабатывают методами вариационной статистики по t-критерию Стьюдента.
Пример 6. Оценка способности заявляемого БПК вызывать активную кожную анафилаксию у морских свинок in vivo. Исследование проводят на морских свинках в количестве по 10 голов в каждой исследуемой группе, всего 2 группы. Сенсибилизируют животных по схеме: первая инъекция подкожно, две последующие внутримышечно через день в область бедра. На 14 день на выстриженных участках спины морским свинкам вводят внутрикожно раствор БПК в концентрации 10-9 мг/мл (приготовление описано в примере 5). Для контроля реактивности кожи вводят физиологический раствор тому же животному на другой выстриженный участок кожи. Контрольным животным вводят разрешающую инъекцию препарата (равную сенсибилизирующей дозе). Затем животным вводят внутривенно по 0,5 мл 1% раствора синего Эванса. Через 30 минут животных выводят из эксперимента эфирным наркозом и определяют размер синего пятна на внутренней стороне кожи в месте введения. Положительной считают реакцию при размере пятна выше 6 мм, не более 3 мм в контроле. При подсчете результатов эксперимента у обеих групп животных положительных реакций не наблюдалось. При статистической обработке полученных результатов не обнаружена достоверная разница между результатами опытных и контрольной групп (р>0,05).
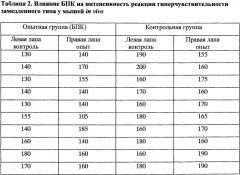
Пример 7. Влияние заявляемого БПК на реакцию гиперчувствительности замедленного типа у мышей. Опыты проводят на белых беспородных мышах, самцы, весом 18-20 г, по 10 животных в группе. Общее количество животных в опыте - 30. Животных опытной группы однократно сенсибилизируют внутрикожно в основании хвоста эмульсией БПК (1:1) в неполном адъюванте Фрейнда (НАФ). Доза введения составляет 60 мкл. Контрольных животных сенсибилизируют эмульсией НАФ с раствором Хенкса (1:1). Для выявления сенсибилизации через 5 суток мышам в подушечку задней лапы вводят 40 мкл раствора БПК в концентрации 10-9 мг/мл (приготовление описано в примере 5), приготовленного на растворе Хенкса. Через 24 часа после тестирования измеряют величину отека с помощью инженерного микрометра МК-0-25. Результаты измерения толщины лапы у испытуемых животных приведены в таблице 2.
При статистической обработке полученных результатов не обнаружена достоверная разница в толщине лапок опытных групп и контрольной (р>0,05). Введение раствора БПК не вызывает реакции гиперчувствительности замедленного типа.
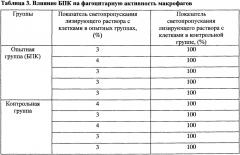
Пример 8. Влияние заявляемого БПК на фагоцитарную активность макрофагов крысы in vitro. Эксперименты проводят на крысах Wistar, самки, весом 180-200 г, по 10 животных в каждой группе. Общее число животных в опыте 20. Метод основан на определении оптической плотности лизирующего раствора после разрушения фагоцитов, поглотивших частицы нейтрального красного. Крыс, подвергнутых воздействию исследуемого препарата, декапитируют. Асептически внутрибрюшинно вводят 5 мл среды 199, содержащей 20% эмбриональной телячьей сыворотки. После массажа брюшной полости среду отбирают шприцем. Порции клеточной суспензии, полученные от всей группы животных, объединяют в общий пул. Концентрацию живых клеток доводят до 1,5×103 клеток/мл. Суспензию клеток стерильно разливают по 2 мл в пластиковые чашки Петри диаметром 40 мм и инкубируют 2 часа при 37°C. Надосадочную фракцию, содержащую не адгезировавшие к пластику клетки, сливают, а фиксированный на пластике монослой дважды промывают средой 199. В слегка подсушенные чашки наливают раствор, содержащий нейтральный красный, и выдерживают при 37°C в течение 1 часа, затем раствор сливают, клетки промывают средой 199. В каждую чашку вносят по 3 мл лизирующего раствора, которым обрабатывают тщательно клетки, совершая вращательное движение чашки. Раствор сливают в пробирки и на спектрофотометре при длине волны 540 нм измеряют оптическую плотность. Результаты исследования светопропускания лизирующего раствора представлены в таблице 3.
При внутрибрюшинном введении БПК в концентрации 10-9 мг/мл (приготовление описано в примере 5) не было отмечено изменения фагоцитарной активности макрофагов по сравнению с животными контрольной группы. Статистически достоверных различий между показателями в опытной и контрольной группах нет (p>0,05).
Пример 9. Влияние заявляемого БПК на реакцию дегрануляции тучных клеток у крыс in vitro. Эксперименты проводят на крысах Wistar, самки, весом 180-200 г, общее количество животных в опыте - 30. Вводят раствор БПК внутрибрюшинно, контролем служит интактная группа.
Для получения взвеси тучных клеток животных декапитируют, в брюшную полость вводят буфер; после массажа передней брюшной стенки взвесь тучных клеток собирают центрифугированием в пробирки (3000 g, 30 мин). Препараты готовят на предметных стеклах, окрашенных 0,3%-ным спиртовым раствором нейтрального красного. К 0,03 мл взвеси тучных клеток добавляют 0,03 мл сыворотки опытного животного и 0,03 мл исследуемого раствора БПК (концентрация составляет 10-9 мг/мл, приготовление описано в примере 5) в разведении 1:100. Препараты накрывают покровным стеклом, края которого герметизируют парафином. Затем инкубируют 15 минут в термостате при 37°C. Препараты исследуют микроскопически при увеличении ×40, подсчитывая тучные клетки, подвергшиеся дегрануляции и нормальные, сумму принимают за 100%. Реакцию считают положительной, если степень дегрануляции превышает 20%.
В контроле дегрануляция не превышала 5%. Введение раствора БПК не вызывает дегрануляции тучных клеток: значения параметра дегрануляции не отличаются от контроля и не превышают порогового значения 5%. Результаты контрольной и опытной групп статистически не имеют достоверных отличий (р>0,05).
Пример 10. Исследование влияния БПК, выделенного из яичников коров, на состояние тканей внутренних органов организма млекопитающих. Исследование по изучению острой токсичности раствора БПК, выделенного из яичников коров, проводят на 70 белых беспородных мышах, самцы, весом 18-20 г. Животные были разделены на 6 групп, по 15 в каждой. Исследуемый препарат вводят животным опытной группы однократно внутримышечно в объеме 0,05 мл в виде стерильных растворов следующих концентраций: 10-3 мг/мл, 10-5 мг/мл, 10-7 мг/мл, 10-9 мг/мл, 10-11 мг/мл, 10-13 мг/мл, 10-15 мг/мл белка, приготовленных на 0,9%-ном растворе NaCl. Животным контрольной группы (10 мышей) в том же объеме аналогичным образом вводят 0,9% раствор NaCl.
При изучении острой токсичности было показано, что однократное внутримышечное введение раствора БПК крысам Wistar, обоего пола, весом 200-220 г., в концентрации 10-5 мг/мл, которая превышает рекомендованную для клинического применения (10-9 мг/мл) в 10000 раз, не вызывает развития никаких реакций, указывающих на токсическое действие заявляемого БПК. Исследование подострой и хронической токсичности раствора БПК в концентрациях 10-9 и 10-5 мг/мл белка также не выявляет развития негативных побочных реакций со стороны отдельных тканей и организма в целом у экспериментальных животных в течение длительного введения раствора БРК.
Патоморфологическими методами изучают состояние головного (гипофиза, гипоталамуса), спинного мозга (спинных ганглиев), костного мозга. Изучают состояние таких желез, как надпочечники, паращитовидные, щитовидная и поджелудочная железы. Кроме того, исследуют сердце, коронарные сосуды, легкие, печень и желчны