Способ применения коронарной техники при проведении трансъюгулярного внутрипеченочного портосистемного шунтирования (типс)
Иллюстрации
Показать всеИзобретение относится к хирургии и может быть применимо для трансъюгулярного внутрипеченочного портосистемного шунтирования при циррозах печени. Коронарный проводник 0,014ʺ проводят параллельно жесткому проводнику 0,035ʺ из печеночной вены в дистальное русло верхней брыжеечной вены, после чего по коронарному проводнику 0,014ʺ выполняют бужирование и предилатацию канала печени между печеночной веной и портальной венозной системой коронарным баллонным катетером 2.5×20 мм. Способ позволяет упростить технику, увеличить безопасность вмешательства. 7 ил.
Реферат
Цирроз печени (ЦП) - это хроническое полиэтиологическое прогрессирующее заболевание печени, являющееся последней стадией развития, как правило, неблагоприятно протекающих форм хронического гепатита, проявляющееся поражением паренхиматозной и интерстициальной ткани органа со значительным уменьшением числа функционирующих клеток печени ввиду некроза и дистрофии печеночных клеток, узловой регенерации и диффузного разрастания соединительной ткани [1, 2]. Чаще всего этиологическими причинами ЦП являются хроническая интоксикация алкоголем (от 40-50% до 70-80%) и вирусные гепатиты В, С и D (30-40%) [2, 3, 4]. ЦП входит в десятку самых частых причин смерти, унося ежегодно до миллиона человек в мире.
По данным Росстата общая смертность от ЦП на территории Российской Федерации в 2013 году зарегистрирована на уровне 47 тысяч человек [5]. ЦП и всегда сопровождающая его портальная гипертензия (ПГ) способны вызвать ряд жизнеугрожающих осложнений: пищеводно-желудочные кровотечения из варикозно расширенных вен, гепаторенальный синдром, печеночная кома в исходе энцефалопатии.
Учитывая высокую актуальность проблемы профилактики и лечения ЦП и его осложнений, поиск оптимальных методов оперативного лечения ЦП остается одним из актуальных вопросов в современной хирургической практике. В последнее время в решении этого вопроса все большую роль приобретают малоинвазивные хирургические вмешательства, в том числе эндоваскулярные. К таковым относится прежде всего трансъюгулярное внутрипеченочное портосистемное шунтирование (Transjugular Intrahepatic Portosystemic Shunt - TIPS/ТИПС).
Впервые операция ТИПС была предложена в 1980-х гг. и сразу получила широкое клиническое применение. Целью данной методики оперативного лечения ПГ является достижение эффективной портальной гипертензии. На сегодняшний день количество выполненных операций ТИПС превышает 200 тысяч [6, 7, 8, 9].
Аналогом предлагаемого изобретения является операция трансъюгулярного внутрипеченочного портосистемного шунтирования. Процедура ТИПС подразумевает собой создание сообщения между печеночной веной и портальной венозной системой с целью обеспечения оттока крови от печеночных синусов и уменьшение портальной гипертензии. Обезболивание обеспечивается проведением эндотрахеального наркоза. Первым этапом операции является пункция и катетеризация внутренней яремной вены с целью установки в ней интродьюсера 12,5 F. Далее по проводнику 0.035/ основной изогнутый катетер проводится через верхнюю полую вену, синус правого предсердия и нижнюю полую вену в печеночную вену. Для выполнения синхронной возвратной портографии и флебографии правой печеночной вены мы катетеризируем верхнюю брыжеечную артерию чрезплечевым (трансбрахиальным) способом при помощи интродьюсера 5 F и катетера «Headhunter-1».
Выяснив местоположение бифуркации воротной вены, через проведенный катетер в печеночную вену вводится специальная игла, с помощью которой пунктируется печень. Далее через пункционную иглу в соответствующую пропунктированную ветвь воротной вены вводится гидрофильный проводник 0.035/. Таким образом образуется доступ из печеночной вены в ветвь воротной вены. С помощью специального катетера 5 F гидрофильный проводник меняется на сверхжесткий проводник 0.035/. Пункционный паренхиматозный канал печени последовательно расширяется периферическими баллонными катетерами различного диаметра, чаще всего это 5-8 мм (Фиг. 1). Затем в сформированный канал печени имплантируется различного типа стент. После удаления системы доставки стента выполняется постдилатация стента баллонным катетером соответствующего диаметра. Таким образом формируется сообщение между портальным и системным кровотоком, обеспечивая декомпрессию воротной вены. С целью профилактики развития повторных пищеводно-желудочных кровотечений, при наличии показаний, в некоторых случаях выполняется эмболизация левой желудочной и коротких вен желудка спиралями «Gianturko».
Однако, для способа-аналога при выраженном цирротическом поражении печени возникают сложности с невозможностью провести периферический баллонный катетер в пункционный канал печени с целью его предилатации.
С каждым годом в связи с развитием медицины и увеличением общего объема выполненных оперативных вмешательств совершенствуются и создаются новые методики выполнения операции ТИПС.
Целью данного изобретения является упрощение техники баллонной дилатации пункционного канала печени с применением коронарной методики, что приводит к уменьшению технических сложностей ее выполнения и обеспечению безопасности хирургического вмешательства, а иногда и единственной возможностью создать оптимальный канал печени, и, следовательно, в последующем сформировать портокавальный шунт.
Сущность предлагаемого нами способа заключается в следующем: коронарный проводник 0,014'' проводится параллельно 0,035'' проводнику от печеночной вены в дистальное русло верхней брыжеечной вены. После чего выполняется бужирование и дилатация узкого «канала печени» коронарным баллонным катетером (Фиг. 2). Затем по жесткому проводнику 0,035'' в уже предилатированный «канал печени» проводятся периферические баллонные катетеры различного диаметра и выполняется его дальнейшая дилатация до оптимальных размеров.
Способ осуществляют следующим образом:
В асептических условиях, под эндотрахеальным наркозом, выполняется пункция и катетеризация внутренней яремной вены с целью установки в ней интродьюсера 12,5 F. Далее по проводнику 0.035/ основной изогнутый катетер проводится через верхнюю полую вену, синус правого предсердия и нижнюю полую вену в одну из наиболее подходящих печеночных вен. Параллельно выполняется пункция правой плечевой артерии с целью установки интродьюсера. Устанавливается интродьюсер 5 F с гемостатическим клапаном. В целях профилактики ангиоспазма плечевой артерии внутриартериально через интродьюсер вводится раствор Нитроглицерина 100 мкг и 20 мл физ. раствора в соответствии с существующими стандартами. Через установленный интродьюсер на 0.035/ проводнике проводят катетер «Headhunter-1» - 5 F до устья верхней брыжеечной артерии. С целью определения анатомии сосудов печени выполняется синхронная возвратная портография и флебография правой печеночной вены.
Тракцией стилетом-катетером пунктируется воротная вена. Через пункционную иглу в соответствующую пропунктированную ветвь воротной вены вводится гидрофильный проводник 0.035/. Далее коронарный проводник 0,014'' проводится параллельно 0,035'' проводнику от печеночной вены в дистальное русло верхней брыжеечной вены. После чего выполняется блокирование и дилатация узкого «канала печени» коронарным баллонным катетером. С помощью специального катетера 5 F гидрофильный проводник меняется на сверхжесткий проводник 0.035'. Затем пункционный паренхиматозный канал печени последовательно расширяется периферическими баллонными катетерами различного диаметра с последующей имплантацией в него самораскрывающегося нитинолового стента. После удаления системы доставки стента выполняется его постдилатация баллонным катетером соответствующего диаметра.
Оперативное вмешательство заканчивается поочередным удалением катетеров, интродьюсеров. Производится мануальный гемостаз мест пункции пальцевым прижатием, после чего накладывается асептическая давящая повязка на 24 часа.
Преимущества данного способа:
Применение коронарной техники при операциях ТИПС, когда возникают сложности в проведении инструментов через сформированный «канал печени» из-за выраженного цирротического поражения печени, является практически единственным решением для успешного результата данной операции.
Способ апробирован в ГБУЗ «ККБ №2» г. Краснодара. В период с января 2014 г. по 2016 г с применением коронарной техники при операциях ТИПС проведено лечение у двух из четырнадцати пациентов с цирротическим поражением печени различного генеза. Осложнений в этой группе больных не было. Послеоперационный период после эндоваскулярной окклюзии у всех больных в среднем составил 7 суток.
Клинический пример
Пациентка К., 65 лет. Ds: Цирроз печени смешанного генеза (токсический + вирусный С), класс В по Чайлд-Пью (9 баллов), осложненный синдромом портальной гипертензии (спленомегалия, варикозное расширение вен пищевода I-II степени, миниальный гидроперитонеум), печеночно-клеточной недостаточностью (коагулопатия, гиперхолестеринестераземия), гиперспленизмом (панцитопения), печеночной энцефалопатией легкой степени. Поступила в сентябре 2016 года в плановом порядке для выполнения оперативного вмешательства ТИПС. На момент поступления пациентка предъявляла жалобы на общую слабость, отсутствие аппетита, нарушение памяти. Анамнестически пациентка считает себя больной с 2005 года, когда был установлен диагноз хронического вирусного гепатита С. Ухудшение состояния наступило в 2010 году, когда стала отмечать увеличение живота, тошноту, общую слабость. По поводу чего обследовалась и был установлен диагноз цирроза печени вирусной этиологии. Проходила консервативное лечение у гастроэнтеролога, инфекциониста. В 2015 году при выполнении ФГДС выявлено варикозное расширение вен пищевода 2 ст. За период с 2015 г. по 2016 г. отмечены три эпизода пищеводных кровотечений, два из них потребовали эндоскопического лигирования.
При поступлении по данным УЗИ органов брюшной полости определяются УЗ-признаки цирротической трансформации печени, портальной гипертензии (спленомегалия, гидроперитонеум, диффузные изменения поджелудочной железы). По данным лабораторных методов исследования: лейкоцитопения, нормохромная анемия легкой степени тяжести, выраженная тромбоцитопения, гиперхолестеринестераземия, панцитопения, остальные показатели в пределах нормальных значений.
В сентябре 2016 года пациентке в плановом порядке выполнена операция ТИПС. Интраоперационно пациентке внутривенно введено 5000 ЕД гепарина. Под комбинированной анестезией выполнена пункция правой плечевой артерии, установлен интродьюсер 5F Prelude (MeritMedical). Далее катетером HH1-5F селективно катетеризирована верхняя брыжеечная артерия. Затем проведена пункция правой внутренней яремной вены, установлен проводниковый интродьюсер 10F (Optimed), который заведен в правую печеночную вену. Выполнена синхронная возвратная портография и флебография правой печеночной вены для определения анатомии сосудов печени (Фиг. 3).
Тракцией стилетом-катетером пунктирована воротная вена. По гидрофильному проводнику 0,035'' Aquatrack (Cordis) выполнено блокирование «канала печени» гидрофильным катетером Bern-4F (MeritMedical), который проведен в желудочную вену. Выполнена флебография желудочной вены, по данным которой определяется варикозное расширение вен желудка и пищевода на всем протяжении, наличие антеградного кровотока в них (источник пищеводных кровотечений) Фиг. 4. Выполнена эмболизация в проксимальной трети желудочной вены спиралями «MReye» 15×15 мм, 8×5 мм (COOK) Фиг. 5
Далее катетер Bern-4F по гидрофильному проводнику 0,035'' проведен в верхнюю брыжеечную вену. Произведена смена проводника на жесткий проводник 0,035'' Amplatz Super Stiff. Многочисленные попытки провести по жесткому проводнику 0,035'' баллонные катетеры Armada 5.0×60 мм (Abbott), Empira 4.0×40 мм (Cordis) по «каналу печени» не увенчались успехом, в связи с этим принято решение использовать коронарную технику. Коронарный проводник 0,014'' «Pilot 150» - 300 мм (Abbott) проведен параллельно 0,035'' проводнику от печеночной вены в дистальное русло верхней брыжеечной вены. После чего выполнено бужирование и дилатация узкого «канала печени» баллонным катетером Trek 2.5×20 мм (Abbott) Фиг. 6, что позволило провести по жесткому проводнику 0,035'' баллонные катетеры диаметром 5.0×80 мм, 6.0×80 мм, 7.0×20 мм в «канал печени» и его дилатировать до оптимальных размеров. Далее по жесткому проводнику 0,035'' Amplatz Extra Support заведен катетер Pigtail-5F в воротную вену. Выполнена флебография воротной вены для определения длины стента. После этого был имплантирован самораскрывающийся нитиноловый стент «Egis» 10×60 мм (S&G Biotech Inc.) с последующей его постдилатацией баллонным катетером Armada 10×40 мм (Abbott). На контрольной флебографии: порто-кавальный анастомоз (ТИПС) функционирует, сброс контрастного препарата в правое предсердие адекватен, признаков дислокации стента и спиралей нет, окклюзия эмболизированной желудочной вены Фиг. 7.
В послеоперационном периоде чувствовала себя удовлетворительно, ухудшения состояния не наблюдалось, выписана на седьмые сутки в удовлетворительном состоянии под наблюдение гастроэнтеролога по месту жительства.
Медико-социальная эффективность:
Данный способ лечения у пациентов с портальной гипертензией является высокоэффективным и малотравматичным, позволяет выполнить эффективную декомпрессию портальной системы, профилактику развития рецидивирующих кровотечений из варикозно расширенных вен пищевода и желудка, асцитический синдром, и значительно улучшает качество жизни пациентов. Использование коронарной методики «упрощает» технику бужирования «канала печени», уменьшает длительность оперативного вмешательства и частоту интраоперационных осложнений, а иногда и является единственным способом создания оптимального канала печени. Применение коронарной техники при операциях ТИПС, когда возникают сложности в проведении инструментов через сформированный «канал печени» из-за выраженного цирротического поражения печени, является практически единственным решением для успешного результата данной операции. ТИПС является альтернативой хирургическим методам лечения портальной гипертензии и имеет ряд преимуществ перед достаточно травматичными хирургическими шунтирующими операциями: наложение портокавальных ангио- и органоанастомозов.
Краткое описание чертежей:
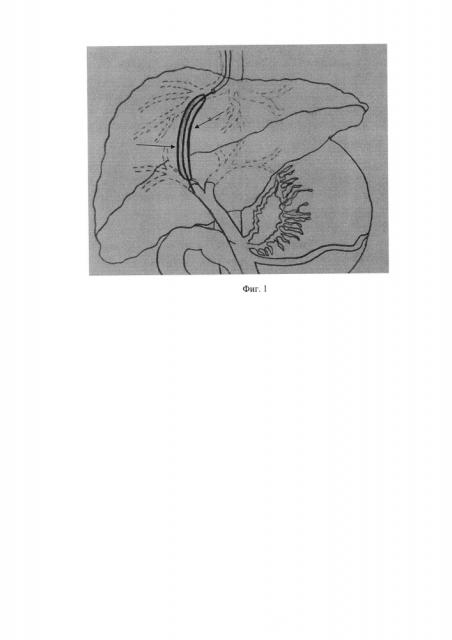
Фиг. 1
Пункционный паренхиматозный канал печени дилатируется периферическим баллонным катетером (указан стрелками)
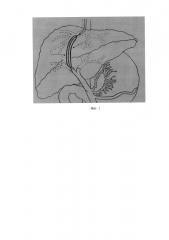
Фиг. 2
Пункционный паренхиматозный канал печени дилатируется коронарным баллонным катетером (указан черными стрелками), проведенный параллельно 0,035'' проводнику
Фиг. 3
Синхронная возвратная портография и флебография правой печеночной вены - белыми стрелками указана печеночная вена, черными - воротная вена
Фиг. 4
Белыми стрелками указан гидрофильный катетер Bern-4F, черными - варикозно расширенная вена желудка
Фиг. 5
Результат эмболизации: стрелками указана полная редукция кровотока в желудочной вене
Фиг. 6
Стрелками указана дилатация «канала печени» баллонным катетером Trek 2.5×20 мм
Фиг. 7
Контрольная флебография: белыми стрелками указан порто-кавальный анастомоз (ТИПС), черными - эмболизированная желудочная вена.
Список используемой литературы
1. Алексеева О.П., Курышева М.А., «Цирроз печени и его осложнения». Нижний Новгород, НГМА, 2004 г., 96 с.
2. Шиповский В.Н., «Техника операции ТИПС», Практическое руководство, М. Издатель И.В. Балабанов, 2010 г.
3. Садовникова И.И., «Циррозы печени. Вопросы этиологии, патогенеза, клиники, диагностики, лечения». РМЖ, 2003 г. - Т. 5 - №2.
4. Ивашкин В.Т., «Болезни печени и желчевыводящих путей: руководство для врачей». 2-е изд. - М.: ООО Издательский дом «М-вести» - 2005 г. - С. 536.
5. Хазанов А.И., «Итоги длительного изучения (1946-2005 гг.) циррозов печени у стационарных больных». Рос. журн. гастроэнтерол., гепатол., коло-проктол. - 2006 г. - Т. 16, №2 - С. 11-18.
6. Сборник «Демографический ежегодник России». Росстат. - 2013 г.
7. Затевахин И.И., Шиповский В.Н., Шагинян А.К., Монахов Д.В., «Опыт применения трансъюгулярного внутрипеченочного портокавального шунтирования (TIPS) у больных с синдромом портальной гипертензии». Анналы хирургической гепатологии. - 2005 г. - Т. 10, №2 - С. 78.
8. Котив Б.Н., Дзидзава И.И., Алентьев С.А., «Портокавальное шунтирование в лечении больных циррозом печени с синдромом портальной гипертензии». Анналы хирургической гепатологии. - 2008 г. - Т. 13, №4 - С. 76-78.
9. Мухамедьянов И.Ф., Нартайлаков М.А., Шаймуратов И.Х., Нуриахметов P.P., «Трансъюгулярное внутрипеченочное портосистемное шунтирование как новый метод в лечении портальной гипертензии». Материалы научно-практической конференции «Высокие технологии в медицине». СТМ 2010 г. - 1 (2). - С. 79-83.
10. Бабенков Г.Д., Усов С.Н., Глазунов В.К. и др. Результаты лечения больных циррозом печени, осложненного кровотечением. Анналы хирургической гепатологии. 2000. - Т. 5. - №2.
11. Борисов А.Е., Рыжков В.К., Карев А.Е., Кащенко В.А., Васюкова Е.Л. Эндоваскулярное внутрипеченочное портокавальное шунтирование. Хирургия. 2002. - №4.
12. Борисов А.Е, Кащенко В.А., Ибронов Ш.М. Отдаленные результаты эндоваскулярных вмешательств у больных циррозом печени. Анналы хирургической гепатологии. 2000 г.
13. Хоронько Ю,В. Черкасов М.Ф., Поляк М.И., Косовцев Е.В., Хоронько Е.Ю., Дмитриев А.В. Трансъюгулярное внутрипеченочное портосистемное шунтирование: роль и место в комплексе мероприятий при лечении пищеводно-желудочных кровотечений цирротического генеза. Вестник хирургической гастроэнтерологии. 2011 г. №3.
14. Kerlan R.K., LaBerge J.M., Gordon R.L., Ring E.J., «Transjugular intrahepatic portosystemic shunts: current status». Am J Roentgenol. - 1995; 164: 1059-1066.
15. Ferguson J.W., Hayes P.C. «Transjugular intrahepatic portosystemic shunt in the prevention of rebleeding in oesophageal varices». Eur J Gastroenterol Hepatol. - 2012 - Vol. 18, №11.
16. Astrup L.В., Solvig J., Cwikiel W., Transjugulaer intrahepatisk portosistemisk shunt-behandling of portal hypetension. Ugeskr. Laeger. 1998.
17. Baiar J.S., Seaien K., MELT skore does not discriminate against patients with hepatic encephalopathy. Dig Dis Sci 2005.
18. Bataller R., Gines P., Guevara M., Arroyo V., Hepatorenal syndrome. Semin Liver Dis/ 1997.
19. Bosch J., Garcia-Pagan J.C. Complications of cirrhosis. I. Portal hypertension. J. Hepatol 2000.
20. Ochs A. Trasjugular intrahepatic portosistemic shunt//Digestive Diseases. 2005. №1.
21. Owen A.R., Stanley A.J., Vijayananthan A., Moss J.G. The trasjugular intrahepatic portosistemic shunt (TIPS)// Clin Radiol. 2009.
22. Cherkasov V.A., Prokubovskii V.I., Shertsinger A.G., Bour A.V. Endovaskuliarnaia embolizatsiia ven zheludka pri portalnoi gipertenzii, oslozhnennoi ezofagogastralnymi krovotecheniiami. Khirurgiia. 1998.
23. De Franchis R. Evolving consensus in portal hypetension. Report of the Baveno IV consensus workshop on methodology of diagnosis and therapy in portal hypetension. J. Hepatol. 2010
24. Feral H., Gamboa P., Postoak D.V., et al. Transjugulaer intrahepatic portosistemic shunt creation: prediction with model for end-stage liver disease score. Radiology 2004.
25. Friedman L.S. The risk of surgery in patients with liver disease. Hepatology 1999.
26. Henderson J.M., Boyer T.D., Kutner M.H. Distal splenorenal shunt versus transjugulaer intrahepatic portal sistematic shunt for variceal bleeding: a randomized trail. Gastroenterology. 2006.
Способ трансъюгулярного внутрипеченочного портосистемного шунтирования при циррозах печени, заключающийся в последовательном расширении пункционного паренхиматозного канала печени периферическими баллонными катетерами различного диаметра, отличающийся тем, что коронарный проводник 0,014ʺ проводят параллельно жесткому проводнику 0,035ʺ из печеночной вены в дистальное русло верхней брыжеечной вены, после чего по коронарному проводнику 0,014ʺ выполняют бужирование и предилатацию канала печени между печеночной веной и портальной венозной системой коронарным баллонным катетером 2.5×20 мм.