Фармацевтическая композиция для пассивной иммунизации против бешенства, фармацевтический набор, способ применения фармацевтического набора
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к иммунологии, и может быть использована для получения фармацевтического набора для пассивной иммунизации против бешенства. Фармацевтический набор, помещенный в приемлемую упаковку, включает: 1) фармацевтическую композицию, содержащую вируснейтрализующие антирабические однодоменные антитела в эффективном количестве и фармацевтически приемлемый буферный раствор до 1 мл, при этом вируснейтрализующие антирабические однодоменные антитела имеют аминокислотную последовательность SEQ ID NO.1; причем эффективной дозой вируснейтрализующих антирабических однодоменных антител является доза - не менее 150 ME активности, в лиофилизированном виде; 2) фармацевтическую композицию, содержащую рекомбинантные псевдоаденовирусные частицы, несущие ген вируснейтрализующих антирабических однодоменных антител в эффективном количестве, фармацевтически приемлемый буферный раствор до 1 мл; при этом рекомбинантные псевдоаденовирусные частицы, несущие ген вируснейтрализующих антирабических однодоменных антител, имеют нуклеотидную последовательность генетической вставки SEQ ID NO.3, и эффективная доза рекомбинантных псевдоаденовирусных частиц, несущих ген вируснейтрализующих антирабических однодоменных антител, составляет не менее 5×108 БОЕ в 1 мл фармацевтически приемлемого растворителя; 3) инструкцию для введения этого фармацевтического набора. Группа изобретений относится также к применению фармацевтического набора для пассивной иммунизации против бешенства. Использование данной группы изобретений позволяет проводить экстренную профилактику бешенства путем пассивной иммунизации с использованием полученных фармацевтических композиций, действие которых начинается с 6 часов введения в организм и продолжается до 7 дней. 2 н.п. ф-лы, 12 пр., 4 табл., 6 ил.
Реферат
Область техники
Настоящее изобретение относится к области вирусологии, иммунологии, биотехнологии и медицины. Предложенная фармацевтическая композиция для пассивной иммунизации против бешенства, нейтрализующая вирус бешенства, позволяет обеспечить эффективную экстренную постэкспозиционную профилактику бешенства у покусанных животными людей.
Предшествующий уровень техники
Бешенство - остропротекающее инфекционное заболевание животных и человека, вызываемое вирусом бешенства Rabies virus, относящегося к роду Lyssavirus семейства Rhabdoviridae. Бешенство встречается более чем в 150 странах и территориях и, по оценке ВОЗ, входит в пятерку инфекционных зоонозов, наносящих наибольший экономический ущерб. Ежегодно в мире от бешенства умирают 45-60 тысяч человек, в основном, в Азии и Африке.
Источником вируса бешенства являются больные животные (лисицы, волки, собаки, летучие мыши, кошки, крысы, домашний скот и другие теплокровные). В организм человека вирус бешенства может проникать при укусе больного животного, чаще всего бродячими или домашними собаками и кошками, и попадании слюны на кожу, пораженную микротравмами. В редких случаях возможно заражение при вдыхании аэрозолей, содержащих вирус или при трансплантации инфицированного органа [11].
В подавляющем большинстве случаев смерти людей от бешенства источником инфекции являются собаки (99%). Около 10 миллионов людей, получивших повреждения от животных, обращаются за антирабической помощью, при этом 40%, подвергшихся укусам бешеных животных, составляют дети в возрасте до 15 лет [11]. Например, в странах Азии и Африки постконтактная профилактика помогает предотвратить 330304 смертей [10].
В России, по данным Роспотребнадзора, ежегодно за антирабической помощью обращается около 400 тысяч человек (в среднем 300,0 на 100 тысяч населения), из них около 250 тысяч человек нуждаются в проведении специфического лечения. Доля детей до 17 лет, пострадавших от укусов животными, остается постоянной и составляет 28-30% ежегодно. В 2015 г. количество человек, обратившихся по поводу нападений и укусов животными, составило 392586, из них дети до 17 лет - 114622. При этом от диких животных пострадали 9950 человек.
По ориентировочным расчетам экспертов Роспотребнадзора, в 2015 г. экономический ущерб для страны от укусов, ослюнения, оцарапывания животными составил 3542144,2 тыс. руб. В 2015 г. в 5 субъектах Российской Федерации (Липецкая, Ярославская, Владимирская, Нижегородская области и Ставропольский край) было зарегистрировано 6 случаев бешенства (в 2014 г. - 3, в 2013 г. - 6), в т.ч. один - у ребенка в возрастной группе от 3 до 6 лет
К сожалению, до настоящего времени эффективных средств и методов лечения уже развившегося заболевания бешенством еще не разработано. Однако даже после контакта с подозрительным животным медицинские специалисты все-таки могут надежно предотвратить заболевание бешенством с помощью особой методики, называемой «постэкспозиционная профилактика» (или экстренная, ПЭП). Возможность ее осуществления основана на длительном инкубационном периоде, во время которого после введения антирабических препаратов вырабатывается иммунитет и заболевания человека бешенством не происходит.
Инкубационный период является особенностью патогенеза бешенства и составляет в среднем 1-3 месяца, но иногда встречается менее 1 недели или более одного года [11]. Близость места проникновения вируса к центральной нервной системе увеличивает вероятность более короткого инкубационного периода. Так, наиболее короткий инкубационный период наблюдается при укусах лица и головы, а наиболее длительный - при укусах нижних конечностей и туловища. Предполагаемая скорость миграции вируса составляет 15-100 мм в день [17].
Таким образом, исходя из знаний патогенеза, важнейшим условием эффективной постэкспозиционной профилактики является ее незамедлительное начало и соблюдение схем введения препаратов укушенному человеку, благодаря чему можно предотвратить наступление симптомов заболевания и смертельный исход.
Согласно позиции ВОЗ основными компонентами постэкспозиционной профилактики являются:
- курс иммунизации мощной и эффективной вакциной против бешенства, отвечающей рекомендациям ВОЗ,
- при наличии показаний (контактах II и III категорий) введение антирабического иммуноглобулина (пассивная иммунизация) [11].
При проведении вакцинации для индукции гуморального ответа требуется время, что не отвечает требованиям экстренности при осуществлении постэкспозиционной профилактики бешенства. Поэтому в схему ПЭП и добавляется введение антирабического иммуноглобулина, действие которого наступает практически с момента введения, так как препарат содержит готовые антирабические антитела.
Используемые схемы ПЭП включают антирабический иммуноглобулин (АИГ), который применяется при всех контактах категории III и контактах категории II (у лиц с иммунодефицитом). При контактах категории III пациенту вводят АИГ в рану или вокруг нее и 4-5 доз вакцины.
Под контактами подразумеваются:
- Категория II - мелкие укусы непокрытых участков кожи, незначительные царапины или ссадины без кровотечения, ослюнение поврежденных кожных покровов;
- Категория III - укус или царапина или множественные укусы или царапины с повреждением кожи, попадание слюны животного на слизистые оболочки, контакт с летучими мышами [10].
В отношении контактов категорий II и III рекомендуемый лечебно-профилактической курс предусматривает введение 5 доз антирабической вакцины в дни 0, 3, 7, 14 и 28 курса постэкспозиционной профилактики. Антирабический иммуноглобулин для пассивной иммунизации вводится лишь единожды, предпочтительно к началу иммунизации (в день 0) или, по возможности, сразу после ее начала. ВОЗ обращает особое внимание на то, что после 7-го дня применение АИГ не показано, поскольку предполагается, в организме выработались активные антитела в ответ на антирабическую вакцину [5, 8].
Важнейшим моментом, определяющим защиту от бешенства после иммунизации, является наличие минимального защитного титра антирабических антител. Согласно рекомендациям ВОЗ минимальный титр антирабических антител в сыворотке крови иммунизированного должен составлять 0,5 МЕ/мл (определяется в тесте быстрого ингибирования фокусов флуоресценции (RFFIT) или в реакции нейтрализации вируса флюоресцентными антителами (FAVN)).
Существующие в настоящее время препараты антирабических иммуноглобулинов основаны на использовании сывороток человеческого или животного происхождения, содержащих высокий титр специфичных к вирусу бешенства иммуноглобулинов. Рекомендуемая доза антирабического человеческого (гомологичного) иммуноглобулина составляет 20 МЕ/кг массы тела, а лошадиного (гетерологичного) иммуноглобулина антирабического - 40 МЕ/кг массы тела [16].
Известен препарат лошадиного (гетерологичного) антирабического иммуноглобулина (Патент РФ 2339401) для внутривенного и внутримышечного введения, в котором в качестве исходного сырья используют высокоспецифичную антирабическую сыворотку, полученную от иммунизации животных-продуцентов очищенным вирусом бешенства, выращенным на культуре клеток Vero или ПСХ. Содержание γ-глобулиновой фракции в препарате составляет не менее 90%, молекулярно-массовое распределение: агрегаты не более 1,0%, димеры и мономеры менее 10,0%, F(ab)2-фрагменты не менее 84,0%, Fab- и Fc-фрагменты менее 5,0%, низкая антикомплементарная активность, специфическая активность не менее 150 МЕ/мл. Осмолярность готового препарата находится в пределах 250-350 мОсм/кг. Изобретение обеспечивает получение высокоочищенного гетерологичного антирабического иммуноглобулина, стабильного при хранении и транспортировке.
Описанный аналог имеет существенный недостаток, не позволяющий считать гетерологичный (лошадиный) иммуноглобулин предпочтительным препаратом при осуществлении постэкспозиционной профилактики бешенства. Являясь чужеродным белком для организма человека, гетерологичный антирабический иммуноглобулин реактогенен, может вызывать тяжелые аллергические реакции, в том числе анафилактический шок и сывороточную болезнь.
Лишены вышеуказанных недостатков человеческие (гомологичные) иммуноглобулины.
Известен человеческий антирабический иммуноглобулин высокой степени очистки (патент CN 101450967A «High-purity rabies human immunoglobulin and raw material production method thereof» - Антирабический человеческий иммуноглобулин высокой степени очистки и сырье для его получения, методы использования).
Данное техническое решение, как наиболее близкое к заявляемому по составу действующего вещества и способу его использования выбрано авторами настоящего изобретения за прототип.
Полученный по такому способу препарат характеризуется тем, что содержание иммуноглобулина составляет более 98% от общего содержания белка; титр антирабических антител - равен или больше, чем 150 МЕ/мл, содержание белка - меньше, чем 120 г/л. При этом содержание мономера и димера иммуноглобулина Ig G составляет более чем 99%. Процесс получения такого иммуноглобулина достаточно трудоемок и включает несколько этапов: 1) подготовка сырья на основе крови с титром антирабических антител 10 МЕ/мл крови; 2) фракционирование холодным этанолом, очистка; 3) ионообменная хроматография; (4) инактивация вирусов инкубацией при низком pH; (5) мембранная фильтрация для удаления вирусов; (6) ультрафильтрация, дозирование, стерилизация.
Представленный прототип имеет существенные недостатки из-за содержания в своем составе человеческих иммуноглобулинов.
- антирабические глобулины из сыворотки крови человека является дефицитным и дорогим препаратом, требуются иммунизированные люди-доноры;
- так как препарат получают из крови доноров, не исключена потенциальная возможность контаминации инфекционными агентами;
- пассивные антирабические антитела снижают эффективность антирабической вакцины, что может привести к заболеванию бешенством и, в конечном итоге, к смерти человека.
Известно, что присутствие пассивных антирабических антител на срок более 7 суток в крови иммунизированного иммуноглобулином снижает эффективность вакцинации из-за наличия тормозящего действия пассивных антител на образование активных антител [18]. Данные свидетельствуют, что образование активных антител происходит уже на 7 день после введения вакцины [1, 2], а время полувыведения человеческого антирабического иммуноглобулина составляет около 21 дня [3].
- из-за наличия тормозящего эффекта классических антител на индукцию вакцинных, не допускается введение иммуноглобулинов позднее 7 суток после предыдущей антирабической вакцинации, что является прямым противопоказанием к введению иммуноглобулинов покусанному пациенту, если ему менее чем за 7 суток до инцидента была введена вакцина с профилактической целью [5, 8];
- вируснейтрализующие действие человеческих антирабических иммуноглобулинов реализуется медленнее, в течение 24 часов с пиком на 2-13 день, по сравнению с однодоменными антителами, концентрация которых достигает пика на 4-й час после внутримышечного введения [9].
На сегодняшний день в России для экстренной профилактики бешенства применяются всего два типа препаратов - лошадиный (гетерологичный) антирабический иммуноглобулин, а также человеческий (гомологичный) импортного производства. Оба препарата применяются достаточно давно и имеют определенные недостатки. Исходя из современного уровня техники, очевидна необходимость в разработке инновационных препаратов для экстренной профилактики бешенства, способных нейтрализовывать вирус бешенства и заменить классические антирабические иммуноглобулины в стандартной схеме лечебно-профилактической иммунизации.
Раскрытие изобретения
Задача заявляемого изобретения направлена на создание препарата для быстрой нейтрализации вируса бешенства в организме зараженного человека, безопасного и не снижающего эффективность антирабической вакцины в схеме экстренной постэкспозиционной профилактики бешенства.
Техническая задача решается за счет того, что создана фармацевтическая композиция для пассивной иммунизации против бешенства, в виде лиофилизатов во флаконах и раствора для инъекций, помещенных в приемлемую упаковку, включающая вируснейтрализующие антирабические однодоменные антитела и рекомбинантные псевдоаденовирусные частицы, несущие ген вирус-нейтрализующих антирабических однодоменных антител в фармакологически эффективных дозах.
Вируснейтрализующие антирабические однодоменные антитела имеют аминокислотную последовательность SEQ ID NO.1.
Эффективной дозой вирус-нейтрализующих антирабических однодоменных антител является доза - не менее 150 ME активности, в лиофилизированном виде.
Рекомбинантные псевдоаденовирусные частицы, несущие ген вирус-нейтрализующих антирабических однодоменных антител имеют нуклеотидную последовательность генетической вставки SEQ ID NO.3.
При этом эффективная доза рекомбинантных псевдоаденовирусных частиц, несущих ген вирус-нейтрализующих антирабических однодоменных антител составляет не менее 5×108 акт.ед. в 1 мл фармацевтически приемлемого растворителя.
Фармацевтический набор для пассивной иммунизации против бешенства, помещенный в приемлемую упаковку, включает фармацевтическую композицию в виде лиофилизатов во флаконах и раствора для инъекций, содержит вирус-нейтрализующие антирабические однодоменные антитела и рекомбинантные псевдоаденовирусные частицы, несущие ген вируснейтрализующих антирабических однодоменных антител в фармакологически эффективных дозах и инструкцию для одновременного администрирования компонентов этого фармацевтического набора.
Способ применения фармацевтического набора для пассивной иммунизации против бешенства заключается в следующем: лиофилизат вирус-нейтрализующих антирабических однодоменных антител восстанавливают путем смешивания лиофилизата с фармацевтически приемлемым растворителем, затем вводят субъекту, инфицированному вирусом бешенства, в дозе не менее 20 МЕ/кг, сразу после этого вводят рекомбинантные псевдоаденовирусные частицы, несущие ген вирус-нейтрализующих антирабических однодоменных антител - не менее 5×108 акт.ед. в растворителе.
Из литературных данных известно, что лишены указанных в прототипе недостатков, свойственных традиционным иммуноглобулинам, препараты рекомбинантных однодоменных антител, полученных на основе антител животных семейства Верблюдовых. Данные антитела состоят из димера только одной укороченной (без первого константного района CH1) тяжелой цепи иммуноглобулина и полнофункциональны в отсутствие легкой цепи иммуноглобулина. Для специфического узнавания и связывания антигена при этом необходим и достаточен лишь один вариабельный домен этого антитела. Известен пример использования рекомбинантного однодоменного антитела для специфического связывания и нейтрализации вируса бешенства с высокой эффективностью in vitro (патент РФ №2533802 C1 «Trimerised single - domain antibody that specifically binds with glycoprotein G of rabies virus, neutralizing rabies virus» - «Тримеризованное однодоменное антитело, специфически связывающееся с гликопротеином G вируса бешенства, нейтрализующее вирус бешенства»).
Полным эквивалентом термина «однодоменное антитело» является вошедшее в широкое употребление обозначение «нанотело», «NANOBODY», а также «наноантитело» и «однодоменное наноантитело».
Преимуществами рекомбинантных однодоменных антител по сравнению с прототипными классическими иммуноглобулинами являются:
1) Наличие высокоэффективного способа генерирования и селекции, для получения препаратов однодоменных антител не нужны люди-доноры.
2) Малый размер, ~2×4 нм, 13-15 кДа, позволяет в отличие от классических антител проникать в нервные клетки, которые являются местом локализации вируса бешенства. Однодоменные антитела способны находиться в нервной ткани в эффективной концентрации и нейтрализовать там вирус бешенства, что крайне важно при покусах вблизи головы, когда время для проникновения вируса сокращено и он может ускользать от воздействия классических антител, находящихся в других тканях кроме нервной.
3) Отсутствие тормозящего влияния на образование активных (вакцинных) антител, так как выведение организмом однодоменных антител осуществляется ранее 7 дней и не накладывается на период их индукции.
4) Отсутствие тормозящего влияния на индукцию вакцинных антител также происходит за счет отсутствия Fc фрагмента у однодоменных антител, что позволяет вводить их недавно вакцинированным с профилактической целью людям, даже позднее 7 дней после вакцинации.
5) При введении препаратов однодоменных антител экспериментальным животным (или пациентам) противовирусное действие оказывается немедленно, в отличие от классических антител, максимальная концентрация которых наблюдается только через 2-3 дня [15, 6, 13]. Это отличие позволяет однодоменным антителам быстрее реализовывать вируснейтрализующую функцию в организме инфицированного, что невероятно важно при осуществлении экстренной профилактики бешенства.
6) Структурные особенности (способность образовывать необычные для классических антител паратопы, позволяющие связываться с углублениями и активными центрами белков); могут использоваться для выявления «скрытых» эпитопов или эпитопов, которые не могут быть узнаны существенно более крупными обычными антителами.
7) Высокая растворимость и стабильность (в широком диапазоне температур и кислотности среды) позволяет разрабатывать различные решения готовых лекарственных форм.
8) Высокий экспрессионный выход, экономичность наработки в больших количествах. Обычно однодоменные антитела нарабатывают в периплазме бактерий E. coli (в количестве 1-10 мг из 1 литра культуры). Продемонстрирована возможность их эффективной наработки в дрожжах, растениях и клетках млекопитающих.
9) Простота всевозможных генно-инженерных манипуляций, адаптаций для конкретных задач, возможность создания многовалентных и многофункциональных производных.
10) Низкая иммуногенность; возможность экономично «гуманизировать» антитела без заметной потери их специфической активности.
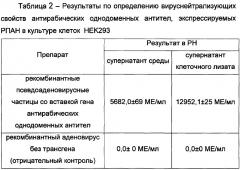
Будучи высокоэффективными препаратами, однодоменные антитела однако имеют короткое время жизни в организме (не более 2-4 дней), что не позволяет использовать препарат антирабических антител в схеме ПЭП бешенства в качестве замены классическим иммуноглобулинам. Повторные инъекции однодоменных антител удорожают курс иммунизаций, требуют трудозатрат медперсонала, многократных посещений клиники пациентом и травмирование мышцы в месте введения. Для увеличения периода действия препарата на основе однодоменных антител предложено пролонгировать их действие за счет использования рекомбинантного аденовируса, обеспечивающего постоянный синтез антирабических антител непосредственно в клетках организма. Однократное введение данного препарата снижает стоимость проводимой ПЭП, (не требуется производство и введение готовых антител, они нарабатываются самим организмом), многократные инъекции заменяются однократным введением препарата рекомбинантных псевдоаденовирусных частиц в 0 день курса. Период продукции ими целевого белка составляет несколько дней и хорошо вписывается в общую схему экстренной профилактики бешенства, так как присутствует в организме вплоть до образования вакцинных антител. Подобный подход по успешному пролонгированию действия белкового препарата рекомбинантными псевдоаденовирусными частицами был описан в Патенте РФ №2488406 (Фармацевтическая композиция для терапии острых токсических состояний). Безопасность и эффективность данного типа векторов доказана в ходе целого ряда доклинических и клинических испытаний, проводимых во всем мире, в том числе и в России [14]. Кроме того, на сегодняшний момент разработаны быстрые и гибкие технологии получения данного типа векторов, позволяющие реализацию масштабного производства различных терапевтических средств на их основе (Заявка на патент РФ 2012107702; Патент РФ 2219241). Особенно важной способностью является возможность поддержания эффективной концентрации антирабических однодоменных антител прямо в нервной ткани за счет проникновения аденовирусного вектора и экспрессии генов однодоменных антител [7].
Исходя из вышесказанного, авторы предложили в качестве средства для экстренной профилактики бешенства фармацевтическую композицию для пассивной иммунизации против бешенства, в виде лиофилизатов во флаконах и раствора для инъекций, помещенных в приемлемую упаковку, включающая вирус-нейтрализующие антирабические однодоменные антитела (Препарат 1), специфичные к гликопротеину G вируса бешенства (действует с 0,5 часов вплоть до 12 часов) и рекомбинантные псевдоаденовирусные частицы, несущие ген вирус-нейтрализующих антирабических однодоменных антител в фармакологически эффективных дозах (Препарат 2), действие которых начинается с 6-ти часов после введения в организм и продолжается вплоть до 7 дней.
Способ получения фармацевтической композиции для пассивной иммунизации против бешенства для экстренной постэкспозиционной профилактики бешенства включает следующие принципиальные этапы:
1) Получение препарата антирабических однодоменных антител (Препарат 1) путем получения библиотеки вариабельных доменов неканонических одноцепочечных антител, селекции однодоменных антител, специфически узнающих вирус бешенства (гликопротеин G), их тримеризация (модификация, форматирование) и дальнейшая их наработка в Е.coli (штамм BL21), с активностью в готовой форме Препарата 1 от 150 до 250 ME на флакон.
2) Получение препарата рекомбинантных псевдоаденовирусных частиц, несущих ген вирус-нейтрализующих антирабических однодоменных антител (Препарат 2) путем конструирования рекомбинантной псевдоаденовирусной частицы, несущей ген вирус-нейтрализующего антирабического однодоменного антитела и их получения с активностью в готовой форме Препарата 2 от 5×108 до 5×109 БОЕ /мл (доза).
3) Компоновка готового фармацевтического набора для пассивной иммунизации против бешенства, помещенный в приемлемую упаковку, включающего фармацевтическую композицию в виде лиофилизатов во флаконах и раствора для инъекций, содержащую вирус-нейтрализующие антирабические однодоменные антитела (Препарат 1) и рекомбинантные псевдоаденовирусные частицы, несущие ген вирус-нейтрализующих антирабических однодоменных антител (Препарат 2) в фармакологически эффективных дозах и инструкцию для одновременного администрирования компонентов этого фармацевтического набора.
4) Готовый фармацевтический набор для пассивной иммунизации против бешенства комплекта препаратов для экстренной профилактики бешенства, состоит из препаратов 1 и 2. Количество флаконов препарата 1 регулируется требуемой эффективностью, и может состоять из 9 флаконов с активностью от 150 до 250 ME на флакон, или меньшим количеством флаконов с увеличением активности и объема флаконов, например 300-500 ME на флакон; или 1500-5000 ME на флакон, но не ограничивается указанными вариациями. Препарат 1 представлен в виде лиофилизата. Препарат 2 входит в состав комплекта в виде раствора в количестве 1 флакон объемом 1 см3.
5) Способ применения фармацевтического набора для пассивной иммунизации против бешенства заключается в следующем: лиофилизат вирус-нейтрализующих антирабических однодоменных антител восстанавливают путем смешивания лиофилизата с фармацевтически приемлемым растворителем, затем вводят субъекту, инфицированному вирусом бешенства, в дозе не менее 20 МЕ/кг, сразу после этого вводят рекомбинантные псевдоаденовирусные частицы, несущие ген вирус-нейтрализующих антирабических однодоменных антител - не менее 5×108 акт.ед. в растворителе.
Каждый из препаратов обладает рядом положительных свойств.
Полученные по изобретению антирабические однодоменные антитела характеризуются следующими улучшенными свойствами [13]: 1) Наличие отработанного заявителем способа получения и селекции однодоменных антител, в основе которого лежит получение нуклеотидных последовательностей генов неканонических антител животных семейства верблюдовых (Camelidae); 2) Возможность экономичной наработки в больших количествах, так как продуцентом является бактерия E.coli, что говорит о промышленной применимости изобретения; 3) Биологическая безопасность антител, так как культура бактерии E.coli не может контаминироваться патогенами эукариотов; 4) Низкая иммуногенность, так как однодоменное антитело состоит только из вариабельного фрагмента тяжелой цепи, ответственного за связывание с антигеном и не содержит других доменов, на которые образуются нежелательные иммунные реакции; 5) Однодоменные антитела имеют улучшенную проницаемость в клетки, в том числе нервные, за счет малого размера (~2×4 нм, 13-15 кДа), что очень важно при инфицировании вирусом бешенства; 6) Отсутствует влияние на вакцинный иммунный ответ, что повышает эффективность антирабической вакцинации в составе ПЭП; 7) Высокая растворимость и стабильность (в широком диапазоне температур и кислотности среды) позволяет готовить на их основе однодоменных антител препараты для медицинского применения; 8) Возможность пролонгирования действия за счет применения рекомбинантных аденовирусных частиц со вставкой гена антирабических однодоменных антител, экспрессирующих трансген непосредственно в организме пациента.
Основным преимуществом применения препарата 2 на основе рекомбинантных псевдоаденовирусных частиц является пролонгирование наработки в организме и поддержание протективного уровня однодоменных антител, начиная с 6 часов до 7-ми дней после инъекции препарата 2 в организм. Такой эффект достигается путем того, что введение рекомбинантных псевдоаденовирусных частиц, несущих ген антирабических вируснейтрализующих мини-антител приводит к экспрессии гена антирабического однодоменного антитела непосредственно в клетках организма, в связи с чем не требуются дополнительные инъекции препарата однодоменных антител для поддержания эффективной концентрации однодоменных антител в организма, в том числе в нервной ткани [7].
Описание фигур
На фиг. 1
SEQ ID NO: 1 - аминокислотная последовательность отобранного тримеризованного однодоменного антитела, способного специфически связывать и нейтрализовать вирус бешенства.
SEQ ID NO: 2 нуклеотидная последовательность, кодирующая аминокислотную последовательность тримеризованного однодоменного антитела, способного специфически связывать и нейтрализовать вирус бешенства.
В указанной последовательности SEQ ID NO: 1 выделены жирным и подчеркнуты соответственно (слева направо, от N- к C-концу) гипервариабельные участки CDR1, CDR2 и CDR3, которые являются определяющими (особенно важен CDR3) для специфического узнавания данным однодоменным антителом поверхностного белка вируса бешенства. В аминокислотной последовательности выделены (серым цветом) также два остатка цитозина, которые, исходя из многих предшествующих структурных исследований подобных молекул, могут образовывать дополнительную неканоническую Cys- Cys-связь и таким образом существенно стабилизировать структуру антитела. Добавленные при модификации (адаптации) исходного полученного однодоменного антитела последовательности содержат линейный участок (линкерный район, соответствующий длинному шарнирному участку особого верблюжьего антитела («hinge», h) без цистеиновых остатков, принципиально важный для усиления нейтрализующей вирус функции тримеризующийся домен (вариант мотива «лейциновой молнии», ILZ, выделен серым цветом), а также (на самом конце) участки, кодирующие два олигопептидных тага: HA-таг и (His)6-таг. На конце находится терминирующий кодон TAA (в аминокислотной последовательности ему соответствует звездочка).
На фиг. 2
Представлены данные анализа очищенного тримеризованного однодоменного антитела, специфически связывающегося с вирусом бешенства, с помощью электрофореза по Лэммли в разделяющем 14% полиакриламидном геле в денатурирующих и восстановительных условиях (с додецилсульфатом натрия, SDS, и с дитиотреитолом, ДТТ). В левой дорожке нанесен маркер молекулярного веса.
Тримеризованное однодоменное антитело было наработано в периплазме бактерий и затем почищено (в том числе с помощью аффинной металл-хелатной хроматографии и последующей гель-фильтрационной хроматографии) до практически индивидуально белкового продукта, мигрирующего в геле в зоне белков размером примерно 28 кДа (реальный размер - примерно 23,4 кДа; антитело движется в геле замедленно вследствие особенностей структуры, в частности из-за наличия концевых положительно заряженных шести остатков гистидина (His-таг)).
На фиг. 3
Показан профиль гель-фильтрационной хроматографии очищенного тримеризованного однодоменного антитела, пропущенного через колонку Sephacryl S-100 HR 1.5x50 в стандартном буферно-солевом растворе PBS (в нормальных физиологических условиях без денатурации). Белки с известным молекулярным весом были использованы как маркеры: Бычий сывороточный альбумин, БСА - 67 кДа; Овальбумин, ОВА - 45 кДа; Лизоцим, ЛЦ - 14,4 кДа. Препарат антитела элюируется во фракциях, соответствующих тримеризованному антителу.
На фиг. 4
Проиллюстрированы результаты иммуноферментного анализа (ИФА) связывания созданного антирабического однодоменного антитела с иммобилизованным в лунке планшета препаратом белка гликопротеина G вируса бешенства.
Антиген (гликопротеини G) иммобилизовали в лунках в объеме 50-100 мкл из раствора (в PBS) с концентрацией примерно 5 мкг/мл. Проверяемое мини-антитело использовали в разведениях кратных 4 (1:4), начиная с 40 мкг/мл (1) и заканчивая примерно 40 нг/мл (6). В одном из контролей использовали лунку без первичного антитела (7). В области наиболее достоверного анализа активности антитела, в лунке (4), где использовали мини-антитело в концентрации примерно 0,6 мкг/мл. результирующая оптическая плотность при 405 нм была около 0,85 о.е.
На фиг. 5
Представлен SEQ ID NO: 3 - нуклеотидная последовательность экспрессирующей кассеты рекомбинантной псевдоаденовирусной частицы (РПАН), несущая ген тримеризованного вирус-нейтрализующего антирабического однодоменного антитела Б3. Дополнительными элементами конструкции являются ATG - старт-кодон, igk leader - лидерный пептид, осуществляющий транспорт наработанного пептида из клетки, hinge-ILZ-HA таг - линейный участок (линкерный район, соответствующий длинному шарнирному участку особого верблюжьего антитела («hinge», h) без цистеиновых остатков, принципиально важный для усиления нейтрализующей вирус функции тримеризующийся домен (вариант мотива «лейциновой молнии», ILZ), олигопептидный таг: HA-таг. Заканчивается последовательность стоп-кодоном ТАА.
На фиг. 6
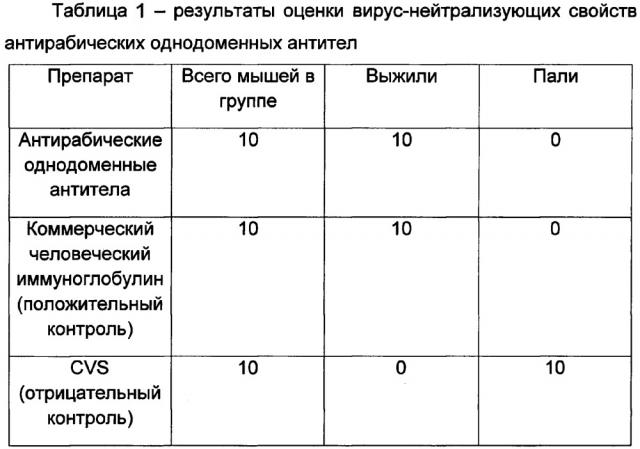
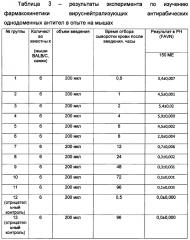
Изображена совокупная фармакокинетическая кривая уровня вирус-нейтрализующих антирабических антител после однократного внутримышечного введения мышам антирабических препаратов 1 и 2 по изобретению в схеме экстренной профилактики бешенства. В день 0 вначале вводили вирус-нейтрализующие антирабические однодоменные антитела (Препарат 1) и сразу же рекомбинантные псевдоаденовирусные частицы, несущие ген вируснейтрализующих антирабических однодоменных антител (РПАН) - (Препарат 2), в разные группы мышц. Сразу же после этого вводили официальную антирабическую вакцину. На горизонтальной оси отложен защитный уровень антирабических антител по стандарту ВОЗ, соответствующий 0,5 ME на мл крови.
Вид кривой свидетельствует о том, что защитный титр вируснейтрализующих антирабических антител (выше 0,5 ME) в сыворотке крови иммунизированного субъекта наблюдается при предложенной схеме введения препаратов 1 и 2 комплекта в период от 0,5 часа до 168 часов (7 дней), после чего происходит эффективное образование вакцинных антирабических антител. Таким образом, тормозящего эффекта однодоменных антител на образование классических антирабических антител не отмечается.
При этом из-за невозможности отличить однодоменные антитела Препарата 1 и Препарата 2 их уровень отмечен одинаковой пунктирной линией с седьмого дня начинают образовываться вакцинные антитела
Реализация изобретения
Реализация данного изобретения проиллюстрирована в нижеприведенных примерах.
Пример 1
Получение однодоменных антител, нейтрализующих вирус бешенства (препарат 1).
Процесс получения однодоменных антител для Препарата 1 является известным специалисту в данной области и детально описан в ряде открытых источников (например, Патент РФ 2533802. Тримеризованное однодоменное антитело, специфически связывающееся с гликопротеином G вируса бешенства, нейтрализующее вирус бешенства). Основными его стадиями являются:
1) Получение библиотеки вариабельных доменов неканонических однодоменных антител.
2) Селекция однодоменных антител, специфически узнающих вирус бешенства, их тримеризация (модификация, форматирование).
3) Наработка антирабических однодоменных антител, специфически узнающих вирус бешенства.
В ходе осуществления данных работ было получено уникальное однодоменное антитело, специфически связывающееся с вирусом бешенства.
Аминокислотная последовательность отобранного антирабического однодоменного антитела представлена на Фигуре 1, SEQ ID NO: 1.
Для того чтобы повысить эффективность выделения и детекции однодоменного антитела, а также с целью значительно усилить биологическую активность исходно отобранного однодоменного антитела, была использована разработанная ранее эффективная процедура тримеризации (форматирования, модифицирования аминокислотной последовательности антитела), подробно описанная в работе Тиллиба и соавт. [12]. Эта процедура включала присоединение к С-концу исходно отобранного антитела четырех дополнительных аминокислотных участков (доменов), представленных на фиг. 1: линкерного линейного участка (соответствующего верхнему удлиненному шарнирному участку особых иммуноглобулинов IgG2a верблюда), - специального тримеризующегося домена - "ILZ" ("isoleucine zipper domain", или, в переводе, «изолейциновой молнии»), - HA-тага (пептида из белка гемагглютинина, к которому есть коммерческие антитела) и His-тага (шести остатков гистидина на самом C-конце белка для эффективной очистки белка с помощью металл-хелатной хроматографии.
В результате проведенных работ было получено уникальное связывающееся с вирусом бешенства однодоменное антитело по изобретению.
Получаемый препарат 1 антирабического однодоменного антитела на различных стадиях анализировали с помощью электрофореза в 14% SDS-полиакриламидном геле (фиг. 2). Очищенные антитела хранили в аликвотах при 4°C или, после добавления 50% глицерина, при -20°C. Для более долгого хранения антитела лиофилизировали.
После проведения гель-фильтрационной хроматографии очищенного тримеризованного однодоменного антитела, пропущенного через колонку Sephacryl S-100 HR 1.5x50 в стандартном буферно-солевом растворе PBS (в нормальных физиологических условиях без денатурации), было установлено, что препарат однодоменного антитела элюируется во фракциях, соответствующих тримеризованному антителу (Фиг. 3).
Пример 2
Демонстрация специфического связывания полученного по изобретению антирабического однодоменного антитела с вирусом бешенства in vitro (препарат 1).
Демонстрация специфического связывания полученного по изобретению антирабического однодоменного антитела с вирусом бешенства in vitro (препарат 1).
Способность полученного однодоменного антитела связывать белок вируса бешенства, гликопротеин G и анализ активности созданного тримеризующегося однодоменного антитела изучали с помощью ИФА-анализа.
Для ИФА в ячейки стандартной 96-луночной иммунологической плашки (из полистирола, Microlon 600 hi-binding, фирмы Greiner bio-one) наносили в объеме 50-100 мкл разбавленный (в PBS в концентрации примерно 5 мкг/мл) материал антигена. Иммобилизацию проводили в течение ночи при +4°C. Затем ячейки отмывали (в PBS) от несвязавшегося антигена и блокировали лунки раствором 1% бычьего сывороточного альбумина (БСА) или 1% казеина в PBS в течение 2 часов при комнатной температуре. Яч