Лечение заболеваний, связанных с нейтрофическим фактором головного мозга (bdnf), путем ингибирования природного антисмыслового транскрипта bdnf
Иллюстрации
Показать всеНастоящее изобретение относится к биохимии. Описан способ повышающей регуляции экспрессии полинуклеотида нейротрофического фактора головного мозга (BDNF) в биологической системе. Осуществляют контакт указанной биологической системы с по меньшей мере одним антисмысловым олигонуклеотидом, длиной от 10 до 30 нуклеотидов, где указанный по меньшей мере один антисмысловой олигонуклеотид имеет по меньшей мере 90% комплементарность и специфически гибридизуется с участком в 10-30 нуклеотидов природного антисмыслового полинуклеотида для полинуклеотида BDNF. Причем указанный природный антисмысловой полинуклеотид состоит по существу из последовательности, выбранной из группы, состоящей из нуклеотидов: 1-1279 в SEQ ID NO: 3, или 1-1478 в SEQ ID NO: 4, или 1-1437 в SEQ ID NO: 5, или 1-2322 в SEQ ID NO: 6, или 1-2036 в SEQ ID NO: 7, или 1-2364 в SEQ ID NO: 8, или 1-3136 в SEQ ID NO: 9, или 1-906 в SEQ ID NO: 10, или 1-992 в SEQ ID NO: 11, что приводит к повышающей регуляции экспрессии полинуклеотида нейротрофического фактора головного мозга (BDNF), при условии, что по меньшей мере один антисмысловой олигонуклеотид не имеет последовательность любую из SEQ ID NO: 50-55. Также описан аналогичный способ повышающей регуляции функции полинуклеотида BDNF в биологической системе. Также описаны соответствующие способ повышающей регуляции функции полинуклеотида BDNF в биологической системе и способ повышающей регуляции экспрессии полинуклеотида BDNF в клетках или тканях пациента in vivo или in vitro, в том числе млекопитающего. Представлен олигонуклеотид длиной от 10 до 30 нуклеотидов, имеющий по меньшей мере одну модификацию и/или замещение, причем указанный олигонуклеотид имеет по меньшей мере 90% комплементарность и специфически гибридизуется с участком в 10-30 нуклеотидов природного антисмыслового полинуклеотида для полинуклеотида BDNF. Причем указанный природный антисмысловой полинуклеотид состоит по существу из последовательности, выбранной из группы состоящей из нуклеотидов: 1-1279 в SEQ ID NO: 3, или 1-1478 в SEQ ID NO: 4, или 1-1437 в SEQ ID NO: 5, или 1-2322 в SEQ ID NO: 6, или 1-2036 в SEQ ID NO: 7, или 1-2364 в SEQ ID NO: 8, или 1-3136 в SEQ ID NO: 9, или 1-906 в SEQ ID NO: 10, или 1-992 в SEQ ID NO: 11, при условии, что олигонуклеотид не имеет последовательность любую из SEQ ID NO: 50-55, где по меньшей мере одну модификацию, выбранную из: по меньшей мере одного модифицированного остатка сахара, по меньшей мере одного модифицированного межнуклеозидного мостика, по меньшей мере одного модифицированного нуклеотида и любой их комбинации. Кроме того, указанный олигонуклеотид представляет собой антисмысловое соединение, которое гибридизуется с и повышает регуляцию экспрессии гена BDNF in vivo или in vitro по сравнению с стандартным контролем. Описана фармацевтическая композиция для лечения заболевания, ассоциированного с по меньшей мере одним полинуклеотидом BDNF, содержащая по меньшей мере один представленный олигонуклеотид, специфичный к одному или более полинуклеотидам BDNF, и фармацевтически приемлемый эксципиент. Также описан способ профилактики или лечения заболевания, ассоциированного с по меньшей мере одним полинуклеотидом BDNF и/или по меньшей мере одним продуктом, который он кодирует, включающий введение пациенту терапевтически эффективной дозы по меньшей мере одного представленного олигонуклеотида. 9 н. и 18 з.п. ф-лы, 9 ил., 1 табл., 2 пр.
Реферат
Данная заявка претендует на приоритет предварительной заявки США на патент №61/611225, поданной 15 марта 2012 г, и предварительной заявки США на патент №61/614664, поданной 23 марта 2012 г, которые включены полностью в данную заявку посредством отсылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Варианты данного изобретения относятся к олигонуклеотидам, модулирующим экспрессию и/или функцию BDNF и связанных с ним молекул.
УРОВЕНЬ ТЕХНИКИ
Гибридизация ДНК-РНК и РНК-РНК имеет значение во многих аспектах функции, включающих репликацию, транскрипцию и трансляцию ДНК. Гибридизация также является центральным событием в ряде технологий, которые или позволяют обнаружить конкретную нуклеиновую кислоту, или изменить ее экспрессию. Например, антисмысловые олигонуклеотиды подавляют экспрессию генов за счет гибридизации РНК-мишени, участвуя при этом в сплайсинге, транскрипции, трансляции и репликации РНК. Антисмысловая ДНК характеризуется дополнительным признаком, состоящим в том, что гибриды ДНК-РНК служат в качестве субстрата для расщепления рибонуклеазой Н, эта активность имеется в большинстве типов клеток. Антисмысловые молекулы могут быть доставлены в клетки, как это имеет место в случае олигодезоксинуклеотидов (ODNs) или они могут быть экспрессированы из эндогенных генов как молекулы РНК. Недавно FDA одобрила антисмысловое лекарство, VITRAVENE™ (для лечения цитомегаловирусного ретинита), что свидетельствует о том, что антисмысловая терапия имеет смысл.
В заявке WO 2010/093904 и в заявке США 2011/ 0319475 описан белок BDNF в качестве мишени для модуляции с использованием олигонуклеотидов. Необходимо постоянно развивать создание антисмысловых мишеней и новых олигонуклеотидов, которые дополняют такие мишени и модулируют экспрессию белка BDNF для возможного лечения или применения в исследованиях, связанных с лечением заболеваний и состояний, ассоциируемых с BDNF.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
В этом разделе изложена сущность изобретения, то есть кратко описаны природа и содержание изобретения. Предполагается, что это описание не будет трактоваться как ограничивающее объем или значение формулы изобретения.
Согласно одному из вариантов данное изобретение предусматривает способы ингибирования действия природного антисмыслового транскрипта путем использования антисмыслового(ых) олигонуклеотида(ов), нацеленного(ых) на любую область природного антисмыслового транскрипта, приводящего к усилению экспрессии соответствующего смыслового гена BDNF в организме млекопитающего. Данное изобретение предусматривает также, что ингибирование природных антисмысловых транскриптов, указанных в данной заявке, может быть достигнуто при помощи короткой интерферирующей РНК, киРНК (siRNA), рибозимов и малых молекул, которые входят в объем данного изобретения.
Один из вариантов данного изобретения предусматривает способ модуляции функции и/или экспрессии полинуклеотида BDNF в биологических системах, включая, но без ограничения, клетки или ткани пациентов in vivo и in vitro, предусматривающий осуществление контакта указанной биологической системы или указанных клеток или тканей с антисмысловым олигонуклеотидом, содержащим от примерно 5 до примерно 30 звеньев нуклеотидов, при этом указанный олигонуклеотид имеет по меньшей мере 50%-ную идентичность последовательности, которая представляет собой обратный комплемент природной антисмысловой последовательности для полинуклеотида, содержащего 5-30 последовательных нуклеотидов в пределах нуклеотидов 1-1279 в SEQ ID NO: 3, или 1-1478 в SEQ ID NO: 4, или 1-1437 в SEQ ID NO: 5, или 1-2322 в SEQ ID NO: 6, или 1-2036 в SEQ ID NO: 7, или 1-2364 в SEQ ID NO: 8, или 1-3136 в SEQ ID NO: 9, или 1-906 в SEQ ID NO: 10, или 1-992 в SEQ ID NO: 11, при этом происходит модуляция функции и/или экспрессии полинуклеотида BDNF в указанной биологической системе, включая указанные клетки и ткани пациентов in vivo или in vitro, при условии, что олигонуклеотиды, содержащие SEQ ID NO: 50-55, исключены.
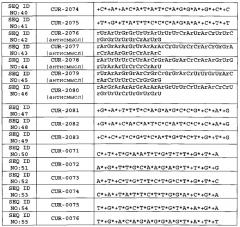
Согласно одному из вариантов олигонуклеотид, описанный в данной заявке, нацелен на природную антисмысловую последовательность полинуклеотидов в BDNF, имеющихся в биологической системе, например, нуклеотидов в SEQ ID NO: 3-11, и любых вариантов, аллелей, гомологов, мутантов, производных, фрагментов и их комплементарных последовательностей. Примеры таких антисмысловых олигонуклеотидов представлены в SEQ ID NO: 12-49.
Согласно другому варианту настоящее изобретение предусматривает способ модуляции функции или экспрессии полинуклеотида BDNF в биологической системе, предусматривающий осуществление контакта указанной биологической системы с по меньшей мере одним антисмысловым олигонуклеотидом, который нацелен на природный антисмысловой транскрипт для полинуклеотида BDNF, содержащий 5-30 последовательных нуклеотидов в пределах нуклеотидов 1-1279 в SEQ ID NO: 3, или 1-1478 в SEQ ID NO: 4, или 1-1437 в SEQ ID NO: 5, или 1-2322 в SEQ ID NO: 6, или 1-2036 of SEQ ID NO: 7, или 1-2364 в SEQ ID NO: 8, или 1-3136 в SEQ ID NO: 9, или 1-906 в SEQ ID NO: 10, или 1-992 в SEQ ID NO: 11, при этом происходит модуляция функции и/или экспрессии полинуклеотида BDNF в указанной биологической системе.
Согласно еще одному варианту настоящее изобретение предусматривает способ модуляции функции или экспрессии полинуклеотида BDNF в биологической системе, предусматривающий осуществление контакта указанной биологической системы с по меньшей мере одним антисмысловым олигонуклеотидом, который нацелен на область природного антисмыслового транскрипта для полинуклеотида BDNF, содержащего 5-30 последовательных нуклеотидов в пределах нуклеотидов 1-1279 в SEQ ID NO: 3, или 1-1478 в SEQ ID NO: 4, или 1-1437 в SEQ ID NO: 5, или 1-2322 в SEQ ID NO: 6, или 1-2036 of SEQ ID NO: 7, или 1-2364 в SEQ ID NO: 8, или 1-3136 в SEQ ID NO: 9, или 1-906 в SEQ ID NO: 10, или 1-992 в SEQ ID NO: 11, при этом происходит модуляция функции и/или экспрессии полинуклеотида BDNF в указанной биологической системе.
Согласно одному из вариантов данное изобретение предусматривает способ возрастания функции и/или экспрессии полинуклеотида BDNF, содержащего SEQ ID NO: 1 и 2, в биологической системе, предусматривающий осуществление контакта указанной биологической системы с по меньшей мере одним антисмысловым олигонуклеотидом, который нацелен на природный антисмысловой транскрипт для полинуклеотида BDNF, содержащий 5-30 последовательных нуклеотидов в пределах нуклеотидов 1-1279 в SEQ ID NO: 3, или 1-1478 в SEQ ID NO: 4, или 1-1437 в SEQ ID NO: 5, или 1-2322 в SEQ ID NO: 6, или 1-2036 of SEQ ID NO: 7, или 1-2364 в SEQ ID NO: 8, или 1-3136 в SEQ ID NO: 9, или 1-906 в SEQ ID NO: 10, или 1-992 в SEQ ID NO: 11, при этом происходит усиление функции и/или увеличение экспрессии полинуклеотида BDNF в указанной биологической системе.
Согласно одному из вариантов данное изобретение предусматривает способ усиления функции и/или увеличения экспрессии полинуклеотида BDNF, содержащего SEQ ID NO: 1 и 2, в биологической системе, предусматривающий осуществление контакта указанной биологической системы с по меньшей мере одним антисмысловым олигонуклеотидом, который нацелен на природный антисмысловой транскрипт для полинуклеотида BDNF, при этом происходит усиление функции и/или увеличение экспрессии полинуклеотида BDNF или его продукта экспрессии, и природные антисмысловые транскрипты выбраны из SEQ ID NO: 3-11.
Согласно одному из вариантов данное изобретение предусматривает способ усиления функции и/или увеличения экспрессии полинуклеотида BDNF, содержащего SEQ ID NO: 1 и 2, в биологической системе, предусматривающий осуществление контакта указанной биологической системы с по меньшей мере одним антисмысловым олигонуклеотидом, который нацелен на природный антисмысловой транскрипт полинуклеотида BDNF, при этом происходит усиление функции и/или увеличение экспрессии полинуклеотида BDNF или его продукта экспрессии, и природные антисмысловые транскрипты выбраны из SEQ ID NO: 3-11, и антисмысловые олигонуклеотиды выбраны из по меньшей мере одной из последовательностей соответствующих SEQ ID NO: 12-49.
Согласно одному из вариантов предусмотрена композиция, которая содержит один или более антисмысловых олигонуклеотидов, которые связываются со смысловыми и/или антисмысловыми полинуклеотидами BDNF.
Согласно одному из вариантов олигонуклеотиды содержат один или более модифицированных или замещенных нуклеотидов.
Согласно еще одному варианту олигонуклеотиды содержат одну или более модифицированных связей.
Согласно еще одному варианту олигонуклеотиды содержат модифицированные основания, содержащие фосфоротиоатные, метилфосфонатные мостики, пептидные нуклеиновые кислоты (пептидо-нуклеиновые кислоты), 2'-O-метил-, фтор- или углерод-, метилен- или иначе закрытые ("запертые") молекулы (LNA) нуклеиновой кислоты. Предпочтительно, модифицированные нуклеотиды представляют собой закрытые молекулы нуклеиновых кислот, включая α-L-LNA.
Согласно одному из вариантов олигонуклеотиды вводят пациенту подкожно, внутримышечно, внутривенно или внутрибрюшинно (интраперитонеально).
Согласно одному из вариантов олигонуклеотиды вводят в виде фармацевтической композиции. Схема лечения включает введение пациенту антисмысловых соединений по меньшей мере один раз, однако, это способ лечения может быть модифицирован и может включать введение многократных доз в течение определенного периода времени.
Согласно одному из вариантов применяют олигонуклеотиды, инкапсулированные в липосому или присоединенные к молекуле носителя (например, молекуле холестерина, пептида ТАТ).
Согласно одному из вариантов данное изобретение предусматривает применение SEQ ID NO: 50-55 в качестве олигонуклеотидов, нацеленных на природные антисмысловые транскрипты (NATs) с целью модуляции экспрессии полинуклеотида BDNF, при этом указанные NATs выбраны из группы последовательностей, состоящей из SEQ ID NO. 3-11. Согласно другому варианту данное изобретение предусматривает применение SEQ ID NO 50-55 в качестве олигонуклеотидов, нацеленных на природные антисмысловые транскрипты (NATs) с целью модуляции экспрессии полинуклеотида BDNF, при этом указанные NATs выбраны из группы, состоящей из SEQ ID NO. 3, 4, 5, 7, 8, 9, 10 и 11.
Другие аспекты изобретения описаны ниже.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
[0001] На Фигурах 1а-е показана антисенс-опосредованная регуляция смысловой siPHK и белка. Фигура 1а показывает, что после трансфекции нескольких человеческих и мышиных клеточных линий с тремя олигонуклеотидами киРНК, нацеленными на неперекрывающиеся области транскрипта BDNF-AS, происходили нокдаун и стимулирующая регуляция транскрипта BDNF. На Фигуре 1b показаны результаты с течением времени после введения BDNF-AS-нацеленной киРНК при эндогенной экспрессии и транскриптов BDNF, и транскриптов BDNF-AS. Данные показывают, что с течением времени экспрессия BDNF-AS снижается и затем экспрессия BDNF усиливается, и этот процесс обратим. На Фигуре 1с показано, что содержание белка BDNF, анализируемое методом ELISA, значительно увеличивалось с двумя транскриптами BDNF-AS, на которые нацелена киРНК, но не в случае рандомизированных киРНК или контрольной ненацеленной киРНК. Фигура 1d показывает уровень белка BDNF после введения различных киРНК, определенный методом ELISA или вестерн-блоттинга. На Фигуре 1е показано кратное изменение количества BDNF по сравнению с имитирующим контролем в зависимости от увеличивающихся концентраций олигонуклеотида (10-12-10-6 М).
Фигура 2 показывает, что увеличенная экспрессия BDNF приводит к увеличению разрастания нейронов.
Фигура 3 показывает, что BDNF-AS регулирует мРНК (матричную, синоним - информационную) и белка BDNF in vivo.
Фигура 4 показывает, что блокирование BDNF-AS in vivo вызывает увеличение выживаемости и пролиферации нейронов.
Фигура 5 показывает, что нокдаун BDNF-AS приводит к увеличению экспрессии мРНК.
Фигура 6 иллюстрирует пост-трансляционную регуляцию экспрессии BDNF.
Фигура 7 иллюстрирует ингибирование человеческого транскрипта BDNF-AS с помощью антагоNATs hBDNF.
Фигура 8 показывает ингибирование мышиного транскрипта BDNF-AS в клетках N2a с помощью AntagoNATs (aнтагоNATs).
На Фигуре 9 показано, что нокдаун BDNF-AS не меняет ни уровень TrkB, ни уровень соседних генов (Let7C и KIF18A) в обоих направлениях: Let7C и KIF18A представляют собой гены, расположенные в положении 3' в 5'-3' направлении и в положении 5' в 3'-5' направлении, соответственно.
Описание перечня последовательностей: нейротрофический фактор головного мозга Homo sapiens (BDNF), транскрипт, вариант 3, мРНК. (NCBI, номер доступа: NM_170735); SEQ ID NO: 2: нейротрофический фактор головного мозга мыши Mus museums (BDNF), транскрипт, вариант 1, мРНК (NCBI, номер доступа: NM_007540); SEQ ID NO: 3: антисмысловая последовательность природного BDNF (транскрипт, вариант BT1A; NR_033313.1); SEQ ID NO: 4: антисмысловая последовательность природного BDNF (транскрипт, вариант ВТ2А; NR_033314.1); SEQ ID NO: 5: антисмысловая последовательность природного BDNF (транскрипт, вариант ВТ1В; NR_033315.1); SEQ ID NO: 6: антисмысловая последовательность природного BDNF (транскрипт, вариант ВТ2В; NR_002832.2); SEQ ID NO: 7: антисмысловая последовательность природного BDNF (транскрипт, вариант ВТ1С; NR_033312.1); SEQ ID NO: 8: антисмысловая последовательность природного BDNF (BDNF-AS вариант); SEQ ID NO: 9: антисмысловая последовательность природного BDNF; SEQ ID NO: 10:: антисмысловая последовательность мышиного природного BDNF (мышиный BDNF-AS вариант 1); SEQ ID NO: 11: антисмысловая последовательность мышиного природного BDNF (мышиный BDNF-AS variant 2); SEQ ID NO: 12 to 55: антисмысловые олигонуклеотиды; SEQ ID NO: 56 to 59: обратный комплемент антисмысловых олигонуклеотидов 12-15, соответственно; SEQ ID NO: 60-64: обратный комплемент антисмысловых олигонуклеотидов 42-46, соответственно; SEQ ID NO: 65 и 66: последовательности для анализа. LNA (нуклеиновая кислота, закрытая через 2'-O, 4'-С метиленовый мостик): +А* или +Т* или +С* или +G*; 2'OM (2'-O-метил): mU* или mA* или mC* или mG*; PS (фосфоротиоатный мостик): Т* или А* или G* или с*; РНК: rU или rA или rG или rC.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Ниже описаны несколько аспектов данного изобретения со ссылкой на примеры осуществления изобретения для его иллюстрации. Следует отметить, что многочисленные конкретные детали, взаимосвязи и методы описаны для полного понимания изобретения. Однако для специалиста в данной области очевидно, что изобретение может быть осуществлено и без использования одной или более конкретных деталей или с помощью других методов. Данное изобретение не ограничено порядком действий или событий, так как некоторые действия могут происходить в другом порядке и/или совместно с другими действиями или событиями. Кроме того, не все описанные действия или события требуются для осуществления настоящего изобретения.
Все гены, названия генов и генные продукты, описанные в данной заявке, соответствуют гомологам любого вида, для которых применимы композиции и способы, описанные в данной заявке. Таким образом, эти термины включают, но без ограничения, гены и генные продукты из организмов людей и мышей. Следует иметь в виду, что когда описан ген или генный продукт из конкретных видов, это описание является только примером, и эти термины не следует интерпретировать как ограничение изобретения, если это явно не следует из контекста описания. Так, например, гены, описанные в данной заявке, которые согласно некоторым вариантам относятся к последовательностям нуклеиновой кислоты или аминокислоты человека, охватывают гомологичные и/или ортологичные гены и генные продукты из организмов других животных, включая, но без ограничения, других млекопитающих, рыб, амфибий, рептилий и птиц. Согласно одному из вариантов гены или последовательности нуклеиновых кислот являются человеческими.
Определения
Термины, используемые в данной заявке, используются с целью описания только конкретных вариантов изобретения и не ограничивают его. Термины, используемые здесь в единственном числе, включают и множественное число, если из контекста не следует иное. Далее, термины "включающий", "включает", "имеющий", "имеет", "с" и их варианты, которые используются или в подробном описании, или в формуле изобретения должны рассматриваться как включающие, в смысле, похожем на термин "содержащий". Термин "около" или "примерно" означает приемлемую ошибку для конкретной величины, определенной специалистом, которая частично зависит от того, каким образом измерена или определена эта величина, то есть ограничения измерительной системы. Например, термин "около" в уровне техники может означать одну или более чем одну единицу стандартного отклонения Альтернативно, термин "около" может означать интервал отклонения до 20%, предпочтительно, до 10%, более предпочтительно, до 5% и, наиболее предпочтительно, до 1% от данной величины. Или же, особенно по отношению к биологическим системам или процессам, этот термин может означать порядок величины, предпочтительно, 5-кратную и, более предпочтительно, 2-кратную величину. Когда в описании или в формуле изобретения данной заявки указаны конкретные величины, термин "около" означает, что нужно предполагать приемлемую ошибку в интервале этой конкретной величины.
Используемый в данной заявке термин "мРНК" означает известный(ые) в настоящее время транскрипт(ы) мРНК гена-мишени и любой другой транскрипт, который может быть выявлен.
Под "антисмысловым олигонуклеотидом" или "антисмысловым соединением" подразумевается молекула РНК или ДНК, которая связывается с другой РНК или ДНК (РНК, ДНК-мишени). Например, если это олигонуклеотид РНК, он связывается с другой РНК или ДНК путем взаимодействий РНК-РНК и изменяет активность РНК-мишени. Антисмысловой олигонуклеотид может приводить к повышающей или понижающей регуляции экспрессии и/или функции конкретного полинуклеотида. Это определение включает любую чужеродную молекулу РНК или ДНК, которая полезна с терапевтической, диагностической или другой точки зрения. Такие молекулы включают, например, молекулы антисмысловых РНК или ДНК, РНК-интерференцию (RNAi), микроРНК, РНК-приманку, киРНК, ферментативную РНК, терапевтически редактированную РНК и РНК - агонисты и антагонисты, антисмысловые олигомерные соединения, антисмысловые олигонуклеотиды, внешние вспомогательные последовательности, альтернативные сплайсеры, праймеры, зонды и другие олигомерные соединения, которые гибридизуются с по меньшей мере частью нуклеиновой кислоты-мишени. Как таковые, эти соединения могут вводиться в виде однонитевых, двунитевых, частично однонитевых или кольцевых олигомерных соединений.
В контексте данного изобретения термин "олигонуклеотид" относится к олигомеру или полимеру рибонуклеиновой кислоты (РНК) или дезоксирибонуклеиновой кислоты (ДНК) или к их миметикам. Термин "олигонуклеотид" включает также линейные или кольцевые олигомеры природных и/или модифицированных мономеров или соединений, включая дезоксирибонуклеозиды, рибонуклеозиды, замещенные или альфа-аномерные их формы, пептидо-нуклеиновые кислоты (ПНК), закрытые нуклеиновые кислоты (LNA), фосфоротиоаты, метилфосфонаты и т.п. Олигонуклеотиды способны специфически связываться с полинуклеотидом-мишенью при помощи мономер-мономерных взаимодействий на регулярной основе, таких как спаривание оснований по Уотсону-Крику, хугстиновское спаривание оснований или обратимое хугстиновское спаривание оснований или т.п.
Олигонуклеотид может быть "химерным", то есть состоящим из различных областей. В контексте данного изобретения "химерные" соединения представляют собой олигонуклеотиды, которые содержат две или более химических областей, например, области(ей) ДНК, области(ей) РНК, области(ей) ПНК и т.д. Каждая химическая область состоит из по меньшей мере одного мономерного звена, то есть нуклеотида в случае олигонуклеотидного соединения. Эти олигонуклеотиды обычно содержат по меньшей мере одну область, в которой олигонуклеотид модифицирован с целью придания одного или более желаемых свойств. Желаемые свойства олигонуклеотида включают, но без ограничения, например, повышенную стойкость к расщеплению нуклеазами, повышенное клеточное поглощение и/или повышенное сродство к связыванию для нуклеиновой кислоты-мишени. Поэтому различные области олигонуклеотида могут иметь разные свойства. Химерные олигонуклеотиды согласно данному изобретению могут быть образованы как смешанные структуры двух или более олигонуклеотидов, модифицированных олигонуклеотидов, олигонуклеозидов и/или аналогов олигонуклеотидов, описанных выше.
Олигонуклеотид может состоять из областей, которые могут быть связаны в "список", то есть мономеры связаны последовательно, как в природной ДНК, или связаны посредством спейсеров. Спейсеры образуют ковалентный "мостик" между областями и в предпочтительных случаях имеют длину, не превышающую 100 атомов углерода. Спейсеры могут содержать различные функциональности, например, иметь положительный или отрицательный заряды, обладать специфическими свойствами к связыванию нуклеиновой кислоты (интеркаляторы, связыватели бороздок, токсины, флуорофоры и т.д.), будучи липофильными, включая особые вторичные структуры, подобно, например, пептидам, содержащим аланин, которые индуцируют альфа-спирали.
Применяемый в данной заявке термин "BDNF" и "нейтрофический фактор головного мозга" включает все члены этого семейства, мутанты, аллели, фрагменты, молекулы, кодирующие и некодирующие последовательности, смысловые и антисмысловые нити полинуклеотидов и т.д.
Используемые в данной заявке термины "нейтрофический фактор головного мозга" и "BDNF" имеют то же значение, что и в литературе, и используются как взаимозаменяемые.
Применяемый в данной заявке термин "олигонуклеотид, специфический по отношению к" или "олигонуклеотид, который направлен (нацелен) на" относится к олигонуклеотиду, содержащему последовательность (i) способную к образованию стабильного комплекса с частью гена-мишени, или (ii) способную к образованию стабильного дуплекса с частью транскрипта мРНК гена-мишени. Стабильность комплексов и дуплексов может быть определена путем теоретических расчетов и/или анализов in vitro. Примеры методов анализа, пригодных для определения стабильности комплексов и дуплексов гибридизации описаны ниже в Примерах.
Применяемый в данной заявке термин "целевая нуклеиновая кислота (мишень)" охватывает ДНК, РНК (содержащие пре-мРНК и мРНК), транскрибированные из таких ДНК, и также кДНК, синтезированную из таких РНК, кодирующие, некодирующие последовательности, смысловые и антисмысловые полинуклеотиды. Специфичная гибридизация олигомерного соединения с его нуклеиновой кислотой-мишенью влияет на нормальную функцию нуклеиновой кислоты. Эту модуляцию функции целевой нуклеиновой кислоты соединениями, которые специфически гибридизуются с ней, обычно называют "антисенс-модуляцией". Функции РНК, которые модулируются, включают, но без ограничения, все жизненно важные функции, такие как, например, транслокацию РНК в место трансляции белка, трансляцию белка из РНК, сплайсинг РНК с получением одного или более видов мРНК и каталитическую активность, которая может быть повышена с помощью РНК. Общий эффект такого действия на функцию целевой нуклеиновой кислоты (мишени) состоит в модулировании экспрессии кодированного продукта или олигонуклеотидов.
РНК-интерференция "RNAi" опосредована молекулами двунитевой РНК (днРНК), которые имеют гомологию, специфичную по последовательности к последовательностям целевой нуклеиновой кислоты. Согласно некоторым вариантам данного изобретения медиаторы представляют собой дуплексы "короткой интерферирующей" РНК (киРНК) длиной 5-25 нуклеотидов. KhRNAs синтезируются путем процессинга днРНК в результате активности фермента РНазы (рибонуклеазы), известного как Dicer. Дуплексные продукты киРНК рекрутируются в мультибелок комплекса киРНК, называемый RISC (комплекс сайленсинга, индуцированный РНК). Не основываясь на какой-либо теории, полагают, что RISC затем направляется в целевую нуклеиновую кислоту (обычно мРНК), где дуплекс киРНК взаимодействует специфически по последовательности, опосредуя расщепление каталитическим образом. Затем короткие интерферирующие РНК, которые могут быть использованы в соответствии с данным изобретением, могут быть синтезированы и применены согласно методикам, хорошо известным из уровня техники и знакомым специалистам в данной области. Короткие интерферирующие РНК, которые могут быть использованы в соответствии с данным изобретением, обычно содержат от примерно 1 до примерно 50 нуклеотидных звеньев (nt). В Примерах согласно неограничивающим вариантам киРНК могут содержать от примерно 5 до примерно 40 nt, от примерно 5 до примерно 30 nt, от примерно 10 до примерно 30 nt, от примерно 15 до примерно 25 nt или примерно 20-25 нуклеотидов.
Выбор подходящих олигонуклеотидов облегчается с помощью компьютерных программ, которые автоматически выравнивают последовательности нуклеиновых кислот и выявляют области идентичности или гомологии. Такие программы применяются для сравнения полученных последовательностей нуклеиновых кислот, например, путем поиска в базах данных, таких как GenBank, или путем секвенирования продуктов ПЦР. Сравнение последовательностей нуклеиновых кислот различных видов позволяет выбрать последовательности, которые проявляют соответствующую степень идентичности между видами. В случае генов, которые не были секвенированы, осуществляли саузерн-блоттинг для определения степени идентичности между генами в целевых видах и других видах. Проводя саузерн-блоттинг в строгих условиях, как хорошо известно из уровня техники, можно получать приблизительную меру идентичности. Эти методы позволяют осуществить выбор олигонуклеотидов, которые обладают высокой степенью комплементарности к последовательностям целевых нуклеиновых кислот у субъекта, которого нужно контролировать, и низкой степенью комплементарности к последовательностям других нуклеиновых кислот. Специалисту в данной области очевидно, что имеется значительный выбор при отборе соответствующих областей генов, которые применяются в данном изобретении.
Под "ферментативной РНК" понимают молекулу РНК с ферментативной активностью (Cech, (1988) J. American. Med. Assoc. 260, 3030-3035). Ферментативные нуклеиновые кислоты (рибозимы) действуют путем первоначального связывания с целевой РНК. Такое связывание происходит через направленную связывающую часть ферментативной нуклеиновой кислоты, которая находится вблизи ферментативной части молекулы, которая расщепляет целевую РНК. Таким образом, ферментативная нуклеиновая кислота первая распознает и затем связывает целевую РНК через спаривание оснований и, будучи связанной с нужным сайтом, действует как фермент, расщепляя целевую РНК.
Под "РНК-приманкой" понимают молекулу РНК, которая имитирует природный связывающий домен для лиганда. Следовательно, РНК-приманка конкурирует с природной мишенью при связывании специфического лиганда. Например, было показано, что при чрезмерной экспрессии транс-активирующего ответа (TAR) ВИЧ РНк может действовать как "приманка" и эффективно связывать белок вируса Тат ВИЧ, тем самым предотвращая его связывание с последовательностями TAR, кодированными в РНК ВИЧ. Это является конкретным примером. Специалистам в данной области является очевидным, что это пример не единственный и могут быть реализованы другие варианты при помощи известных из уровня техники методов.
Применяемый в данной заявке термин "мономер" обычно обозначает мономеры, связанные фосфодиэфирными мостиками или их аналогами с образованием олигонуклеотидов, размер которых может быть в пределах от нескольких мономерных единиц, например, от примерно 3-4 до примерно нескольких сотен мономерных единиц. Аналоги фосфодиэфирных мостиков включают фосфоротиоатные, фосфородитиоатные, метилфосфонатные, фосфороселеноатные, фосфоамидатные мостики и т.п., что более подробно будет описано ниже.
Термин "нуклеотид" охватывает нуклеотиды природного происхождения, а также неприродные нуклеотиды. Специалистам в данной области очевидно, что различные нуклеотиды, которые ранее рассматривались как неприродные, затем были обнаружены в природе. Так, термин "нуклеотиды" включает не только известные молекулы, содержащие пуриновые и пиримидиновые гетероциклы, но также их гетероциклические аналоги и таутомеры. Примерами других типов нуклеотидов являются молекулы, содержащие аденин, гуанин, тимин, цитозин, урацил, пурин, ксантин, диаминопурин, 8-оксо-N6-метиладенин, 7-деазаксантин, 7-деазагуанин, N4-этанцитозин, N6,N6-этан-2,6-диаминопурин, 5-метилцитозин, 5-(С3-С6)-алкинилцитозин, 5-фторурацил, 5-бромурацил, псевдоизоцитозин, 2-гидрокси-5-метил-4-триазолпиридин, изоцитозин, изогуанин, инозин и "неприродные" нуклеотиды, которые описаны в патенте США на имя Benner et al. №5,432,272. Термин "нуклеотид" охватывает каждый и все из этих примеров, а также их аналоги и таутомеры. Особенно интересными являются те нуклеотиды, которые содержат адениновые, гуаниновые, тиминовые, цитозиновые и урациловые звенья, которые считаются нуклеотидами природного происхождения при их применении для лечения и профилактики заболеваний у людей. Нуклеотиды включают природные 2'-дезокси- и 2'-гидрокси-сахара, например, описанные в публикации Kornberg and Baker, DNA Replication, 2nd Ed. (Freeman, San Francisco, 1992), а также их аналоги.
Термин "аналоги" по отношению к нуклеотидам включает синтетические нуклеотиды, содержащие модифицированные фрагменты оснований и/или модифицированные фрагменты сахаров (см. например, нуклеотиды, описанные Scheit, Nucleotide Analogs, John Wiley, New York, 1980; Freier & Altmann, (1997) Nucl. Acid. Res., 25(22), 4429-4443, Toulmé, J.J., (2001) Nature Biotechnology 19: 17-18; Manoharan M., (1999) Biochemica et Biophysica Acta 1489: 117-139; Freier S. M., (1997) Nucleic Acid Research, 25: 4429-4443, Uhlman, E., (2000) Drug Discovery & Development, 3: 203-213, Herdewin P., (2000) Antisense & Nucleic Acid Drug Dev., 10: 297-310); 2'-O, 3`-C-linked [3.2.0] bicycloarabinonucleosides. Такие аналоги включают синтетические нуклеотиды, сконструированные для улучшения способности нуклеотида к связыванию, например, стабильности дуплекса или триплекса, специфичности и т.п.
Применяемый в данной заявке термин "гибридизация" означает соединение комплементарных цепочек олигомерных соединений. Один механизм соединения включает образование водородных связей, которыми могут быть водородные связи Уотсона-Крика, связи Хугстена и обратные водородные связи Хугстена, между комплементарным нуклеозидом или нуклеозидными основаниями (нуклеотидами) цепочек олигомерных соединений. Например, аденин и тимин представляют собой комплементарные нуклеотиды, которые соединяются (спариваются) путем образования водородных связей. Гибридизация может происходить в различных условиях.
Антисмысловое соединение является "специфически гибридизуемым", когда связывание соединения с целевой нуклеиновой кислотой вмешивается в нормальное функционирование целевой нуклеиновой кислоты, вызывая модуляцию этой функции и/или активности и имеется значительная степень комплементарности, чтобы избежать неспецифического связывания антисмыслового соединения с последовательностями нецелевой нуклеиновой кислоты в условиях, когда желательно специфическое связывание, например, в физиологических условиях в случае анализа in vivo или при терапевтическом лечении и в условиях, в которых проводят in vitro анализы.
Применяемое в данной заявке выражение "строгие условия гидридизации" или "строгие условия" относится к условиям, при которых соединение по изобретению будет гибридизоваться с целевой последовательностью, но с минимальным количеством других последовательностей. Строгие условия зависят от вида последовательности и будут разными в различных обстоятельствах, и в контексте данного изобретения "строгие условия", при которых олигомерные соединения гибридизуются с целевой последовательностью, определяются природой и составом олигомерных соединений и видами их анализов. В общем, строгие условия гибридизации включают низкие концентрации (<0.15 М) солей с неорганическими катионами, такими как Na+ или K+ (то есть с низкой ионной силой), и температуру выше 20°С-25°С, но ниже Tm (температуры плавления) комплекса соединение: целевая последовательность, и наличие денатурирующего агента, такого как формамид, диметилформамид, диметилсульфоксид, или поверхностно-активного вещества додецилсульфата натрия (SDS). Например, скорость гибридизации уменьшается на 1.1% с каждым добавлением 1% формамида. Одним из примеров строгих условий гибридизации является применение 0.1 X буферного раствора хлорид натрия-цитрат натрия (SSC)/0.1% (вес/об) SDS при температуре 60°С в течение 30 минут.
Термин "комплементарный", используемый в данной заявке, относится к способности к точному спариванию между двумя нуклеотидами в одной или двух олигомерных цепях. Например, если нуклеооснование в некотором положении антисмыслового соединения способно к связыванию водородными связями с нуклеооснованием в некотором положении целевой нуклеиновой кислоты, причем указанная целевая нуклеиновая кислота является ДНК, РНК или олигонуклеотидом, тогда положение водородной связи между олигонуклеотидом и целевой нуклеиновой кислотой рассматривается как комплементарное положение. Олигомерное соединение и другие ДНК, РНК или олигонуклеотид комплементарны друг другу, когда достаточное количество комплементарных положений в каждой молекуле занято нуклеотидами, которые могут связываться водородными связями друг с другом. Таким образом, термины "специфически гибридизуемый" и "комплементарный" применяются для указания достаточной степени точного спаривания или комплементарности для достаточного количества нуклеотидов таким образом, что образуется стабильное и специфическое связывание между олигомерным соединением и целевой нуклеиновой кислотой.
Из уровня техники известно, что последовательность олигомерного соединения не должна быть на 100% комплементарна последовательности его целевой нуклеиновой кислоты, чтобы считаться специфически гибридизуемой. Более того, олигонуклеотид может гибридизоваться с одним или более сегментами, при этом интроны или соседние сегменты не участвуют в гибридизации (например, структура петли, ошибочное спаривание оснований или шпилькообразная структура). Олигомерные соединения согласно данному изобретению имеют по меньшей мере примерно 70%, или по меньшей мере 75%, или по меньшей мере 80%, или по меньшей мере 85%, или по меньшей мере 90%, или по меньшей мере 95%, или по меньшей мере 99%-ную комплементарность последовательности с целевой областью в целевой нуклеиновой кислоте, на которую они направлены (нацелены). Например, антисмысловое соединение, в котором 18 из 20 нуклеотидов антисмыслового соединения являются комплементарными целевой области, и, следовательно, будут гибридизоваться, будет иметь 90% комплементарность. В этом примере остающиеся некомплементарные нуклеотиды могут входить в состав кластера или рассеиваться вместе с комплементарными нуклеотидами и не должны быть смежными друг другу или комплементарным нуклеотидам. Как таковое, антисмысловое соединение длиной 18 нуклеотидов, содержащее 4 (четыре) некомплементарных нуклеотида, которые фланкированы двумя областями с полной комплементарностью к целевой нуклеиновой кислоте, будет иметь 77.8% полную комплементарность к целевой нуклеиновой кислоте и поэтому будет входить в объем настоящего изобретения. Степень комплементарности антисмыслового соединения к области целевой нуклеиновой кислоты может быть определена стандартными методами с применением компьютерной программы BLAST (основной инструмент поиска локальных выравниваний) и программ PowerBLAST, известных из уровня техники. Степень гомологии, идентичность последовательностей или комплементарность могут быть определены, например, с помощью программы Gap (Wisconsin Sequence Analysis Package, Version 8 for Unix, Genetics Computer Group, University Research Park, Madison Wis.), с применением параметров по умолчанию, которая использует алгоритм Смита и Уотермана (Adv. Appl. Math., (1981) 2, 482-489).
Термин "температура плавления", используемый в данной заявке, относится к температуре при определенной ионной силе, величине рН и концентрации нуклеиновой кислоты, при которой 50% олигонуклеотидов комплементарных к целевой последовательности, гибридизуется с целевой нуклеиновой кислотой в равновесном состоянии. Обычно строгие условия будут такими, при которых концентрация соли равна по меньшей мере примерно 0.01-1.0 М иона натрия (или других солей) при рН 7.0-8.3 и температура равна по меньшей мере примерно 30°С для коротких олигонуклеотидов (например, от 10 до 50 звеньев нуклеотидов). Строгие условия могут быть достигнуты путем добавления дестабилизирующих агентов, таких как формамид.
Термин "модуляция", используемый в данной заявке, означает или повышение (стимуляцию), или сн