Микробиома языка как прогностическая модель для определения обсеменённости кариесогенными бактериями streptococcus mutans твёрдых тканей зубов у детей раннего возраста
Иллюстрации
Показать всеИзобретение относится к области медицины - стоматология/детская стоматология и микробиология/бактериология, и может быть использовано для определения титра кариесогенных бактерий S. mutans в зубном налете на модели микробиома языка у детей раннего возраста. Способ определения обсемененности кариесогенными бактериями Streptococcus mutans твердых тканей зубов у детей раннего возраста включает забор биоматериала со всей поверхности слизистой оболочки средней трети спинки языка стерильным тупфером, далее биоматериал наносят на стандартные тест-полоски «Dentocult SM Strip Mutans» с квадратным концом и шероховатой поверхностью, помещают их в селективную питательную среду для кариесогенных стрептококков, после инкубации оценивают степень колонизации стрептококками микробиомы слизистой оболочки спинки языка, относя их количество к классам от 0 до 3, соответственно от КОЕ<104/мл до КОЕ>106/мл, после отнесения к классу обсемененности S. mutans микробиомы языка, определяют обсемененность ими биотопа язычной поверхности молочных зубов, учитывая, что количество/плотность/обсемененность/титр S. mutans в микробиоме языка статистически достоверно соответствует титру Streptococcus mutans в зубном налете язычной поверхности молочных зубов. 5 ил., 1 табл., 5 пр.
Реферат
Изобретение относится к области медицины - стоматология/детская стоматология и микробиология/бактериология и может быть использовано для определения титра кариесогенных бактерий Streptococcus mutans в зубном налете на модели микробиома языка у детей раннего возраста.
Акселерация физического развития детей приводит к раннему прорезыванию как временных, так и постоянных зубов. Эмаль зубов «не успевает» насытиться макро- и микроэлементами, и после прорезывания зубы, находящиеся на стадии структурно-функциональной незрелости, сильно подвержены агрессивному воздействию кариесогенных факторов (Кисельникова Л.П., Зуева Т.Е., Кружалова О.А. Кариес временных зубов у детей раннего возраста: обоснование этиопатогенетических подходов к профилактическому лечению // Стоматология детского возраста и профилактика. 2000. №2. С. 19-22; Корчагина В. В. Лечение кариеса зубов у детей раннего возраста. М.: МЕДпресс-информ. 2008. 95 с.). В связи с тем, что восприимчивость эмали к воздействию кислот в период незавершенной минерализации является наибольшей, в первые 2-3 года после прорезывания отмечается высокая распространенность очаговой деминерализации, вероятность возникновения которой возрастает при недостаточном гигиеническом уходе за полостью рта и потреблении большого количества углеводов (Корчагина В.В. Лечение кариеса зубов у детей раннего возраста. М.: МЕДпресс-информ. 2008. 95 с.; Кузьмина Э.М. Профилактика основных стоматологических заболеваний. М.: Медицина, 1997. 45 с.; Kaste L.М., Drury Т.F., Horowitz А.М., Beltran Е. An evaluation of NHANES III estimates of early childhood caries. J Public Health Dent 1999; 59:198-200; Berkowitz RJ. Cause, treatment and prevention of early childhood caries. J Can Dent Assoc. 2003; 69:304-7).
Период физиологического созревания, то есть минерализация эмали занимает более 2-х лет, и на протяжении всего периода минерального созревания, особенно в течение первого года после прорезывания, зубы ребенка нуждаются в бережном и эффективном уходе (Харитонова Т.Л., Лебедева С.Н., Казакова Л.Н. Ранняя профилактика кариеса зубов у детей // Саратовский научно-мед. журнал. 2011. Т. 7, №1 приложение. С. 260-262).
При кариесе раннего детского возраста временные зубы поражаются практически сразу после их прорезывания. Первые кариозные поражения обычно обнаруживаются на вестибулярной поверхности резцов верхней челюсти в пришеечной области в виде участков меловидного цвета. Кариозный процесс характеризуется быстротой течения, распространением в ширину, множественным поражением зубов в порядке их прорезывания, кроме резцов нижней челюсти. Редкое поражение нижних резцов при данной патологии объясняется лучшими возможностями самоочищения из-за положения языка и обильного омывания слюной (Кузьмина Э.М. Профилактика стоматологических заболеваний. М.: Медицина. 2001. 32 с.).
Накопление на поверхности зубов мягкого бактериального налета мешает процессу физиологического созревания эмали временных зубов, так как препятствует поступлению из слюны макро- и микроэлементов. Микроорганизмы зубного налета являются ключевым этиологическим фактором развития кариозного процесса. Бактерии в биопленке всегда метаболически активны, вызывая колебания в рН слюны, они производят органические кислоты, воздействуя на незрелую эмаль прогрессируя кариес зубов у детей раннего возраста (Seow KW. Biological mechanisms of early childhood caries. Community Dent Oral Epidemiol. 1998; 26 (1 Suppl): 8-27).
Чем раньше выявлены, устранены или ослаблены факторы риска, тем меньший прирост кариеса отмечается у детей. Профилактика кариеса зубов у детей является залогом стоматологического здоровья на всю жизнь. Сохранение здоровых временных зубов до физиологической смены позволит избежать многих проблем с постоянными зубами в будущем.
Многими авторами отмечено, что меры, направленные на снижение уровня кариеса у детей, заключающиеся в ранней профилактике и лечении, распространенность и тяжесть кариозного процесса в различных регионах нашей страны до сих пор остается на высоком уровне (Кисельникова Л.П., Токарева А.В. Кариес раннего детского возраста и его осложнения. 9-th Congress of the European Academy of Pediatric Dentistry, Croatia, Dubrovnik, may 29 - june 1, 2008, p. - 107.; Скрипкина Г.И., Смирнов С.И. Модель развития кариозного процесса у детей // Стоматология детского возраста и профилактика.-2012. - №3. - С. 3-7.). При этом практически в 2,5-3 раза увеличилось поражаемость кариесом именно молочных зубов среди детей раннего и дошкольного возраста (Харитонова Т.Л., Лебедева С.Н., Казакова Л.Н. Ранняя профилактика кариеса зубов у детей // Саратовский научно-медицинский журнал. - 2011. Том 7 - №1. Приложение. С. 260.; Шаковец Н.В. и др. Факторы риска возникновения раннего детского кариеса по результатам трех стран // Стоматология детского возраста и профилактика стоматологических заболеваний: Сб. трудов VII научно-практической конференции с международным участием /Москва, 16 мая 2011 года под редакцией проф. Кисельниковой Л.П., Дроботько Л.Н. - С. 213-215.). По данным зарубежных авторов, наибольший рост распространенности и интенсивности кариеса наблюдается в возрастной категории от 2 до 5 лет (Borutta A., Wagner М., Kneist S. Early Childhood Caries: A Multi-Factorial Disease// OHDMBSC; Splieth С.H., Treuner A., Berndt C. Oral health in toddlers. und Gesundheits derung. 2009; 4. - P. 119-123).
Кариес - инфекционное заболевание, не угрожающее жизни ребенка, но значительно влияющее на функциональные свойства и рост организма, снижающее качество жизни (American Academy of Pediatric Dentistry. Symposium on the prevention of oral disease in children and adolescents. Chicago, I11, November 11-12, 2005: Conference papers. Pediatr Dent 2006; 28(2); 196-198).
В связи с высокой распространенностью данной патологии, в зарубежной литературе предложен специальный термин: ранний детский кариес «Early Childhood Caries», характеризующий наличие одной или более кариозной, удаленной по поводу осложненного кариеса или запломбированной поверхности в любом временном зубе у детей в возрасте 71 месяца и ранее (Milnes A.R. Description and epidemiology of nursing caries. J Public Health Dent 1996; 56:38-50; Tinanoff N, Kaste L M, Corbin SB. Early childhood caries : positive beginning. Comm Dent Oral Epidemiol 1998; 117-119). Кариес раннего возраста уже давно признан клиническим синдромом, описанный Belterami в 1930-е годы как "Les dents noire de tout-petits / "черные зубы самых маленьких" (Belterami G. Les dents noires de tout-petits. In Belterami G (ed). La infantile. Marseille: Leconte 1952).
Для такого многофакторного заболевания как ранний детский кариес, проведение шаблонных профилактических мероприятий не дает возможности надеяться на высокий конечный результат, необходимо искать иные, современные подходы к профилактике кариеса зубов и требует обязательного определение индивидуальной предрасположенности человека к этому заболеванию (Пузикова О.Ю., Омск, 1999). Наряду с массовыми профилактическими мероприятиями, проводится индивидуализированная профилактика, базирующаяся на донозологической диагностике и прогнозировании заболеваний челюсто-лицевой области (Laurisch L., ZWR., 1990; Мельник А.И. автореф. дис.1991; Li Y., W. Wang J. Dent. Res., 2002; M. Fontana et al., J. Dent. Res., 2011). Анализируя вышесказанное, актуален вопрос диагностики риска развития раннего детского кариеса в процессе комплексного анализа наиболее значимых клинических и субклинических параметров и разработка индивидуальных подходов к лечебно-профилактическим методам коррекции.
На сегодняшний день доказана ведущая роль микрофлоры в возникновении кариеса зубов (Кнайст С., Маслак Е., Царе Р., Берзина С., Скривеле С., Терехова Т., Шаковец Н., Вагнер М., де Мура - Зибер В., де Мура Р., Берутта А. Биологические и социальные факторы риска возникновения раннего детского кариеса // Современная стоматология. -2011. - №1. - С. 62-65).
Зубной налет, благодаря скоплению микроорганизмов, способен превращать углеводы, поступающие с пищей, в кислоту и приводить к образованию очага деминерализации эмали и последующему формированию кариозной полости. Уже через 6 часов после тщательной чистки зубов можно определить наличие бляшки, которая быстро образуется при употреблении мягкой пищи и липких углеводов. Сахароза ускоряет образование бляшки и является наиболее значимым агрессивным фактором, так как преобразует некариесогенные/ anticariogenic продукты в кариесогенные, способствует увеличению пропорции Streptococcus mutans и лактобактерий, одновременно снижая уровень Streptococcus sanguini (Douglass J.M. Response to Tinan off and Palmer: Dietary determinants of dental caries and dietary recommendations for preschool children. J Public Health Dent 2000; 60(3):207-209; Paes Leme, H. Koo, С.M. Bellato, G. Bedi, and J.A. Cury. The Role of Sucrose in Cariogenic Dental Biofilm Formation- New Insight. J Dent Res 2006, 85(10):878-887).
Быстрый рост бляшки отмечается во время сна, максимальное образование ее осуществляется через 30 дней. Бляшке принадлежит основная роль в активации жизнедеятельности микробов, создающих условия для кислотообразования, ферментативной деятельности и других процессов и продуктов метаболизма (Е.В. Боровский, В.К. Леонтьев, Биология полости рта. М. Медицина, 1991. 304 с.; Грохольский А. П. Кодола Н.А., Центило Т. Назубные отложения: их влияние на зубы, околозубные ткани и организм, Киев: Здоровья, 2000. 160 с.; Левицкий А.П., И.К. Мизина. Зубной налет, 2-е изд., Киев. Здоровья, 1987. 80 с.; Леонтьев В.К., В.Т. Шестаков, Оценка основных направлений развития стоматологии, М.: Мед. книга, 2007. 279 с.; Соловьева А.М. рН зубной бляшки и роль слюны в ее нормализации. Новое в стоматологии. 2000. - №3 (94). С. 33-39).
Микрофлора, населяющая организм человека, в биотопе может находиться либо в свободном состоянии, либо в связанном, формируя биопленку. Нефиксированная/планктонная микрофлора слущивается с поверхности биопленки и выбрасывается во внешнюю среду с выделениями человека, например, со слюной, с испражнениями. Микрофлора, формирующая биопленку, закрывает рецепторы от внешнего посягательства, тогда как свободно живущие микроорганизмы через свои продукты метаболизма вступают в конкурентные взаимодействия с чужеродной микрофлорой (Costerton J.W., Stewart P.S., Greenberg Е.Р. Bacterial biofilms: a common cause of persistent infections // Science. -1999. - №284. - C. 1318-1322).
Биопленка - особая форма организации микрофлоры в организме человека. Она представляет собой хорошо взаимодействующее сообщество микроорганизмов, состоящее из бактерий одного или нескольких видов, занимающих чувствительные рецепторы в макроорганизме и колонизирующие на них, а также отделенных от внешней среды структурой, являющейся производной продуктов жизнедеятельности микроорганизмов и клеток тканей, на которых они адгезируют. Согласно концептуальной модели зубной биопленки по Jill S. Nield-Gehrig (2003) она состоит из бактерий; микроколоний, агрегатов микроколоний бактерий, экстрацеллюлярного полисахаридного матрикса EPS-субстанции, эпителиоцитов, компонентов слюны и пищи, клеток крови. Биопленка, ассоциируемая с состоянием здоровья зубов и пародонта / Health-associated dental plaque. Микробиологический портрет здоровой биопленки представлен: S. sanguinis, S. mitis, S. orates, S. salivarium, Veillonella, Actinomycetaceae, Haemophilus, Bacteroides. Биопленка, ассоциируемая с кариесом, пародонтитом, периимплантитом / Disease-associated dental plaque представлена нарушением микробного гомеостаза: доминирование ацидогенных и ацидотолерантных Streptococci spp. и Lactobacillus spp., утрата доминантных позиций основной симбионтной и увеличение представительства транзиторной микрофлоры (О.С. Гилева, Г. Масис, материалы конферен. «Опережая будущее», М. Эндодонтия today, 2012 г.).
Специальные исследования показали, что в биопленке по-иному, в сравнении с чистыми культурами бактерий, происходят их многочисленные физиолого-биологические процессы (O'Toole G.A., Kaplan Н.В., Kolter R. Biofilm formation as microbial development // Annu. Rev. Microbiol. - 2000. - №54. P. 49-79). Сообщество организует единую генетическую систему, устанавливающую поведенческие формы для членов биопленки, определяющую их пищевые/трофические, энергетические и другие связи между собой и внешним миром (Slots J, Jorgensen М.G.: Effective, safe, practical and affordable periodontal therapy: where are we going, and are we there yet? Periodontology 2002). Последнее получило специальное название: «социальное поведение микроорганизмов» - «quorum sensuum» (Бабин В.Н., Домарадский И.В. Биохимические и молекулярные аспекты симбиоза человека и его микрофлоры // электрон. версия Росс, химического журнала. - 2006. - №6.., Гинцбург А.Л., Ильина Т.С., Романова Ю.М. «Quorum sensing» или социальное поведение бактерий // ЖМЭИ - 2003. - №5. - С. 86-93).
Патогенные бактерии не проявляют агрессивности против организма хозяина до тех пор, пока степень их вирулентности не достигает необходимого уровня, чтобы эффективно преодолеть защиту организма хозяина. In vitro резистентность биопленки антибиотикам в 500-1000 раз превышает аналогичную способность отдельных колоний бактерий (Allais G. Биопленка полости рта, Новое в стоматологии. 2006).
Среди микрофлоры, заселяющей разные экологические ниши организма человека, выделяют индигенную/аутохтонную микрофлору и заносную, то есть привнесенную в организм извне (Бондаренко В.М. Микрофлора человека: норма и патология // электронная версия научно-информационного журнала «Наука в России». - 2007. - №1, Осипов Г.М.
Невидимый орган - микрофлора человека. М., 2008). Состав индигенной микрофлоры определяют характеристические виды микроорганизмов, число которых невелико, но концентрация всегда значимо выражена. Частота обнаружения S. mutans, S. salivarius, S. mitis в слюне и зубодесневых карманах составляет 100,0% случаев, а концентрация каждого из них достигает 105-108 в 1 мл. слюны (Боровский Е.В., Леонтьев В.К. Биология полости рта. - М.: Медицинская книга, 2001. - 304 с.).
Именно характеристические группы микроорганизмов определяют механизмы формирования стабильности в биотопе. Для них было принято определение «базовая симбиотическая единица», т.е. то наименьшее число видов, которое способно совместно существовать в конкурентных условиях и при котором ни один из них не смог бы выжить самостоятельно в данных условиях внешней среды (Шендеров Б.А. Медицинская микробная экология и функциональное питание: в 3 т. Т. 1. Микрофлора человека и животных и ее функции. - М.: ГРАНТЪ, 1998. - 288 с.).
Наиболее сложными по составу являются микробиоценозы полости рта, носоглотки и толстой кишки (Янковский Д.С. Состав и функции микробиоценозов различных биотопов человека // электронная версия всеукраинского научно-практич. журнала «Здоровье женщины». - Киев, 2003. - Т. 16, №4). Более простыми являются микробиоценозы кожи и носовых ходов (Шендеров Б.А. Медицинская микробная экология и функциональное питание: в 3 т. Т. 1. Микрофлора человека и животных и ее функции. - М.: ГРАНТЪ, 1998 - 288 с., Янковский Д. С.Состав и функции микробиоценозов различных биотопов человека // электронная версия всеукраинского научно-практич. журнала «Здоровье женщины». - Киев, 2003. - Т. 16, №4).
Колонии бактерий обладают свойством адгезии к органическим структурам и образуют налет, который совсем недавно называли бактериальной бляшкой. (Asikainen S, Chen С: Oral ecology and person to person transmission of Aa and Pg. Periodontology 2000, Rateischak K.H., Wolf H.F.: Parodontologie. 2. Aufl. Thieme 1989). В современной трактовке бактериальный налет также называют «биопленкой, которая является специализированной бактериальной экосистемой, обеспечивающей жизнеспособность и сохранение составляющих ее видов микроорганизмов и увеличение общей популяции» (Caufield P.W., Cutter G.R., Dasanayake А.Р.: Initial a cquisition of mutans streptococci by infants: evidence for a discrete window of infectivity. J DentRes 1993, Леус П.А. Коммунальная стоматология, 2000). Бактерии могут прилипать к разным поверхностям полости рта, включая покрытые пленкой слюны поверхности зубов, эпителия щек, десен и языка, и в дальнейшем колонизировать их. Если эти поверхности уже колонизированы, особое значение приобретает способность бактерий разных видов прилипать друг к другу в процессе коадгезии. Такое взаимодействие между бактериями приводит к образованию гетерогенных по составу биопленок и формированию пищевых взаимоотношений между микробами.
Большинство из оральных стрептококков, заселяющих различные биотопы верхних дыхательных путей и ротовой полости, относятся к зеленящим стрептококкам. Они не содержат в клеточной стенке группоспецифичных углеводов / С-полисахаридов и поэтому не включены в серологическую классификацию (Р. Лэнсфилд, 1933). Различные виды оральных стрептококков избирательно колонизируют определенные участки: S.mitior - буккальные эпителиоциты слизистой оболочки; S. mutans - эмаль зубов. Численность оральных стрептококков, подверженных существенным изменениям, как и в микробиоценозе кишечника, является информативным показателем и отражает степень гомеостатических нарушений (Разживин, А.П. Дисбиотические состояния у детей: клиника, диагностика и лечение учебное пособие. Н. Новгород: НГМА. - 1999. - 123 с.).
Микрофлора - важнейшая структурно-составная часть многокомпонентной системы полости рта, индикатор стоматологического и системного здоровья, состояния окружающей среды (О.С. Гилева, материалы конферен. «Опережая будущее», Г. Масис, М. Эндодонтия today, 2012 г.). Нормальная флора полости рта принимает участие в формировании зубной бляшки или зубного налета. На основе данных многочисленных исследований, по составу микрофлоры, бляшка характеризуется выраженной гетерогенностью.
Известно, что более 800 видов изученных микроорганизмов населяют полость рта здорового человека, сохраняя экосистему и не нарушая гомеостаз (Slavkin, 1999, Чайковская И.В., 2002, Зеленова Е.Г. и др., 2004, Тец В.В., 2008). В возникновении и развитии кариеса особую роль играют грамположительные стрептококки вида Streptococcus mutans, инициирующие формирование зубного налета как биологической пленки на поверхности зуба, обеспечивающих за счет коадгезии и накопления других представителей патогенной флоры (Кузнецов Е.А., Царев В.Н. и др., 1996; Burt and Pai 2001, Berkowitz, Чайковская И.В., 2002, R.J. Causes, 2003, Тец В.В., 2008, Скрипкина Г.И., 2014). Гипотеза о роли стрептококков в развитии кариеса была принята в США для практического руководства с 1960 года после исследований, проводившихся в стране с 40-х годов XX века (Shafer W.G., A textbook of oral pathology, 1974)
Стрептококки составляют значительную долю микрофлоры зубной бляшки, до 80% от общего количества микроорганизмов полости рта (Максимовский Ю.М. и др., 2009), что соответствует данным зарубежных авторов, отмечающие наличие кислотообразующих стрептококков в 86% (Weiilherell I.A. Composition of dental enamel // Brit. Med. Bull. 1975. - Vol. 31, №2. - P. 1415-1420). Наиболее важным фактором вирулентности Streptococcus mutans является их процветание в кислой среде (Овруцкий Г.Д., Леонтьев В.К., 2010). Осуществляя метаболизм углеводов, S. mutans интенсивно продуцируют молочную кислоту, во много раз быстрее, чем другие микроорганизмы мягкого зубного налета. Каждый прием сахара вызывает в полости рта «метаболический взрыв» (Леонтьев В.К., Пахомов Г.Н. Профилактика стоматологических заболеваний. М. 2006 - 416 с.). Эти свойства позволяют стрептококкам первыми заселять различные биотопы полости рта ребенка (В.С. Крамарь с соавт., 1992). Основными биотопами полости рта являются слизистые оболочки, спинка языка, десневая борозда, ротовая жидкость и зубной налет (Зеленова Е.Г. Заславская М.И., Салина Е.В., Рассанов СП. Микрофлора полости рта: норма и патология: Учебное пособие. - Н. Новгород: Изд. НГМА, 2004. - 158 с.). S. mutans избирательно адсорбируется на твердой поверхности зубов. По обсемененности стрептококками отдельных биотопов имеются разноречивые данные (Зеленова Е.Г. и др., 2004, Скрипкина Г.И., 2014).
Ранее считали, что инфицирование ребенка Streptococcus mutans происходит между 19 и 31 месяцами, в так называемое дискретное окно инфекции (Caufield P.W., Cutter G.R., Dasanayake А.P.: Initial a cquisition of mutans streptococci by infants: evidence for a discrete window of infectivity. J DentRes 1993). Но в настоящее время доказано, что инфицирование кариесогенными видами S. mutans и их колонизация в бороздках языка, возможны еще до прорезывания зубов (Berkowitz 2003), что подтверждает передачу Streptococcus mutans от матери к ребенку (Кузьмина Э.М. Профилактика стоматологических заболеваний: учебное пособие. Москва, 2001; Кузьмина Э.М. Профилактика кариеса зубов как важнейший аспект сохранения стоматологического здоровья детей. // Рос. педиатр. Журн. - 2006. - №6). В тоже время Tanzer пишет, что для колонизации Streptococcus mutans необходимы твердые поверхности, о чем свидетельствует быстрое появление S. mutans у младенцев до прорезывания зубов, когда для исправления заячьей губы используются обтураторы (Tanzer, Livingston et al, 2001). Исследования, проведенные (Thorhild I, Lindau-Johnson B, Twetman S, 2002, Berkowitz, 2003, Шаковец H.В., 2009, Caufield, Ratanapridakul et al, 1988, Loveren, Buijsetal, 2000; Кузьмина Э.M., И.И. Лысенкова, Профилактика кариеса зубов как важнейший аспект сохранения стоматологического здоровья детей, // Рос. педиатр. Журн. -2006. - №6; Кисельникова Л.П. Индивидуальная профилактика кариеса у детей школьного возраста/Клинич. Стоматология. - 2006).) подтвердили также горизонтальный путь передачи кариесогенных стрептококков: дети, посещающие один детский сад, имеют идентичные штаммы бактерий в слюне (Berkowitz, 2003), и дети, которые находятся на домашнем воспитании, имеют идентичные штаммы стрептококков и их титр с матерью и отцом (Seow K W., Biological mechanisms of early childhood caries. Community Dent Oral Epidemiol. 1998; 26(1 Suppl):8-27; Caufield P W, Griffen A L. Dental Caries. An infectious and transmissible disease. Pediatr Clin North Am. 2000; 47:1001-19). Streptococcus mutans является одним из лидеров бактериального сообщества в этиологии возникновения кариеса (Хавкин А.И., Ипполитов Ю.А., Алешина Е.О., Комарова О.Н., Микробиота и болезни полости рта, 2015, 78-81).
Таким образом, чем раньше полость рта ребенка колонизируется S. mutans, тем выше шанс покрытия незрелой эмали недавно прорезавшихся зубов зубным налетом, свойства которого будут очень сильно зависеть от потребляемой пищи (Alaluusua S, Malmivirta R. Early plaque accumulation, a sign for caries risk in young children. Community Dent Oral Epidemiol 1994; 22:273-276). Содержание в пище легко ферментируемых углеводов будет высоким, то S. mutans будут находиться в симбиотическом взаимодействии с Lactobacillus. spp., синтезируя внеклеточные полисахариды, благоприятствующие увеличению стабильности матрикса зубной бляшки (Tinanoff N, Kanellis М J, Vargas С М. Current understanding of the epidemiology mechanisms, and prevention of dental caries in preschool children. Pediatr Dent 2002; 24:543-55). При этом, четко прослеживается связь высокого уровня обсемененности Streptococcus mutans у матерей и риска массированной обсемененности их детей и тем выше распространенность кариеса к 4 годам жизни ребенка (American Association of Pediatric Dentistry (AAPD). Dental care for your baby. 2009).
Лечебный контроль за неспецифической биопленкой является простым и обычным эффективным средством в лечении кариеса и заболеваний пародонта (Кузьмина Э. М. Профилактика стоматологических заболеваний: учебное пособие. - Москва, 2001., Socranssky S.S., Haffajee A.D.: Dental Biofilms: difficult the rapeutictargets. Periodontology 2002).
Лечение должно охватывать всю поверхность полости рта и прилегающей поверхности глотки, а не только область зубов и пародонта (Theilade Е. Factors controlling the microflora of the healthy mouth. In: Human microbial ecology. Hill M. J., Marsh P.D. Boca Raton, F L, CRC Press 1990). Главной целью регулярного механического удаления налета является уменьшение общего количества бактерий и модификация состава биопленки.
Распространение зубного налета по поверхности зуба происходит от межзубных промежутков и десневых желобков; рост колоний подобен развитию последних на питательной среде (Asikainen S, Chen С: Oral ecology and person to person transmission of Aa and Pg. Periodontology 2000, Кузьмина Э. M. Профилактика кариеса зубов как важнейший аспект сохранения стоматологического здоровья детей/ И. И. Лысенкова//Рос.педиатр. Журн. - 2006, Netuschil L: Biofilm alsorganisation form der plaque. Prophilaxe Dialog 2004; Wilton JMA, Bampton JLM, Hurst TJ: Interleukin-IB and Ig G subclass concentrations in gingival crevicular fluid from patinets with a history of destructive periodontal disease. Journal of Clinical Periodontology, 2005).
Прогностические приемы, которые направлены на первичное предупреждение кариозного процесса у детей, рассматривают, в основном, субъективные критерии при сборе анамнеза: аспекты вскармливания, физиологический статус и двигательная активность, потребление углеводов, социально-экономический уровень жизни, течение беременности, заболеваемость ребенка, наследственность, сроки прорезывания зубов и т.д. (Reich Е. Профилактика кариеса сегодня/Новое в стоматологии. -2011. - №6 (178). - С 6-15.; Slayton R. Оценка риска развития кариеса // Маэстро стоматологии. - 2007. - №25. - С 23-26; Пузикова О.Ю. Прогнозирование развития кариеса зубов с учетом интегрированных показателей и математического моделирования: дис. канд. мед. наук - Омск, 1999. - 183 с.; J. Tsubonchi, et al. A study of dental caries and risk factors among Native American infants / // J Dent Child. - 1995. - Vol. 62. - P. 283-287).
Переход от нормы к патологии принято обозначать донозологическими состояниями, распознавание которых, получившее название «донозологической диагностики», является основой формирования групп здоровья и выработки первичных профилактических мероприятий (Виноградова Т.Ф., 1977; Окушко В.Р., Косарева Л.И., 1983; Удовицкая Е.В. с сотр., 1983). Сегодня предпринимаются попытки донозологического прогнозирования кариозного процесса у детей, оперируя объективными показателями гомеостаза полости рта. Особое место в целях прогнозирования стоматологической патологии у детей занимает изучение ряда показателей слюны (Сунцов В.Г., 1987; Леонтьев В.К., Петрович Ю.А., 1976). Предпринята попытка изучения иммунологического статуса ротовой жидкости. Ведется поиск иммунологического маркера течения кариеса зубов у детей с целью прогнозирования заболевания на донозологическом этапе развития (Risik of aktoren ftir das Nursingottle-yndrome /Ch. Hirsh [et al.] // Oralprophylaxe. - 2000. - Vol. 22. - P. 103-07; Robko F.J. Haufigkeit der Nuckelflaschen karies beiVorschulkindern in einer westdeutschen Grobstadt / F.J. Robko, M. Buitkamp // Oralprophylaxe. - 2002. - Vol. 24. - P. 59-65; Sellmann H.H. Kariesrisikotest jetzt auch als DNSSonden-Test // Dental Spigel. 2003. Vol. 1. - P. 44-45; van Palenstein Helderman W.H. Rise factors of early childhood caries in a Southeast Asian population / W.H. van Palenstein Helderman, W. Soe, M. A. van't H о // J. Dent. Res. - 2006. - Vol. 85, №1. - P. 85-88; Горбунова И.Л. Использование ДНК технологий для раннего выявления предрасположенности к кариесу /Стоматология - 2006. - №4. - С. 18-19; Р ост и развитие ребенка/ В.В Юрьев и др. - 2-е изд - С Пб: Литер 2003. - 272 с.). Наряду с вышеописанными методами донозологической диагностики стоматологической патологии в различное время предлагались: метод определение резистентности кариеса по флоре зубного налета (Кускова В.Ф., Ребреева Л.Н., 1971); по титру лактобактерий ротовой полости (И.А. Бегельман, 1964); по буферной емкости слюны (Sidney, 1963). Массовая донозологическая диагностика должна явиться одним из важнейших элементов в системе охраны здоровья детей, так как направлена не на поиск болезни, а на установление уровня здоровья (Сунцов В.Г., Леонтьев В.К., Дистель В.А., Вагнер В. Д. Стоматологическая профилактика у детей, Москва, 2001. 344 с.).
В связи с вышеизложенным, наши исследования посвящены определению титра бактерий Streptococcus mutans в биотопах полости рта у детей раннего возраста.
В настоящее время для исследований микробного состава полости рта и интегральных показателей слюны используются экспресс-методики, являющиеся достаточно простыми и удобными у детей в применении непосредственно в стоматологическом кабинете: «Dentobuff Strip», «Dentocult SM Strip mutans», «Dentocult LB» («Vivadent») и «Saliva-Check Buffer», «Saliva-Check mutans» («GC»). Они помогают в совокупности оценить гомеостаз полости рта и предсказать развитие кариозного процесса в детском возрасте. В условиях клиники это позволяет индивидуализировано назначать профилактические мероприятия и значительно повысить эффективность их проведения. Прогнозирование риска развития кариеса у ребенка имеет значительный потенциал в его профилактике и лечении, включая организацию динамического наблюдения.
Для проведения микробиологического тестирования используются диагностические тесты in vitro у детей: Steptococcus mutans - «Dentocult SM Strip mutans» (фирма «Vivadent, Лихтенштейн); «Saliva-Check Mutans» (фирма «GC», Япония).
Для проведения экспресс-теста «Dentocult SM Strip mutans» шероховатая поверхность тест-полоски с закругленным концом прижимается к языку ребенка, на котором присутствует слюна. Тест-полоски с квадратным концом имеют шероховатую поверхность, на которую наносят зубной налет с эмали зубов. Затем полоски помещаются в селективную питательную слюну во флакон с предварительно растворенным диском антибиотика бацитрацина, который задерживает рост бактерий, кроме S. mutans. Флакон помещается в инкубатор на 48 часов при температуре 37°С. После проведения инкубации наличие бактерий выявляется по росту на шероховатой поверхности тест-полоски колоний, имеющих цвет, варьирующий от темно-синего до голубого. Количественный состав характеризуется плотностью их прикрепления и сравнивается с эталонной картой/схемой.
Известен способ взятия проб материала для изучения микроорганизмов полости рта тестовый набор «Saliva-Checkmutans» позволяет провести полуколичественный анализ концентрации S. mutans в слюне высоко специфическим иммунохроматографическим методом. При высокой концентрации S. mutans в слюне бактерии вступают в реакцию с меченным золотом коллоидными анти - S. mutans - моноклональными антителами, которые содержатся в тестирующем устройстве. Получившиеся бактерии вступают в реакцию с другими анти-S. mutans-антителами, что приводит к появлению положительной красной линии в окне Т. Меченные анти - S. mutans / монокланальные антитела, не вступившие в реакцию, формируют контрольную красную линию в окне контроля С.Слюна у детей собирается в контейнер объемом до линии А, у детей до 3-х лет для этого используется специальный тампон на стержне. В контейнер со слюной в вертикальном положении добавляется капля реагента N21 / щелочной раствор для растворения вязких компонентов слюны) и тщательно перемешивается путем постукивания по контейнеру в течение 10 с. Затем добавляется 4 капли реагента N22 / кислотный раствор для изменения рН раствора. При этом цвет получаемого раствора меняется на светло-зеленый. Пипеткой из контейнера забирается необходимое количество раствора и выдавливается в окно образца на тестирующем устройстве, в окне контроля появляется широкая красная полоса. По истечении 15 минут оцениваются полученные результаты. Уровень концентрации расценивается как высокий - >5×105 КОЕ/мл, если в окне теста «Т» появляется тонкая красная линия. Если линия не появляется, то уровень концентрации S.mutans в слюне низкий. Результат теста считается положительным даже при появлении еле заметной красной линии в окне «Т».
Известен также способ взятия проб материала для изучения микроорганизмов полости рта (Кускова В. Ф., Ребреева Л. И., "Стоматология", №4., М., 1971, с. 57-60), при котором материал берут тонкими ватными турундами на корневых иглах или плотно скрученными из ваты шариками диаметром от 2 до 5 мм, предварительно простерилизованными в чашках Петри или бумажных пакетиках суховоздушным методом при 165-170°С в течение 1 ч. Турунду или ватный шарик непосредственно перед взятием пробы слегка увлажняют прикосновением к стерильному физраствору в пробирке. Немедленно после взятия пробы турунду, снятую пинцетом с корневой иглы, ватный шарик опускают в пробирку с питательной средой. При этом соблюдается обычная бактериостатическая техника посевов над пламенем горелки. Для вымывания микробов в слюну из тех участков, где они скапливаются в наибольшем количестве - межзубные промежутки, поверхность корня языка, десневые карманы, могут быть применены два следующих способа. Первый способ: обследуемому дают жевать кусочки стерильного воска или парафина /объемом около 5 см3/. Стерилизацию производят в автоклаве большими порциями в колбах. Перед употреблением парафин или воск расплавляют на водяной бане, разливают в стерильные чашки Петри и нарезают стерильным инструментом. Достаточно выбрать 5-6 мл слюны. Непосредственно перед стимуляцией обследуемый прополаскивает рот кипяченой водой.
Второй способ: обследуемый предварительно прополаскивает рот 50-100 мл стерильного физраствора для удаления остатков пищи и стимуляции слюноотделения. Спустя 10-15 минут обследуемому дают полоскать рот 8-10 мл стерильного физраствора и берут разведенную таким путем слюну полоскательную жидкость. Полоскание должно быть сильным и продолжительным, до 3-х мин. Полоскательная жидкость должна омыть рот полностью. При обоих способах слюну берут в широкогорлые пробирки или колбочки, простерилизованные под двойными колпаками, чем обеспечивается стерильность краев стекла, которых обследуемый может коснуться губами. Такая же предосторожность нужна при стерилизации пробирок с физраствором для полоскания рта. Когда проба взята, бумажный колпачок заменяют ватной пробкой. Пробы слюны сохраняют в холодильнике без замораживания, не дольше 4-х ч.
Известен способ взятия проб материала для микробиологических исследований полости рта и устройство для его осуществления, согласно патенту №2101692 Зуфарова С.А. и соавторов. Сущность изобретения: прополаскивают рот стерильным физраствором, отбирают пробы, культивируют их и идентифицируют микроорганизмы полости рта в стандартном наборе сред. Микрофлору берут с локальных участков слизистой оболочки и зубных протезов непосредственно в стерилизованные металлические гильзы с находящейся там питательной средой. Устройство для взятия проб материала для микробиологических исследований полости рта содержит простерилизованную емкость, которая выполнена в виде металлической гильзы, помещенной в гильзодержатель, соединенный с головкой, ручкой, при этом ручка соединена с хвостовиком головки резьбой с возможностью осевого поворота, гильзодержатель прикреплен к головке шарнирно. Головка выполнена упругой с возможностью регулировки трения в шарнире, а гильза имеет элемент локализации пробы в виде носика с острыми краями. Шарнирные соединения головки с гильзодержателем выполнены в виде полукольцевой упругой пластины, внутри которой на двух полуосях подвешен гильзодержатель, при этом одна из осей снабжена резьбой и регулировочным винтом. Способ позволяет получить более качественные пробы с локальной поверхности полости рта и протезов и повысить достоверность микробиологического анализа, удобен в эксплуатации.
Известны способы забора со спинки языка и бактериологическое исследование материала соскоба слизистых оболочек из очага поражения, описанные в учебнике «Микробиология, вирусология и иммунология полости рта» под редакцией профессора В.Н. Царева, издательской группы ГЭОТАР-Медиа, главе 10. Общие правила и нормативы микробиологического исследования различных биотопов полости рта.
Эти способы и применяемые для его реализации средства приняты в качестве наиболее близких аналогов-прототипов. Однако у всех выше перечисленных способов есть существенные недостатки. Все они малоприменимы для исследования кариесогенной флоры у детей раннего возраста, не дают точной методики забора материала с корня и спинки языка, алгоритма его посева, выбора питательных сред, бактериологической диагностики и идентификации активной микрофлоры как модельной системы для определения наличия и титра кариесогенных S. mutans, с помощью современных питательных сред. Также недостатком вышеперечисленных аналогов-прототипов является: временные затраты, длительная манипуляция, высокая затрата специализированного труда. В связи с особенностями психосоматического статуса детей раннего возраста, их неусидчивостью, забор материала с поверхностей зубов неудобен. В этой связи необходимо выбрать биотоп и оптимальный способ, который предполагает минимальные временные затраты для забора биоматериала, удобен, безвреден, легкодоступен у детей раннего возраста.
В доступной научной литературе не имеется указаний на взаимосвязь и взаимозависимость между обсемененностью кариесогенной флорой биотопов слизистой оболочки спинки языка и зубного налета с твердых поверхностей зубов и слюны у детей раннего возраста.
Мы провели микробиологические исследования и предложили усовершенствование стандартного метода, используя готовую селективную среду для забора слюны не только с языка, но и с других биотопов полости рта. При этом, делили стандартную тест-полоску, на 4 части, этой площади на ее шероховатой поверхности достаточно, чтобы выявить уровень обсемененности Streptococcus mutans и провести сравнительный анализ плотности роста колоний из 4-х различных актуальных биотопов полости рта ребенка между собой.
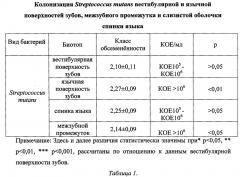
В процессе нашего исследования выявлено, что плотность обсемененности кариесогенной флорой язычной поверхности зубов и слизистой оболочки спинки языка статистически достоверно одинаковы.
Анализ плотности колонизации различных поверхностей зубов, межзубного промежутка и спинки языка патогенными стрептококками, представлен в таблице 1, он показал преобладание Streptococcus mutans на язычной поверхности зубов и слизистой оболочке спинки языка, с наименьшей концентрацией микроорганизмов на вестибулярной поверхности (р<0,001).
Задача изобретения: предложить опосредованный способ бактериологической диагностики для выявления обсемененности Streptococcus mutans зубного налета молочных зубов у детей путем определения кариесогенных микроорган