Способ лечения заболеваний человека, вызванных грамположительными бактериями
Иллюстрации
Показать всеГруппа изобретений относится к области медицины и предназначена для лечения заболеваний человека, вызванных грамположительными бактериями. В качестве антибактериального средства используется эремомицин, либо его фармацевтически приемлемые соли и сольваты. Доза от 20 до 2000 мг в день, при этом вводимый эремомицин содержит в качестве примеси не более 3 % мас. дезэремозаминил-эремомицина. Группа изобретений позволяет расширить арсенал терапевтических средств. 2 н. и 23 з.п. ф-лы, 11 пр., 9 табл.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к области медицины и касается способа лечения заболеваний человека, вызванных грамположительными бактериями, в котором в качестве активного начала используется эремомицин, либо его фармацевтически приемлемые соли и сольваты. Данный способ лечения может быть реализован при различных режимах и лекарственных формах введения эремомицина, либо его фармацевтически приемлемых солей и сольватов, человеку. Заявленный способ лечения характеризуется повышенной эффективностью, сниженным количеством побочных эффектов, низкой частотой рецидивов, подавлением резистентных штаммов бактерий, чего не наблюдалось для других полициклических гликопептидов, например, ванкомицина, тейкопланина, ристомицина, далбаванцина и других. Также изобретение предусматривает фармацевтические составы эремомицина, используемые в заявленном способе лечения.
Уровень техники
Грамположительные бактерии (Грам (+) бактерии) - бактерии, которые, в отличие от грамотрицательных бактерий, сохраняют окраску, не обесцвечиваются при промывке при использовании окраски микроорганизмов по методу Грама.
Большинство Грам (+) бактерий имеют однослойную клеточную мембрану, без внешней мембраны, присущей грамотрицательным бактериям.
Большая часть патогенных для человека микроорганизмов относится к грамположительным. Шесть родов грамположительных организмов (Bacillus, Listeria, Staphylococcus, Streptococcus, Enterococcus и Clostridium) являются типичными патогенами человека. Два из них, стрептококки и стафилококки, являются кокками (шарообразными бактериями). Остальные - палочковидные и делятся далее по возможности образовывать споры. Неспорообразующие: Corynebacterium и Listeria; спорообразующие: Бациллы и Клостридии. Спорообразующие можно разделить на факультативных анаэробов Бациллы и облигатных анаэробов Клостридий.
Грамположительные бактерии вызывают огромное количество разнообразных болезней человека, среди них эндокардит, сепсис, инфекции дыхательных путей (пневмония, абсцесс легкого, отит, синусит, эпиглоттит), инфекции ЦНС (менингит), различные колиты (стафилококковый энтероколит, псевдомембранозный колит, ассоциированный с Clostridium difficile), а также всевозможные инфекции кожи, мягких тканей, костей и суставов (целлюлит, рожа, импетиго, диабетическая язва стопы, инфекции после укусов человека, фолликулит, фурункулы, карбункулы, гнойный гидраденит, паронихия, пиомиозит, гнойный тендовагинит, пролежни, инфекционный артрит, остеомиелит, острый бурсит, послеоперационные раневые инфекции).
Среди огромного множества заболеваний, вызываемых грамположительными бактериями, большую опасность представляет клостридиальная инфекция, более известная как клостридиальный псевдомембранозный колит или псевдомембранозный колит, ассоциированный с Clostridium difficile. Опасность данного заболевания заключается в том, что оно вызвано антибиотикотерапией, в том числе и антибиотиками, которые могут подавлять Clostridium difficile.
Псевдомембранозный или Clostridium difficile - ассоциированный колит представлен широким спектром клинических проявлений от умеренной диареи до фульминантной формы с возможным летальным исходом. В «доантибиотическую» эру псевдомембранозный колит вызывался различными возбудителями (например, Staphylococcus); в настоящее время наиболее типичной причиной является избыточное размножение симбионтного анаэроба Clostridium difficile на фоне антибиотикотерапии или химиотерапии онкобольных.
Патофизиология заболевания: гибель нормальных бактерий толстой кишки, вызванная антибиотиками (от нескольких дней до 10 недель после приема антибиотиков), приводит к колонизации токсинпродуцирующим Clostridium difficile (орально-фекальный путь заражения). Высвобождение токсинов А и В приводит к гибели слизистой и воспалению. В основе различных степеней проявления заболевания лежат: 1) иммунные факторы хозяина и 2) вирулентные факторы микроорганизмов.
Антибиотики, связанные с клостридиальным колитом: любые антибиотики (даже те, которые применяются при лечении клостридиального коллита - метронидазол и ванкомицин); частота возникновения колита в значительной степени является отражением повсеместного использования соответствующих лекарственных препаратов: пенициллинов, цефалоспоринов, фторхинолонов, клиндамицина и даже метронидазола (несмотря на то, что последний применяется для лечения при Clostridium difficile).
Лечение клостридиального колита проводят от консервативного (в том числе антибиотиками ванкомицином и метронидазолом) до колэктомии, которая может спасти больному жизнь.
Clostridium difficile наиболее распространенная нозокомиальная инфекция ЖКТ. Отмечается эпидемический рост заболеваемости от 6-7 случаев на 1000 госпитализаций в 1990 г. до 23 случаев на 1000 госпитализаций в 2004 г.; >450 тысяч случаев в год в США, >60 из 100000 пациентов выписываются с первичным диагнозом «клостридиальный колит» после краткосрочной госпитализации.
Бессимптомная колонизация Clostridium difficile:
- >50% здоровых новорожденных;
- 1-3% здоровых взрослых;
- 25% взрослых, недавно получавших антибиотики => важный скрытый резервуар Clostridium difficile;
- 20-25% госпитализированных больных подвергается колонизации Clostridium difficile во время пребывания в стационаре.
Кроме того, в настоящее время выделена группа особо вирулентных штаммов (8% изолятов), обусловливающих тяжесть инфекции С.difficile: токсинотип III, CD бинарный токсин, риботип 027. Упомянутые штаммы проявляют высокую устойчивость к лечению антибиотиками (ванкомицин и другие).
Большая распространенность заболеваний, вызванных грам положительным и бактериями, а также возникновение новых более устойчивых штаммов бактерий (The American Journal of Medicine, 2006, V. 119(6A), S11-19; Antimicrobial Agents and Chemotherapy, 2012, V. 56, №6, P. 2929-2932) приводит к необходимости разрабатывать новые антибиотики, а также устранять недостатки уже известных антибиотиков.
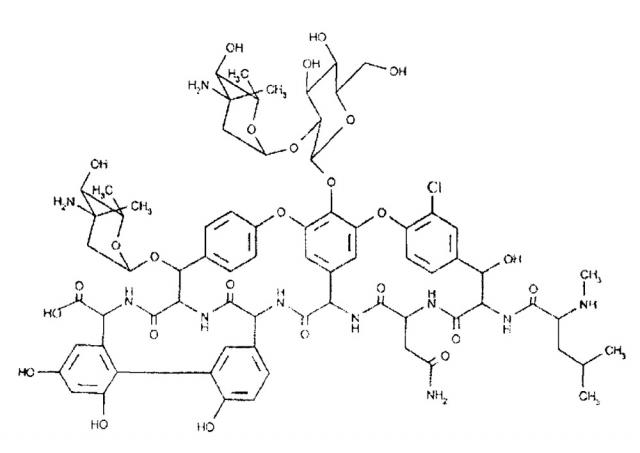
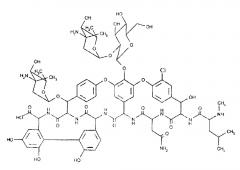
Антибиотик эремомицин (структурная формула представлена ниже) относится к группе полициклических гликопептидов (далгапептидов), в которую входят антибиотики ристомицин (ристоцетин), актиноидин, ванкомицин, тейкопланин, далбаванцина (Drugs, 2004, V. 64, Р. 913-936).
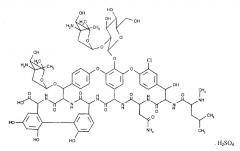
Эремомицин является гидрофильным амфотерным соединением, растворим в водных растворах кислот и щелочей, не растворим в обычных органических растворителях. Из концентрированных водных растворов при слабощелочной реакции среды (рН=8,1) антибиотик выпадает в виде основания. Подкисление водного раствора антибиотика кислотой (до pH 6,5-6,7) приводит к образованию соответствующей соли. Например, при использовании серной кислоты выпадает сульфат эремомицина следующей формулы:
В состав эремомицина входят аминокислоты - актиноидиновая кислота, дехлорванкомициновая кислота, аспарагин, N-метил-лейцин и сахара - эремозамин (2 остатка) и глюкоза. Брутто-формула эремомицина C73H89N10ClO26, Относительная молекулярная масса составляет 1558.
Эремомицин дает положительные реакции на свободные аминогруппы (с нингидрином), на углеводы (реакция Молиша и Фелинга), на фенольные гидроксилы (с треххлористымжелезом и реакция Паули).
Обладает характерным УФ-спектром с λmax при 280 нм (вода) и λmin при 263 нм и удельным поглощением равным 41.
В ИК-спектре (KBr) имеются сильные полосы поглощения в области (νmax): 3400-3200, 2900, 1670, 1600, 1200-1000 см-1.
Эремомицин обладает более высокой чимиотерапевтической активностью, чем известные антибиотики далгапептидов. Эремомицин в 2-3 раза более эффективен в отношении различных штаммов стафилококка, стрептококка, бациллам. Кроме того, эремомицин показал себя менее токсичным антибиотиком, чем ванкомицин и другие представители далгапептидов (Антибиотики и медицинская биотехнология, 1987, XXXII, №8, с. 571-575; J. Antibiotics, 1989, V. 42, Р. 1790-1799).
Также упоминалось о начале проведения клинических испытаний эремомицина (J. Antibiotics, 1989, V. 42, Р. 1790-1799), однако они не увенчались успехом из-за чрезвычайно сильной аллергической реакции при внутривенном введении эремомицина (сильный анафилактической шок). Позднее появились сведения, подтверждающие сильные аллергенные свойства эремомицина при внутривенном введении в эксперименте на животных (J. Antibiotics. 1996. v. 49 (2), p. 194-198).
Неудачу эремомицина при внутривенном введении попытались исправить за счет его перорального использования (перорально эремомицин практически не всасывается) при лечении клостридиальной инфекции у животных. Сравнение эремомицина и ванкомицина при лечении клостридиальной инфекции в одинаковых дозах (100 мг/кг) на модели золотистого хомяка показало превосходство в эффективности у ванкомицина (Антибиотики и химиотерапия, 1992, т. 37, №11, с. 32-35).
Несмотря на хорошие данные по эффективности эремомицина in vitro, в исследованиях in vivo была продемонстрирована его неэффективность при лечении заболеваний, вызванных грамположительными бактериями, из-за сильного аллергического эффекта при внутривенном введении, а также существенно более низкой активности при пероральном/ внутрибрюшинном введении, по сравнению с ванкомицином при лечении клостридиальной инфекции на модели золотистого хомяка.
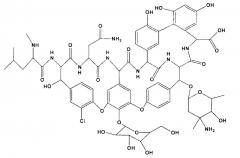
Авторы настоящего изобретения неожиданно обнаружили, что аллергические и анафилактические реакции у человека на эремомицин были вызваны наличием (более 3% масс.) в препарате эремомицина дезэремозаминил-эремомицина - основной примеси распада эремомицина. Структурная формула дезэремозаминил-эремомицина представлена ниже:
Дезэремозаминил-эремомицин был впервые получен в 1991 году (Антибиотики и химиотерапия, 1991, т. 36, №6, с. 28-31) при гидролизе эремомицина 0,2 М раствором соляной кислоты.
Таким образом, используя субстанцию эремомицина, содержащую не более 3% масс. дезэремозаминил-эремомицина, а также композиции эремомицина, позволяющие его стабилизировать от распада на дезэремозаминил-эремомицин, можно эффективно лечить заболевания человека, вызванные грамположительными бактериями.
Авторы также неожиданно обнаружили, что эремомицин более эффективно подавляет штаммы Clostridium difficile человека, чем ванкомицин. В связи с этим, эремомицин является отличным средством для лечения клостридиальной инфекции человека. Причем терапия эремомицином существенно снижает количество рецидивов и побочных реакций, в сравнении с терапией ванкомицина. Неожиданным оказалось наличие у эремомицина сладкого вкуса, что исключает проявление тошноты при пероральном приеме препарата человеком, имеющей место в случае терапии ванкомицином.
Способы лечения человека с использованием эремомицина не раскрываются в уровне техники. Также отсутствуют сведения о композициях эремомицина, которые могут использоваться в названных способах.
Раскрытие изобретения
В настоящем изобретении авторы неожиданно обнаружили высокую эффективность использования эремомицина при лечении у человека заболеваний, вызванных грамположительными бактериями. Высокая эффективность использования эремомицина при лечении заболеваний человека, вызванных грамположительными бактериями, проявляется в снижении количества побочных эффектов, частоты рецидивов, а также подавлении резистентных штаммов бактерий, чего не наблюдалось для других полициклических гликопептидов, например, ванкомицина, тейкопланина, ристомицина, далбаванцина и других.
При этом авторы изобретения неожиданно установили, что вышеприведенные эффекты от использования эремомицина возможны только в том случае, если используемый эремомицин содержит в качестве примеси не более 3% масс. дезэремозаминил-эремомицина. Упомянутая примесь в количестве более 3% масс. вызывает сильнейшие аллергические реакции (вплоть до анафилактического шока), приводящие к невозможности проведения терапии эремомицином.
В связи с этим, настоящее изобретение направлено на способ лечения заболеваний человека, вызванных грамположительными бактериями, включающий введение нуждающемуся человеку эремомицина или его фармацевтически приемлемой соли, сольвата в количестве от 20 до 2000 мг в день, при этом вводимый эремомицин содержит в качестве примеси не более 3% масс. дезэремозаминил-эремомицина.
В одном варианте изобретения эремомицин или его фармацевтически приемлемую соль, сольват вводят перорально.
В предпочтительном варианте изобретения эремомицин или его фармацевтически приемлемую соль, сольват вводят перорально в виде капсулы, таблетки или раствора для приема внутрь.
В предпочтительном варианте изобретения раствор для приема внутрь содержит эремомицин или его фармацевтически приемлемую соль, фармацевтически приемлемый углевод и воду.
В предпочтительном варианте изобретения таблетка содержит эремомицин или его фармацевтически приемлемую соль, сольват и макрогол.
В одном варианте изобретения капсула содержит эремомицин или его фармацевтически приемлемую соль, сольват и фармацевтически приемлемый углевод.
В одном варианте изобретения эремомицин или его фармацевтически приемлемую соль, сольват вводят внутривенно.
В предпочтительном варианте изобретения эремомицин или его фармацевтически приемлемую соль, сольват вводят в виде раствора для инфузий.
В предпочтительном варианте изобретения раствор для инфузий содержит эремомицин или его фармацевтически приемлемую соль, фармацевтически приемлемый углевод и воду.
В одном варианте изобретения эремомицин или его фармацевтически приемлемую соль, сольват вводят в количестве от 100 до 1500 мг в день.
В предпочтительном варианте изобретения эремомицин или его фармацевтически приемлемую соль, сольват вводят в количестве от 250 до 1000 мг в день.
В одном варианте изобретения эремомицин или его фармацевтически приемлемую соль, сольват вводят в два приема.
В одном варианте изобретения эремомицин или его фармацевтически приемлемую соль, сольват вводят в четыре приема.
В наиболее предпочтительном варианте изобретения эремомицин или его фармацевтически приемлемую соль, сольват вводят в количестве 1000 мг в день в четыре приема.
В одном варианте изобретения грамположительные бактерии выбраны из бактерий, включающих бактерий родов Bacillus, Listeria, Staphylococcus, Streptococcus, Enterococcus и Clostridium.
В одном варианте изобретения заболевание человека, вызванное грамположительными бактериями, выбрано из группы, включающей эндокардит, сепсис, пневмонию, абсцесс легкого, менингит, стафилококковый энтероколит, псевдомембранозный колит, ассоциированный с Clostridium difficile и прочие инфекции, вызванные Clostridium difficile, инфекции кожи, мягких тканей, костей и суставов.
Кроме того, настоящее изобретение направлено на способ лечения клостридиальной инфекции у человека, включающий пероральное введение нуждающемуся человеку эремомицина или его фармацевтически приемлемой соли, сольвата в количестве от 20 до 2000 мг в день.
В одном варианте изобретения эремомицин или его фармацевтически приемлемую соль, сольват вводят в количестве от 250 до 1000 мг в день.
В одном варианте изобретения эремомицин или его фармацевтически приемлемую соль, сольват вводят в два приема.
В предпочтительном варианте изобретения эремомицин или его фармацевтически приемлемую соль, сольват вводят в четыре приема.
В наиболее предпочтительном варианте изобретения эремомицин или его фармацевтически приемлемую соль, сольват вводят в количестве 1000 мг в день в четыре приема.
В одном варианте изобретения эремомицин или его фармацевтически приемлемую соль, сольват вводят перорально в виде капсулы, таблетки или раствора для приема внутрь.
В наиболее предпочтительном варианте изобретения таблетка содержит эремомицин или его фармацевтически приемлемую соль, сольват и макрогол.
В наиболее предпочтительном варианте изобретения раствор для приема внутрь содержит эремомицин или его фармацевтически приемлемую соль, сольват, а также фармацевтически приемлемый углевод и воду.
В одном варианте изобретения вводимый эремомицин содержит в качестве примеси не более 3% масс. дезэремозаминил-эремомицина.
Также настоящее изобретение предусматривает композицию эремомицина или его фармацевтически приемлемой соли с фармацевтически приемлемым вспомогательным веществом, причем композиция характеризуется содержанием не более 3% масс. дезэремозаминил-эремомицина.
Эремомицин, для использования в заявленном способе лечения, может быть получен в соответствии со способами получения, известными в SU 1475150, RU 2110578, RU 2352631, RU 2621866.
Фармацевтически приемлемой солью или сольватом эремомицина могут являться любые подходящие известные соли или сольваты, например, сульфат эремомицина, гидрохлорид эремомицина, трифторацетат эремомцина, мезилат эремомицина и другие.
Наиболее предпочтительной фармацевтически приемлемой солью эремомицина является сульфат эремомицина.
В еще одном варианте изобретения эремомицин, либо его фармацевтически приемлемая соли или сольват, может использоваться в виде композиции, содержащей обычные фармацевтически приемлемые вспомогательные вещества, принятые в технологии приготовления лекарственных средств, такие как связующие, наполнители, консерванты, регуляторы текучести, смягчители, смачиватели, диспергаторы, эмульгаторы, растворители, антиокислители и/или пропелленты, пролонгаторы действия [Sucker et al.: Pharmazeutische Technologie, Thieme-Verlag, Stuttgard, 1991 г.].
Неожиданно оказалось, что субстанция эремомицина обладает хорошей растворимостью и приемлемыми технологическими свойствами. Таким образом, эремомицин для создания композиции может быть смешан с наполнителями в любом подходящем соотношении. В одном варианте изобретения содержание эремомицина в композиции составляет от 5 до 90% масс. В еще одном варианте изобретения содержание эремомицина в композиции составляет от 20 до 85% масс.
Наиболее предпочтительными вспомогательными веществами являются стабилизирующие эремомицин вещества. К таковым вспомогательным веществам относят фармацевтически приемлемые углеводы (маннитол, сахароза, лактоза, циклодекстрины, целлюлоза и ее производные, крахмал и его производные, сорбит, фруктоза) и твердые макроголы (макрогол 3350, макрогол 4000, макрогол 6000 и другие). При необходимости к вышеупомянутым веществам могут быть добавлены подходящие связующие, наполнители, консерванты, регуляторы текучести, смягчители, смачиватели, диспергаторы, эмульгаторы, растворители, антиокислители и/или пропелленты, пролонгаторы действия для улучшения физико-химических свойств готовой композиции.
Для получения готовых композиций эремомицина в качестве предпочтительных фармацевтически приемлемых вспомогательных веществ могут быть использованы макрогол, стеариновая кислота и ее соли, тальк, коповидон, диоксид кремния, полисорбаты (например, полисорбат 80), полоксамеры (например, полоксамер 188), оксид магния, циклодекстрины (например, β-циклодекстрин), натрия карбоксиметилцеллюлоза, микрокристаллическая целлюлоза, крахмал, карбонат кальция, основный карбонат магния, фосфат кальция, желатин, лактоза, крахмал прежелатинизированный, каолин, маннит, сорбит.
Более предпочтительными вспомогательными веществами являются маннит, макрогол, лактоза, натрия карбоксиметилцеллюлоза, циклодектрин, полисорбат, полоксамер и сорбит.
Наиболее предпочтительными вспомогательными веществами являются маннит, макрогол, лактоза и циклодекстрин. Авторы изобретения неожиданно обнаружили, что использование в композициях эремомицина макрогола позволяет добиться более эффективной обработки эремомицином зараженных органов, а также лучшей стабильности эремомицина.
В наиболее предпочтительном варианте изобретения композиция эремомицина, содержащая обычные фармацевтически приемлемые вспомогательные вещества, может быть выполнена в виде пероральной лекарственной формы, например, в виде таблетки необязательно покрытой оболочкой, раствора или суспензии для перорального приема. Композиции эремомицина могут быть выполнены стандартными методами («Фармацевтическая технология. Технология лекарственных форм», 2-ое изд., Москва, 2006 г.).
Фармацевтическая композиция по настоящему изобретению может быть покрыта подходящей пленочной оболочкой, содержащей, например, подходящий полимер (поливиниловый спирт, гипролозу, этилцеллюлозу и другие), тальк, диокид титана, полиэтиленгликоль (макрогол) и красители. В качестве оболочки для композиции по настоящему изобретению может быть использована готовая оболочка, например, оболочка серий «Опадрай», «Опаспрей», «Опатинт». Например, можно использовать готовую оболочку Опадрай II розовый 85 F 14399 (поливиниловый спирт - 40,00%, титана диоксид - 24,85%, тальк - 14,80%, макрогол 3350 - 20,20%, краситель железа оксид красный Е172 - 0,15%).
Осуществление изобретения
Представленные ниже примеры иллюстрируют (без ограничения объема притязаний) наиболее предпочтительные варианты осуществления изобретения, а также подтверждают возможность осуществления заявленного способа лечения заболеваний, вызванных грамположительными бактериями, и достижения указанных технических результатов.
Пример 1
Определение примесей в субстанции эремомицина методом ВЭЖХ.
Ниже представлена методика определения содержания эремомицина и примесей в нем методом ВЭЖХ.
0,6% раствор формиат аммония pH 8,0. В мерную колбу вместимостью 1000 мл помещают 6 г формиата аммония, растворяют в воде, доводят объем раствора до метки тем же растворителем и перемешивают. Доводят pH полученного раствора до 8,0 при помощи 10% раствора аммиака. Полученный раствор фильтруют и дегазируют любым удобным способом. Материал фильтра - капрон или другой материал, совместимый с полученным раствором, с величиной пор не более 0,45 мкм.
Растворитель для проб. Смешивают 92 мл компонента подвижной фазы А и 8 мл ацетонитрила.
Испытуемый раствор. Около 25 мг субстанции (точная навеска) помещают в мерную колбу вместимостью 50 мл, растворяют в растворителе для проб, доводят объем раствора до метки тем же растворителем, перемешивают и фильтруют через мембранный фильтр (материал фильтра - регенерированная целлюлоза) с размером пор не более 0,45 мкм, отбрасывая первые порции фильтрата.
Раствор используют свежеприготовленным.
Раствор для оценки чувствительности хроматографической системы. 2,0 мл испытуемого раствора переносят в мерную колбу вместимостью 100 мл, доводят объем раствора до метки растворителем для проб и тщательно перемешивают. 2,0 мл полученного раствора переносят в мерную колбу вместимостью 10 мл, доводят объем до метки растворителем для проб и тщательно перемешивают. Концентрация эремомицина сульфата в полученном растворе составляет около 0,002 мг/мл.
Раствор амида эремомицина сульфата. Около 5 мг (точная навеска) амида эремомицина сульфата (стандартный образец фирмы) помещают в мерную колбу вместимостью 50 мл, растворяют в растворителе для проб, доводят объем раствора до метки тем же растворителем и тщательно перемешивают.
Раствор для проверки пригодности хроматографической системы. 5,0 мл раствора амида эремомицина сульфата переносят в мерную колбу вместимостью 10 мл, прибавляют 2 мл испытуемого раствора, доводят объем до метки растворителем для проб и тщательно перемешивают.
Хроматографические условия:
| Kromasil С8; 250×4,6 мм; 5 мкм (Akzo Nobel) | ||
| Колонка | - | или аналогичная; |
| Подвижная фаза А | - | 0,6% раствор формиат аммония рН 8,0 |
| Подвижная фаза В | - | ацетонитрил |
| Скорость потока | - | 1,0 мл/мин; |
| Температура колонки | - | 25°C; |
| Детектор | - | длина волны 280 нм; |
| Объем вводимой пробы | - | 20 мкл; |
Последовательно хроматографируют растворитель, получая бланк-хроматограмму, раствор для оценки чувствительности хроматографической системы, раствор для проверки пригодности хроматографической системы и испытуемый раствор (не менее 2 раз). Время удерживания эремомицина сульфата должно быть около 16,5 мин.
Хроматографическая система считается пригодной, если выполняются следующие условия:
- на хроматограмме раствора для проверки пригодности хроматографической системы разрешение между пиками эремомицина сульфата и пиком амида эремомицина сульфата должно быть не менее 3;
- на хроматограмме раствора для проверки чувствительности отношение сигнал/шум должно быть не менее 10.
При необходимости хроматографические условия могут быть скорректированы с целью выполнения требований теста «Проверка пригодности хроматографической системы».
Пики примесей, присутствующие на бланк-хроматограмме, пики, площадь которых менее площади пика на хроматограмме раствора для оценки чувствительности хроматографической системы (менее 0,4%), а также пики со временем удерживания менее 4 минут не учитывают при определении содержания примесей.
Содержание единичной примеси в таблетках (X) в процентах вычисляют по формуле:
,
где:
Si - площадь пика единичной примеси на хроматограмме испытуемого раствора;
ΣSi - сумма площадей всех пиков на хроматограмме испытуемого раствора.
Содержание единичной неидентифицированной примеси - не более 4,0%; содержание дезэремозаминил-эремомицина (относительное время удерживания (относительно эремомицина 1,35) - не более 3,0%; сумма примесей - не более 8,0%.
Пример 2
Получение эремомицина.
Эремомицин получают в соответствии со следующим способом, ранее раскрытым в заявке RU 2621866. Названный способ синтеза заключается в использовании штамма Amycolatopsis orientalis VKM Ac-2717D и включает в себя подготовку посевного материала, выращивание посевного материала, биосинтез эремомицина и выделение эремомицина.
Подготовка посевного материала.
Посевной материал готовят в чашках Петри с использованием агаризованной среды (состав среды % масс.: глюкоза - 2,0; соевый пептон - 1,5; дрожжевой экстракт - 0,1; агар - 2,0; рН=7,0 до стерилизации).
Агаризованную среду засевают мицелием посевной культуры и выдерживают в термостате от 5 до 7 суток, при температуре 28°C. Культура на чашках должна давать сплошной газон, поверхность складчатая, мицелий бежевого цвета.
Выращивание посевного материала.
Выращивание посевного материала в колбах проводят на вегетативной среде (состав среды % масс: соевая мука - 0,5, глицерин - 3,0, калий азотнокислый - 1,0, натрия хлорид - 1,0, магний сернокислый - 0,01, вода водопроводная до 1 л, pH 7,0 до стерилизации).
Мицелием культуры Amycolatopsis oriental is VKM Ac-2717D, после инкубации в течение 5-7 суток при 28°C на агаризованной среде, засевают вегетативную питательную среду (100 мл в колбах Эрленмейера объемом 1,0 л), и выращивают при 28°C в течение 24-48 часов на термостатируемой качалочной установке при 230-250 об/мин (эксцентриситет 5 см). При микроскопии наблюдается негустая базофильная сетка, протоплазма в гифах дифференцирована.
Биосинтез эремомицина.
В ферментере готовят ферментационную питательную среду. Для этого в ферментер заливают питьевую воду (7 литров) и при перемешивании загружают навески следующих компонентов: глицерин - 600 г.; соевая мука - 200 г.; калий фосфорнокислый однозамещенный - 2 г.; хлорид магния - 2 г.; нитрат калия - 60 г.; хлорид кальция - 30 г.; дрожжевой экстракт - 30 г.; сухое обезжиренное молоко - 30 г. Доводят объем питательной среды питьевой водой до 10 литров.
В качестве дополнительного источника углеводов используется глицерин, в количестве 5 г/л среды в сутки. Подпитку глицерина вносят на 2е, 3е и 4е сутки культивирования.
В ферментационной питательной среде создают pH (7,0±0,2) с помощью 20%-го раствора едкого натра и стерилизуют в течение часа. После стерилизации, ферментер со средой охлаждают до 29-30°C. Среда должна быть стерильна и иметь pH (7,6±0,3).
Посев ферментера посевным материалом осуществляют в асептических условиях, при этом количество посевного материала составляет 10% от объема среды в ферментере. После засева ферментера температуру культуральной жидкости поддерживают на уровне 28±1°C.
В ферментер непрерывно подают стерильный воздух в количестве 300-600 л/час. Перемешивание со скоростью 100-500 об/мин. Концентрация растворенного кислорода поддерживается на уровне 50%.
Время ферментации 144-168 часов.
Начиная с 72 часов роста, ведут контроль содержания эремомицина методом ВЭЖХ. При максимальном накоплении эремомицина на 6-7 сутки процесс ферментации прекращают.
К концу биосинтеза (144±24 часа) культуральная жидкость имеет значение pH 8,3±0,25.
Содержание эремомицина 3300 мг/л (ВЭЖХ).
Микроскопическое описание мицелия: в препарате, окрашенном метиленовым синим, наблюдаются короткие, слабоветвящиеся, членистые, базофильные гифы.
Выделение эремомицина
Выделяют эремомицина в форме кислотно-аддитивной соли за счет сорбции на катионите Purolite С-104 в Н+-форме.
К культуральной жидкости объемом 10 л (содержание эремомицина 3300 мг/л) добавляют в один прием 150 г слабокислотного катионита Purolite С-104 в Н+-форме, перемешивают суспензию в течение 1,5 часов и отбирают пробу для определения остаточного содержания эремомицина в культуральной жидкости (ВЭЖХ). При отсутствии эремомицина в отобранной пробе перемешивание останавливают и отделяют катионит от культуральной жидкости. Катионит тщательно трижды промывают водой. Затем к отмытому таким образом катиониту добавляют 600 мл воды и при интенсивном перемешивании по каплям добавляют аммиак до pH 9. Отфильтровывают смолу и повторно обрабатывают ее так, как описано выше. Фильтраты, полученные после первой и второй обработки, объединяют и концентрируют в вакууме при температуре 29-34°C до 2/3 исходного объема, а затем нейтрализуют 40%-ным раствором серной кислоты до pH 6,9 (при необходимости получения другой соли эремомицина на данной стадии должна использоваться подходящая кислота).
Из полученного концентрата эремомицин кристаллизуют в форме сульфата при добавлении двукратного объема изопропилового спирта, охлаждают до 8-10°C и выдерживают в течение 2 часов. Затем фильтруют, промывают на фильтре небольшим количеством изопропилового спирта и сушат в вакууме при 30°C в течение 6 часов. Получают 28 г эремомицина сульфата следующей структурной формулы:
Выход целевого продукта от содержания в культуральной жидкости составляет не менее 80% (содержание основного вещества не менее 98%).
Полученный сульфат может быть использован при приготовлении подходящих лекарственных форм.
Пример 3
Сравнение восприимчивости различных ПЦР-риботипов Clostridium difficile к эремомицину и ванкомицину.
В настоящее время существует значительное количество резистентных к существующей терапии штаммов Clostridium difficile. В данном примере была поставлена задача сопоставить активность эремомицина и ванкомицина в эксперименте in vitro на примере различных ПЦР-риботипов Clostridium difficile. Для сопоставления активностей ванкомицина и эремомицина были определены их минимальные ингибирующие концентрации (МИК) против группы наиболее распространенных и агрессивных в отношении человека европейских ПЦР-риботипов Clostridium difficile.
Методы
Клинические изоляты Clostridium difficile (n=22) были предоставлены лабораторией Clostridium difficile Ribotyping Network (CDRN) в Лидсе, Великобритания. Изоляты были отобраны для отражения наиболее распространенных ПЦР-риботипов Clostridium difficile в Европе, согласно последним эпидемиологическим отчетам (Lancet Infect Dis. 201414(12):1208-19; Clin Microbiol Infect. 2015 21(3): 248.e9-248.e16). Все изоляты были переданы в CDRN в 2015 году.
Восприимчивость изолятов к ванкомицину и эремомицину определяли по методу введения агара Уилкинса-Чалгрена, как описано ранее (J Antimicrob Chemother 2008; 62:1046-1052). Вкратце, клинические изоляты Clostridium difficile культивировали в предварительно восстановленных анаэробных бульонах Шадлера при 37°C анаэробно в течение 24 часов до разбавления изотоническим раствором. Разведенные растворы добавляли в чашки, содержащие агара Уилкинса-Чалгрена и антибиотик. Чашки инкубировали анаэробно при 37°C в течение 48 часов и исследовали на рост. МИК определяли, как самое низкое противомикробное разведение, чтобы полностью ингибировать рост, либо рост характеризовался только отдельными малозначительными колониями.
Результаты и обсуждение
Эремомицин оказался более активным агентом против Clostridium difficile (среднее арифметическое значение МИК=0,18 мг/л, МИК50=0,125 мг/л, МИК90=0,25 мг/л). Активность эремомицина оказалась примерно в 4,6 раз выше, чем ванкомицина (среднее арифметическое значение МИК составляло 0,83 мг/л, МИК50=1 мг/л, MIC90=1 мг/л) против протестированной группы клинических изолятов Clostridium difficile. Диапазоны МИК были узкими и в пределах двух удвоенных разведений для каждого агента.
Противомикробные средства были протестированы против группы Clostridium difficile, взятой из наиболее распространенных ПЦР-риботипов Европе, включая те, которые, как известно, поддерживают устойчивость к многим антибиотикам - ПЦР-риботипы 027, 001 и 017 (Clin Microbiol Infect. 2015 21(3): 248.e9-248.e16). Не было никаких специфичных для риботипов различий в МИК для каждого из тестируемых агентов, а диапазон МИК был узким.
Как видно из вышеприведенной таблицы, эремомицин оказался значительно более активным в отношении распространенных ПЦР-риботипов Clostridium difficile, чем ванкомицин.
Пример 4
Примеры композиций эремомицина.
Ниже представлены примеры предпочтительных композиций эремомицина, которые могут использоваться в способе лечения по настоящему изобретению. Композиции эремомицина получают общепринятыми стандартными методами («Фармацевтическая технология. Технология лекарственных форм», 2-ое изд., Москва, 2006 г.).
Таблица №2. Композиции эремомицина, выполненные в виде таблетки.
Представленные лиофилизаты можно растворять в подходящих солевых растворах (раствор Рингера, ацесоль, изотонический раствор) или воде и вводить внутривенно в концентрации не более 5 мг/мл
Оболочка капсулы может, например, содержать диоксид титана, лаурилсульфат натрия и красители.
Пример 5
Сравнение токсичности эремомицина и ванкомицина
Целью данного исследования являлось изучение острой токсичности эремомицина и выявление токсических эффектов только при внутривенном введении и сравнение полученным данных с таковыми для ванкомицина (при пероральном введении ванкомицин и эремомицин практически не всасываются в кровь и считаются абсолютно безопасными соединениями, их ЛД50 (перорально)>10000 мг/кг).
Поскольку информация о токсических дозах тестируемого объекта эремомицина отсутствовала, то выбор доз для исследования был сделан на основании предварительного пилотного исследования и известной информации по безопасности антибиотика ванкомицина из аналогичной фармакотерапевтической группы - трициклические антибиотики группы гликопептидов (Drugs, 2004, V. 64, Р. 913-936). По результатам предварительного исследования летальности дозы для крыс составили - 375 мг/кг, 550 мг/кг, 820 мг/кг, 1200 мг/кг, 1750 мг/кг; для мышей - 550 мг/кг, 730 мг/кг, 970 мг/кг, 1290 мг/кг, 1750 мг/кг.
По данным проведенной токсикометрии были установлены средне-летальные дозы для исследуемых препаратов (ЛД50), характеризующие позднюю отсроченную гибель животных - за период 14 дней.
ЛД50 (в/в, самцы крыс) = 941±179 мг/кг; ЛД10 (в/в, самцы крыс) = 308 мг/кг;
Л