Суппозитории нефопама для лечения острого и хронического болевого синдрома на гидрофильной эмульсионной основе и способ их получения
Иллюстрации
Показать всеГруппа изобретений относится к области фармацевтической промышленности, а именно к фармацевтической композиции для лечения острого и хронического болевого синдрома в форме ректальных суппозиториев, содержащей в 100 г композиции: 0,40-8,00 г нефопама гидрохлорида, 9,0-16,0 г полиэтиленоксида 400 и гидрофильную эмульсионную основу (до 100 г); а также к способу получения указанной композиции, согласно которому нефопама гидрохлорид суспендируют в полиэтиленоксиде 400, затем полученную суспензию смешивают с охлажденной до 40-45°С расплавленной гидрофильной эмульсионной основой и гомогенизируют, далее суппозиторную массу в жидком состоянии дозируют в контурные ячейковые упаковки и охлаждают до затвердевания. Группа изобретений обеспечивает предоставление стабильных при хранении суппозиториев анальгезирующего действия, сопоставимого по эффективности и длительности с таким действием при внутримышечном введении. 2 н. и 9 з.п. ф-лы, 4 пр., 8 табл.
Реферат
Изобретение относится к области медицины и химико-фармацевтической промышленности, конкретно к созданию, производству и применению лекарственных средств для лечения (купирования) острого и хронического болевого синдрома в разных областях медицины, в частности, в хирургии и онкологии.
Терапия острой боли остается актуальной проблемой в разных областях медицины, несмотря на значительное количество методов медикаментозного и немедикаментозного обезболивания. Особенно остро стоит проблема фармакотерапии острой боли в раннем послеоперационном периоде (Лебедева Р.Н., Никода В.В. Фармакотерапия острой боли. - М.: Изд-во «Аир-Арт», 1998. - 184 с.), а также у больных со злокачественными новообразованиями (ЗНО) (Состояние онкологической помощи населению России в 2008 году / Под ред. Чиссова В.И., Старинского В.В., Петровой Г.В. - М.: «ФГУ МНИОИ им. П.А. Герцена Росмедтехнологий», 2009. - 192 с.). Так, из 53 млн. ежегодно производимых в США хирургических вмешательств в 33-75% случаев пациенты жалуются на среднюю и сильную по интенсивности боль, несмотря на проводимую обезболивающую терапию (Wall P.D., Melzack R. (Eds) Textbook of pain, 3rd ed. - Churchill Livingstone, Edinburgh. - 1994). Число больных с ЗНО неуклонно растет и по прогнозу ВОЗ к 2030 г. увеличится в 3 раза (World Cancer Report 2008 // International Agency for Research on Cancer. - WHO, 2008).
Так, в России зарегистрировано более 2,6 млн больных с ЗНО; ежегодно от них умирает около 300 тысяч человек. Боль является значимым симптомом у половины больных на начальных стадиях болезни, у 75% больных при ее распространении и в 90% в терминальной стадии.
Не устраненная острая боль приводит к разнообразным осложнениям (сердечно-сосудистым, респираторным, тромбоэмболическим и др.), связанным с болевой рефлекторной импульсацией и иммобилизацией пациента и может также стать причиной развития хронической боли.
Наиболее распространенным и удобным методом лечения острой и хронической боли является системная фармакотерапия, т.е. терапия, при которой анальгетическое средство оказывает свое действие после всасывания в кровь при различных способах введения (внутрь, парентерально, интраназально, ректально и др.) (Овечкин A.M., Свиридов С.В. Послеоперационная боль и обезболивание: современное состояние проблемы // Регионарная анестезия и лечение острой боли. - 2006. - Т. 1, №10. - С. 61-76).
Лекарственные препараты, наиболее часто используемые для послеоперационной анальгезии, подразделяются на следующие группы:
- нестероидные противовоспалительные препараты (НПВП);
- опиаты и опиоиды (наркотические анальгетики);
- неопиоидные анальгетики центрального действия;
- местные анестетики;
- вспомогательные лекарственные средства.
Назначение препаратов должно осуществляться ступенчато: от неопиоидных анальгетиков (метамизол натрия, парацетамол, НПВП) к слабым опиоидам (кодеин, трамадол) и, при неэффективности комбинации этих средств, назначаются сильные опиоидные анальгетики (морфин в таблетках и ампулах, ТТС фентанила, промедол в ампулах) (Осипова Н.А., Абузарова Г.Р., Петрова В.В. Принципы применения анальгетических средств при острой и хронической боли. - М.: ФГБУ «МНИОИ им. П.А. Герцена Минздрав-соцразвития России», 2010. - 67 с.). В РФ препаратом второй ступени является только трамадол, а при его неэффективности назначают морфин, фентанил и, к сожалению, промедол, который при длительном приеме нейротоксичен. В РФ ступени лестницы обезболивания у онкологических больных распределяются следующим образом: 16% неопиоидные анальгетики, 35% слабые опиоиды, 49% сильные опиоиды. При этом по среднему медицинскому потреблению наркотических средств в Европе Россия находится на 38 месте: в 40 раз меньше чем в Греции и в 180 раз меньше чем в Германии.
Используемые для обезболивания у онкологических и постоперационных больных анальгетики (опиоиды, НПВС, парацетамол), как известно, характеризуются рядом побочных эффектов, среди которых тошнота и рвота, угнетение тромбоцитарного звена гемостаза, потенциальный риск почечной недостаточности и т.п..
После обширных внутриполостных хирургических вмешательств для достижения адекватного обезболивания нередко требуется использование опиоидов в дозах, вызывающих выраженный седативный эффект, угнетение дыхания, тошноту, рвоту, парез ЖКТ, дисфункцию желче- и мочевыводящих путей. Это негативно сказывается на состоянии оперированных больных, затрудняет их активизацию, способствует развитию респираторных, тромбоэмболических и других осложнений. Таким образом, врач, назначая тот или иной опиоидный аналгетик и желая избежать побочных эффектов, ограничивает суточную дозу препарата, что в большинстве случаев служит причиной неадекватного обезболивания. Двойственность положения заставляет клиницистов применять дополнительно препараты других лекарственных групп, способных потенцировать обезболивающий эффект опиоидов. Важным аспектом при этом является возможность снижения дозы опиоидов. При этом наиболее патогенетически обоснованным является применение НПВП.
Самым эффективным анальгетиком среди НПВП является кеторолак. Однако применение препаратов кеторолака вызывает сильные побочные эффекты, что ограничивает курс лечения кеторолаком (Компендиум 2011 - лекарственные препараты / Под ред. В.Н. Коваленко, А.П. Викторова. - К.: МОРИОН, 2011. - 2320 с.).
У пациентов, имеющих сопутствующую патологию, ограничивающую возможность назначения вышеуказанных препаратов, может быть целесообразным использование неопиоидного анальгетика центрального действия нефопама (Овечкин A.M. Роль и место нефопама (Акупана®) в схемах мультимодальной послеоперационной анальгезии // Регионарная анестезия и лечение острой боли - 2011. - Т. 5, №4. - С. 5-12. (http://medi.ru/doc/g740505.htm.
Нефопам (3,4,5,6-tetrahydro-5-methyl-1-phenyl-1H-2,5-benzoxazocine; № CAS: 13669-70-0) является циклическим аналогом антигистаминного препарата дифенгидрамина, по химической структуре он также близок к м-холинолитику орфенадрину (Martindal. The Complete Drug Reference. - London: Pharmaceutical Press, 2009. - 3694 p.).
Фармакологическое действие препарата реализуется на спинальном и супраспинальном уровнях ЦНС путем влияния на нисходящие моноаминергические пути контроля болевого импульса, а именно - путем ингибирования обратного синаптического захвата серотонина, норадреналина и дофамина. Нефопам обладает слабыми антихолинергическими, антигистаминными и симпатомиметическими свойствами.
Нефопам характеризуется хорошей переносимостью даже при длительном (несколько недель) применении у большинства пациентов с хронической болью. К уникальным терапевтическим свойствам препарата относят также его способность купировать боль без угнетения дыхания и отсутствие эффекта привыкания при длительном использовании (Evans M.S., Lysakowski С, M.R. Nefopam for the prevention of postoperative pain: quantitative systematic review // Br. J. Anaesth. - 2008. - Vol. 101. - P. 610-617). Это позволяет применять нефопам не только при острой боли, но и длительно при хронической боли, что выгодно отличает нефопам от опиоидов и НПВС, в частности, кеторолака.
Нефопам применяют при болевом синдроме различной этиологии и интенсивности (при травмах, в постоперационном периоде, для обезболивания родов, при зубной боли, миалгии, почечной и печеночной колике и др.), а также как средство премедикации перед болезненными медицинскими процедурами.
Мировая номенклатура лекарственных форм нефопама включает только раствор для инъекций (20 мг/мл) и таблетки, покрытые оболочкой, по 30 мг [9]; при этом в России зарегистрированы лишь растворы для инъекционного введения (Государственный реестр лекарственных средств России (http://www.grls.rosminzdrav.ru). Растворам для инъекций свойственны недостатки: травматизация больного при введении препарата, необходимость наличия стерильного шприца и медицинского персонала, возможность заражения больного инфекциями, связанными с оказанием медицинской помощи, особенно в случае нарушения кожных покровов и др. Пероральный прием в ряде случаев затруднен или нежелателен. Схема парентерального дозирования нефопама предусматривает от 3 до 6 инъекций в сутки (до 180 мг); прием внутрь - 1-3 таблетки 3 раза в сутки (до 270 мг) (Kyung Hoon Kim, Salahadin Abdi. Rediscovery of nefopam for the treatment of neuropathic pain // Korean J. Pain. - 2014. - Vol. 27, №2. - P. 103-111. Режим доступа: http://dx.doi.Org/10.3344/kjp.2014.27.2.103).
Альтернативой инъекционному лечению и пероральному приему может служить применение нефопама в новой лекарственной форме ректальных суппозиториев.
Ректальные суппозитории, как лекарственная форма могут обладать определенными преимуществами: высокой относительной биодоступностью лекарственного вещества, обусловливающей эффективность системного фармакотерапевтического действия, сопоставимую с его эффективностью при инъекционном введении; простотой и возможностью применения в амбулаторных условиях, отсутствием влияния на действующее вещество кишечного сока, возможностью применения у больных с рвотным рефлексом, отсутствием травматизации при введении.
Таким образом, существует потребность в болеутоляющем лекарственном средстве центрального действия, содержащем нефопам, применение которого не было бы затруднено в амбулаторных условиях и не было бы ограничено у пациентов с рвотным рефлексом и дистрофией мышц. Для этого в качестве технического решения могут быть предложены фармацевтические композиции в форме ректальных суппозиториев.
Ректальные суппозитории - твердые однодозовые лекарственные средства, которые по форме, объему и консистенции должны подходить для ректального применения. Суппозитории имеют твердую консистенцию при комнатной температуре и плавятся при температуре тела (Приложение 1 к Отраслевому стандарту ОСТ 91500.05.001-00 «Стандарты качества лекарственных средств. Основные положения»). Суппозитории готовят на липофильных или гидрофильных основах (Технология изготовления лекарственных форм / Под ред. Э.М. Аванесьянца. - Ростов-на-Дону: «Феникс», 2002. - С. 296-300).
При производстве готовых лекарственных средств в подавляющем большинстве случаев в качестве липофильных основ применяют различные марки твердого жира, а в качестве гидрофильных основ используют сплавы полиэтиленоксидов (ПЭО) с разными молекулярными массами, например, ПЭО-1500 80% и ПЭО-400 20%. В аптечных условиях в качестве липофильной основы применяют масло какао.
ПЭО основы имеют существенный недостаток, связанный с их быстрым и сильным дегидратирующим действием на слизистую оболочку прямой кишки, которое приводит к выраженному послабляющему эффекту вплоть до диареи, что может препятствовать как всасыванию лекарственных веществ в системный кровоток, так и проявлению терапевтического действия.
Суппозитории готовят разными методами: выливанием, прессованием и выкатыванием. Последний метод применяется для изготовления суппозиториев на основе масло какао в условиях аптек. Основным методом изготовления суппозиториев при промышленном производстве является выливание. Этот метод включает такие стадии, как: 1) приготовление суппозиторной основы при повышенной температуре, обеспечивающей ее жидкую консистенцию; 2) введение в основу лекарственных веществ и гомогенизацию; 3) дозирование расплавленной суппозиторной массы в ячейковые контурные упаковки и охлаждение; 4) упаковка и маркировка готовой продукции.
Известна фармацевтическая композиция, включающая эффективное количество опиоидного анальгетика налбуфина гидрохлорида, растворенного в гидрофильной эмульсионной основе, содержащей формообразователи (полиэтиленоксиды с высокой молекулярной массой), полоксамер (смачиватель и формообразователь), наполнитель (твердый жир), комплексный эмульгатор и два растворителя: пропиленгликоль и полиэтиленоксид 400 (Патент RU 2513514 С1, опубл. 20.04.2014).
Однако применение налбуфина ограничено (в частности, в амбулаторных условиях) в связи с тем, что он является наркотическим опиоидным анальгетиком, и суппозитории налбуфина не могут применяться длительно при хронической боли.
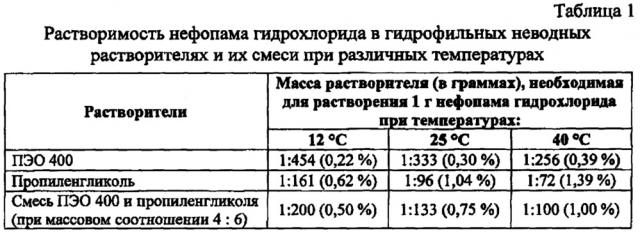
Для эффективности системного анальгетического действия нефопама гидрохлорид также должен был бы находиться в суппозиторной основе в виде истинного раствора, поскольку степень и скорость всасывания лекарственного вещества в растворенном состоянии через слизистую оболочку прямой кишки должны быть больше, чем в виде суспензии. Однако нефопама гидрохлорид не растворим в твердом жире и масло какао, а также в полиэтиленоксидах с высокой молекулярной массой. Кроме того, непофама гидрохлорид при температуре хранения суппозиториев около 12°С мало растворим в пропиленгликоле 1:161, мало растворим в полиэтиленоксиде 400 1:454 и мало растворим в смеси пропиленгликоля и ПЭО 400 (6:4) 1:196. Поэтому трудно прогнозировать высокую эффективность суппозиториев с нефопамом на гидрофильной эмульсионной основе, сопоставимую с эффективностью инъекции нефопама при внутримышечном введении, а тем более на основе твердого жира и полиэтиленоксидной основе.
Задача данного изобретения заключается в расширении арсенала фармацевтических композиций для лечения болевого синдрома умеренной и высокой интенсивности в форме суппозиториев, которые можно будет применять в амбулаторных условиях, при отсутствии недостатков, свойственных растворам для инъекций и связанных с травматизацией больного при введении препарата, необходимостью наличия стерильного шприца и медицинского персонала, возможностью заражения больного инфекциями, связанными с оказанием медицинской помощи и др. Задача также заключается в разработке способов изготовления этих композиций.
Технический результат данного изобретения состоит в обеспечении эффективного анальгезирующего действия ректальных суппозиториев, содержащих нефопама гидрохлорид, сопоставимого по эффективности и длительности с анальгетическим действием нефопама гидрохлорида при внутримышечном введении. Кроме того суппозитории имеют высокую стабильность при хранении по количественному содержанию активного вещества с течением времени.
Для решения поставленной задачи предлагается применение нефопама гидрохлорида в форме ректальных суппозиториев на гидрофильной эмульсионной основе, содержащей растворитель полиэтиленоксид 400 для лечения острого и хронического болевого синдрома.
А именно, предлагается фармацевтическая композиция для лечения болевого синдрома умеренной и высокой интенсивности в форме суппозиториев, включающая в качестве действующего вещества нефопама гидрохлорид и содержащая гидрофильную эмульсионную суппозиторную основу, включающую полиэтиленоксид 400, в которой доля нефопама гидрохлорида от 80 до 95 масс. % находится в виде суспензии, при следующем соотношении компонентов, г/100 г композиции:
| нефопама гидрохлорид | 0,40-8,00 |
| полиэтиленоксид 400 | 09,0-16,0 |
| гидрофильная эмульсионная основа | до 100 г |
В предпочтительном варианте до 90% суспендированных частиц нефопама гидрохлорида имеют размер от 0,5 до 90 мкм при среднем медианном размере частиц не более 30 мкм.
Полиэтиленоксид 400 (ПЭО 400) является растворителем, в котором мало растворяется нефопама гидрохлорид: при 12°С 1:450, при 25°С 1:330, при 40°С 1:250. Это позволяет использовать полиэтиленоксид как жидкую среду для суспендирования нефопама гидрохлорида. Последний при нагревании не будет растворяться в ПЭО 400 до такой степени, которая при последующем охлаждении приведет к неуправляемой кристаллизации. Кроме того, гидрофильная эмульсионная суппозиторная основа включает еще один растворитель (предпочтительно пропиленгликоль, который является усилителем проникновения нефопама гидрохлорида), формообразователи (смесь полиэтиленоксидов с высокими молекулярными массами и полоксамера, который также обеспечивает смачивание и биоадгезию), липофильный наполнитель, который является дисперсной фазой основы), и комплексный эмульгатор при следующем соотношении компонентов, г/100 г композиции:
| нефопама гидрохлорид | 0,40-8,00 |
| полиэтиленоксид 400 | 9,0-16,0 |
| пропиленгликоль | 14,0-21,0 |
| полиэтиленоксиды с высокими молекулярными массами | 35,0-60,0 |
| полоксамер | 1,0-15,0 |
| липофильный наполнитель | 1,5-7,5 |
| комплексный эмульгатор | 1,8-4,2 |
При этом в качестве формообразователей композиция предпочтительно содержит полиэтиленоксид (ПЭО) 4000 и полиэтиленоксид 1500 при следующем соотношении компонентов, г/100 г композиции:
| полиэтиленоксид 4000 | 5,0-20,0 |
| полиэтиленоксид 1500 | 30-40 |
Кроме того, в качестве комплексного эмульгатора композиция предпочтительно содержит смесь эмульгатора 1 рода и эмульгатора 2 рода. В частном случае в качестве эмульгатора 1 рода композиция содержит макрогола 20 цетостеариловый эфир, а в качестве эмульгатора 2 рода - цетостеариловый спирт при их массовом соотношении 1:5.
Для решения поставленной задачи также предлагается способ получения вышеописанной фармацевтической композиции на гидрофильной эмульсионной основе, по которому нефопама гидрохлорид суспендируют в полиэтиленоксиде 400, суспензию нефопама гидрохлорида смешивают с расплавленной гидрофильной эмульсионной суппозиторной основой и гомогенизируют; суппозиторную массу в жидком состоянии дозируют в контурные ячейковые упаковки и охлаждают.
В предпочтительном варианте нефопама гидрохлорид предварительно диспергируют в полиэтиленоксиде 400 с помощью подходящей коллоидной мельницы или ультразвука и/или с помощью коллоидной мельницы и ультразвука.
В другом предпочтительном варианте нефопама гидрохлорид предварительно диспергируют в сухом состоянии с помощью подходящей мельницы, а затем суспендируют в полиэтиленоксиде 400.
Заявляемое соотношение нефопама гидрохлорида и вспомогательных веществ (целевых добавок) в варианте состава фармацевтической композиции с гидрофильной эмульсионной суппозиторной основой является оптимальным, обеспечивая время распадаемости суппозиториев в пределах от 30 до 60 мин и устойчивость суппозиториев к разрушению от 2,0 кг до 3,5 кг. Кроме того, обеспечивается медленная и пролонгированная абсорбция воды суппозиторной основой, что необходимо для предотвращения послабляющего эффекта.
Смешанный гидрофильный неводный растворитель, состоящий из ПЭО (полиэтиленоксида) 400 и пропиленгликоля, является жидкой средой, в которой нефопама гидрохлорид большей частью суспендирован и немного растворен (табл. 1). Растворимость нефопама гидрохлорида в неводных гидрофильных растворителях уменьшается с понижением температуры (табл. 1).
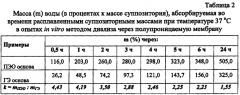
В качестве наполнителя основы используется твердый жир, который не обладает осмотической активностью. Вследствие этого путем введения твердого жира в одном суппозитории снижается содержание гидрофильных компонентов и соответственно уменьшается дегидратирующее действие суппозиторной массы (табл. 2) по сравнению с полиэтиленоксидной основой.
Для эмульгирования твердого жира применяется комплексный эмульгатор в концентрации 1,8-4,2 г/100 г. Предпочтительно, чтобы он содержал неионогенный эмульгатор 1 рода (например, макрогола 20 цетостеариловый эфир) и эмульгатор 2 рода (например, цетостеариловый спирт) при их массовых соотношениях от 0,3:1,5 до 0,7:3,5. Комплексный эмульгатор снижает степень и скорость абсорбции воды суппозиторной массой (табл. 2), в связи с чем уменьшает ее дегидратирующее действие на слизистую оболочку, что устраняет слабительный эффект.
В опытах in vitro методом диализа через полупроницаемую целлофановую мембрану была исследована кинетика абсорбции воды суппозиториями на разных основах (табл. 2).
Чем больше масса абсорбируемой воды в первые часы эксперимента, тем сильнее будет дегидратирующее действие суппозиториев на слизистую оболочку прямой кишки и тем вероятнее возникновение послабляющего эффекта или диареи. Суппозитории на ПЭО основе в течение 0,5-2 ч абсорбируют значительные количества воды до 260%, что свидетельствует о сильном дегидратирующем эффекте, который может приводить с большой вероятностью к возникновению диареи. Благодаря оптимальному подбору вспомогательных веществ, скорость и степень абсорбции воды суппозиториями на гидрофильной эмульсионной основе (ГЭ основе) оказываются гораздо меньше. Так, по сравнению с ПЭО основой в течение 0,5-2 ч ГЭ основа абсорбирует воды в несколько раз меньше, что практически исключает возникновение диареи (табл. 2).
Возможность осуществления изобретения может быть продемонстрирована ниже представленными конкретными примерами.
Пример 1.
В ПЭО 400 при температуре не ниже 5°С и не выше 45°С при перемешивании суспендируют (однородно распределяют) нефопама гидрохлорид без дополнительного диспергирования. В вакуумный реактор-гомогенизатор последовательно загружают предварительно отвешенные твердый жир, цетостеариловый спирт, макрогола 20 цетостеариловый эфир, полоксамер 188, ПЭО 4000, ПЭО 1500 и пропиленгликоль. Массу в реакторе перемешивают при нагревании до расплавления всех компонентов и эмульгируют расплавленный твердый жир. Суппозиторную основу охлаждают под вакуумом при перемешивании до температуры 40-45°С, после чего смешивают с суспензией нефопама гидрохлорида в ПЭО 400 и гомогенизируют. Суппозиторную массу в жидком состоянии дозируют в контурные ячейковые упаковки и охлаждают до температуры около 12°С. Проводят термосваривание верхней части ленты с ячейковыми упаковками, обрезают верхнюю кромку ленты и разрезают ленту.
Состав по примеру, г/100 г композиции:
| нефопама гидрохлорид | 8,00 |
| полиэтиленоксид 400 | 12,00 |
| пропиленгликоль | 16,20 |
| полиэтиленоксид 4000 | 12,00 |
| полиэтиленоксид 1500 | 35,00 |
| полоксамер 188 | 7,80 |
| твердый жир | 6,00 |
| макрогола | 20 |
| цетостеариловый эфир | 0,50 |
| цетостеариловый спирт | 2,50 |
| Итого: | 100,0 |
В композиции (пример 1) при температуре 12°С нефопама гидрохлорида в виде суспензии находится около 0,65 г (около 81% от 0,80 г). Распределение частиц по размерам представлено в таблице 3 (графа «Не измельченный»); основная масса частиц до 90% имеет размеры от 1,742 мкм до 195,615 мкм при среднем медианном диаметре 65,355 мкм.
Пример 2. Заявляемое лекарственное средство изготовляют аналогично примеру 1 с таким соотношением компонентов, г/100 г композиции:
| нефопама гидрохлорид | 1,60 |
| полиэтиленоксид 400 | 12,00 |
| пропиленгликоль | 18,20 |
| полиэтиленоксид 4000 | 12,00 |
| полиэтиленоксид 1500 | 35,00 |
| полоксамер 188 | 13,00 |
| твердый жир | 5,20 |
| макрогола | 20 |
| цетостеариловый эфир | 0,50 |
| цетостеариловый спирт | 2,50 |
| Итого: | 100,0 |
В композиции (пример 2) при температуре 12°С нефопама гидрохлорида в виде суспензии находится около 1,45 г (около 90,6% от 1,60 г). Распределение частиц по размерам представлено в таблице 3 (графа «Не измельченный»); основная масса частиц до 90% имеет размеры от 1,742 мкм до 195,615 мкм при среднем медианном диаметре 65,355 мкм.
Пример 3. Заявляемое лекарственное средство изготовляют аналогично примеру 1 с таким соотношением компонентов, г/100 г композиции:
| нефопама гидрохлорид | 2,40 |
| полиэтиленоксид 400 | 12,00 |
| пропиленгликоль | 18,20 |
| полиэтиленоксид 4000 | 12,00 |
| полиэтиленоксид 1500 | 35,00 |
| полоксамер 188 | 13,00 |
| твердый жир | 4,40 |
| макрогола | 20 |
| цетостеариловый эфир | 0,50 |
| цетостеариловый спирт | 2,50 |
| Итого: | 100,0 |
В композиции (пример 3) при температуре 12°С нефопама гидрохлорида в виде суспензии находится около 2,25 г (около 93,75% от 2,40 г). Распределение частиц по размерам представлено в таблице 3 (графа «Не измельченный»); основная масса частиц до 90% имеет размеры от 1,742 мкм до 195,615 мкм при среднем медианном диаметре 65,355 мкм.
Пример 4.
В ПЭО 400 при нагревании до 40°С подходящим способом диспергируют (измельчают) частички нефопама гидрохлорида и перемешивают для образования однородной суспензии. В вакуумный реактор-гомогенизатор последовательно загружают предварительно отвешенные твердый жир, цетостеариловый спирт, макрогола 20 цетостеариловый эфир, полоксамер 188, ПЭО 4000, ПЭО 1500 и пропиленгликоль. Массу в реакторе перемешивают при нагревании до расплавления всех компонентов и эмульгируют расплавленный твердый жир. Суппозиторную основу охлаждают под вакуумом при перемешивании до температуры 40-45°С, после чего смешивают с суспензией нефопама гидрохлорида в ПЭО 400 и гомогенизируют. Суппозиторную массу в жидком состоянии дозируют в контурные ячейковые упаковки и охлаждают. Проводят термосваривание верхней части ленты с ячейковыми упаковками, обрезают верхнюю кромку ленты и разрезают ленту.
Заявляемое лекарственное средство имеет такое же соотношение компонентов, г/100 г композиции, как и для примера 1. В композиции (пример 4) при температуре 12°С нефопама гидрохлорида в виде суспензии находится около 0,65 г (около 81% от 0,80 г). Распределение частиц по размерам представлено в таблице 3 (графа «Измельченный»); основная масса частиц до 90% имеет размеры от 0,499 мкм до 84,542 мкм при среднем медианном диаметре 25,585 мкм.
Таким образом, в испытуемых образцах нефопама гидрохлорида в виде суспензии находится от 0,65 г до 2,25 г в 100 г композиции, что составляет от 81,0% до 93,75% от содержания нефопама гидрохлорида в композиции. Данные о распределении частиц по размерам в суспензиях нефопама гидрохлорида в ПЭО 400 (без диспергирования и после диспергирования), измеренные с помощью лазерного дифрактометра, представлены в таблице 3.
Как видно из данных, приведенных в табл. 3, после диспергирования в жидкой среде размер суспендированных частиц нефопама гидрохлорида в разных фракциях уменьшился в 2,31-2,79 раза (в среднем в 2,54 раза), а после микронизации с помощью коллоидной мельницы и просеивания - в 2,54-4,21 раза (в среднем в 3,36 раза).
Были проведены сравнительные исследования анальгетической активности нефопама гидрохлорида в разных дозах при ректальном введении суппозиторной массы (примеры 1, 2, 3, 4) и внутримышечном введении препарата Нефопам раствор для инъекций 20 мг/мл на модели формалиновой гиперальгезии у крыс, которую вызывали подкожным введением 0,05 мл 5% раствора формалина в дорсальную поверхность правой задней стопы крыс (The formalin test: an evaluation of the method / Tjolsen A., Berge O., Hunskaar S. et al. // Pain. - 1992. - Vol. 51, №1. - P. 5-17) [17]. Препараты нефопама гидрохлорида вводили за 20 минут до инъекции формалина: суппозитории - ректально в дозах 20 мг/кг (примеры 1 и 4), 40 мг/кг (пример 2) и 60 мг/кг (пример 3 и 5), раствор нефопама для инъекций - внутримышечно в дозе 20 мг/кг в объеме 0,1 мл на 100 г массы тела. Дозы (в мг/кг массы крысы) рассчитывали по нефопама гидрохлориду.
О выраженности анальгетической активности сравниваемых препаратов судили по снижению интенсивности боли, о чем свидетельствовало устранение поведенческих признаков ее проявления.
Показатели болевого поведения регистрировали в динамике: в течение ранней фазы (5 мин после инъекции формалина) и поздней фазы болевой реакции - с 10-й по 15-ю, с 20-й по 25-ю, с 30-й по 35-ю, с 40-й по 45-ю и с 50-й по 55-ю мин после инъекции формалина.
Для количественной оценки выраженности боли в течение каждого из указанных 5-минутных (300 сек) интервалов регистрировали длительность периодов (сек): T1 - нормальной двигательной активности; Т2 - частичного нарушения двигательной активности (прихрамывания, легкого касания пола); Т3 - лифтинга (удержания лапы на весу), облизывания лапы (Тлиз), а также количество реакций подергивания/встряхивания лапы (N).
Критериями эффективности сравниваемых препаратов нефопама гидрохлорида служили [17]:
1. Индекс боли (ИБ), характеризующий среднюю интенсивность боли в течение 5-минутного (300 сек) интервала. Индекс боли (ИБ) рассчитывали по формуле:
ИБ=(T1+2×Т2+3×Т3)/300.
Таким образом, нормальная двигательная активность в течение 300 сек (T1=300, Т2=0, Т3=0) соответствует ИБ=1, а при максимально выраженной боли, сопровождающейся лифтингом лапы в течение всего временного интервала (Т1=0; Т2=0, Т3=300), ИБ=3.
2. Продолжительность сильной боли (Т, сек) в течение 5-минутного интервала. Симптомами сильной боли у животных служили наиболее выраженный показатель нарушения двигательной активности (лифтинг инъецированной лапы) и ее облизывание. Т рассчитывали как суммарную продолжительность симптомов лифтинга и облизывания лапы: Т=Т3+Тлиз.
3. Число реакций подергивания/встряхивания лапы (N).
Число подергиваний/встряхиваний (N) рассчитывали по формуле:
N=[(Xк-Xo)×100%]/Xк,
где Хк и Хо - соответствующий показатель в контрольной и опытной группах соответственно.
Анальгетический эффект (АЭ) по каждому показателю в каждой экспериментальной точке рассчитывали по формуле:
АЭ=[(Пк-По)/Пк]×100%,
где Пк и По - соответствующий показатель в контрольной и опытной группах соответственно.
Оценивали также суммарный анальгетический эффект (Σ АЭ) препаратов нефопама гидрохлорида по каждому из указанных критериев, рассчитывая его как площадь под кривой «время-эффект» методом трапеций.
Статистическую обработку результатов проводили общепринятыми в фармакологии методами, рассчитывая средние значения показателей () и стандартную ошибку (). Достоверность различий между средними значениями определяли по t-критерию Стьюдента. Вероятность полученных результатов оценивали на уровне значимости не менее 95% (р≤0,05) (Урбах В.Ю. Статистический анализ в биологических и медицинских исследованиях. - М.: Медицина, 1975. - 295 с.) [18].
Результаты исследований приведены в таблицах 4, 5, 6 и 7.
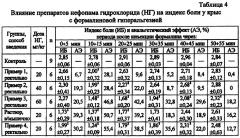
Как свидетельствуют данные табл. 4, 5 и 6, у контрольных нелеченных крыс инъекция формалина под кожу стопы вызывает выраженную боль, приводящую к нарушению их двигательной активности. У большинства крыс в течение всех 5-минутных интервалов наблюдения преобладал лифтинг инъецированной лапы, что свидетельствует о высокой выраженности боли. Индекс боли у нелеченных контрольных крыс стабильно удерживался на уровне 2,78-2,96, то есть был близок к максимальному уровню (табл. 4).
Нефопама гидрохлорид оказывает анальгетическое действие при ректальном введении суппозиторной массы в дозах от 20 мг/кг до 60 мг/кг, о чем свидетельствуют данные по трем критериям эффективности, представленные в таблицах 4-7. Как при ректальном, так и при внутримышечном введении, кинетика анальгетического эффекта была одинакова; максимальный эффект нефопама гидрохлорида достигался через 15 мин после инъекции формалина (35 мин после введения препарата) и далее активность препаратов снижалась, что практически не зависело от типа суппозиторной основы, дозы и пути введения (табл. 4-6).
Эффективность анальгетического действия при ректальном введении суппозиторной массы возрастает с увеличением дозы нефопама гидрохлорида с 20 мг/кг до 60 мг/кг (примеры 1, 2 и 3). При этом в дозах 20 и 40 мг/кг (примеры 1 и 2) суппозитории нефопама гидрохлорида, содержащие неизмельченную субстанцию, существенно уступают по анальгетическому эффекту, характеризуемому индексом боли (табл. 4) и продолжительностью сильной боли (табл. 5), раствору нефопама гидрохлорида для инъекций в дозе 20 мг/кг. Сопоставимые анальгетические эффекты оказывают раствор нефопама гидрохлорида для инъекций в дозе 20 мг/кг и суппозитории нефопама гидрохлорида, содержащие неизмельченную субстанцию, в дозе 60 мг/кг на гидрофильной и липофильной основах (примеры 3 и 5). При этом в период с 25-35 мин до 55 мин имеется тенденция к более высоким показателям анальгетической активности суппозиториев нефопама гидрохлорида.
Усиление анальгетического действия при ректальном введении суппозиторной массы с увеличением дозы нефопама гидрохлорида с 20 мг/кг до 60 мг/кг (примеры 1, 2 и 3) возрастает за счет увеличения содержания в суппозиторной массе нефопама гидрохлорида в виде суспензии, поскольку его масса в виде раствора одинакова во всех трех композициях.
Неожиданно было обнаружено, что нефопама гидрохлорид при ректальном введении в виде суппозиторной массы в дозе 20 мг/кг оказывает анальгетическое действие, сопоставимое по разным критериям эффективности с анальгетическим действием раствора нефопама гидрохлорида для инъекций в дозе 20 мг/кг и суппозиториев нефопама гидрохлорида в дозе 60 мг/кг (пример 3), если нефопама гидрохлорид диспергируется (измельчается) в ходе технологического процесса (пример 4). При этом суммарные анальгетические эффекты, характеризуемые индексом боли и продолжительностью сильной боли, при ректальном введении суппозиторной массы с измельченным нефопама гидрохлоридом оказывались больше (табл. 7).
Таким образом, результаты доклинических исследований подтвердили, что заявляемая фармацевтическая композиция в соответствии с изобретением обладает анальгетической активностью, усиленной или сопоставимой по эффективности и длительности с фармакологическим действием раствора нефопама для инъекций. При ректальном введении суппозиториев на гидрофильной эмульсионной основе отсутствуют условия для их дегидратирующего действия на слизистую оболочку прямой кишки и возникновения диареи. Различная эффективность анальгетического действия в зависимости от типа суппозиторной основы, доз и технологии изготовления дает возможность выбрать оптимальную дозу нефопама гидрохлорида, оптимальную массу суппозитория и оптимальную технологию препарата для его применения в разных клинических ситуациях. Ректальное применение заявляемого лекарственного средства атравматично, не осложнено в амбулаторных условиях и не ограничено у пациентов с рвотным рефлексом и дистрофией мышц.
Полученные композиции в форме суппозиториев, содержащие нефопама гидрохлорид на гидрофильной эмульсионной основе отвечают фармакопейным нормативным требованиям относительно фармако-технологических испытаний суппозиториев и однородности содержания действующего вещества и имеют срок годности более 2 лет.
Стабильност