Суппозитории нефопама для лечения острого и хронического болевого синдрома на липофильной основе и способ их получения
Иллюстрации
Показать всеГруппа изобретений относится к области фармацевтической промышленности, а именно к фармацевтической композиции для лечения острого и хронического болевого синдрома в форме ректальных суппозиториев, содержащей в 100 г композиции 0,40-8,00 г нефопама гидрохлорида в микронизированном виде и липофильную основу (до 100 г); а также к способу получения указанной композиции, согласно которому микронизированную субстанцию нефопама гидрохлорида суспендируют в расплавленной липофильной основе. Группа изобретений обеспечивает предоставление стабильных при хранении суппозиториев анальгезирующего действия, сопоставимого по эффективности и длительности с таким действием при внутримышечном введении. 2 н. и 2 з.п. ф-лы, 1 пр., 5 табл.
Реферат
Изобретение относится к области медицины и химико-фармацевтической промышленности, конкретно к созданию, производству и применению лекарственных средств для лечения (купирования) острого и хронического болевого синдрома в разных областях медицины, в частности в хирургии и онкологии.
Терапия острой боли остается актуальной проблемой в разных областях медицины несмотря на значительное количество методов медикаментозного и немедикаментозного обезболивания. Особенно остро стоит проблема фармакотерапии острой боли в раннем послеоперационном периоде (Лебедева Р.Н., Никода В.В. Фармакотерапия острой боли. - М.: Изд-во «Аир-Арт», 1998. - 184 с.), а также у больных со злокачественными новообразованиями (ЗНО) (Состояние онкологической помощи населению России в 2008 году / Под ред. Чиссова В.И., Старинского В.В., Петровой Г.В. - М.: «ФГУ МНИОИ им. П.А. Герцена Росмедтехнологий», 2009. - 192 с.). Так, из 53 млн ежегодно производимых в США хирургических вмешательств в 33-75% случаев пациенты жалуются на среднюю и сильную по интенсивности боль несмотря на проводимую обезболивающую терапию (Wall P.D., Melzack R. (Eds) Textbook of pain, 3rd ed. - Churchill Livingstone, Edinburgh. - 1994). Число больных с ЗНО неуклонно растет и по прогнозу ВОЗ к 2030 г. увеличится в 3 раза (World Cancer Report 2008 // International Agency for Research on Cancer. - WHO, 2008). Так, в России зарегистрировано более 2,6 млн больных с ЗНО; ежегодно из них умирает около 300 тысяч человек. Боль является значимым симптомом у половины больных на начальных стадиях болезни, у 75% больных при ее распространении и в 90% в терминальной стадии.
Не устраненная острая боль приводит к разнообразным осложнениям (сердечно-сосудистым, респираторным, тромбоэмболическим и др.), связанным с болевой рефлекторной импульсацией и иммобилизацией пациента и может также стать причиной развития хронической боли.
Наиболее распространенным и удобным методом лечения острой и хронической боли является системная фармакотерапия, т.е. терапия, при которой анальгетическое средство оказывает свое действие после всасывания в кровь при различных способах введения (внутрь, парентерально, интраназально, ректально и др.) (Овечкин A.M., Свиридов С.В. Послеоперационная боль и обезболивание: современное состояние проблемы // Регионарная анестезия и лечение острой боли. - 2006. - Т. 1, №10. - С. 61-76).
Лекарственные препараты, наиболее часто используемые для послеоперационной анальгезии, подразделяются на следующие группы:
- нестероидные противовоспалительные препараты (НПВП);
- опиаты и опиоиды (наркотические анальгетики);
- неопиоидные анальгетики центрального действия;
- местные анестетики;
- вспомогательные лекарственные средства.
Назначение препаратов должно осуществляться ступенчато: от неопиоидных анальгетиков (метамизол натрия, парацетамол, НПВП) к слабым опиоидам (кодеин, трамадол) и, при неэффективности комбинации этих средств, назначаются сильные опиоидные анальгетики (морфин в таблетках и ампулах, ТТС фентанила, промедол в ампулах) (Осипова Н.А., Абузарова Г.Р., Петрова В.В. Принципы применения анальгетических средств при острой и хронической боли. - М.: ФГБУ «МНИОИ им. П.А. Герцена Минздрав-соцразвития России», 2010. - 67 с.). В РФ препаратом второй ступени является только трамадол, а при его неэффективности назначают морфин, фентанил и, к сожалению, промедол, который при длительном приеме нейротоксичен. В РФ ступени лестницы обезболивания у онкологических больных распределяются следующим образом: 16% неопиоидные анальгетики, 35% слабые опиоиды, 49% сильные опиоиды. При этом по среднему медицинскому потреблению наркотических средств в Европе Россия находится на 38 месте: в 40 раз меньше, чем в Греции, и в 180 раз меньше, чем в Германии.
Используемые для обезболивания у онкологических и постоперационных больных анальгетики (опиоиды, НПВС, парацетамол), как известно, характеризуются рядом побочных эффектов, среди которых тошнота и рвота, угнетение тромбоцитарного звена гемостаза, потенциальный риск почечной недостаточности и т.п.
После обширных внутриполостных хирургических вмешательств для достижения адекватного обезболивания нередко требуется использование опиоидов в дозах, вызывающих выраженный седативный эффект, угнетение дыхания, тошноту, рвоту, парез ЖКТ, дисфункцию желче- и мочевыводящих путей. Это негативно сказывается на состоянии оперированных больных, затрудняет их активизацию, способствует развитию респираторных, тромбоэмболических и других осложнений. Таким образом, врач, назначая тот или иной опиоидный аналгетик и желая избежать побочных эффектов, ограничивает суточную дозу препарата, что в большинстве случаев служит причиной неадекватного обезболивания. Двойственность положения заставляет клиницистов применять дополнительно препараты других лекарственных групп, способных потенцировать обезболивающий эффект опиоидов. Важным аспектом при этом является возможность снижения дозы опиоидов. При этом наиболее патогенетически обоснованным является применение НПВП.
Самым эффективным анальгетиком среди НПВП является кеторолак. Однако применение препаратов кеторолака вызывает сильные побочные эффекты, что ограничивает курс лечения кеторолаком (Компендиум 2011 - лекарственные препараты / Под ред. В.Н. Коваленко, А.П. Викторова. - К.: МОРИОН, 2011. - 2320 с.).
У пациентов, имеющих сопутствующую патологию, ограничивающую возможность назначения вышеуказанных препаратов, может быть целесообразным использование неопиоидного анальгетика центрального действия нефопама (Овечкин A.M. Роль и место нефопама (Акупана®) в схемах мультимодальной послеоперационной анальгезии // Регионарная анестезия и лечение острой боли - 2011. - Т. 5, №4. - С. 5-12 (http://medi.ru/doc/g740505.htm).
Нефопам (3,4,5,6-tetrahydro-5-methyl-1-phenyl-1H-2,5-benzoxazocine; № CAS: 13669-70-0) является циклическим аналогом антигистаминного препарата дифенгидрамина, по химической структуре он также близок к м-холинолитику орфенадрину (Martindal. The Complete Drug Reference. - London: Pharmaceutical Press, 2009. - 3694 p.).
Фармакологическое действие препарата реализуется на спинальном и супраспинальном уровнях ЦНС путем влияния на нисходящие моноаминергические пути контроля болевого импульса, а именно - путем ингибирования обратного синаптического захвата серотонина, норадреналина и дофамина. Нефопам обладает слабыми антихолинергическими, антигистаминными и симпатомиметическими свойствами.
Нефопам характеризуется хорошей переносимостью даже при длительном (несколько недель) применении у большинства пациентов с хронической болью. К уникальным терапевтическим свойствам препарата относят также его способность купировать боль без угнетения дыхания и отсутствие эффекта привыкания при длительном использовании (Evans M.S., Lysakowski С., Tramer M.R. Nefopam for the prevention of postoperative pain: quantitative systematic review // Br. J. Anaesth. - 2008. - Vol. 101. - P. 610-617). Это позволяет применять нефопам не только при острой боли, но и длительно при хронической боли, что выгодно отличает нефопам от опиоидов и НПВС, в частности кеторолака.
Нефопам применяют при болевом синдроме различной этиологии и интенсивности (при травмах, в постоперационном периоде, для обезболивания родов, при зубной боли, миалгии, почечной и печеночной колике и др.), а также как средство премедикации перед болезненными медицинскими процедурами.
Мировая номенклатура лекарственных форм нефопама включает только раствор для инъекций (20 мг/мл) и таблетки, покрытые оболочкой, по 30 мг; при этом в России зарегистрированы лишь растворы для инъекционного введения (Государственный реестр лекарственных средств России (http://www.grls.rosminzdrav.ru). Растворам для инъекций свойственны недостатки: травматизация больного при введении препарата, необходимость наличия стерильного шприца и медицинского персонала, возможность заражения больного инфекциями, связанными с оказанием медицинской помощи, особенно в случае нарушения кожных покровов и др. Пероральный прием в ряде случаев затруднен или нежелателен. Схема парентерального дозирования нефопама предусматривает от 3 до 6 инъекций в сутки (до 180 мг); прием внутрь - 1-3 таблетки 3 раза в сутки (до 270 мг) (Kyung Hoon Kim, Salahadin Abdi. Rediscovery of nefopam for the treatment of neuropathic pain // Korean J. Pain. - 2014. - Vol. 27, №2. - P. 103-111. Режим доступа: http://dx.doi.org/10.3344/kjp.2014.27.2.103).
Альтернативой инъекционному лечению и пероральному приему может служить применение нефопама в новой лекарственной форме ректальных суппозиториев.
Ректальные суппозитории как лекарственная форма могут обладать определенными преимуществами: высокой относительной биодоступностью лекарственного вещества, обусловливающей эффективность системного фармакотерапевтического действия, сопоставимую с его эффективностью при инъекционном введении; простотой и возможностью применения в амбулаторных условиях, отсутствием влияния на действующее вещество кишечного сока, возможностью применения у больных с рвотным рефлексом, отсутствием травматизации при введении.
Таким образом, существует потребность в болеутоляющем лекарственном средстве центрального действия, содержащем нефопам, применение которого не было бы затруднено в амбулаторных условиях и не было бы ограничено у пациентов с рвотным рефлексом и дистрофией мышц. Для этого в качестве технического решения могут быть предложены фармацевтические композиции в форме ректальных суппозиториев.
Ректальные суппозитории - твердые однодозовые лекарственные средства, которые по форме, объему и консистенции должны подходить для ректального применения. Суппозитории имеют твердую консистенцию при комнатной температуре и плавятся при температуре тела (Приложение 1 к Отраслевому стандарту ОСТ 91500.05.001-00 «Стандарты качества лекарственных средств. Основные положения»). Суппозитории готовят на липофильных или гидрофильных основах (Технология изготовления лекарственных форм / Под ред. Э.М. Аванесьянца. - Ростов-на-Дону: «Феникс», 2002. - С. 296-300). При производстве готовых лекарственных средств в подавляющем большинстве случаев в качестве липофильных основ применяют различные марки твердого жира. В аптечных условиях в качестве липофильной основы применяют масло какао.
Липофильные основы перспективны для ректальных суппозиториев, поскольку в отличие от гидрофильных основ не оказывают послабляющего действия, но они могут плохо высвобождать суспендированные в них гидрофильные лекарственные вещества, в частности нефопам, который является гидрофильным веществом, растворимым в воде в концентрации 1% (1:100) при температуре около 20°С.
Суппозитории готовят разными методами: выливанием, прессованием и выкатыванием. Последний метод применяется для изготовления суппозиториев на основе масла какао в условиях аптек. Основным методом изготовления суппозиториев при промышленном производстве является выливание. Этот метод включает такие стадии, как: 1) приготовление суппозиторной основы при повышенной температуре, обеспечивающей ее жидкую консистенцию; 2) введение в основу лекарственных веществ и гомогенизацию; 3) дозирование расплавленной суппозиторной массы в ячейковые контурные упаковки и охлаждение; 4) упаковка и маркировка готовой продукции.
Лекарственные вещества в суппозиторную основу можно вводить в виде суспензии или в виде раствора.
Известны ректальные суппозитории с трамадола гидрохлоридом (100 мг), который суспендирован в липофильной основе, состоящей из твердого жира и глицерол (моно-, ди-, три-)алканоата (Медицинская энциклопедия VIDAL, http://www.vidal.ru/poisk_preparatov/tramadol~19014.htm. распечатано 20.11.2012). Они предназначены для применения при остром и хроническом болевом синдроме умеренной степени выраженности (перед- и послеоперационные периоды, злокачественные опухоли, травмы, невралгия). Однако эффективность трамадола ограничена его токсичностью и выраженными побочными эффектами. Максимальная суточная доза - 400 мг. Кроме того, суппозитории трамадола эффективны только при умеренной боли.
Задача данного изобретения заключается в расширении арсенала фармацевтических композиций для лечения болевого синдрома умеренной и высокой интенсивности в форме суппозиториев, которые можно будет применять в амбулаторных условиях, при отсутствии недостатков, свойственных растворам для инъекций и связанных с травматизацией больного при введении препарата, необходимостью наличия стерильного шприца и медицинского персонала, возможностью заражения больного инфекциями, связанными с оказанием медицинской помощи и др. Задача также заключается в разработке способов изготовления этих композиций.
Технический результат данного изобретения состоит в обеспечении эффективного анальгезирующего действия ректальных суппозиториев, содержащих нефопама гидрохлорид, сопоставимого по эффективности и длительности с анальгетическим действием нефопама гидрохлорида при внутримышечном введении. Кроме того, суппозитории имеют высокую стабильность по количественному содержанию активного вещества с течением времени.
Для решения поставленной задачи предлагается применение нефопама гидрохлорида в форме ректальных суппозиториев на липофильной основе для лечения острого и хронического болевого синдрома.
Для решения поставленной задачи также предлагается фармацевтическая композиция для лечения острого и хронического болевого синдрома в форме ректальных суппозиториев, содержащая нефопама гидрохлорид в микронизированной форме и липофильную основу при следующем соотношении компонентов, г/100 г композиции:
| нефопама гидрохлорид | 0,40-8,00 |
| липофильная основа | до 100 г |
В качестве липофильной основы предпочтительно используется твердый жир, а до 90% суспендированных частиц нефопама гидрохлорида имеют размер от 0,5 до 90 мкм при среднем медианном размере частиц не более 30 мкм.
Для решения поставленной задачи также предлагается способ получения вышеописанной фармацевтической композиции на липофильной основе, по которому микронизированную субстанцию нефопама гидрохлорида суспендируют в расплавленной липофильной основе.
Приводим конкретный пример осуществления изобретения.
Пример 1.
В вакуумный реактор-гомогенизатор загружают предварительно отвешенный и расплавленный твердый жир, а затем микронизированную субстанцию нефопама гидрохлорида. Расплавленный твердый жир при температуре 40-45°С смешивают с микронизированной субстанцией нефопама гидрохлорида и гомогенизируют. Суппозиторную массу в жидком состоянии дозируют в контурные ячейковые упаковки и охлаждают. Проводят термосваривание верхней части ленты с ячейковыми упаковками, обрезают верхнюю кромку ленты и разрезают ленту.
Полученное лекарственное средство имеет состав, г/100 г композиции:
| нефопама гидрохлорид | 2,40 |
| твердый жир | 97,60 |
| Итого: | 100,0 |
В композиции (пример 1) нефопама гидрохлорида в виде суспензии находится около 2,40 г (около 100% от 2,40 г). Распределение частиц: основная масса частиц до 90% имеет размеры от 1,275 мкм до 46,469 мкм при среднем медианном диаметре 19,919 мкм.
После диспергирования размер суспендированных частиц нефопама гидрохлорида в разных фракциях уменьшился в 2,31-2,79 раза (в среднем в 2,54 раза), а после микронизации с помощью коллоидной мельницы и просеивания - в 2,54-4,21 раза (в среднем в 3,36 раза).
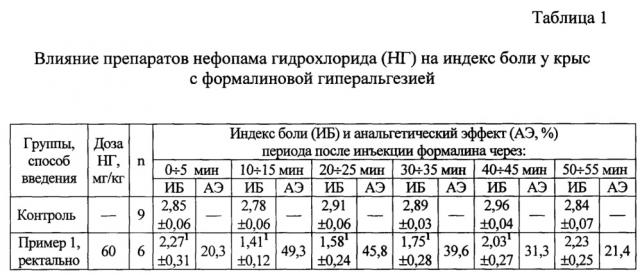
Были проведены сравнительные исследования анальгетической активности нефопама гидрохлорида в разных дозах при ректальном введении суппозиторной массы и внутримышечном введении препарата Нефопам раствор для инъекций 20 мг/мл на модели формалиновой гиперальгезии у крыс, которую вызывали подкожным введением 0,05 мл 5% раствора формалина в дорсальную поверхность правой задней стопы крыс (The formalin test: an evaluation of the method / Tjolsen A., Berge O., Hunskaar S. et al. // Pain. - 1992. - Vol. 51, №1. - P. 5-17). Препараты нефопама гидрохлорида вводили за 20 минут до инъекции формалина: суппозитории - ректально 60 мг/кг (пример 1), раствор нефопама для инъекций - внутримышечно в дозе 20 мг/кг в объеме 0,1 мл на 100 г массы тела. Дозы (в мг/кг массы крысы) рассчитывали по нефопама гидрохлориду.
О выраженности анальгетической активности сравниваемых препаратов судили по снижению интенсивности боли, о чем свидетельствовало устранение поведенческих признаков ее проявления.
Показатели болевого поведения регистрировали в динамике: в течение ранней фазы (5 мин после инъекции формалина) и поздней фазы болевой реакции - с 10-й по 15-ю, с 20-й по 25-ю, с 30-й по 35-ю, с 40-й по 45-ю и с 50-й по 55-ю мин после инъекции формалина.
Для количественной оценки выраженности боли в течение каждого из указанных 5-минутных (300 сек) интервалов регистрировали длительность периодов (сек): T1 - нормальной двигательной активности; Т2 - частичного нарушения двигательной активности (прихрамывания, легкого касания пола); Т3 - лифтинга (удержания лапы на весу), облизывания лапы (Тлиз), а также количество реакций подергивания/встряхивания лапы (N).
Критериями эффективности сравниваемых препаратов нефопама гидрохлорида служили:
1. Индекс боли (ИБ), характеризующий среднюю интенсивность боли в течение 5-минутного (300 сек) интервала. Индекс боли (ИБ) рассчитывали по формуле:
ИБ=(Т1+2×Т2+3×Т3)/300.
Таким образом, нормальная двигательная активность в течение 300 сек (Т1=300, Т2=0, Т3=0) соответствует ИБ=1, а при максимально выраженной боли, сопровождающейся лифтингом лапы в течение всего временного интервала (Т1=0; Т2=0, Т3=300), ИБ=3.
2. Продолжительность сильной боли (Т, сек) в течение 5-минутного интервала. Симптомами сильной боли у животных служили наиболее выраженный показатель нарушения двигательной активности (лифтинг инъецированной лапы) и ее облизывание. Т рассчитывали как суммарную продолжительность симптомов лифтинга и облизывания лапы: Т=Т3+Тлиз.
3. Число реакций подергивания/встряхивания лапы (N).
Число подергиваний/встряхиваний (N) рассчитывали по формуле:
N=[(Xк-Xo)×100%]/Xк,
где Хк и Хо - соответствующий показатель в контрольной и опытной группах соответственно.
Анальгетический эффект (АЭ) по каждому показателю в каждой экспериментальной точке рассчитывали по формуле:
АЭ=[(Пк-По)/Пк]×100%,
где Пк и По - соответствующий показатель в контрольной и опытной группах соответственно.
Оценивали также суммарный анальгетический эффект (Σ АЭ) препаратов нефопама гидрохлорида по каждому из указанных критериев, рассчитывая его как площадь под кривой «время-эффект» методом трапеций.
Статистическую обработку результатов проводили общепринятыми в фармакологии методами, рассчитывая средние значения показателей () и стандартную ошибку (). Достоверность различий между средними значениями определяли по t-критерию Стьюдента. Вероятность полученных результатов оценивали на уровне значимости не менее 95% (p≤0,05) (Урбах В.Ю. Статистический анализ в биологических и медицинских исследованиях. - М.: Медицина, 1975. - 295 с.). Результаты исследований приведены в таблицах 1, 2, 3 и 4.
Как свидетельствуют данные табл. 1, 2 и 3, у контрольных нелеченных крыс инъекция формалина под кожу стопы вызывает выраженную боль, приводящую к нарушению их двигательной активности. У большинства крыс в течение всех 5-минутных интервалов наблюдения преобладал лифтинг инъецированной лапы, что свидетельствует о высокой выраженности боли. Индекс боли у нелеченных контрольных крыс стабильно удерживался на уровне 2,78-2,96, то есть был близок к максимальному уровню (табл. 1).
Нефопама гидрохлорид оказывает анальгетическое действие при ректальном введении суппозиторной массы в дозах от 20 мг/кг до 60 мг/кг, о чем свидетельствуют данные по трем критериям эффективности, представленные в таблицах 1-4. Как при ректальном, так и при внутримышечном введении, кинетика анальгетического эффекта была одинакова; максимальный эффект нефопама гидрохлорида достигался через 15 мин после инъекции формалина (35 мин после введения препарата) и далее активность препаратов снижалась, что практически не зависело от типа суппозиторной основы, дозы и пути введения (табл. 1-3).
При этом суммарные анальгетические эффекты, характеризуемые индексом боли и продолжительностью интенсивной боли, при ректальном введении липофильной суппозиторной массы с микронизированной субстанцией нефопама гидрохлоридом оказывались больше, чем при инъекционном введении раствора нефопама гидрохлорида в дозе 20 мг/кг (табл. 4).
Таким образом, результаты доклинических исследований подтвердили, что заявляемая фармацевтическая композиция в соответствии с изобретением обладает анальгетической активностью, усиленной или сопоставимой по эффективности и длительности с фармакологическим действием раствора нефопама для инъекций. При ректальном введении суппозиториев на гидрофильной эмульсионной основе и липофильной основе отсутствуют условия для их дегидратирующего действия на слизистую оболочку прямой кишки и возникновения диареи. Различная эффективность анальгетического действия в зависимости от типа суппозиторной основы, доз и технологии изготовления дает возможность выбрать оптимальную дозу нефопама гидрохлорида, оптимальную массу суппозитория и оптимальную технологию препарата для его применения в разных клинических ситуациях. Ректальное применение заявляемого лекарственного средства атравматично, не осложнено в амбулаторных условиях и не ограничено у пациентов с рвотным рефлексом и дистрофией мышц.
Полученные композиции в форме суппозиториев, содержащие нефопама гидрохлорид на липофильной основе, отвечают фармакопейным нормативным требованиям относительно фармако-технологических испытаний суппозиториев и однородности содержания действующего вещества и имеют срок годности более 2 лет.
Стабильность по количественному содержанию активного компонента с течением времени отображена в табл. 5.
Таким образом, все вышеизложенное свидетельствует о выполнении поставленной в изобретении цели, которая заключается в создании новых фармацевтических композиций с нефопама гидрохлоридом в форме ректальных суппозиториев, проявляющих анальгетическое действие, усиленное или сопоставимое по эффективности и длительности с анальгетическим действием нефопама гидрохлорида при внутримышечном введении, что позволит применять лекарственные средства для лечения (купирования) острого и хронического болевого синдрома, а также в разработке способов изготовления этих композиций.
Примечания. 1 - p<0,05 сравнительно с контролем; n - число крыс в группе.
Примечания. 1 - p<0,05 сравнительно с контролем; n - число крыс в группе.
Примечания. 1 - p<0,05 сравнительно с контролем; n - число крыс в группе.
1. Фармацевтическая композиция для лечения острого и хронического болевого синдрома в форме ректальных суппозиториев, содержащая нефопама гидрохлорид в микронизированном виде и липофильную основу при следующем соотношении компонентов, г/100 г композиции:
| нефопама гидрохлорид | 0,40-8,00 |
| липофильная основа | до 100 г |
2. Композиция по п. 1, отличающаяся тем, что в качестве липофильной основы используется твердый жир.
3. Композиция по п.1 или 2, отличающаяся тем, что до 90% суспендированных частиц нефопама гидрохлорида имеют размер от 0,5 до 90 мкм при среднем медианном размере частиц не более 30 мкм.
4. Способ получения фармацевтической композиции по любому из пп. 1-3, по которому микронизированную субстанцию нефопама гидрохлорида суспендируют в расплавленной липофильной основе.