Способ моделирования хронической токсической коагулопатии у экспериментальных животных
Иллюстрации
Показать всеИзобретение относится к экспериментальной медицине, а именно к токсикологии и экологии, и может быть использовано для моделирования хронической токсической коагулопатии у экспериментальных животных. Для этого проводят ежедневное 1 раз в сутки введение в желудок крысы раствора хлорида никеля в дозе 5 мг/кг в пересчете на металл. При этом в единице раствора, равной 0,2 мл, содержится 0,5 мг никеля. Введение осуществляют в течение 60 дней. Способ обеспечивает развитие коагулопатии у животного за счет оптимальной дозы и срока воздействия металла, что может быть использовано при поиске средств для профилактики и лечения указанной патологии. 1 табл., 1 пр.
Реферат
Изобретение относится к экспериментальной медицине и может быть использовано для изучения механизмов нарушения системы гемостаза у экспериментальных животных при хроническом отравлении тяжелыми металлами, в частности никелем, а также для экспериментальной разработки методов и средств профилактики и лечения нарушений гемостаза.
Избыточное поступление в организм тяжелых металлов в результате загрязнения окружающей среды и в эксперименте приводит к их накоплению в организме, повреждению и нарушению функций органов-«мишеней» повреждающего воздействия (Авцын А.П. и соавт., 1991). Показано, что поступивший в организм никель накапливается преимущественно в почках и печени, обуславливая наиболее выраженное поражение этих органов (Брин В.Б. и соавт., 2012). Одним из механизмов токсического действия никеля на организм является активация процессов перекисного окисления липидов и подавление механизмов антиоксидантной защиты клетки (Arif T.J., Mudsser A., Kehkashan S., 2015).
Показано, что ключевая роль в формировании адаптивного ответа при действии на организм любых неблагоприятных факторов принадлежит системе гемостаза (Киселев В.И., Шахматов И.И. 2011). Известно, что артериальная гипертензия, патология почек и печени, оксидативный стресс являются частыми причинами коагулопатий (Батырова А.С., Баканов М.И., Сурков А.Н. Современные представления о системе гемостаза при хронических заболеваниях печени / Клиническая лабораторная диагностика, №8, 2015. С. 40-47), роль в развитии которых тяжелых металлов - недостаточно изучена. Существуют лишь единичные работы, описывающие разнонаправленные и противоречивые изменения в системе гемостаза под влиянием различных соединений тяжелых металлов.
Имеются указания о том, что тяжелые металлы обладают прокоагулянтной активностью в последовательности Ni2+>Cu2+>Со2+>Zn2+ (Mutch NJ1, Waters EK, Morrissey JH. Immobilized transition metal ions stimulate contact activation and drive factor ХII-mediated coagulation // J Thromb Haemost. 2012 Oct; 10(10): 2108-15. doi: 10.1111/j.1538-7836.2012.04890.x.), что было обусловлено активацией внутреннего пути свертывания крови через фактор контакта.
Напротив, Chen С.Y. и соавторы (Chen С.Y., Lin Т.Н. Effects of nickel chloride on human platelets: enhancement of lipid peroxidation, inhibition of aggregation and interaction with ascorbic acid // Journal of Toxicology and Environmental Health Part A. - 2001. - T. 62. - №.6. - C. 431-438) выявили снижение агрегационной активности тромбоцитов человека под влиянием никеля, на фоне выраженной активации процессов перекисного окисления липидов.
Известен способ (Arbi S, Oberholzer НМ, Van Rooy MJ, Venter С, Bester MJ. Effects of chronic exposure to mercury and cadmium alone and in combination on the coagulation system of Sprague-Dawley rats // Ultrastruct Pathol. 2017 Jun 15:1-9. doi: 10.1080/01913123.2017.1327909), включающий введение в организм крыс Sprague-Dawley солей кадмия и ртути, растворенных в питьевой воде, в дозе, превышающей ПДК в 1000 раз в течение 28 дней. Было выявлено, что соли кадмия и ртути способны активировать прокоагулянтные свойства тромбоцитов.
Недостатком способа является сложность определения количества кадмия и ртути, поступающих в организм с питьевой водой на единицу массы тела животного и отсутствие сведений о состоянии плазменного звена системы гемостаза при воздействии тяжелых металлов на организм экспериментального животного.
Известен способ (Бышевский А.Ш., Галян С.Л., Ральченко И.В., Рудзевич А.Ю., Алборов Р.Г., Винокурова Е.А., Волков А.И., Умутбаева М.К. Влияние комбинации витаминов-антиоксидантов на гемостаз при экспериментальной гипероксидации // Экспериментальная и клиническая фармакология. - 2005. - Том 68, №3 - С. 34-36), заключающийся в том, что крысам вводят ацетат свинца в дозе 0,5 мг/кг в течение 15 дней с пищей. Это вызывает снижение толерантности к тромбину, повышает уровень маркеров внутрисосудистого свертывания крови.
Недостатком способа является сложность определения количества свинца, поступающего в организм с пищей на единицу массы тела животного.
Наиболее близким к предлагаемому изобретению является способ моделирования субхронической свинцовой интоксикации животных, заключающийся в том, что животным ежедневно в течение 2-х недель через зонд в желудок вводят хлорид свинца в дозе 0,5 мг/кг массы тела (Подолян С.К. Вплив хлористого свинцю на систему агрегатного стану кровi у бiлих щурiв // Буковинський медичний вiсник. - 1998. - №3-4. - С. 131-136). Моделирование субхронической свинцовой интоксикации животных вызывает нарушения в системе регуляции агрегатного состояния крови и тканевого фибринолиза с развитием синдрома диссеминированного внутрисосудистого свертывания крови. Нарушения гемостаза при металлотоксикозе начинаются с токсического влияния на мембраны тромбоцитов, что приводит к увеличению их адгезивной и агрегационной активности, освобождению индукторов агрегации и вторичной активации коагуляционного гемостаза. Свинцовая интоксикация вызывает снижение активности противосвертывающей системы крови.
Недостатком данного способа является то, что с его помощью невозможно получить модель никелевой коагулопатии, так как в прототипе не рассматривалось влияние никеля на свертывающую систему крови. Известно, что разные металлы имеют преимущественные системы и органы «мишени» повреждающего воздействия. Воздействие хлорида свинца на организм в течение короткого времени не позволяет получить модель хронической коагулопатии. Хронический эксперимент, который проводят в течение двух месяцев, является более информативным, более приближенным к натуральным условиям (моделируя поступление токсиканта в организм с пищей и водой из окружающей среды в условиях антропогенного загрязнения) и позволяет подробно в разные сроки в динамике изучить формирование нарушений звеньев системы гемостаза (через один и два месяца) в условиях токсического воздействия, что особенно важно в коагулологии.
Такие противоречивость и разрозненность сведений и определили цель настоящего исследования.
Цель предлагаемого изобретения - создание модели хронической токсической коагулопатии.
Заявляемое изобретение направлено на решение задачи, заключающейся в создании способа моделирования хронической токсической коагулопатии у экспериментальных животных.
Решение этой задачи позволяет:
- создать способ моделирования хронической токсической коагулопатии у экспериментальных животных, повышающий воспроизводимость модели, удобный для проведения эксперимента на животных и экономически выгодный;
- изучить более полно и в динамике патофизиологические механизмы развития коагулопатии при хроническом воздействии никеля.
Для достижения этого технического результата в заявляемом способе экспериментальным животным ежедневно один раз в сутки в течение 60 дней вводят в желудок токсическое вещество, в качестве которого используют раствор хлорида никеля в дозе 5 мг/кг в пересчете на металл, где в единице раствора, равной 0,2 мл, содержится 0,5 мг никеля.
Данный способ отличается от прототипа использованием в качестве токсического вещества - хлорида никеля, длительностью и дозировкой введения металла.
Между отличительными признаками заявляемого изобретения и техническим результатом существует следующая причинно-следственная связь: длительное введение хлорида никеля в дозе 5 мг/кг приводит к развитию необратимой хронической токсической коагулопатии у экспериментальных животных, что является удобной и приближенной к натуральным условиям моделью.
По имеющимся у авторов сведениям совокупность существенных признаков, характеризующих сущность заявляемого изобретения, не известна, что позволяет сделать вывод о соответствии изобретения критерию «новизна».
По мнению авторов, сущность заявляемого изобретения не следует для специалистов явным образом из известного уровня медицины, так как из него не выявляется вышеуказанная возможность получения способа моделирования хронической токсической коагулопатии у экспериментальных животных. В научно-медицинской литературе нами не выявлено описание использования хлорида никеля для моделирования хронической токсической коагулопатии у экспериментальных животных. Следовательно, изобретение соответствует условию патентоспособности «изобретательский уровень», что позволяет сделать вывод о соответствии критерию «изобретательский уровень».
Совокупность существенных признаков, характеризующих сущность изобретения, в принципе может быть многократно использована в медицине с получением результата, заключающегося в более точном и легко воспроизводимом способе развития хронической токсической коагулопатии у экспериментальных животных под влиянием никеля, что позволяет сделать вывод о соответствии изобретения критерию «промышленная применимость».
Данный способ осуществляется следующим образом. Для получения токсического вещества хлорид никеля растворяют в стерильной дистиллированной воде таким образом, что в единице раствора, равной 0,2 мл, содержится 0,5 мг никеля (в пересчете на металл). На каждые 100 г веса крысы вводят 0,2 мл токсического раствора, что не является чрезмерной водной нагрузкой на организм экспериментального животного. Раствор хлорида никеля вводят через атравматичный зонд в желудок в дозе 5 мг/кг, ежедневно 1 раз в сутки в течение 60 дней одной группе животных (20 крыс).
Материалом для исследования является цельная кровь, а также плазма крови, богатая и бедная тромбоцитами. Забор крови, ее стабилизацию и получение образцов плазмы осуществляют с учетом международных стандартов по клинической лабораторной диагностике для исследований в области гемостаза (Момот А.П. Патология гемостаза. Принципы и алгоритмы клинико-лабораторной диагностики. - СПб.: ФормаТ, 2006. - 208 с.).
В пробах крови и плазмы определяют следующие показатели: активированное частичное тромбопластиновое время (АЧТВ) по Caen et al. (1968); протромбиновое время (ПВ) свертывания по Quick (1935); содержание фибриногена в плазме по Gauss (1961); активность антитромбина III в плазме крови по В.А. Макарову и соавт. (2002); количество растворимых фибрин-мономерных комплексов (РФМК) (Елыкомов В.А., Момот А.П. Авторское свидетельство 1371219, 1987. СССР / Способ определения количества растворимого комплекса фибрин-мономера в плазме крови); ХIIа-калликреин-зависимый фибринолиз (ХIIа-ЗЛ) - для оценки фибринолитической системы; количество тромбоцитов; АДФ - индуцированную агрегация тромбоцитов (Баркаган, З.С. Диагностика и контролируемая терапия нарушений гемостаза / З.С. Баркаган, А.П. Момот. М.: Ньюдиамед-АО, 2008. - 292 с.).
Все коагулологические исследования были выполнены с использованием наборов реагентов для исследования системы гемостаза НПО «Ренам» и ООО фирмы «Технология-Стандарт», Россия на турбидиметрическом коагулометре CGL-2110 и агрегометре АР-2110 «Solar» (Беларусь). Использование крыс в экспериментах осуществляли в соответствии с Европейской конвенцией по охране позвоночных (1986) и правилами лабораторной практики в Российской Федерации (приказ МЗ РФ №708 от 23.08.2010).
Статистическая обработка проводилась с учетом распределения признаков в группах с использованием критерия Шапиро-Уилки. В зависимости от распределения применяли t-критерий Стьюдента и непараметрический U-критерий Манна-Уитни. Статистическую обработку полученных результатов осуществляли с помощью стандартного пакета программ Statistica 10.0.
Пример. Крысам-самцам линии Вистар в течение 2 месяцев ежедневно один раз в сутки через зонд в желудок вводили раствор хлорида никеля в дозе 5 мг/кг веса животного (20 крыс весом 200-300 гр). Контролем служили интактные животные (20 крыс), содержащиеся в стандартных условиях вивария. Состояние системы гемостаза оценивали через один и два месяца.
В крови определяли показатели, характеризующие: сосудисто-тромбоцитарное звено гемостаза (количество тромбоцитов и их агрегационную активность); коагуляционное звено гемостаза (АЧТВ, ПВ, ТВ, содержание фибриногена, РФМК, активность AT (III), ХIIа-ЗЛ).
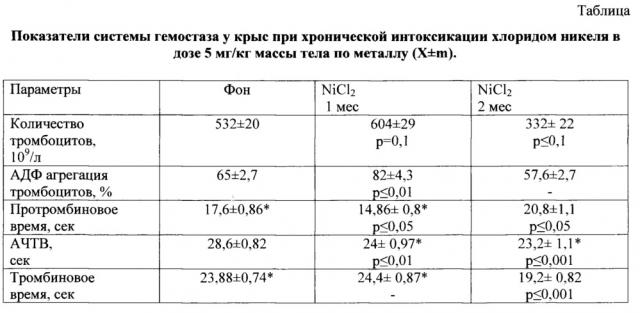
Через один месяц внутрижелудочного введения раствора хлорида никеля у экспериментальных животных выявляется гиперкоагуляционная направленность изменений системы гемостаза (Таблица). Хроническая интоксикация сопровождалась увеличением степени АДФ-индуцированной агрегации тромбоцитов (р<0,05). Со стороны плазменного гемостаза отмечалась активация внутреннего и внешнего путей свертывания (укорочение АЧТВ (р<0,01) и ПВ (р<0,05). Достоверно увеличивалось содержание фибриногена в плазме крови. В ответ на увеличение коагуляционного потенциала происходила активация противосвертывающей и фибринолитической систем. Это выражалось в увеличении активности АТ(Ш) и уменьшении времени ХIIа-зависимого фибринолиза (р<0,01 и р<0,05).
Через два месяца реакция системы гемостаза при более длительном воздействии металла характеризовалась дисбалансом механизмов свертывания крови. В процесс вовлекается как начальный, так и конечный этапы гемокоагуляции. Выявлялось угнетение внешнего механизма свертывания крови - протромбиновое время достоверно удлинялось (р<0,05). Регистрировалось ускореннное образование фибрина по укорочению тромбинового времени (р<0,05). При этом компенсаторного роста активности противосвертывающей и фибринолитической систем уже не выявлялось. Происходило подавление активности АТ(III) и увеличение времени лизиса эуглобулиновой фракции плазмы крови (р<0,05). При этом уровень фибриногена в плазме крови не отличался от контроля. Регистрировалось появление растворимых фибрин-мономерных комплексов, являющихся одним из ранних маркеров тромбинемии. Полученные результаты отражены в таблице.
Примечание: * - обозначены признаки, не подчиняющиеся нормальному распределению; р - уровень статистической значимости различий признаков контрольной и опытных групп; n - количество особей в группе.
Предлагаемый способ моделирования хронической токсической коагулопатии у экспериментальных животных является эффективным, позволяет подробно изучить патофизиологические механизмы развития токсического влияния никеля на состояние системы гемостаза крови и может способствовать разработке и поиску средств для лечения и профилактики токсической коагулопатии.
Способ моделирования хронической токсической коагулопатии у экспериментальных животных, включающий ежедневное один раз в сутки введение в желудок токсического вещества экспериментальным животным, отличающийся тем, что в качестве токсического вещества используют раствор хлорида никеля в течение 60 дней в дозе 5 мг/кг в пересчете на металл, где в единице раствора, равной 0,2 мл, содержится 0,5 мг никеля.