Композиции и способы на основе dac hyp
Иллюстрации
Показать всеНастоящее изобретение относится к области биотехнологии, конкретно к композиции даклизумаба, и может быть использовано в медицине. Полученная композиция препарата даклизумаба подходит для подкожного введения и может быть применена при лечении индивидов, страдающих от рассеянного склероза. Заявленное изобретение отличается от известных аналогов иными профилями изоформ и N-связанного гликозилирования и проявляет более низкую ADCC цитотоксичность. 2 н. и 6 з.п. ф-лы, 38 табл., 9 пр., 23 ил.
Реферат
1. Уровень техники
Даклизумаб (DAC) представляет собой гуманизированное моноклональное IgG1 антитело, которое связывается с альфа-субъединицей (CD25 или Tac) высокоаффинного рецептора человеческого интерлейкина-2 (IL-2), который экспрессируется на поверхности активированных, но не покоящихся, Т- и В-лимфоцитов. При связывании с CD25 на активированных клетках DAC блокирует образование комплекса высокоаффинного рецептора IL-2, тем самым блокируя индуцированную IL-2 пролиферацию активированных клеток.
По данным тестов прямого связывания на ФГА-бластах DAC связывается с CD25 с примерной аффинностью связывания (KD), равной 0,3 нМ, и ингибирует пролиферацию ФГА-бластов в зависимости от концентрации (Hakimi et al., 1993, J. Immunol., 151(2):1075-1085). В субоптимальной концентрации IL-2 (2,5 нг/мл) 15 нМ DAC ингибирует пролиферацию IL-2-зависимой клеточной линии Kit225/K6 на 50% (Pilsonn et al., 1997, J. Immunol., 159(3):1543-1556). В тесте оценки IL-2-зависимой пролиферации Т-клеток, индуцированной антигеном, наблюдали 50% ингибирование пролиферации под действием DAC в пределах концентраций 0,5-1 мкг/мл (3-7 нМ) (Junghans et al., 1990, Cancer Res., 50(5):1495-502).
Ранее вариант DAC был промышленно доступным для лечения острого отторжения аллотрансплантата у пациентов с трансплантированной почкой в качестве дополнительной терапии к схеме лечения иммуносупрессорами, которая включала циклоспорин и кортикостероиды Hoffman-La Roche, Inc., под торговым наименованием ZENAPAXTM. ZENAPAXTM выпускался в виде концентрата для последующего разведения и внутривенного введения. Каждый флакон концентрата содержал 5 мл раствора, содержащего 5 мг/мл DAC, 3,6 мг/мл фосфата натрия однозамещенного моногидрата, 11 мг/мл фосфата натрия двузамещенного моногидрата, 4,6 мг/мл хлорида натрия, 0,2 мг/мл полисорбата 80 и HCl и/или NaOH, в количестве, достаточном для доведения рН до 6,9. Рекомендованная доза для взрослых и детей составляла 1,0 мг/кг при разведении рассчитанного объема 25 мг/5 мл концентрата ZENAPAXTM 50 мл 0,9% стерильного раствора хлорида натрия и внутривенном введении в периферическую или центральную вену в течение 15 мин.
Также DAC показал эффективность в лечении увеита (Nussenblatt et al., 2004, FOCIS 2004 meeting; July 18-23, Montreal, QC. Abstract 4688; Nussenblatt et al., 2003, J. Autoimmun., 21:283-293) и рассеянного склероза (см., например, Bielekova et al., 2004, Proc. Natl., Acad. Sci. USA, 101(23):8705-8708; Rose et al., 2007, Neurology, 69:785-789; патент США № 7258859) и в настоящее время является предметом проводимых клинических испытаний в лечении рассеянного склероза. Несмотря на имеющиеся сведения о том, что DAC является безопасным и эффективным, желательны высококонцентрированные жидкие композиции, имеющие длительный срок хранения, и которые удобно вводить без дополнительной формуляции или манипуляций, а также новые молекулы даклизумаба с улучшенными свойствами, такими как повышенная безопасность, по сравнению с ZENAPAX DAC.
2. Сущность изобретения
Как уже упоминалось в разделе «Уровень техники», даклизумаб представляет собой гуманизированное моноклональное IgG1 антитело, которое специфически связывается с альфа-субъединицей (также относящейся далее к «CD25» или «Tac») рецептора человеческого интерлейкина-2 (IL-2), который является важным медиатором активации лимфоцитов. Ранее вариант DAC был промышленно доступным от Hoffman-La Roche, Inc., под торговым наименованием ZENAPAXTM, который проявил себя безопасным и эффективным препаратом в лечении отторжения аллотрансплантата почек, при использовании в качестве дополнительной терапии к схеме лечения иммуносупрессорами, которая включала циклоспорин и кортикостероиды (см., например, European Medicines Agency («EMEA») под наименованием ZENAPAX), и также показавшего эффективность в лечении рассеянного склероза (см., например, Bielekova et al., 2004, Proc. Natl., Acad. Sci. USA, 101(23):8705-8708; Rose et al., 2007, Neurology, 69:785-789; патент США № 7258859). Согласно EMEA ZENAPAX DAC экспрессируют в клетках GS-NS0 (клетках мышиной миеломы) и выделяют способом, включающим хроматографию на Q-сефарозе, хроматографию на S-сефарозе, диафильтрацию, хроматографию на Q-сефарозе II, ультрафильтрацию, гель-фильтрацию на S-300 и ультрафильтрацию. В настоящее время было установлено, что даклизумаб, экспрессированный в клеточной линии NS0, которая адаптирована к росту в бессывороточных, не содержащих холестерина и других продуктов животного происхождения средах, и выделенный другим способом, имеет характеристики и свойства, отличные от, и в некоторых отношениях, превосходящие даклизумаб ZENAPAX («ZENAPAX DAC»). Этот новый даклизумаб, упомянутый далее как «DAC HYP», имеет иной профиль изоформ, чем ZENAPAX DAC (по данным катионообменной хроматографии); иной профиль N-связанного гликозилирования, чем ZENAPAX DAC, хотя в клетках NS0 экспрессируются обе формы даклизумаба; и более низкой ADCC цитотоксичностью по сравнению с ZENAPAX DAC в биологических тестах.
Например, за счет гетерогенности в N- и C-концах тяжелой цепи возможно образование изоформ даклизумаба. Аминокислотная последовательность зрелой VH тяжелой цепи даклизумаба начинается в положении 20 аминокислотной последовательности, представленной на Фиг. 2 (SEQ ID NO:4). N-концевой глутамин (Q) зрелой VH тяжелой цепи (выделен жирным шрифтом, подчеркнут на Фиг. 2) способен циклизоваться, образуя пироглутамат (pE). В некоторых случаях сигнальная пептидная последовательность может быть усечена, оставляя последовательность валин-гистидин-серин (VHS), соединенную с N-концевым остатком глутамина зрелой VH тяжелой цепи. Поскольку каждая молекула даклизумаба содержит две VH тяжелой цепи, то различные N-концевые изоформы даклизумаба могут включать формы, содержащие: (1) два остатка глутамина (Q/Q); (2) один остаток глутамина и одну последовательность VHS (Q/VHS или VHS/Q); (3) две последовательности VHS (VHS/VHS); (4) один остаток глутамина и один остаток пироглутамата (Q/pE или pE/Q); (5) один остаток пироглутамата и одну последовательность VHS (pE/VHS или VHS/pE) и (6) два остатка пироглутамата (pE/pE). Также возможны различные С-концевые изоформы, которые содержат 0, 1 или 2 С-концевых остатка лизина (K) (0K, 1K или 2K), приводя к образованию сложного изоформного профиля.
Чрезвычайно удивительно, но, несмотря на то, что N-концевые глутамины VH тяжелой цепи ZENAPAX DAC полностью циклизуются с образованием пироглутамата, полной циклизации не достигается для DAC HYP. По данным катионообменной хроматографии DAC HYP отличается пиком изоформы pE/Q и пиком изоформы Q/VHS. Не желая связываться с теорией, полагают, что на данные уникальные изоформы pE/Q и Q/VHS может оказывать влияние лидерная последовательность, используемая для экспрессии DAC HYP. Следовательно, в одном аспекте настоящее изобретение относится к композициям даклизумаба, в которых изоформа pE/Q составляет 3-17%, 3-15%, 5-15%, более предпочтительно 5-12% или 7-12% от N-концевых изоформ, и/или изоформа Q/VHS составляет 1-15%, более предпочтительно 3-12% от N-концевых изоформ по данным катионообменной хроматографии.
В некоторых вариантах осуществления композиция даклизумаба отличается профилем катионообменной хроматографии, который по существу аналогичен представленному на Фиг. 18, или профилем DAC HYP, представленным на Фиг. 23.
Даклизумаб содержит N-связанные олигосахариды, присоединенные к остатку Asn 296 тяжелой цепи. Когда эти N-связанные олигосахариды отщепляют с использованием амидазы PNGaseF и анализируют ВЭЖХ, то DAC HYP имеет профиль гликозилирования, отличный от ZENAPAX DAC, несмотря на тот факт, что оба продуцируются рекомбинантным путем в клеточной линии NS0. Действительно, профиль гликозилирования DAC HYP является необычно однородным. Как показано на верхней панели Фиг. 21, профиль гликозилирования ZENAPAX DAC отличается пиками, представляющими олигосахариды G0-GlcNAc, G0, G1, Man5, G2, Man6, Man7 и сиалилированный олигосахарид. На нижней панели Фиг. 21 показано, что профиль гликозилирования DAC HYP отличается двумя основными пиками, соответствующими гликоформам G0-GlcNAc и гликоформам G0, и минорным пиком, соответствующим гликоформе G1. Гликоформы G0-GlcNAc могут составлять от примерно 5% до примерно 20% AUC, как правило, от 7,2% до 14,6% AUC. Гликоформы G0 могут колебаться от 70% до 99,2% AUC, обычно от 80,9% до 99,2% AUC. Гликоформа G1 может колебаться от 1% до 9% AUC, как правило, от 1,4% до 3,8% AUC. Сиалилированные олигосахариды составляют 1,0% от общей AUC или менее.
Иммуногенность и высокая эффекторная функция могут стать проблемой для лекарственных препаратов с длительным введением. Кроме того, быстрый клиренс может приводить к снижению доступности лекарственного препарата. Как хорошо известно специалистам в данной области, различия в паттернах гликозилирования лекарственных антител могут приводить к различиям в иммуногенности. Антитела, обладающие высокооднородными паттернами гликозилирования, как это имеет место для DAC HYP, могут обеспечивать преимущественные профили иммуногенности, уровни ADCC и клиренса. Кроме того, биологические соединения, имеющие более однородные профили гликозилирования, снижают вариации «партия от партии» и могут повышать постоянство и стабильность.
Следовательно, еще в одном аспекте настоящее изобретение относится к композициям даклизумаба, которые отличаются однородным профилем N-связанного гликозилирования. В одном варианте осуществления композиция даклизумаба отличается профилем N-связанного гликозилирования, который включает примерно 5-20% гликоформ G0-GlcNAc от общей AUC, и в некоторых вариантах осуществления примерно 5-18% или примерно 7-15% (например, 7,2-14,6% или 6,9-14,7%) гликоформ G0-GlcNAc от общей AUC (и в некоторых конкретных вариантах осуществления 7,3% гликоформ G0-GlcNAc от общей AUC) и примерно 70-99,2% гликоформ G0 от общей AUC, и в некоторых вариантах осуществления примерно 75-90%, примерно 75-92% или примерно 81-88% гликоформ G0 от общей AUC (и в некоторых конкретных вариантах осуществления 86% гликоформ G0 от общей AUC) по данным ВЭЖХ. Необязательно пик G1 составляет менее чем примерно 10% от общей AUC, менее чем примерно 5%, менее чем примерно 4% или менее чем примерно 3% от общей AUC, и в некоторых вариантах осуществления его содержание находится в пределах от примерно 1% до примерно 4% (например, от 1,4% до 3,8%) или от примерно 1% до примерно 3%. Гликоформы Man5 предпочтительно составляют примерно 3% от общей AUC или менее. В других вариантах осуществления композиция даклизумаба отличается профилем N-связанных гликоформ по данным ВЭЖХ, по существу аналогичным представленному на Фиг. 19.
В некоторых аспектах композиция даклизумаба по изобретению отличается суммой двух или более пиков гликоформ. В некоторых вариантах осуществления композиции даклизумаба характеризуются (а) двумя основными пиками, соответствующими гликоформам G0-GlcNAc и гликоформам G0, которые вместе составляют примерно от 75% до 100%, от примерно 80% до примерно 100% или от примерно 85% до примерно 100% от общей AUC, и/или (b) пиками, соответствующими гликоформам Man5, Man6 и Man7, которые вместе составляют примерно 6% от общей AUC или менее, и/или (с) пиками, соответствующими гликоформам Man6 и Man7, которые вместе составляют примерно 2% от общей AUC или менее. В таких вариантах осуществления процентное содержание G0-GlcNAc, G0, G1 и/или Man5 может представлять значения, приведенные в предшествующем абзаце.
Связывающие или ингибирующие свойства DAC HYP, а также функциональная активность DAC HYP, оцененные в тесте, позволяющем определить ингибирование индуцированной IL-2 пролиферации Т-клеток, аналогичны таковым для ZENAPAX DAC. Однако очень удивительно, что DAC HYP проявляет значительно меньшую ADCC цитотоксичность по сравнению с ZENAPAX DAC, что вероятно, является результатом, по меньшей мере частично, различий в уровне нефукозилированной маннозы в паттерне гликозилирования (см. Фиг. 21). Как показано на Фиг. 22А и 22В, DAC HYP проявляет ADCC-цитотоксичность, по меньшей мере на 25% более низкую по сравнению с ZENAPAX DAC по данным клеточного теста. Как известно специалистам в данной области, пониженная ADCC-цитотоксичность DAC HYP может быть полезной для назначений, включающих длительное введение, когда не желательна гибель клеток, например, при лечении рассеянного склероза или увеита. В данных контекстах, когда терапия назначается длительно, например, при лечении рассеянного склероза и других неонкологических показаний, то терапия DAC HYP может быть безопаснее по сравнению с лечением ZENAPAX DAC.
Следовательно, в еще одном аспекте изобретение относится к композициям даклизумаба, которые характеризуются проявлением более низкой ADCC-цитотоксичности примерно на 30%, 25%, 20%, 15%, 10%, 5% или даже более в концентрации 1 мкг/мл по данным теста в условиях in vitro с использованием соотношения эффектора к клеткам-мишеням, составляющего 25:1, 40:1, 50:1 или 60:1, например, при использовании Kit225/K6 в качестве клетки-мишени и/или с использованием эффекторных клеток PBMC от 3 или более, 6 или более, 10 или более, 50 или более здоровых доноров. В конкретных вариантах осуществления изобретение относится к композициям даклизумаба, которые характеризуются проявлением ADCC-цитотоксичности в пределах 5-30%, 10-30%, 15-30%, 15-30%, 5-25%, 10-25%, 20-30%, 15-25%, 15-35% или 20-35% в концентрации 1 мкг/мл по данным теста в условиях in vitro с использованием соотношения эффектора к клеткам-мишеням, составляющего 25:1, 40:1, 50:1 или 60:1, например, при использовании Kit225/K6 в качестве клетки-мишени и/или с использованием эффекторных клеток PBMC от 3 или более, 6 или более, 10 или более, 50 или более здоровых доноров. Более низкие уровни ADCC-цитотоксичности, наблюдаемые для DAC HYP по сравнению с ZENAPAX DAC, являются удивительными с учетом того, что DAC HYP является иммуноглобулином IgG1 и не содержит мутаций рамки считывания, о которых известно, что они приводят к снижению ADCC-цитотоксичности.
Профиль безопасности DAC HYP по сравнению с ZENAPAX DAC можно дополнительно повысить при использовании бессывороточного способа с высоким выходом, который позволяет получать высокоочищенный продукт, не содержащий бычьего сывороточного альбумина (BSA). Следовательно, настоящее изобретение относится к композиции даклизумаба, которая не содержит BSA и/или является продуктом способа культивирования клеток, в котором отсутствует BSA.
Композиции даклизумаба, характеризующиеся одним или более свойствами, описанными выше (композиции DAC HYP), можно легко получить рекомбинантной экспрессией в клетках млекопитающих. Не желая связываться с какой-либо конкретной теорией способа, полагается, что одна или более уникальных характеристик и/или свойств, обсужденных выше, могут быть результатом, по меньшей мере частично, применения высокопродуктивной рекомбинантной экспресионной системы. Этого можно достичь любым способом, таким как амплификация гена с использованием DHFR, или с использованием селектируемого гена-маркера под контролем слабого промотора, предпочтительно в комбинации с сильным промотором, регулирующим экспрессию интересующего белка (предпочтительно секретируемого белка). Не желая связываться с теорией, полагают, что выбор маркеров под контролем слабого промотора облегчает идентификацию стабильных трансфектантов, в которых экспресионный вектор интегрирован в хромосомную область, которая является транскрипционно активной, с получением высоких уровней экспрессии интересующего белка. В одном варианте осуществления слабый промотор, регулирующий экспрессию селектируемого маркера, представляет собой промотор SV40 (Reddy et al., 1978, Science, 200:494-502), в котором активность одной или более энхансерных областей снижена или элиминирована посредством частичной или полной делеции, необязательно в комбинации с сильным промотором, таким как промотор CMV IE (Boshart et al., 1985, Cell 41(2):521-530), регулирующим экспрессию интересующего белка.
Следовательно, в еще одном аспекте изобретение относится к векторам, подходящим для получения рекомбинантных клеточных линий, которые стабильно экспрессируют высокие уровни даклизумаба, такого как DAC HYP, в которых экспрессия селектируемого маркера находится под контролем промотора SV40, энхансерная функция которого снижена, посредством частичной делеции одной или более энхансерных последовательностей (обозначенных dE-SV40). Конкретная промоторная последовательность dE-SV40, которую можно использовать для получения клеточных линий со стабильной экспрессией, находится в положениях 6536-6735 вектора pHAT.IgG1.rg.dE (SEQ ID NO:5), приведенного на Фиг. 3А-3D и на Фиг. 3Е (SEQ ID NO:12). Различные варианты осуществления конкретных векторов, которые можно использовать для получения клеточных линий со стабильной экспрессией, описаны в заявке на патент США 61/565419, поданной 30 ноября 2011 г., и в международной заявке PCT/US11/62720, поданной 30 ноября 2011 г., которые включены в данный документ для сведения.
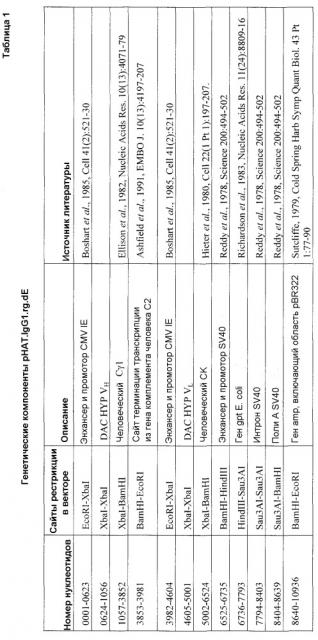
В общем, векторы, пригодные для экспрессии даклизумаба, такого как DAC HYP, будут содержать один или более элементов, характерных для pHAT.IgG1.rg.dE (описанного в разделе 5.1 ниже), таких как промотор. Две цепи даклизумаба можно расположить под отдельным транскрипционным контролем, но предпочтительно в одном и том же векторе, и их кодирующие области могут представлять кДНК или геномную ДНК, содержащую интроны и экзоны. В качестве альтернативы для разделения транскрипционного контроля две цепи могут экспрессироваться в виде одного транскрипта или одной открытой рамки считывания, с их кодирующими областями, разделенными внутренним сайтом входа рибосомы или самоотщепляющейся intein последовательностью, где последовательности, кодирующие тяжелую и легкую цепи, находятся под контролем одного промотора. Приведенным в качестве примера промотором является промотор и энхансер CMV IE (в положениях 0001-0623 и 3982-4604 pHAT.IgG1.rg.dE (SEQ ID NO:5)). Дополнительные элементы включают сайты инициации транскрипции (если отсутствует в выбранном промоторе), сайты терминации транскрипции и ориджины репликации. Примеры таких элементов показаны в таблице 1, в которой приводятся компоненты pHAT.IgG1.rg.dE.
В конкретном варианте осуществления, пригодном для экспрессии обеих тяжелой и легкой цепей даклизумаба, такого как DAC HYP, из одной экзогенной нуклеиновой кислоты в клетках NS0 используется селектируемый маркер, функционирующий в клетках млекопитающих, такой как неомицинфосфотрансфераза (neor), гигромицин В-фосфотрансфераза (hygr), гигромицин В-фосфотрансфераза (Hph), пуромицин N-ацетилтрансфераза (puror), бластицидин S-дезаминаза (bsrr), ксантин-гуанинфосфорибозилтрансфераза (gpt), глутаминсинтетаза (GS) или тимидинкиназа вируса простого герпеса (HSV-tk). В предпочтительном варианте осуществления селектируемый маркер в векторе по изобретению представляет собой селектируемый маркер гуанинфосфорибозилтрансферазу E. coli под контролем промотора SV40 без энхансерной активности, кодирующей последовательности, которую можно найти в положениях 6935-7793 вектора pHAT.IgG1.rg.dE (SEQ ID NO:5), приведенного на Фиг. 3А-3D.
В еще одном аспекте изобретение относится к клеткам-хозяевам, трансфицированным векторами, пригодными для получения рекомбинантным путем даклизумаба, например, такого как DAC HYP. Клетка-хозяин может представлять любую клетку млекопитающего, включая, например, клетки яичника китайского хомячка (CHO), мышиные миеломные клетки NS0, клетки Sp2/0, клетки PER.C6, клетки Vero, клетки BHK, клетки HT1080, клетки COS7, клетки WI38, клетки CV-1/EBNA, L-клетки, клетки 3T3, клетки HEPG2, клетки MDCK и клетки 293. После трансфекции вектор может интегрировать в геном с получением клеточной линии со стабильной продукцией. Специалистам в данной области, очевидно, понятно, что нежелательно включать продукты животного происхождения в композиции, предназначенные для введения людям. Следовательно, клетки-хозяева, для которых не требуется сыворотки крови или других продуктов животного происхождения для культивирования (например, холестерина), являются предпочтительными. Клетки-хозяева, для которых требуются такие продукты животного происхождения, можно адаптировать к использованию среды без сыворотки крови и других продуктов животного происхождения. Способ адаптации мышиных миеломных клеток NS0 к росту в бессывороточной и не содержащей холестерина среде, описан Hartman et al., 2007, Biotech.&Bioeng., 96(2):294-306, и Burky et al., 2007, Biotech.&Bioeng., 96(2):281-293. Конкретный штамм клеток NS0, адаптированный к росту в бессывороточной и не содержащей холестерина среде, стабильно трансфицирован вектором, описанным выше, который можно использовать для получения DAC HYP (клон 7А11-5Н7-14-43).
Специалистам в данной области, очевидно, понятно, что базальные и питательные среды, описанные для культивирования клеток, используемых для рекомбинантного получения белка, а также другие переменные факторы, такие как схема подпитки, скорость роста, температура и уровень кислорода, могут оказывать влияние на выход и качество экспрессированного белка. Специалистам в данной области известны способы оптимизации таких условий; приведенные в качестве примера условия, описываются в разделе «Примерные варианты осуществления». Предпочтительно клетки адаптируют к росту в средах, не содержащих холестерина, сыворотки крови и других компонентов животного происхождения; в таких случаях базальная и питательная среды предпочтительно содержат определенные химические соединения, которые заменяют такие компоненты. Также было установлено, что среды, содержащие высокие концентрации глюкозы, например, 10-35 г/л глюкозы, преимущественно повышают продуктивность культивирования клеток. В конкретном варианте осуществления базальная среда содержит примерно 10-20 г/л, более предпочтительно примерно 15 г/л глюкозы, и питательная среда содержит 22-35 г/л, более предпочтительно 28 г/л глюкозы. Питательную среду можно добавлять к клеткам по возрастающей схеме подпитки, как известно в данной области, в течение периода времени, составляющего 8-15 суток, 9-13 суток или наиболее предпочтительно 10-13 суток.
Для DAC HYP, экспрессированного в штамме-продуценте 7А11-5Н7-14-43 NS0, компоненты культуральной и питательной сред и другие переменные факторы, оказывающие влияние на экспрессию и продукцию, оптимизированы. Следовательно, изобретение также относится к оптимизированным базальным средам, питательным средам, схемам подпитки и другим способам и условиям культивирования, пригодным для получения даклизумаба с высоким выходом и чистотой. Такие среды и параметры культивирования, и способы более подробно описаны в разделе 5.3.
Также было установлено, что выделение даклизумаба из клеточной культуры с использованием комбинации некоторых хроматографических стадий обеспечивает очищенный даклизумаб и лекарственную субстанцию DAC HYP, и жидкий даклизумаб и лекарственные формы даклизумаба, которые стабильны при хранении в жидкой форме в высокой концентрации, как правило, в номинальной концентрации даклизумаба и DAC HYP, составляющей, по меньшей мере, 100 мг/мл ± 10-15% и в некоторых вариантах осуществления 150 мг/мл ± 10-15% (по данным УФ-спектроскопии или показателю преломления).
Стабильные высококонцентрированные лекарственные формы даклизумаба обычно готовят заменой концентрированной композиции на обменный буфер, имеющий осмолярность в пределах примерно 267-327 мОсм/кг (например, 270-310 мОсм/кг) и рН в пределах примерно 5,8-6,2 при 25°С (например, 5,9-6,1 при 25°С), с получением промежуточной композиции и затем разведением промежуточной композиции буфером для разведения с полисорбатом с получением стабильной, высококонцентрированной жидкой композиции, содержащей примерно 100 мг/мл ± 10% даклизумаба (например, DAC HYP) и в некоторых вариантах осуществления, по меньшей мере, примерно 150 мг/мл даклизумаба (например, DAC HYP) по данным УФ-спектроскопии или показателю преломления. Буфер для разведения является таким же, что и обменный буфер, но содержит примерно 0-10% (мас./об.) полисорбата 80, и используется в таком количестве, что конечная стабильная, высококонцентрированная композиция даклизумаба содержит расчетную концентрацию (номинальную концентрацию) полисорбата 80 в пределах 0,02-0,04%, в некоторых вариантах осуществления примерно 0,03% (мас./об.). В обменный буфер и буфер для разведения можно включить различные забуферирующие агенты и наполнители для достижения осмолярности и рН в указанных пределах. Конкретный неограничивающий пример обменного буфера, пригодного для формуляции стабильного, высококонцентрированного жидкого даклизумаба и лекарственных форм DAC HYP, содержит примерно 40 мМ сукцината и примерно 100 мМ NaCl, и имеет рН примерно 6,0 при 25°С. Конкретный неограничивающий пример буфера для разведения, подходящего для применения с таким обменным буфером, содержит примерно 40 мМ сукцината, примерно 100 мМ NaCl и примерно 1% (мас./об.) полисорбата 80, и имеет рН примерно 6,0 при 25°С. Значение рН конечной композиции можно довести кислотой или основанием с получением фактического значения рН, равного примерно 6,0, при 25°С.
Стабильные, высоконцентрированные жидкие лекарственные формы даклизумаба характеризуются низкой степенью агрегации, как правило, содержат, по меньшей мере, 95% мономера и менее чем примерно 3% агрегатов, в некоторых случаях менее чем примерно 1,5% агрегатов, и обычно более чем примерно 99% мономера и менее чем примерно 0,8% агрегатов по данным эксклюзионной хроматографии. Другие характеристики высококонцентрированных жидких лекарственных форм даклизумаба более подробно приведены в разделе 5.6.
Высококонцентрированные лекарственные формы даклизумаба также отличаются длительным периодом хранения, подвергаясь не более чем 5% деградации и образованию не более чем 3% агрегатов (по данным соответственно SDS-PAGE и эксклюзионной хроматографии) в течение периода времени до 54 месяцев или более, например, в течение по меньшей мере 5 лет, при хранении при температуре 2-8°С, в течение периода времени до 9 месяцев при хранении в условиях ускоренного старения (23-27°С/60±5% относительная влажность) и в течение до 3 месяцев при хранении в стрессовых условиях (38-42°С/75±5% относительная влажность).
Как уже отмечалось выше, стабильные высококонцентрированные жидкие композиции даклизумаба можно приготовить разведением промежуточной композиции буфером для разведения с полисорбатом с получением конечной лекарственной формы даклизумаба. Следовательно, в еще одном аспекте изобретение относится к не содержащим полисорбат очищенным промежуточным композициям даклизумаба (предпочтительно DAC HYP), содержащим по меньшей мере примерно 150 мг/мл даклизумаба, в некоторых вариантах осуществления примерно 170-190 мг/мл даклизумаба, которые можно разбавить буфером для разведении с полисорбатом с получением стабильных высококонцентрированных жидких лекарственных форм даклизумаба, описанных в данном документе. В конкретном варианте осуществления концентрированные не содержащие полисорбат промежуточные композиции номинально содержат примерно 155 мг/мл или примерно 180 мг/мл даклизумаба (предпочтительно DAC HYP), примерно 40 мМ цитрата натрия и примерно 100 мМ NaCl, рН 6,0 при 25°С. В конкретном варианте осуществления концентрированные не содержащие полисорбат промежуточные композиции номинально содержат примерно 155 мг/мл или примерно 180 мг/мл даклизумаба (предпочтительно DAC HYP), примерно 40 мМ цитрата натрия и примерно 100 мМ NaCl, рН 6,0 при 25°С. Композиции даклизумаба отличаются низким содержанием агрегатов, как дополнительно описано ниже.
Было установлено, что концентрирование даклизумаба посредством ультрафильтрации приводит к образованию агрегатов, что может привести к получению высококонцентрированной лекарственной формы даклизумаба, содержащей неприемлемые количества агрегатов (например, >3%). Следовательно, предпочтительно использовать стадию «очистки» перед концентрированием лекарственной субстанции даклизумаба для удаления агрегатов. Содержание приемлемых агрегатов перед концентрированием будет зависеть от концентрации лекарственной субстанции даклизумаба, предназначенной для концентрирования, требуемой концентрации в конечной лекарственной форме даклизумаба и приемлемого уровня агрегатов в конечной лекарственной форме даклизумаба. Например, если желательно получить композицию даклизумаба с концентрацией 150 мг/мл, содержащую менее чем 3% агрегатов, и лекарственную субстанцию даклизумаба необходимо сконцентрировать в 10-30 раз (например, в 20 раз) для получения такой конечной композиции даклизумаба, то композиция даклизумаба, предназначенная для концентрирования, должна содержать <0,3% агрегатов, предпочтительно <0,2% агрегатов и предпочтительно даже более низкие количества, например, примерно 0,1% агрегатов.
Можно использовать различные известные способы для получения исходной композиции лекарственной субстанции даклизумаба, содержащей приемлемые уровни агрегатов, для концентрирования с получением концентрированной промежуточной композиции даклизумаба и конечных лекарственных форм, как описано в данном документе, включая, например, сильную катионообменную хроматографию и хроматографию гидрофобных взаимодействий. Однако неожиданнго было установлено, что слабая катионообменная хроматография снижает содержание агрегатов в композициях даклизумаба, содержащих 4-12 мг/мл даклизумаба и до 2,5% агрегатов, до очень низких уровней, как правило, 0,1% агрегатов. Применение слабой катионообменной хроматографии для удаления агрегатов является более благоприятным для окружающей среды по сравнению с хроматографией гидрофобных взаимодействий, для которой применяются растворы азотсодержащих соединений (такие как растворы сульфата аммония).
Следовательно, в еще одном аспекте изобретение относится к способам «очистки» композиций даклизумаба для удаления агрегатов таким образом, что полученная «обработанная» композиция обычно содержит примерно от 4 до 15 мг/мл даклизумаба, в которой 0,3% или менее (например, 0,2% или менее, или 0,1% или менее) находится в агрегатной форме по данным эксклюзионной хроматографии. Как правило, способ включает пропускание композиции даклизумаба, содержащей примерно 4-10 мг/мл, обычно примерно 8-9 мг/мл и предпочтительно примерно 8,5 мг/мл даклизумаба и >0,5% агрегатов, через катионообменную смолу в подходящем буфере для адсорбции даклизумаба и элюирование адсорбированного даклизумаба буфером для элюирования. Подходящие слабые катионообменные смолы включают, не ограничиваясь этим, СМ-650М (Tosoh Biosciences), CM-сефарозу, CM-HyperD. Компоненты буферов для уравновешивания, промывания и элюирования будут зависеть от используемой слабой катионообменной смолы, и они известны специалистам в данной области. Со смолой СМ-650М (Tosoh Biosciences, part Number 101392) хорошо «работает» буфер для уравновешивания и промывания, содержащий примерно 20 мМ цитрата натрия, рН 4,5, и буфер для элюирования, содержащий 20 мМ цитрата натрия и 75 мМ сульфата натрия, рН 4,5. Используемая скорость потока будет зависеть от выбора смолы и размера колонки. Для цилиндрической колонки хорошо «работает» смола CM0650M, имеющая высоту основания в пределах примерно 10-30 см (например, 17-19 см) и скорость потока примерно 50-200 см/ч (например, 90-110 см/ч, предпочтительно примерно 100 см/ч), когда хроматографию проводят при комнатной температуре или более низкой температуре, примеры значений температуры равняются 4°, 10°, 15°, 20° или 25°С. Обычные пригодные пределы температуры составляют 18-25°С (например, 18-22°С).
Для ZENAPAX EMEA способ очистки ZENAPAX DAC включает следующие двенадцать стадий:
(i) концентрирование культурального бульона;
(ii) хроматография на Q-сефарозе;
(iii) хроматография на S-сефарозе;
(iv) обработка при низком значении рН для инактивации вирусов;
(v) концентрирование/диафильтрация;
(vi) фильтрование через DV50 для удаления вирусов;
(vii) хроматография на Q-сефарозе II;
(viii) хроматография для разделения вирусов для удаления вирусов;
(ix) концентрирование ультрафильтрацией;
(x) гель-фильтрация на S-300;
(xi) концентрирование ультрафильтрацией;
(xii) заполнение флаконов в асептических условиях.
Данный способ является неэффективным и обеспечивает низкий выход при очистке. Было установлено, что более высокие выходы можно получить с использованием способа, имеющего меньшее число стадий с одновременным обеспечением более высокой степени очистки, что позволяет формулировать полученную лекарственную субстанцию даклизумаба в высококонцентрированные лекарственные формы даклизумаба, описанные выше. Следовательно, настоящее изобретение также относится к улучшенным способам выделения и/или очистки как лекарственной субстанции, так и высококонцентрированных лекарственных форм даклизумаба. В способе используется аффинная хроматография с протеином А в сочетании с сильной анионообменной хроматографией (на Q-сефарозе) и слабой катионообменной хроматографией (СМ-650М), что обеспечивает непрерывную проточную обработку без разведения промежуточного продукта способа. Улучшенный способ получения очищенной лекарственной субстанции даклизумаба включает следующие стадии:
(i) аффинная хроматография с протеином А для отделения даклизумаба от других компонентов клеточной культуры;
(ii) инактивация вирусов при низком значении рН;
(iii) сильная анионообменная хроматография на Q-сефарозе для удаления ДНК;
(iv) слабая катионообменная хроматография (СМ-650М) для уменьшения содержания агрегатов; и
(v) фильтрование для удаления вирусов.
Точные объемы, размеры колонок и рабочие параметры частично будут зависеть от масштаба очистки, как известно в данной области. Конкретные объемы, размеры колонок и рабочие параметры, пригодные для крупномасштабных очисток, описаны в разделе 5.4.
Неочищенный даклизумаб, предназначенный для очистки и необязательно формуляции с использованием вышеописанных способов, можно собрать из культуры клеток с использованием различных общепринятых способов, например, микрофильтрации, центрифугирования и глубинного фильтрования непосредственно из биореактора. Однако было установлено, что неочищенный даклизумаб можно легко собрать снижением рН клеточной культуры примерно до рН 5 при температуре ниже 15°С для флоккулирования клеток, которые можно удалить центрифугированием. В конкретном варианте осуществления неочищенный даклизумаб собирают снижением рН клеточной культуры примерно до рН 5, охлаждением культуры до температуры ниже 15°С, например, 4°С, в течение 30-90 мин и центрифугированием полученной суспензии для удаления клеток. Обычно данный способ применим для любой клеточной культуры, которая секретирует рекомбинантные белки в культуральную среду, и он не является специфическим для культур, продуцирующих даклизумаб или терапевтические антитела. Значение рН культуры можно довести с использованием разнообразных различных кислот, включая слабые или сильные органические кислоты, или слабые или сильные неорганические кислоты. Было установлено, что для культур с даклизумабом хорошо подходит лимонная кислота. Можно использовать концентрированный раствор лимонной кислоты, например, 0,5М-2М раствор, для доведения рН культуры перед сбором материала.
Очистку DAC HYP проводят с использованием трех хроматографических стадий, инактивации вирусов, фильтрования вирусов и конечной ультрафильтрации. Аффинная хроматография с протеином А является первой стадией в способе очистки, с помощью которой происходит отделение большинства примесей, связанных со способом. Для того чтобы повторно использовать колонку для аффинной хроматографии с протеином А, ее необходимо регенерировать и подвергнуть санитарной обработке. Было установлено, что водный раствор NaOH является эффективным как для регенерации, так и санитарной обработки колонки. Однако применение растворов NaOH может привести к разрушению смолы с протеином А, что повысит стоимость производства в целом. Также было установлено, что санитарная обработка смол с протеином А для аффинной хроматографии раствором, содержащим NaOH и бензиловый спирт, дает хорошие результаты и значительно повышает число возможных циклов очистки. Следовательно, изобретение относится к раствору для санитарной обработки и способу регенерации и санитарной обработки колонок и смол с протеином А для аффинной хроматографии. Обычно буфер содержит примерно от 100 до 500 мМ цитрата натрия, примерно от 10 до 30 мМ NaOH и примерно от 0,5 до 3% (об./об.) бензилового спирта, и имеет рН в пределах примерно от 10 до 13. Необязательно, буфер также может содержать другие компоненты, например, такие как соли и/или детергенты. Оба компонента, цитрат натрия и бензиловый спирт, важны для защиты смолы с протеином А от разрушения под действием NaOH и повышения микробицидной активности. В конкретных вариантах осуществления буфер для санитарной обработки протеина А содержит примерно 200 мМ цитрата натрия, примерно 20 мМ NaOH и примерно 1% (об./об.) бензилового спирта. Как описано в разделе 5.4.2, растворы для санитарной обработки, содержащие бензиловый