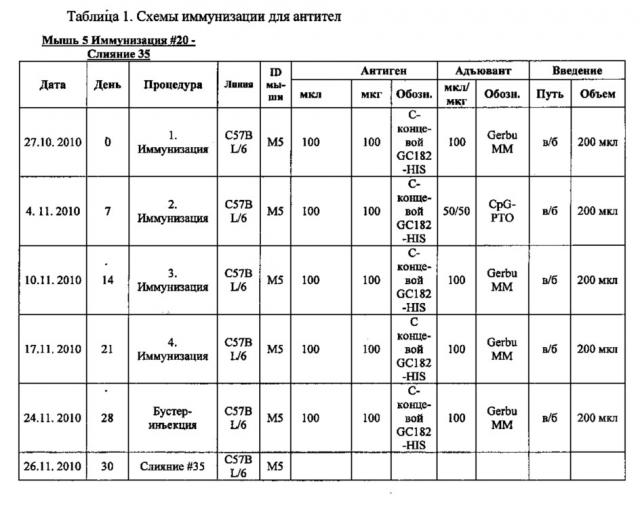
Антитела против клаудина 18.2 для диагностики рака
Иллюстрации
Показать всеИзобретение относится к иммунологии. Предложено антитело и его антигенсвязывающий фрагмент против эпитопа, расположенного в С-концевой части клаудина 18.2 (CLDN18.2). Кроме того, описаны гибридомы, продуцирующие антитело по изобретению, конъюгат, содержащий антитело, и диагностический набор. Также рассмотрены способы, основанные на использовании указанного антитела, для выявления или определения количества CLDN18.2 в образце, определения экспрессии CLDN18.2, диагностирования, выявления или наблюдения за течением рака и определения того, подлежит ли раковое заболевание противораковой терапии. Изобретение может найти дальнейшее применение в терапии и диагностике рака. 9 н. и 16 з.п. ф-лы, 3 ил., 9 табл., 9 пр.
Реферат
Клаудины (CLDN) - это интегральные мембранные белки, являющиеся компонентом плотных межклеточных контактов в эпителии и эндотелии. Предполагается, что в молекуле клаудина четыре трансмембранных сегмента, две внеклеточные петли, а N- и С-концы находятся в цитоплазме. Трансмембранные белки семейства клаудинов играют ключевую роль в поддержании плотных контактов между эпителиальными или эндотелиальными клетками и, возможно, участвуют в поддержании цитоскелета и в клеточных сигнальных механизмах.
Клаудин 18 (CLDN18) представляет собой интегральный трансмембранный белок (тетраспанин), в молекуле которого имеются четыре трансмембранные гидрофобные области и две внеклеточных петли, из которых первая петля в полипептидной цепи находится между первой и второй гидрофобными областями, а вторая петля - между третьей и четвертой гидрофобными областями). Клаудин 18 существует в двух различных сплайс-вариантах, которые описаны у мыши и человека (Niimi, Mol. Cell. Biol. 21:7380-90, 2001). Эти сплайс-варианты [вариант 1 (CLDN18.1) - регистрационный номер в Genbank NP_057453, NM_016369, вариант 2 (CLDN18.2): NM 001002026, NP_001002026) имеют молекулярную массу примерно 27,9/27,72 кДа. Белки CLDN18.1 и CLDN18.2 различаются в N-концевой части, включающей первую трансмембранную (ТМ) область и петлю 1, а первичная структура С-концевой части у них одинакова (см. фиг. 1).
Белок CLDN18.1 экспрессируется только в клетках нормальной легочной ткани, а CLDN18.2 - только в клетках желудка, причем в здоровом желудке экспрессия CLDN18.2 ограничена дифференцированными короткоживущими клетками эпителия желудка. Установлено,, что экспрессия CLDN18.2 имеет место в различных опухолевых тканях. Например, CLDN18.2 экспрессируется в карциноме поджелудочной железы, карциноме пищевода, карциноме желудка, карциноме бронхов, карциноме молочной железы и в опухолях уха-горла-носа. CLDN18.2 является ценной мишенью для предотвращения и/или лечения первичных опухолей, например при раке желудка, раке пищевода, раке поджелудочной железы, раке легких (в частности, при немелкоклеточном раке легких), раке яичника, раке прямой кишки, раке печени, раке головы и шеи, при раке желчного пузыря и их метастазах, в частности при метастазирующем раке желудка (например, при опухолях Крукенберга), при перитонеальных метастазах и метастазах лимфатических узлов.
То, что экспрессия CLDN18.2 различна в нормальных и в раковых клетках и притом ограничена обновляющейся популяцией дифференцированных клеток желудка, которые могут быть восполнены за счет стволовых клеток желудка, не несущих мишени, а также мембранная локализация этого белка и его отсутствие в большинстве токсикологически значимых нормальных тканях делают CLDN18.2 привлекательной мишенью для иммунотерапии рака, и использование терапевтических средств на основе антител, нацеленных на CLDN18.2, сулит высокую терапевтическую эффективность при лечении рака.
Клиническому применению антител, нацеленных на CLDN18.2, препятствует высокая гомологичность человеческих CLDN18.1 и CLDN18.2. Удается получить специфичные к CLDN18.2 антитела, нацеленные на N-концевой внеклеточный домен CLDN18.2, в последовательности которого имеются отличия от CLDN18. Попытки получить антитела, нацеленные на N-концевую часть CLDN18.2 и обладающие свойствами, нужными для клинического применения в диагностических целях, например для выявления экспрессии CLDN18.2 в клетках срезов опухолевой ткани, не имели успеха.
К своему удивлению авторы данного изобретения обнаружили, что антитела против определенного эпитопа, расположенного в С-концевой части CLDN18.2, удовлетворяют критериям диагностической применимости антител, в частности для выявления и идентификации клеток, в которых экспрессируется CLDN18.2. Как ни странно, эти антитела, хотя и направлены против последовательности, которая одинакова в CLDN18.1 и в CLDN18.2, не связываются с нераковыми клетками легких.
Антитела по данному изобретению можно использовать, например, при диагностировании рака и/или при установлении экспрессии CLDN18.2 в раковых клетках. Предпочтительно использование антител по данному изобретению касается раковых заболеваний или раковых клеток, которым свойственна экспрессия CLDN18.2 на клеточной поверхности. Мишенью терапии, нацеленной на CLDN18.2, например терапии с использованием антител против CLDN18.2, являются раковые клетки, в которых экспрессируется CLDN18.2. В одном из воплощений данного изобретения в раковых клетках имеет место экспрессия или аномальная экспрессия CLDN18.2, тогда как в нормальных клетках CLDN18.2 не экспрессируется или экспрессируется очень мало. Клетки, в которых экспрессируется CLDN18.2, предпочтительно выбирают из группы, состоящей из туморогенных раковых клеток желудка, пищевода, поджелудочной железы, легких, яичника, прямой кишки, печени, головы и шеи, желчного пузыря.
Раскрытие изобретения
Данное изобретение относится к антителу или к антиген-связывающему фрагменту, которые:
(i) связываются с пептидом, имеющим аминокислотную последовательность TEDEVQSYPSKHDYV (SEQ ID NO: 5) или EVQSYPSKHDYV (SEQ ID NO: 6) и/или
(ii) связываются с клаудином 18.2 (CLDN18.2), причем указанное антитело или его антиген-связывающий фрагмент, связываются с CLDN18.2 путем связывания с по меньшей мере одним эпитопом в молекуле CLDN18.2, имеющим аминокислотную последовательность TEDEVQSYPSKHDYV (SEQ ID NO: 5) или EVQSYPSKHDYV (SEQ ID NO: 6).
В одном из воплощений данного изобретения указанный CLDN18.2 является CLDN18.2, связанным с клеточной мембраной. В одном из воплощений данного изобретения указанный CLDN18.2 присутствует на раковых клетках, причем указанные раковые клетки являются предпочтительно раковыми клетками, в которых экспрессируется CLDN18.2. В одном из воплощений данного изобретения указанные раковые клетки выбирают из группы, состоящей из клеток желудка, пищевода, поджелудочной железы, легких, яичника, прямой кишки, печени, головы и шеи, желчного пузыря. В одном из воплощений данного изобретения антитело или его антиген-связывающий фрагмент по данному изобретению не связывается с нераковыми клетками, за исключением эпителиальных клеток желудка. В одном из воплощений данного изобретения антитело или его антиген-связывающий фрагмент по данному изобретению не связывается с нераковыми клетками легких. В одном из воплощений данного изобретения антитело по данному изобретению является химерным, человеческим или гуманизированным. В одном из воплощений данного изобретения антитело по данному изобретению является моноклональным антителом.
В этом и других своих аспектах данное изобретение относится к антителу, содержащему:
(I) тяжелую цепь антитела, включающую
(i) последовательность тяжелой цепи антитела, соответствующую SEQ ID NO: 7 или ее варианту,
(ii) по меньшей мере одну, предпочтительно две, более предпочтительно - все три последовательности CDR аминокислотной последовательности тяжелой цепи молекулы антитела, соответствующей SEQ ID NO: 7 или ее варианту, или
(iii) последовательность CDR3, соответствующую SEQ ID NO: 10 или ее варианту, и предпочтительно также содержащему последовательность CDR1, соответствующую SEQ ID NO: 8 или ее варианту, и/или последовательность CDR2, соответствующую SEQ ID NO: 9 или ее варианту,
и/или
(II) легкую цепь антитела, включающую:
(i) последовательность легкой цепи антитела, соответствующую SEQ ID NO: 11 или ее варианту,
(ii) по меньшей мере одну, предпочтительно две, более предпочтительно - все три последовательности CDR аминокислотной последовательности легкой цепи молекулы антитела, соответствующей SEQ ID NO: 11 или ее варианту, или
(iii) последовательность CDR3, соответствующую SEQ ID NO: 14 или ее варианту, и предпочтительно также содержащему последовательность CDR1, соответствующую SEQ ID NO: 12 или ее варианту, и/или последовательность CDR2, соответствующую SEQ ID NO: 13 или ее варианту.
В указанных выше и в других своих аспектах данное изобретение относится также к антителу, содержащему:
(I) тяжелую цепь антитела, включающую
(i) последовательность тяжелой цепи антитела, соответствующую SEQ ID NO: 15 или ее варианту,
(ii) по меньшей мере одну, предпочтительно две, более предпочтительно - все три последовательности CDR аминокислотной последовательности тяжелой цепи молекулы антитела, соответствующей SEQ ID NO: 15 или ее варианту, или
(iii) последовательность CDR3, соответствующую SEQ ID NO: 18 или ее варианту, и предпочтительно также содержащему последовательность CDR1, соответствующую SEQ ID NO: 16 или ее варианту, и/или последовательность CDR2, соответствующую SEQ ID NO: 17 или ее варианту,
и/или
(II) легкую цепь антитела, включающую:
(i) последовательность легкой цепи антитела, соответствующую SEQ ID NO: 19 или ее варианту,
(ii) по меньшей мере одну, предпочтительно две, более предпочтительно - все три последовательности CDR аминокислотной последовательности легкой цепи молекулы антитела, соответствующей SEQ ID NO: 19 или ее варианту, или
(iii) последовательность CDR3, соответствующую SEQ ID NO: 22 или ее варианту, и предпочтительно также содержащему последовательность CDR1, соответствующую SEQ ID NO: 20 или ее варианту, и/или последовательность CDR2, соответствующую SEQ ID NO: 21 или ее варианту.
В предпочтительных воплощениях данного изобретения антитело по данному изобретению содержит тяжелую цепь, включающую константную область тяжелой γ1-цепи, предпочтительно константную область тяжелой γ1-цепи человеческого антитела, и/или антитело по данному изобретению содержит легкую цепь, включающую константную область легкой κ-цепи.
В указанных выше и в других своих аспектах данное изобретение относится к антителу, продуцируемому гибридомой (или получаемому из нее), депонированной в Немецком банке микроорганизмов и клеточных культур (DSMZ, Inhoffenstr. 7В, 38124 Брауншвейг, Германия) и имеющей одно из следующих обозначений и регистрационных номеров:
1. muAB 43-14А, регистрационный номер DSM АСС3144, депонировано 6 октября, 2011; или
2. muAB 35-22А регистрационный номер DSM АСС3143, депонировано 6 октября, 2011.
Антитела по данному изобретению в настоящем документе обозначаются по обозначению антитела и/или по обозначению продуцирующего его клона, например muAB 43-14А.
Также по данному изобретению предпочтительны антитела, обладающие специфичностью антител, продуцируемых упомянутыми выше гибридомами (или получаемыми из них) и, в частности, антитела, содержащие участок или сайт связывания антигена, в частности вариабельную область, идентичную или в высокой степени гомологичную таковой антител, продуцируемых упомянутыми выше гибридомами (или получаемых из них). Предполагается, что предпочтительные по данному изобретению антитела имеют области CDR, идентичные или в высокой степени гомологичные областям CDR антител, продуцируемых упомянутыми выше гибридомами (или получаемых из них). Выражение «в высокой степени гомологичные» подразумевает, что в каждой области CDR может быть от 1 до 5 замен, предпочтительно от 1 до 4, например 1-3 или 1-2. Особенно предпочтительны по данному изобретению химеризованные или гуманизированные формы антител, продуцируемых упомянутыми выше гибридомами (или получаемых из них).
Таким образом, антитело по данному изобретению выбирают из группы, состоящей из (i) антитела, продуцируемого клоном, депонированным под регистрационным номером DSM АСС3144 (muAB 43-14А) или DSM АСС3143 (muAB 35-22А), или получаемым из них; (ii) антитела, являющегося химеризованной или гуманизированной формой антитела по пункту (i); (iii) антитела, обладающего специфичностью антитела по пункту (i), и (iv) антитела, содержащего участок или сайт связывания антигена антитела по пункту (i). Участок или сайт связывания антигена антитела по пункту (i) может представлять собой вариабельную область антитела по пункту (i). В объем данного изобретения входят также антиген-связывающие фрагменты антител, описанных в настоящем документе.
Антитела по данному изобретению предпочтительно способны связываться с клаудином 18.2 в его нативном виде, то есть в природном или не денатурированном виде, или же в денатурированном виде.
В одном из воплощений данного изобретения антитела по данному изобретению получают способом, включающим этап иммунизации животных пептидом, содержащим аминокислотную последовательность SEQ ID NO: 5 или SEQ ID NO: 6, а предпочтительно состоящим из нее, или иммунологически эквивалентным пептидом, или нуклеиновой кислотой, или клетками-хозяевами, в которых экспрессируется указанный пептид. Предпочтительно указанный пептид содержит не более 110, 100, 90, 80, 70, 60, 50, 40, 30, или 20 расположенных подряд аминокислотных остатков CLDN18.2.
В одном из воплощений данного изобретения антитела по данному изобретению получают способом, включающим этап иммунизации животных пептидом, содержащим аминокислотную последовательность SEQ ID NO: 24 или SEQ ID NO: 25, а предпочтительно состоящим из нее, или иммунологически эквивалентным пептидом, или нуклеиновой кислотой, или клетками-хозяевами, в которых экспрессируется указанный пептид. Предпочтительно указанный пептид содержит не более 110, 100, 90, 80 или 75 расположенных подряд аминокислотных остатков CLDN18.2.
Антитела или антиген-связывающие фрагменты, по данному изобретению могут быть соединены, то есть ковалентно или не ковалентно связаны, с другими молекулами, например с метками, по которым их можно выявить.
Данное изобретение относится также к клетками, например гибридомам, продуцирующим описанные в настоящем документе антитела.
Предпочтительными по данному изобретению гибридомами являются клетки, депонированные в Немецком банке микроорганизмов и клеточных культур (DSMZ, Inhoffenstr. 7 В, 38124 Брауншвейг, Германия) и имеющие одно из следующих обозначений и регистрационных номеров:
1. muAB 43-14А, регистрационный номер DSM АСС3144, депонирован 6 октября, 2011; или
2. muAB 35-22А регистрационный номер DSM АСС3143, депонирован 6 октября, 2011.
Данное изобретение относится также к пептидам, содержащим аминокислотную последовательность SEQ ID NO: 5 или SEQ ID NO: 6, а предпочтительно состоящим из нее, или к иммунологически эквивалентным пептидам. Предпочтительно указанный пептид содержит не более ПО, 100, 90, 80, 70, 60, 50, 40, 30, или 20 расположенных подряд аминокислотных остатков CLDN18.2.
Данное изобретение относится также к пептидам, содержащим аминокислотную последовательность SEQ ID NO: 24 или SEQ ID NO: 25, а предпочтительно состоящим из нее, или к иммунологически эквивалентным пептидам, или нуклеиновым кислотам, или клеткам-хозяевам, в которых экспрессируется указанный пептид. Предпочтительно указанный пептид содержит не более ПО, 100, 90, 80 или 75 расположенных подряд аминокислотных остатков CLDN18.2.
Данное изобретение относится также к нуклеиновым кислотам, содержащим гены или нуклеотидные последовательности, кодирующие антитела или их части, например какие-либо из цепей молекулы антитела, или антиген-связывающие фрагменты, или пептиды, описанные в настоящем документе. Предпочтительно нуклеиновая кислота по данному изобретению функционально соединена с элементами, регулирующими экспрессию в эукариотических или прокариотических клетках. Регуляторные элементы, обеспечивающие экспрессию генов в эукариотических или прокариотических клетках хорошо известны в данной области техники.
Нуклеиновая кислота по данному изобретению может входить в состав вектора, например плазмиды, космиды, вируса, бактериофага или иного вектора, обычно используемого в генетической инженерии. Этот вектор может также содержать маркерные гены, позволяющие осуществлять его отбор в подходящих клетках-хозяевах и в подходящих условиях. Также этот вектор может содержать элементы, регулирующие экспрессию, которые обеспечивают должную экспрессию кодирующих последовательностей в подходящих организмах-хозяевах. Такие регуляторные элементы известны специалистам в данной области техники; они включают промоторы, сплайсирующиеся кассеты и кодоны инициации трансляции.
Методы конструирования молекул нуклеиновых кислот и содержащих их векторов, методы введения векторов в соответственно выбранные клетки-хозяева и методы инициирования и обеспечения экспрессии этих молекул хорошо известны в данной области техники.
В другом своем аспекте данное изобретение относится к клеткам-хозяевам, содержащим нуклеиновые кислоты или векторы, описанные в настоящем документе.
В другом своем аспекте данное изобретение относится к выявлению CLDN18.2 или клеток, в которых экспрессируется CLDN18.2, или определения количества CLDN18.2 или клеток, в которых экспрессируется CLDN18.2, с использованием антител или антиген-связывающего фрагмента, по данному изобретению. CLDN18.2 или клетки, в которых экспрессируется CLDN18.2, определяют путем выявления или определения количества комплекса, образуемого CLDN18.2 и антителом или антиген-связывающим фрагментом по данному изобретению. Образование такого комплекса указывает на присутствие CLDN18.2 или клеток, в которых экспрессируется CLDN18.2. Подобное выявление или определение количества может осуществляться различными путями, включая иммунодетекцию с использованием антител или антиген-связывающих фрагментов по данному изобретению (но не ограничиваясь ею). Методы использования антител для выявления пептидов или белков хорошо известны; к ним относятся твердофазный иммуноферментный анализ (ELISA), анализ конкурентного связывания и проч. В принципе в таких методах используются антитела или фрагменты антител, специфично связывающиеся с мишенью - пептидом или белком, непосредственно или опосредованно связанным с меткой, обеспечивающей выявление, например с индикаторным ферментом, радиоактивным веществом, флуорофором или парамагнитными частицами. Способы по данному изобретению позволяют качественно и/или количественно определить, например измерить в абсолютных или относительных единицах, уровни CLDN18.2 или клеток, в которых экспрессируется CLDN18.2.
В одном из своих аспектов данное изобретение относится к способу выявления CLDN18.2 или определения количества CLDN18.2 в образце, включающему этапы:
(i) контактирования образца с антителом или антиген-связываюпщм фрагментом по данному изобретению или с конъюгатом по данному изобретению и
(ii) выявления образования комплекса или определения количества комплекса, образуемого CLDN18.2 и таким антителом, антиген-связьтающим фрагментом, или конъюгатом.
В одном из воплощений данного изобретения упомянутый образец является клеточным, то есть это образец, содержащий клетки, например раковые клетки. В этом воплощении комплекс образуют предпочтительно антитело, антиген-связывающий фрагмент или конъюгат, с одной стороны, и CLDN18.2, экспрессирующийся в клетках указанного образца, с другой стороны.
В одном из своих аспектов данное изобретение относится к способу определения экспрессии CLDN18.2, включающему этапы:
(i) контактирования клеточного образца с антителом или антиген-связьтающим фрагментом, по данному изобретению или с конъюгатом по данному изобретению и
(ii) выявления образования комплекса, образуемого CLDN18.2, экспрессирующимся в клетках указанного образца, и антителом, антиген-связывающим фрагментом, или конъюгатом.
В одном из воплощений данного изобретения клетки образца являются раковыми. Предпочтительно образуется комплекс из CLDN18.2, экспрессирующегося в клетках указанного образца, и антитела, антиген-связывающего фрагмента, или конъюгата по данному изобретению.
В других своих аспектах данное изобретение относится к способам диагностирования или классифицирования заболеваний с помощью CLDN18.2 в качестве мишени и антитела или антиген-связывающего фрагмента по данному изобретению. Эти способы обеспечивают избирательное выявление клеток, в которых экспрессируется CLDN18.2, тем самым позволяя отличить эти клетки от нормальных клеток, в которых не экспрессируется CLDN18.2, или аномальных клеток, в которых не экспрессируется CLDN18.2. Заболевания, характеризующиеся тем, что в обусловливающих его клетках экспрессируется CLDN18.2, подлежат лечению, при котором CLDN18.2 служит мишенью, например лечение терапевтическими антителами против CLDN18.2. Предпочтительными для такой диагностики или лечения являются те заболевания, при которых имеет место экспрессия или аномальная экспрессия CLDN18.2, в частности раковые заболевания, например описанные в настоящем документе.
В одном из своих аспектов данное изобретение относится к способам диагностирования, выявления или наблюдения за течением, то есть определения регрессии, прогрессирования, динамики и/или начала, ракового заболевания, включающим выявление CLDN18.2 или клеток, в которых экспрессируется CLDN18.2, и/или определение количества CLDN18.2 или клеток, в которых экспрессируется CLDN18.2, в биологическом образце, взятом у больного, при помощи антитела или антиген-связывающего фрагмента по данному изобретению. Такие способы можно применять для того, чтобы определить, имеется ли у пациента раковое заболевание или повышен ли для него риск развития ракового заболевания, или, например, эффективно ли схема лечения.
Таким образом, в одном из своих аспектов данное изобретение относится к способу диагностирования, выявления или наблюдения рака, включающему этапы:
(i) контактирования биологического образца с антителом или антиген-связывающим фрагментом, по данному изобретению или с конъюгатом по данному изобретению и
(ii) выявления образования и/или определения количества комплекса, образуемого CLDN18.2 и антителом, антиген-связьшающим фрагментом, или конъюгатом по данному изобретению:
В одном из воплощений данного изобретения биологический образец является клеточным образцом, то есть образцом, включающим клетки, например раковые клетки. В этом воплощении данного изобретения предпочтительно образуется комплекс из CLDN18, экспрессирующегося в клетках указанного образца, и антителом, антиген-связывающим фрагментом, или конъюгатом по данному изобретению.
Способы наблюдения за течением болезни по данному изобретению предпочтительно включают выявление и/или определение количества CLDN18.2 или клеток, в которых экспрессируется CLDN18.2, в первом образце в первый момент времени и в другом образце во второй момент времени, причем регрессия, прогрессирование, динамика и/или начало опухолевого заболевания можно определить путем сравнения этих двух образцов.
В типичном случае уровень CLDN18.2 или клеток, в которых экспрессируется CLDN18.2, в биологическом образце сопоставляют с некоторым уровнем, выбранпым для сравнения, причем отклонение от этого уровня является указанием на наличие или стадию ракового заболевания у данного пациента. Уровнем, взятым для сравнения, может быть уровень, определенный в контрольном образце (например, взятом из нормальной ткани или у здорового индивида, в частности у индивида, не страдающего раковым заболеванием), или средний уровень по данным для здоровых индивидов. Под отклонением от уровня, взятого для сравнения, понимается любое значительное изменение, например увеличение на по меньшей мере 10%, 20% или 30%, предпочтительно по меньшей мере на 40% или 50%, или даже больше.
Предпочтительно присутствие CLDN18.2 или клеток, в которых экспрессируется CLDN18.2, и/или увеличение количества CLDN18.2 или клеток, в которых экспрессируется CLDN18.2, по сравнению с уровнем, взятым для сравнения, например по сравнению с индивидом, не страдающим раковым заболеванием, указывает на наличие или риск (то есть возможность развития) ракового заболевания у данного пациента.
Уменьшение количества CLDN18.2 или клеток, в которых экспрессируется CLDN18.2, по сравнению с биологическим образцом, взятым у данного пациента ранее, может указывать на регрессию, положительную динамику, например на успешность лечения, или на уменьшение риска возникновения ракового заболевания у данного пациента.
Увеличение количества CLDN18.2 или клеток, в которых экспрессируется CLDN18.2, по сравнению с биологическим образцом, взятым у данного пациента ранее, может указывать на прогрессирование: отрицательную динамику, например на неэффективность лечения, рецидив или метастазирование, на начало или на риск возникновения ракового заболевания у данного пациента.
В одном из своих аспектов данное изобретение относится к способу, позволяющему определять, подлежит ли раковое заболевание лечению методом с использованием CLDN18.2 в качестве мишени, включающему этапы:
(i) контактирования образца, содержащего раковые клетки, с антителом или антиген-связывающим фрагментом, по данному изобретению или с конъюгатом по данному изобретению и
(ii) выявления образования комплекса из CLDN18.2 и антитела, антиген-связывающего фрагмента, или конъюгата по данному изобретению.
Предпочтительно образуется комплекс из CLDN18.2, экспрессирующегося в раковых клетках указанного образца, и антитела, антиген-связывающего фрагмента, или конъюгата по данному изобретению.
Такие способы можно применять для того, чтобы определить, подходит ли для данного пациента лечение, нацеленное на клетки, в которых экспрессируется CLDN18.2, например использование антител, обладающих одной или более иммуноэффекторными функциями, например являющихся специфичными к CLDN18.2 антителами, вызывающими цитотоксический эффект, например антителами, меченными цитотоксическим агентом (токсином или радиоактивным изотопом), или приводящими в действие механизмы гибели клеток, например зависимой от комплемента цитотоксичности (CDC) или зависимой от антител клеточно-опосредованной цитоксичности (ADCC). Лечению, нацеленному на CLDN18.2, подлежат заболевания, характеризующиеся тем, что в обусловливающих заболевание клетках экспрессируется CLDN18.2, например раковые заболевания, в частности описанные в настоящем документе.
В одном из воплощений данного изобретения в упомянутых выше аспектах образец, клеточный образец или биологический образец - это образец, взятый у индивида с раковым заболеванием, с подозрением на наличие или вероятность развития ракового заболевания. В одном из воплощений данного изобретения образец, клеточный образец или биологический образец берут из ткани или органа, в клетках которого в отсутствие ракового поражения этой ткани или органа нет существенной экспрессии CLDN18.2. Предпочтительно указанная ткань не является тканью желудка. Предпочтительно указанная ткань является тканью легкого, пищевода, поджелудочной или молочной железы, причем уже мог быть поставлен диагноз ракового поражения данной ткани или органа, например в результате осмотра или цитологического исследования этой ткани или органа. В этом воплощении данного изобретения указанием на то, что данному индивиду подходит лечение, нацеленное на клетки, в которых экспрессируется CLDN18.2, служит присутствие CLDN18.2 или клеток, в которых экспрессируется CLDN18.2, и/или увеличение количества CLDN18.2 или клеток, в которых экспрессируется CLDN18.2, по сравнению с уровнем, взятым для сравнения, например по сравнению с индивидом, не имеющим опухолевых заболеваний.
В одном из аспектов данного изобретения предлагаются композиции, например диагностического назначения, или наборы, включающие описанные в настоящем документе антитела или фрагменты, связывающие антиген, или сочетание антител и/или антиген-связывающего фрагмента. Такие диагностические композиции или наборы для анализа полезны при осуществлении способов по данному изобретению, например способов для диагностирования, выявления или наблюдения. Эти наборы при необходимости могут содержать выявляемую метку, например индикаторный фермент, радиоактивную метку, флуорофор или парамагнитные частицы. В набор может входить инструкция, содержащая практически полезную информацию, например сведения о том, как использовать реагенты для осуществления способа, описанного в настоящем документе.
Другие признаки и преимущества данного изобретения явствуют из приведенных ниже раздела «Подробное описания изобретения» и формулы изобретения.
Подробное описание изобретения
Хотя ниже данное изобретение описывается подробно, следует учесть, что оно не ограничивается конкретными методиками, протоколами и реагентами, описанными в настоящем документе, поскольку они могут варьировать. Следует также принять во внимание, что используемая в настоящем документе терминология служит лишь задаче описания конкретных воплощений данного изобретения и не должна ограничивать объем данного изобретения, который ограничивается только прилагаемой формулой изобретения. Если не говорено иного, то все технические и научные термины в настоящем документе употребляются в тех же значениях, в которых они понимаются рядовым специалистом в данной области техники.
Ниже описываются элементы данного изобретения. Эти элементы упоминаются в связи с конкретными воплощениями данного изобретения, однако следует учесть, что их можно комбинировать любым образом и в любом числе для создания дополнительных воплощений. Различным образом описанные примеры и предпочтительные воплощения не следует истолковывать как ограничивающие объем изобретения только конкретно описанными воплощениями. Настоящее описание следует понимать как подтверждающее и охватывающее воплощения данного изобретения, в которых сочетается подробное описание с любым числом описанных и/или предпочтительных элементов. Также любые перестановки и комбинации всех описанных элементов в настоящей заявке следует считать раскрытыми в настоящем описании, если только из контекста не следует иного.
Предпочтительно употребляемые в настоящем документе термины имеют значения, определяемые «Многоязычным словарем биотехнологических терминов» - "А multilingual glossary of biotechnological terms: (IUPAC Recommendations)", H.G.W. Leuenberger, B. Nagel, and H. Kolbl, Eds., Helvetica Chimica Acta, CH-4010, Базель, Швейцария (1995).
Практическое осуществление данного изобретения включает, если не указано иного, применение общепринятых химических, биохимических, цитологических, иммунологических методов и технологии рекомбинантных ДНК, освещенных в литературе по данной области техники (см., например, Molecular Cloning: A Laboratory Manual, 2nd Edition, J. Sambrook et al. eds., Cold Spring Harbor Laboratory Press, Cold Spring Harbor 1989).
В настоящем описании и в прилагаемой формуле изобретения, если и контекста не следует иного, глагол «содержать» и его производные такие как «содержащий» «содержит» означают, что указанный компонент, число или этап или группа компонентов, чисел или этапов включаются, но при этом не исключаются какие-либо другие компоненты, числа или этапы или группы компонентов, чисел иди этапов, хотя в некоторых воплощениях данного изобретения такие другие компоненты, числа или этапы или группы компонентов, чисел иди этапов могут исключаться, то есть существенно включение указанного компонента, числа иди этапа или группы компонентов, чисел или этапов. В контексте описания данного изобретения (и особенно в контексте формулы изобретения) слова указанные в единственном числе подразумевают как единственное, так и множественное число, если только не указано или с очевидностью не следует из конкретного контекста иное значение). Приведенные в настоящем документе диапазоны значений той или иной величины служат лишь для краткости обозначения всего набора отдельных значений в пределах указанного диапазона. Каждое из этих отдельных значений включается в данное описание, как если бы оно было указано буквально (если не оговорено иного). Все описанные в настоящем документе способы можно осуществлять в любом удобном порядке, если иное не указано или не следует с очевидностью из конкретного контекста. Использование в настоящем документе примеров или выражений типа «например», «такие как» и т.п. имеет лишь иллюстративную цель и не носит ограничительного характера в отношении объема данного изобретения, если только не заявлено иного. Никакие выражения в настоящем документе не следует понимать как указывающие на не заявленные элементы, существенные для практического осуществления данного изобретения.
В настоящем описании цитируется ряд документов. Каждый из них (включая все патенты, патентные заявки, научные публикации, инструкции и описания производителей и проч.) как выше, так и ниже по тексту полностью включается в настоящий документ путем отсылки. Ничто в настоящем документе не дает оснований для допущения, что данное изобретение не вправе включать задним числом такие описания в силу более раннего создания настоящего изобретения.
Термин «рекомбинантный» в контексте данного изобретения означает «полученный/созданный путем генетической инженерии». В контексте данного изобретения " рекомбинантный объект, например рекомбинантные клетки, предпочтительно не существует в природе.
Выражения «существует/встречается в природе» или «природный» в настоящем документе относится к тому факту, что данный объект можно найти в естественных условиях в. природе. Например, пептиды или нуклеиновые кислоты, которые присутствуют в организме (включая вирусы), могут быть выделены из природного источника и не были намеренно модифицированы людьми в лабораторных условиях, являются природными/встречающимися в природе.
Термин «антиген» относится к агентам, содержащим эпитоп, против которого возникает и/или направляется иммунный ответ. В контексте данного изобретения антиген - это предпочтительно вещество, которое, при необходимости после некоторых превращений, вызывает иммунологическую реакцию, предпочтительно направленную против этого антигена. Термин «антиген» включает, в частности, белки, пептиды, полисахариды, нуклеиновые кислоты, в том числе РНК и ДНК, и нуклеотиды.
Термин «эпитоп» относится к антигенной детерминанте в молекуле, то есть к той ее части, которая распознается иммунной системой, например, распознается антителами. Например, эпитопами являются дискретные организованные в трех измерениях сайты в молекуле антигена, распознаваемые иммунной системой. Эпитоп обычно состоит из химически активных группировок, располагающихся на поверхности молекулы, например аминокислотных остатков или боковых цепей Сахаров; эпитоп, как правило, обладает специфическими особенностями пространственной структуры, а также специфическими электрическими свойствами (зарядом). Различают конформационные и неконформационные эпитопы: первые, в отличие от вторых, исчезают в присутствии денатурирующих агентов. Эпитоп белка, например клаудина, предпочтительно представляет собой непрерывный или составной участок полипептидной цепи длиной предпочтительно от 5 до 100, предпочтительно от 5 до 50, более предпочтительно от 8 до 30, наиболее предпочтительно от 10 до 25 аминокислотных остатков; например, эпитоп может быть длиной предпочтительно 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23,24 или 25 аминокислотных остатков.
Термин «составной/дискретный/не непрерывный эпитоп» в настоящем документе означает конформационный эпитоп белкового антигена, образованный по меньшей мере двумя не. соседними участками первичной структуры (аминокислотной последовательности) данного белка.
В одном из предпочтительных воплощений данного изобретения антиген является ассоциированным с опухолью, например это CLDN18.2, то есть компонент раковых клеток, происходящий из цитоплазмы, клеточной поверхности или ядра, в частности это может быть антиген, образующийся предпочтительно в большом количестве внутри или на поверхности раковой клетки.
В контексте данного изобретения термин «антиген, ассоциированный с опухолью» или «опухолевый антиген» относится к белкам, которые в норме экспрессируются специфически - только в ограниченном числе тканей и/или органов или на определенной стадии развития, например антиген, ассоциированный с опухолью, в норме экспрессируется в ткани желудка, предпочтительно в слизистой желудка, в репродуктивных органах, например в яичках, в трофобластной ткани (например, в плаценте) или в клетках зародышевой линии, и экспрессируется или аномально экспрессируется в одной или более опухолях или раковых тканях. В этом контексте выражение «только в ограниченном числе» предпочтительно означает «не более чем в трех», более предпочтительно «пе более чем в двух». В контексте данного изобретения антигены, ассоциированные с опухолями, включают, например, дифференцировочные антигены, предпочтительно дифференцировочные антигены, специфичные в отношении типа клетки, то есть белки, которые в норме экспрессируются только в клетках определенного типа; раковые/тестикулярные антигены, то есть белки, которые в норме экспрессируются в яичках и иногда в плаценте; и антигены, специфичные для клеток зародышевой линии. В контексте данного из