Способ остановки язвенных гастродуоденальных кровотечений
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к эндоскопической хирургии и рентгенхирургии, и касается остановки язвенных гастродуоденальных кровотечений. Способ включает чрескожную транскатетерную артериальную эмболизацию приносящих сосудов после установления источника кровотечения. При этом у пациентов с рецидивом язвенного гастродуоденального кровотечения источник кровотечения устанавливают при целиакографии и верхней мезентерикографии по экстравазации контрастного водорастворимого вещества. Затем выполняют эмболизацию с использованием состава, включающего 1 часть маслорастворимого контрастного вещества и 3 части аутогенных жировых эмболов. Последние извлекают из среднего слоя аспирированной подкожной жировой клетчатки после ее центрифугирования в течение 10 минут 15 секунд со скоростью 600 оборотов в минуту. Для эмболизации одного приносящего сосуда используют 2,0 мл эмболизирующего состава, который вводят болюсом на расстоянии не более 2,0 см от визуализированной экстравазации. Способ обеспечивает эффективную остановку язвенного гастродуоденального кровотечения. 5 ил., 4 пр.
Реферат
Изобретение относится к медицине, а именно к хирургии, эндоскопической хирургии и рентгенхирургии.
При изучении патентной литературы выявлены следующие способы остановки язвенных гастродуоденальных кровотечений.
Известен «Способ лечения кровоточащей язвы двенадцатиперстной кишки» [RU 2301639, опубликован 27.06.2007], при котором выполняют дуоденоскопию и лапароскопию. В проекции кровоточащей язвы, установленной при дуоденоскопии, лапароскопически на стенку двенадцатиперстной кишки накладывают коллагеновую пластину. Под визуальным контролем прошивают через пластину источник кровотечения. Завязывают сквозной интракорпоральный шов. Пластину фиксируют вторым и третьим сквозными интракорпоральными швами, наложенными выше и ниже первого шва на расстоянии 0,7 см.
Недостатки способа обусловлены его ограниченным применением при локализации источника кровотечения вне передней и переднебоковой стенок двенадцатиперстной кишки, способ не может использоваться в условиях спаечного процесса в гепатопанкреатодуоденальной зоне и при рубцовой деформации двенадцатиперстной кишки.
Известен «Способ хирургического лечения язвенных кровотечений желудка и двенадцатиперстной кишки» [RU 2290882, опубликовано 10.01.2007], при котором выполняют лапаротомию, продольную гастротомию, дуоденотомию. Выполняют ревизию слизистой. Выявляют и останавливают язвенное кровотечение. После гемостаза отсепаровывают слизисто-подслизистый лоскут вокруг язвы. В образовавшийся дефект над язвой имплантируют микропористую никелидтитановую пластину. Пластина пропитана капрофером или хлористым кальцием.
Недостатками данного способа является необходимость выполнения лапаротомии, продольной гастротомии, дуоденотомии, а также формирование слизисто-подслизистого лоскута вокруг язвы - данные технические приемы во время продолжающегося язвенного гастродуоденального кровотечения либо непосредственно «после гемостаза» являются неоправданно длительными и ограничивают его практическое применение. Кроме того, для реализации способа необходимо соблюдение условия «… в операционную в охлажденном (0-5°C) растворе стерильного раствора кальция хлорида доставляется имплантат из никелида титана…», выполнение данного условия ограниченно в неотложной хирургии, а также «…циркулярно острым и тупым путем выделяется слизисто-подслизистый слой до мышечного в пределах 3-4 мм…», что возможно лишь при язвах определенного размера.
Известен «Способ остановки кровотечения из крупных артериальных сосудов дна язвы желудка и/или двенадцатиперстной кишки» [RU 2445024, опубликовано 20.03.2012], при котором выполняют лапаротомию, дуоденотомию, идентифицируют кровоточащий артериальный сосуд. Захватывают соответственно концу сосуда зажимом Кохера интиму сосуда, вытягивают на 0,3-0,5 см и затем интиму перевязывают.
Недостатки способа связаны с тем, что он предусматривает выполнение лапаротомии и дуоденотомии, а также технические приемы, направленные на «…прецизионное выполнение манипуляции - перемещение интимы сосуда через дно язвы…» - способ технически не может быть реализован в случаях неудовлетворительной визуализации источника кровотечения в язвенном дефекте, при короткой культе сосуда и наличии сгустка в язвенном дефекте.
Известен «Способ остановки кровотечения из дуоденальной язвы, пенетрирующей в головку поджелудочной железы» [RU 2510245, опубликован 27.03.2014], при котором после эндоскопического выявления кровоточащей пенетрирующей язвы задней стенки двенадцатиперстной кишки производят лапаротомию. Гемостаз в язве обеспечивают путем перевязки вокруг язвенного субстрата передних и задних сосудистых ветвей верхней и нижней поджелудочно-дуоденальных артерий.
Недостатки способа связаны с тем, что он предусматривает выполнение лапаротомии, а «…для перевязки сосудистых ветвей arteria pancreaticodiiodenalis superior posterior, arteria pancreaticoduodenalis inferior posterior проводится мобилизация двенадцатиперстной кишки по Кохеру…» - данные технические приемы во время продолжающего язвенного гастродуоденального кровотечения являются неоправданно «агрессивными» при условии невыполнения прямого воздействия на язвенный дефект. Кроме того, «…мобилизация двенадцатиперстной кишки по Кохеру…» может способствовать разделению места пенетрации дуоденальной язвы в головку поджелудочной железы. Далее из описания следует, что выполняется «…Перевязка сосудистых ветвей в месте их отхождения от arteria pancreaticoduodenalis superior anterior, arteria pancreaticoduodenalis inferior anterior, arteria pancreaticoduodenalis superior posterior, arteria pancreaticoduodenalis inferior posterior…» - необратимое прекращение кровотока в перечисленных сосудистых бассейнах неизбежно приведет к ишемии стенки двенадцатиперстной кишки.
Прототипом изобретения, как наиболее близким по совокупности признаков к заявляемому способу, является «Способ остановки язвенных гастродуоденальных кровотечений» [RU 2446753, опубликован 10.04.2012], при котором остановка язвенных гастродуоденальных кровотечений осуществляется путем наложения клипс с помощью эндоклипатора. Предварительно определяют тип язвенного дефекта по Johnson. При 1 типе язвы - клипирование осуществляют на сосуды среднего калибра, отходящие от передней и задней нисходящих ветвей левой желудочной артерии, при 2 типе язвы - клипирование осуществляют на сосуды, питающие заднюю стенку 12-перстной кишки - ветви передней верхней и задней верхней панкреатодуоденальной артерии, при 3 типе язвы - клипирование осуществляют на ветви правой желудочной артерии и ветви дорсальной и нижней панкреатической артерий. Клипсы накладывают на расстоянии 1,5-2,0 см от кровоточащего сосуда.
Недостатки способа обусловлены тем, что «…сосуды среднего калибра, отходящие от передней и задней нисходящих ветвей левой желудочной артерии…», «…сосуды, питающие заднюю стенку 12-перстной кишки…», а также «… ветви правой желудочной артерии и ветви дорсальной и нижней панкреатической артерий…» не всегда возможно прецизионно визуализировать при лапароскопии, кроме того, способ имеет ограниченное применение в условиях спаечного процесса в гепатопанкреатодуоденальной зоне и при рубцовой деформации двенадцатиперстной кишки.
Задачей заявляемого изобретения является эффективная остановка язвенных гастродуоденальных кровотечений.
Поставленная задача достигается тем, что у пациентов с рецидивом язвенного гастродуоденального кровотечения при целиакографии и верхней мезентерикографии по экстравазации контрастного водорастворимого вещества определяется источник кровотечения, выполняется чрескожная транскатетерная артериальная эмболизация приносящих сосудов источника кровотечения 2,0 мл эмболизирующего состава, включающего 3 части калиброваных аутогенных жировых эмболов, полученных при центрифугировании аспирированной подкожной жировой клетчатки в течение 10 минут 15 секунд со скоростью 600 оборотов в минуту, и 1 часть маслорастворимого контрастного вещества.
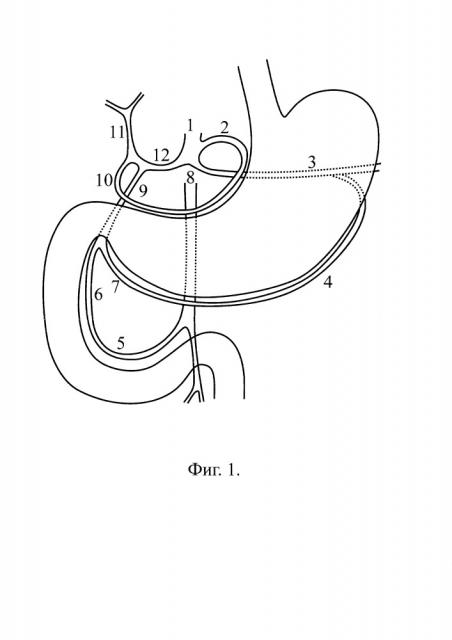
Способ осуществляется следующим образом. При рецидиве язвенного гастродуоденального кровотечения после эндоскопического лечения у пациентов повышенного риска повторного кровотечения и смерти (шкала Blatchford и шкала преэндоскопической оценки Rockall) в качестве альтернативы операции с применением лапаротомии выполняется чрескожная транскатетерная артериальная эмболизация сосудов, питающих кровоточащее поражение. При целиакографии используют 30-40 мл водорастворимого контрастного вещества, которое вводят со скоростью 8-12 мл в секунду. Снимки производят через 2, 4, 6, 8, 10, 15, 20 и 24 секунды от начала введения контрастного вещества. Если целиакографией источник кровотечения не установлен либо дуоденоскопией определена его локализация за луковицей двенадцатиперстной кишки, выполняют верхнюю мезентерикографию. При целиакографии и верхней мезентерикографии исследуют артериальную и возвратную фазы ангиографии, определяют сосудистую анатомию бассейнов чревного ствола и верхней брыжеечной артерии [фиг. 1]. На фиг. 1 поз. 1 - чревный ствол, поз. 2 - левая желудочная артерия, поз. 3 - селезеночная артерия, поз. 4 - левая желудочно-сальниковая артерия, поз. 5 - нижняя передняя панкреатодуоденальная артерия, поз. 6 - верхняя передняя панкреатодуоденальная артерия, поз. 7 - правая желудочно-сальниковая артерия, поз. 8 - верхняя брыжеечная артерия, поз. 9 - желудочно-дуоденальная артерия, поз. 10 - правая желудочная артерия, поз. 11 - собственная печеночная артерия, поз. 12 - общая печеночная артерия. По экстравазации контрастного вещества устанавливают локализацию источника кровотечения.
Аспирацию 20 мл подкожной жировой клетчатки выполняют под местной инфильтрационной анестезией, по передненаружной поверхности верхней трети бедра канюлей диаметром 5 мм с дистально расположенными отверстиями с затупленными краями и тупым концом при отрицательном давлении от 0,6 до 1 атмосферы. Полученный аспирированный материал подкожной жировой клетчатки помещают в шприцы и устанавливают в центрифугу. Центрифугирование осуществляют в течение 10 минут 15 секунд со скоростью 600 оборотов в минуту. После центрифугирования аспирированный материал подкожной жировой клетчатки разделяется на три слоя. Верхний слой состоит в основном из свободных липидов, нижний слой включает кровь и раствор для анестезии, средний слой содержит аутогенные жировые эмболы.
Отделяют средний слой, содержащий калиброванные аутогенные жировые эмболы и используют для приготовления эмболизирующего состава. Эмболизирующий состав включает 3 части калиброванных аутогенных жировых эмболов и 1 часть маслорастворимого контрастного вещества. Для эмболизации одного приносящего сосуда используют 2,0 мл эмболизирующего состава. Состав вводят в артерии - источники кровотечения болюсом, на расстоянии не более 2,0 см от визуалированной экстравазации.
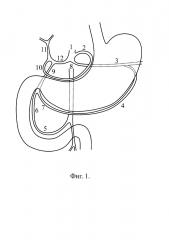
При локализации источника кровотечения по малой кривизне тела желудка либо в антральном отделе [фиг. 2, поз. 12] выполняют вначале селективную эмболизацию в бассейне левой желудочной артерии [фиг. 2, поз. 2], затем при неэффективности гемостаза эмболизируют бассейн правой желудочной артерии [фиг. 2, поз. 10].
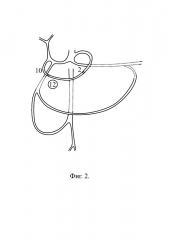
При локализации источника кровотечения по большой кривизне тела желудка [фиг. 3, поз. 13] выполняют вначале селективную эмболизацию в бассейне правой желудочно-сальниковой артерии [фиг. 3, поз. 7], затем при неэффективности гемостаза эмболизируют бассейн левой желудочно-сальниковой артерии [фиг. 3, поз. 4].
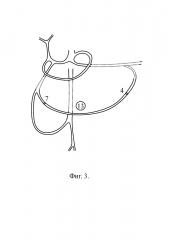
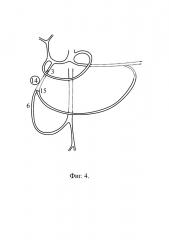
При локализации источника кровотечения в пилорическом отделе желудка либо луковице двенадцатиперстной кишки [фиг. 4, поз. 14] выполняют вначале селективную эмболизацию бифуркации желудочно-дуоденальной артерии [фиг. 4, поз. 15], затем эмболизируют основной ствол желудочно-дуоденальной артерии [фиг. 4, поз. 9], на расстоянии 0,5-1,0 см от ее ответвления от общей печеночной артерии.
При локализации источника кровотечения в нисходящей части двенадцатиперстной кишки [фиг. 5, поз. 16] выполняют вначале селективную эмболизацию бассейна верхней передней панкреатодуоденальной артерии [фиг. 5, поз. 6], затем при неэффективности гемостаза эмболизируют бассейн нижней передней панкреатодуоденальной артерии [фиг. 5, поз. 5].
Способ апробирован у 5 пациентов в МБУЗ ГБСМП г. Ростов-на-Дону.
Примеры выполнения способа.
Пример 1.
Мужчина 43 года, основной диагноз: язва тела желудка, желудочно-кишечное кровотечение 2b по Forrest. Оценка тяжести желудочно-кишечного кровотечения по шкале Blatchford 5 баллов (гемоглобин 105 г/л - 3 балла, систолическое артериальное давление 105 мм рт.ст. - 1 балл, мелена - 1 балл), по шкале преэндоскопической оценки Rockall 3 балла (пульс 105 в минуту - 1 балл, стигматы недавнего кровотечения - 2 балла). Выполнили фиброгастродуоденоскопию выявили язву тела желудка размерами 0,8×0,8 см., выполнили обкалывание источника кровотечения, рецидив желудочно-кишечного кровотечения через 12 часов, 1a по Forrest, электрокоагуляция поверхности язвы не неэффективна. В срочном порядке выполнили ангиографию чревного ствола и брыжеечных сосудов. Установили локализацию источника кровотечения по малой кривизне тела желудка. Под местной инфильтрационной анестезией аспирировали 20 мл подкожной жировой клетчатки, по передненаружной поверхности верхней трети бедра при отрицательном давлении от 0,6 до 1 атмосферы, аспирированный материал подкожной жировой клетчатки центрифугировали в течение 10 минут 15 секунд со скоростью 600 оборотов в минуту. Отделили средний слой центрифугированного материала в объеме 6,0 мл, смешали с 2,0 мл маслорастворимого контрастного вещества. На расстоянии 2,0 см от визуалированной экстравазации выполнили селективную эмболизацию левой желудочной артерии 2,0 мл эмболизирующего состава, интенсивность кровотечения снизилась, окончательный гемостаз не достигнут, 2,0 мл эмболизирующего состава ввели в правую желудочную артерию, окончательный гемостаз достигнут. Рецидивов желудочно-кишечного кровотечения не было, выписан на 8 сутки в удовлетворительном состоянии.
Пример 2.
Мужчина 64 года, основной диагноз: язва тела желудка, желудочно-кишечное кровотечение 1b по Forrest. Оценка тяжести желудочно-кишечного кровотечения по шкале Blatchford 11 баллов (гемоглобин 95 г/л - 6 баллов, систолическое артериальное давление 100 мм рт.ст. - 1 балл, пульс 105 в минуту - 1 балл, мелена - 1 балл, заболевания печени - 2 балла), по шкале преэндоскопической оценки Rockall 4 балла (возраст - 1 балл, пульс 105 в минуту - 1 балл, стигматы недавнего кровотечения - 2 балла). Выполнили фиброгастродуоденоскопию, выявили язву тела желудка размерами 1,0×1,0 см, выполнили обкалывание источника кровотечения и электрокоагуляцию поверхности язвы, рецидив желудочно-кишечного кровотечения через 8 часов, 1a по Forrest, повторная электрокоагуляция поверхности язвы неэффективна. В срочном порядке выполнили ангиографию чревного ствола и брыжеечных сосудов. Установили локализацию источника кровотечения по большой кривизне тела желудка. Под местной инфильтрационной анестезией аспирировали 20 мл подкожной жировой клетчатки, по передненаружной поверхности верхней трети бедра при отрицательном давлении от 0,6 до 1 атмосферы, аспирированный материал подкожной жировой клетчатки центрифугировали в течение 10 минут 15 секунд со скоростью 600 оборотов в минуту. Отделили средний слой центрифугированного материала в объеме 6,0 мл, смешали с 2,0 мл маслорастворимого контрастного вещества. На расстоянии 2,0 см от визуалированной экстравазации выполнили селективную эмболизацию правой желудочно-сальниковой артерии 2,0 мл эмболизирующего состава, интенсивность кровотечения снизилась, окончательный гемостаз не достигнут, эмболизировали левую желудочно-сальниковую артерию 2,0 мл эмболизирующего состава, окончательный гемостаз достигнут. Рецидива желудочно-кишечного кровотечения не было, выписан на 7 сутки в удовлетворительном состоянии.
Пример 3.
Женщина 61 год, основной диагноз: язва пилорического отдела желудка, желудочно-кишечное кровотечение 1b по Forrest. Оценка тяжести желудочно-кишечного кровотечения по шкале Blatchford 10 баллов (мочевина крови 6,5 ммоль/л - 2 балла, гемоглобин 95 г/л - 6 баллов, систолическое артериальное давление 105 мм рт.ст. - 1 баллов, пульс 105 в минуту - 1 балла), по шкале преэндоскопической оценки Rockall 6 баллов (возраст - 1 балл, пульс 105 в минуту - 1 балл, сопутствующая патология (ХСН) - 2 балла, стигматы недавнего кровотечения - 2 балла). Выполнили фиброгастродуоденоскопию, выявили язву пилорического отдела желудка размерами 1,0×1,0 см., выполнили обкалывание источника кровотечения и электрокоагуляцию поверхности язвы, рецидив желудочно-кишечного кровотечения через 12 часов, 1a по Forrest, повторная электрокоагуляция поверхности язвы не неэффективна. В срочном порядке выполнили ангиографию чревного ствола и брыжеечных сосудов. Установили локализацию источника кровотечения в пилорическом отделе желудка. Под местной инфильтрационной анестезией аспирировали 20 мл подкожной жировой клетчатки, по передненаружной поверхности верхней трети бедра при отрицательном давлении от 0,6 до 1 атмосферы, аспирированный материал подкожной жировой клетчатки центрифугировали в течение 10 минут 15 секунд со скоростью 600 оборотов в минуту. Отделили средний слой центрифугированного материала в объеме 6,0 мл, смешали с 2,0 мл маслорастворимого контрастного вещества. На расстоянии 2,0 см от визуализированной экстравазации выполнили селективную эмболизацию бифуркации желудочно-дуоденальной артерии 2,0 мл эмболизирующего состава, интенсивность кровотечения снизилась, окончательный гемостаз не достигнут. Эмболизировали основной ствол желудочно-дуоденальной артерии на расстоянии 1,0 см от ее ответвления от общей печеночной артерии 2,0 мл эмболизирующего состава, окончательный гемостаз достигнут. Рецидива желудочно-кишечного кровотечения не было, выписана на 8 сутки в удовлетворительном состоянии.
Пример 4.
Мужчина 58 лет, основной диагноз: язва двенадцатиперстной кишки, желудочно-кишечное кровотечение 2b по Forrest. Оценка тяжести желудочно-кишечного кровотечения по шкале Blatchford 5 баллов (гемоглобин 110 г/л - 3 балла, систолическое артериальное давление 105 мм рт.ст. - 1 балла, мелена - 1 балл), по шкале преэндоскопической оценки Rockall 4 баллов (сопутствующая патология (хронический вирусный гепатит С) - 2 балла, стигматы недавнего кровотечения - 2 балла). Выполнили фиброгастродуоденоскопию, выявили язву нисходящей части двенадцатиперстной кишки 1,2×1,2 см, выполнили электрокоагуляцию поверхности язвы, рецидив желудочно-кишечного кровотечения через 1 сутки, 1a по Forrest, повторная электрокоагуляция поверхности язвы, клипирование не неэффективны. В срочном порядке выполнили ангиографию чревного ствола и брыжеечных сосудов. Установили локализацию источника кровотечения в нисходящей части двенадцатиперстной кишки. Под местной инфильтрационной анестезией аспирировали 20 мл подкожной жировой клетчатки, по передненаружной поверхности верхней трети бедра при отрицательном давлении от 0,6 до 1 атмосферы, аспирированный материал подкожной жировой клетчатки центрифугировали в течение 10 минут 15 секунд со скоростью 600 оборотов в минуту. Отделили средний слой центрифугированного материала в объеме 6,0 мл, смешали с 2,0 мл маслорастворимого контрастного вещества. На расстоянии 2,0 см от визуалированной экстравазации выполнили селективную эмболизацию бассейна верхней передней панкреатодуоденальной артерии 2,0 мл эмболизирующего состава, интенсивность кровотечения снизилась, окончательный гемостаз не достигнут, эмболизировали нижнюю переднюю панкреатодуоденальную артерию 2,0 мл эмболизирующего состава, окончательный гемостаз достигнут. Рецидива желудочно-кишечного кровотечения не было, выписан на 9 сутки в удовлетворительном состоянии.
По сравнению с прототипом способ позволяет эффективно остановить язвенные гастродуоденальные кровотечения.
Способ остановки язвенных гастродуоденальных кровотечений, включающий чрескожную транскатетерную артериальную эмболизацию приносящих сосудов после установления источника кровотечения, отличающийся тем, что у пациентов с рецидивом язвенного гастродуоденального кровотечения источник кровотечения устанавливают при целиакографии и верхней мезентерикографии по экстравазации контрастного водорастворимого вещества, затем выполняют эмболизацию с использованием эмболизирующего состава, включающего 1 часть маслорастворимого контрастного вещества и 3 части аутогенных жировых эмболов, содержащихся в среднем слое аспирированной подкожной жировой клетчатки после ее центрифугирования в течение 10 минут 15 секунд со скоростью 600 оборотов в минуту, при этом для эмболизации одного приносящего сосуда используют 2,0 мл эмболизирующего состава, который вводят болюсом на расстоянии не более 2,0 см от визуализированной экстравазации.