Обработка нуклеотидных последовательностей
Иллюстрации
Показать всеГруппа изобретений относится к области биохимии. Предложен аппарат и способ обработки нуклеотидных последовательностей, а также средство для секвенирования нуклеиновых кислот, молекулярной диагностики, анализа биологического образца, анализа химического образца, анализа пищевых продуктов и/или судебно-медицинского анализа. Аппарат включает массив электродов и прикрепленный к электроду наношарик, где к электродам избирательно приложимы электрические потенциалы для привлечения и/или отталкивания наношариков и/или несвязанных мешающих компонентов. Способ включает прикрепление к электроду наношарика и избирательное прикладывание к электродам массива электродов электрических потенциалов. Причём наношарик содержит представляющую интерес одноцепочечную повторяющуюся нуклеотидную последовательность. Изобретения обеспечивают эффективную обработку нуклеотидных последовательностей. 3 н. и 19 з.п. ф-лы, 1 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к аппарату и способу для обработки последовательностей нуклеотидов, в частности для определения нуклеотидного порядка ДНК/РНК.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
В WO 2012/042399 A1 описывается биосенсорное устройство, включающее множество электродов, которые покрыты различными ДНК-праймерами. Контролируется электрическая емкость электродов, что позволяет отнести изменения емкости к добавлению нуклеотидов к реплицируемому ДНК-праймеру. Подвергая электроды последовательно действию различных растворов мононуклеотидов, можно управлять тем, какой именно нуклеотид добавляется в данный момент. Для того чтобы быть в состоянии приписать наблюдаемое добавление на электроде к одному конкретному типу праймера, важно, чтобы каждый электрод был покрыт только одним видом праймера. В описанной в WO 2012/042399 A1 процедуре лишь примерно 37% доступных электродов могут быть покрыты таким образом единственным типом праймера, в то время как остальные электроды вообще не содержат праймеров или содержат два или более различных праймера параллельно, что не позволяет сделать единственно возможную интерпретацию сигналов измерения.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Было бы выгодно предложить средства, которые дают возможность проводить более эффективную обработку нуклеотидных последовательностей с массивом электродов.
Эта задача решается с помощью аппарата по п. 1, способа по п. 2 и применения по п. 15. Предпочтительные варианты осуществления раскрыты в зависимых пунктах формулы изобретения.
В соответствии с первым аспектом, вариант осуществления изобретения относится к аппарату для обработки нуклеотидных последовательностей, включающему в себя следующие компоненты:
- массив электродов;
- по меньшей мере один наношарик, содержащий повторения представляющей интерес нуклеотидной последовательности, причем упомянутый наношарик прикреплен к тому электроду, к которому может быть прикреплен одновременно не более чем один наношарик такого размера.
Обработка, которая выполняется с помощью такого аппарата, может представлять собой любой вид манипулирования представляющими интерес нуклеотидными последовательностями, например, деление последовательностей или реплицирование (копирование) нити нуклеотидов. В предпочтительном варианте осуществления обработка содержит пошаговое реплицирование праймера, имеющего неизвестную последовательность нуклеотидов, с целью определения упомянутой последовательности. В этом случае аппарат выполнен в виде биосенсора.
Обработанные нуклеотидные последовательности могут, например, включать (но не ограничены ими): исходные, или «сырые» образцы (бактерии, вирусы, геномную ДНК и т.д.); очищенные образцы, такие как очищенная геномная ДНК или РНК; продукт(ы) реакции амплификации; биологические молекулярные соединения, такие как нуклеиновые кислоты и родственные соединения (например, ДНК, РНК, олигонуклеотиды или их аналоги, продукты ПЦР, геномная ДНК, бактериальные искусственные хромосомы и т. п.).
Термин «массив» обозначает произвольное одно-, двух- или трехмерное расположение множества элементов (здесь – электродов). Обычно массив электродов представляет собой двухмерное и предпочтительно также плоское расположение, и при этом электроды расположены в виде регулярной структуры, например, решетки, сетки или матричной структуры.
Электроды массива могут в целом быть все выполнены индивидуально. Предпочтительно, однако, все электроды или по меньшей мере подгруппы всех электродов идентичны или подобны по форме, размеру и/или материалу. Электроды должны быть электропроводными, и должна быть возможность придать им некий данный электрический потенциал. Наиболее предпочтительно, подгруппы электродов или даже отдельные электроды могут быть индивидуально адресуемыми, т.е. на них можно по отдельности подавать желаемый электрический потенциал.
Термин "наношарик" (от англ. "nanoball", иногда также называемый "наноклубком") в общем обозначает большую молекулу или комплекс, имеющий компактную, например, (приблизительно) сферическую форму с внутренним диаметром, составляющим обычно в диапазоне между примерно 1 нм и примерно 1000 нм, предпочтительно – между примерно 50 нм и примерно 500 нм. Здесь и в дальнейшем под термином "внутренний диаметр" объекта нужно понимать диаметр наибольшей геометрической сферы, которая может быть полностью вписана в упомянутый объект.
Рассматриваемый здесь наношарик должен содержать повторения представляющей интерес нуклеотидной последовательности. Эти повторения, как правило, расположены друг за другом в непрерывной линейной цепи (нити) нуклеотидов, хотя тоже возможны и другие конфигурации (например, разветвленные молекулы и/или молекулы со спейсерными элементами различного состава между повторениями представляющей интерес последовательности). Эта структура тандемного повтора вместе с одноцепочечной природой ДНК индуцируют сворачивающуюся в наношарик («наноклубок») конфигурацию.
Прикрепление наношарика к соответствующему электроду может быть достигнуто с помощью любого подходящего эффекта. Наношарик может быть, например, ковалентно связан с поверхностью электрода и/или прикреплен к некоторому праймеру, который имеется на упомянутой поверхности, и/или связан нековалентно посредством гидрофобных или электростатических взаимодействий.
Поверхность электрода может быть химически модифицирована, чтобы сделать возможным прикрепление наношариков. Такая модификация, если с заряженными молекулами или полимерами, может необязательно быть поддержана и/или улучшена с помощью приложения соответствующих зарядов к электродам, так что модификация быстро приводится в контакт с поверхностью независимо от диффузии и наносится гомогенным, тонким слоем.
Аппарат описанного выше типа имеет то преимущество, что большое число повторений представляющей интерес нуклеотидной последовательности может быть без труда связано с одним электродом, потому что она добавляется с прикреплением только одного-единственного наношарика. В то же время это гарантирует, что никакой другой наношарик, который мог бы содержать повторения другой нуклеотидной последовательности, не может прикрепиться к тому же самому электроду. Это автоматически обеспечивает то, что соответствующий электрод предназначен только для одной конкретной нуклеотидной последовательности, представляющей интерес. Из-за этой автоматической уникальности ассоциации между последовательностями и электродами можно снабдить практически каждый электрод массива наношариком, таким образом используя полностью весь массив для целей обработки.
Хотя настоящим изобретением охватывается аппарат, в котором лишь один-единственный наношарик прикреплен к одному электроду, как правило, там будет множество наношариков, причем каждый из них будет прикреплен к разному из электродов. Как пояснялось выше, наиболее предпочтительно, чтобы наношарик прикреплялся к каждому электроду массива. Кроме того, предпочтительно, чтобы по меньшей мере один первый наношарик (прикрепленный к первому электроду) из множества наношариков содержат повторения первой представляющей интерес нуклеотидной последовательности и чтобы по меньшей мере один второй наношарик (прикрепленный ко второму электроду) содержал повторения второй, иной представляющей интерес нуклеотидной последовательности. Таким образом, соответствующие электроды специально предназначены для обработки различных представляющих интерес нуклеотидных последовательностей. Если все прикрепленные наношарики составлены из повторений различных представляющих интерес последовательностей, то массив электродов используется оптимально, так как каждый электрод предназначен для другой последовательности.
В соответствии со вторым аспектом, изобретение относится к варианту осуществления способа обработки нуклеотидных последовательностей, при котором по меньшей мере один наношарик, содержащий повторения конкретной представляющей интерес нуклеотидной последовательности, прикрепляют к тому электроду массива электродов, к которому может быть прикреплен только один наношарик такого размера.
Способ и аппарат представляют собой различные реализации одного и того же изобретательского замысла, то есть установления соответствия между электродами и наношариками реплицированных нуклеотидных последовательностей. Поэтому пояснения и определения, приведенные для одной из этих реализаций, справедливы также и для другой реализации.
В последующем будут описаны различные предпочтительные варианты осуществления, относящиеся и к аппарату, и к способу, охарактеризованным выше.
В одном предпочтительном варианте осуществления внутренний диаметр наношарика больше, чем примерно 40% внутреннего диаметра соответствующего электрода. Следовательно, нет необходимости в том, чтобы наношарик покрывал всю площадь электрода с целью блокировки прикрепления других наношариков.
В принципе, не существует верхнего предела по размеру наношарика относительно электрода(ов). А значит, наношарик может также быть большим (более крупным), чем электрод. Он, в частности, может охватывать несколько электродов (например, четыре), каждый из которых тогда давал бы один и тот же сигнал.
В общем, электроды аппарата могли бы быть расположены на внешней поверхности, которая может подвергаться воздействию окружающей среды или быть погружена в некоторую среду. В соответствии с предпочтительным вариантом осуществления аппарат содержит контейнер с реакционной камерой, которая может быть наполнена представляющей интерес средой и в которой расположены электроды (как правило, на нижней или донной поверхности камеры).
Вышеупомянутый контейнер может предпочтительно включать вход, к которому могут быть избирательно подключены по меньшей мере два различных резервуара с реагентами. Таким образом, среда рядом с электродами может быть управляемо изменена. Например, если встраивание нуклеотидов в реплицируемую нить должно наблюдаться с помощью полимеразы ("секвенирование с помощью синтеза"), то резервуар с реагентами может содержать растворы чистых мононуклеотидов. Если следует наблюдать встраивание олигонуклеотидов в реплицируемую нить с помощью лигазы ("секвинирование лигированием"), то резервуар с реагентами может содержать растворы чистых олигонуклеотидов. Когда к входу подключают, например, подачу реагента с аденозиновыми нуклеотидами, контейнер будет обеспечивать среду с этими нуклеотидами рядом с электродами, позволяя проводить наблюдение за встраиванием нуклеотидов аденозина на электродах. Подробности об этом подходе можно найти в WO 2012/042399 A1, который включен в настоящий текст с помощью ссылки.
Предпочтительно, вышеупомянутые резервуары с реагентами могут содержать среды с различными диэлектрическими характеристиками (например, буферы, буферные компоненты), которые могут восприниматься электродами. Таким образом, можно сделать заключение о той среде, воздействию которой в данный момент подвергаются электроды.
Электроды аппарата могут, в частности, быть подсоединены к схеме обработки, которая позволяет проводить измерение электрической емкости электродов. Поскольку электрическая емкость электрода изменяется, если в прикрепленный к электроду наношарик встраиваются новые нуклеотиды, этот этап встраивания можно контролировать емкостными измерениями. Электрическая емкость электродов (по отношению к окружающей среде) может, например, измеряться посредством их отклика (амплитуды, фазы) на (предпочтительно высокочастотную) нагрузку. Другая процедура может включать повторное приложение различных напряжений к электродам, при этом определяют общее количество заряда, которое переносится таким образом. Более подробная информация о возможной процедуре измерения электрической емкости электродов может быть найдена в WO 2012/042399 A1.
В предпочтительном варианте осуществления способа электроды массива подвергаются воздействию множества наношариков, содержащих повторения представляющих интерес нуклеотидных последовательностей, причем упомянутые наношарики имеют такие размеры, что только один из них может быть прикреплен к электроду за один раз. Каждый из наношариков, как правило, содержит повторения («реплики») только одной-единственной нуклеотидной последовательности, представляющей интерес, ассоциирующиеся исключительно с этой последовательностью. Кроме того, различные наношарики множества наношариков могут предпочтительно содержать повторения различных представляющих интерес нуклеотидных последовательностей (т.е. первый наношарик содержит первую представляющую интерес последовательность, вторая наношарик – вторую, отличающуюся последовательность, представляющую интерес, и т.д.). Воздействие на массив электродов такого «коктейля» наношариков автоматически гарантирует, что каждый электрод будет, в конце концов, связан с (самое большее) одной конкретной представляющей интерес нуклеотидной последовательностью, обеспечивая однозначную интерпретацию результатов измерения.
В другом варианте осуществления способа электроды массива подвергаются воздействию множества наношариков, содержащих повторения представляющих интерес нуклеотидных последовательностей, при этом упомянутые электроды могут быть адресованы по отдельности или совокупностями для специфичного привлечения упомянутых наношариков из раствора супернатанта. Таким образом, прикрепление наношариков к электродам может быть проделано управляемым образом.
Наношарик(и), который(е) прикрепляется(ются) к электроду(ам) массива, может(могут) быть предпочтительно получен(ы) путем амплификации по типу катящегося кольца (RCA). RCA является известным методом, при котором нуклеотидная последовательность, которая сформирована в виде кольца, служит в качестве шаблона, из которого получается непрерывная нить повторений этой последовательности. Подробности этого метода можно найти в литературе (например, Lizardi и др., "Mutation detection and single-molecule counting using isothermal rolling-circle amplification" ("Обнаружение мутаций и подсчет одиночных молекул с использованием изотермической амплификации по типу катящегося кольца"), Nature Genetics 19, 225-232 (1998); Asiello и др., "Miniaturized isothermal nucleic acid amplification, a review" ("Миниатюризованная изотермичесая амплификация нуклеиновых кислот, обзор"), Lab Chip, 2011, 11, 1420-1430 (2011); Zhao et al., "Rolling Circle Amplification: Applications in Nanotechnology and Biodetection with Functional Nucleic Acids" ("Амплификация по типу катящегося кольца: Применения в нанотехнологии и биодетекции с функциональными нуклеиновыми кислотами"), Angewandte Chemie International Edition ISSN: 1433-7851, Vol: 47 (34) 2008, page: 6330-6337 (2008)). Получение одного вида наношариков (или множества различных наношариков) методом RCA может необязательно иметь место в объеме, смежном с электродами, или в отдельном сосуде.
В другом предпочтительном варианте осуществления к электродам массива могут быть селективно приложены электрические потенциалы для привлечения и/или отталкивания наношариков и/или других компонентов смежной среды. Когда массив непокрытых электродов, например, в первый раз подвергается воздействию среды, включающей наношарики, к электродам могут быть приложены соответствующие электрические потенциалы, чтобы гарантировать, что наношарики прикрепятся только к желаемой подгруппе электродов. Другие электроды могут, например, быть оставлены свободными в целях сравнения или для последующего прикрепления других наношариков (например, со сравнительными нуклеотидными последовательностями), что может обеспечиваться другой средой. Теоретически, таким образом, возможно избирательно снабдить каждый отдельный электрод наношариком из конкретной среды.
При типовом применении описанных аппарата и способа электрическая емкость электродов с прикрепленным наношариком измеряется и предпочтительно контролируется с течением времени. Тогда изменения емкости будут давать информацию о процессах, имеющих место на электродах и/или в прикрепленных наношариках, в частности, информацию о встраивании нуклеотидов и/или олигонуклеотидов в нити, которые на данный момент копируются на упомянутом наношарике. Кроме того, изменения емкости могут указывать на связывание наношарика с электродом.
Как уже указывалось выше, массив электродов можно последовательно подвергать воздействию различных растворов мононуклеотидов и/или олигонуклеотидов. Реакции, которые наблюдаются на электродах, вследствие этого можно однозначно отнести к тому мононуклеотиду или олигонуклеотиду, который находится в соответствующий момент в растворе, смежном с электродом.
Изобретение далее относится к применению описанного выше аппарата для секвенирования нуклеиновых кислот, молекулярной диагностики, анализа биологического образца, анализа химического образца, анализа пищевых продуктов и/или судебно-медицинского (криминалистического) анализа.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Эти и другие аспекты изобретения станут очевидными и разъяснятся при обращении к описываемым далее вариантам осуществления.
Единственный рисунок, фиг. 1, схематично иллюстрирует вариант осуществления биосенсорного аппарата в соответствии с изобретением.
ПОДРОБНОЕ ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Технология секвенирования нуклеиновых кислот быстро усовершенствуется и поэтому в будущем будет предпочтительным способом молекулярной диагностики в генетике, патологии и онкологии. Однако ни одна из доступных в настоящее время технологий не отвечает требованиям рутинного диагностического применения с точки зрения стоимости, правильности (точности) и простоты в использовании. Во многих технологиях «секвенирования с помощью синтеза» используют флуоресцентно меченные, обратимые завершенные нуклеотиды, которые являются дорогостоящими и химически непривычны нормальным ДНК-полимеразам. У технологий, при которых измеряют реакцию встраивания нового нуклеотида, а не сам нуклеотид, имеется то преимущество, что могут быть использованы нормальная полимераза и нормальные, немеченные нуклеотиды, которые значительно снижают стоимость и повышают точность. Одним из примеров этого является "454-секвенирование" (Roche), при котором молекулу пирофосфата, которая высвобождается при встраивании нуклеотида, обнаруживают с помощью ферментативной реакции, которая дает видимый свет, но эта ферментативная реакция требует дополнительных этапов и дорогостояща. Другим примером является технология, при которой контролируют электрическую емкость электродов, что позволяет приписать изменения емкости присоединению нуклеотидов к копируемому ДНК-праймеру на электродах (WO 2012/042399 A1). Недостаток этого способа заключается в том, что нельзя использовать большинство электродов, если должна быть гарантирована уникальная ассоциация между праймером и электродом.
Для решения упомянутых проблем здесь предлагается использовать емкостной (био-)сенсор для секвенирования, помещая амплифицированные клоны подлежащих считыванию молекул на плоскую (нано-)электродную поверхность и обнаруживая емкостное изменение новых нуклеотидов, построенных на этих клонах. В этом способе емкостное изменение от присоединения дополнительных нуклеотидов является постоянным изменением, так что результат измерения сигнала может быть проинтегрирован за более длительный период и поэтому, вероятно, даст робастный (помехоустойчивый) сигнал. Кроме того, используются наношарики представляющих интерес реплицированных нуклеотидных последовательностей, которые имеют размер, обеспечивающий возможность прикрепления только одного наношарика в расчете на электрод.
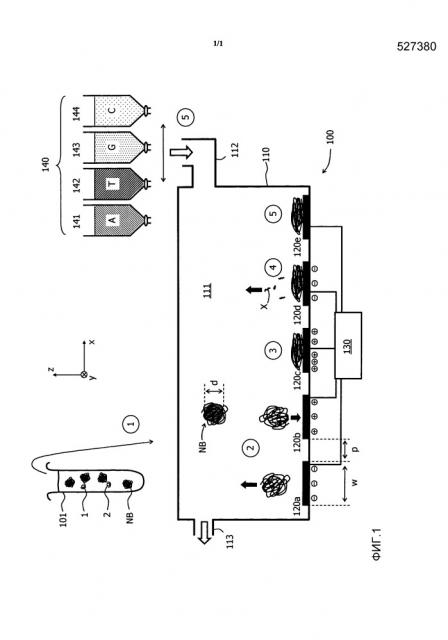
Фигура 1 схематично иллюстрирует аппарат или биосенсор 100, который разработан в соответствии с вариантом осуществления вышеупомянутого общего принципа, и способ, который может быть выполнен таким биосенсором.
В показанном варианте осуществления биосенсор 100 содержит контейнер 110 с реакционной камерой 111, которая может быть заполнена подлежащей обработке средой (текучей средой или жидкостью). Для этой цели контейнер 110 снабжен входом 112, через который может подаваться среда, и выходом 113, через который среда может быть удалена из реакционной камеры.
Кроме того, подача 140 реагентов обеспечивается несколькими отдельными резервуарами 141, 142, 143, 144 с реагентами, причем каждый из этих резервуаров может быть избирательно подключен ко входу 112 для введения соответствующего реагента в реакционную камеру 111. Это достигается с помощью микрожидкостных соединений для подачи различных реагентов один за другим и промывки буферами в промежутках между ними.
Биосенсор 100 дополнительно содержит множество электродов 120a, 120b, … 120e, которые расположены в двумерном массиве (видна только протяженность в направлении х) на дне реакционной камеры 111. Поверхность электродов должна быть предпочтительно плоской и допускать возможность модификации или покрытия для создания субстрата (подложки), к которому(ой) могут быть прикреплены молекулы ДНК. Число электродов, как правило, больше, чем примерно 100, предпочтительно больше, чем примерно 1000. Электроды индивидуально подключены к схеме 130 обработки, которая может индивидуально прикладывать к электродам различные электрические потенциалы. Кроме того, схема 130 обработки должна быть способна измерять индивидуально емкость электродов (по отношению к окружающей среде). Это может, например, достигаться способом, описанным в WO 2012/042399 A1.
Биосенсор 100 может быть подготовлен и использован для секвенирования представляющих интерес нуклеотидных последовательностей следующим образом:
На первом этапе () получают наношарики NB, содержащие повторения представляющих интерес нуклеотидных последовательностей. Это получение может происходить в отдельном контейнере или пробирке 101 (как показано), или в реакционной камере 111. Наношарики могут, в частности, производиться путем амплификации по типу катящегося кольца ("RCA"), начиная с кольцевых шаблонов представляющих интерес нуклеотидных последовательностей 1, 2 (обычно будет присутствовать число различных шаблонов порядка числа электродов в массиве). RCA является способом клональной амплификации, который создает тандемные дубликаты представляющей интерес последовательности, приводя в результате к большим одноцепочечным молекулам ДНК, состоящим, как правило, из 100-10000 копий представляющей интерес последовательности в одной молекуле. В результате этого процесса образуются наношарики NB с внутренними диаметрами d, каждый из которых содержит повторения конкретной представляющей интерес нуклеотидной последовательности. В этом контексте "внутренний диаметр" наношарика определяется как диаметр наибольшей сферы (обозначенной серым оттенком на фигуре для одного наношарика), которая может быть полностью вписана в этот наношарик. Внутренний диаметр d показанных наношариков NB обычно составляет в диапазоне между примерно 100 нм и 500 нм.
На втором этапе процедуры подготовки массив электродов в реакционной камере 111 подвергают воздействию сгенерированного «коктейля» наношариков NB. Это иллюстрировано на на электродах 120a и 120b массива электродов. На электроды можно во время этой стадии избирательно подавать различные положительные или отрицательные (или нейтральные) электрические потенциалы, которые притягивают наношарики (здесь предполагаются положительные потенциалы) или отталкивают наношарики (здесь предполагаются отрицательные потенциалы). Таким образом можно управлять прикреплением наношариков к выбранным подгруппам электродов. Кроме того, в ходе этого этапа можно необязательно контролировать изменение емкости электродов, чтобы обнаружить прикрепление наношарика, что позволяет отслеживать "заполненные" электроды в ходе реакции секвенирования.
Поскольку наношарики, как правило, все будут нести некоторый заряд одного знака (обычно отрицательный), они будут отталкивать друг друга (зависит от буфера), что дополнительно способствует разнесению наношариков по электродам.
Типичный размер наношариков NB, выраженный, например, в виде их внутреннего диаметра d, выбирается в зависимости от размера электродов 120a-120f, причем последний размер может быть, например, измерен по внутреннему диаметру w электродов (на фигуре показан для круглых электродов). Эта зависимость такова, что размер наношарика(ов) делает по существу невозможным, чтобы более чем один наношарик мог прикрепиться к отдельному электроду в одно и то же время ("по существу" означает с вероятностью более чем 95%, предпочтительно более чем 99%, так как множественные связывания вряд ли можно исключить с уверенностью). Типичные значения для внутреннего диаметра w электродов лежат в диапазоне между примерно 100 нм и примерно 200 нм. Шаг p между электродами, как правило, находится в диапазоне от примерно 400 нм до примерно 800 нм. В общем, шаг p должен быть больше чем диаметр d наношариков.
Указанное соотношение размеров может быть реализовано путем адаптации размера наношариков к данному размеру электродов (например, остановкой RCA в соответствующий момент времени), путем изготовления электродов с размером, который соответствует заранее заданному размеру наношариков, или путем комбинации обоих подходов (подстраивая размеры и электродов, и наношариков). Относительно первого варианта может быть сделана следующая оценка: 100-кратная – 10000-кратная амплификация шаблонов примерно 10-1000 нт (нуклеотидов) приводит к наношарикам от примерно 50000 до примерно 500000 нуклеотидов. Использование полимеразы с известной скоростью, например, примерно 1-100 нт/сек, дает возможность настроить размер наношарика на предпочтительное значение.
На необязательном третьем этапе процедуры, показанном на на электроде 120c, можно использовать притягивающий потенциал на электродах для дальнейшего связывания и расплющивания прикрепленных наношариков на поверхности выбранного электрода, таким образом улучшая емкостной сигнал, производимый этими электродами. С этой целью притягивающий потенциал на электроде может необязательно быть повышен по сравнению с предыдущим этапом.
На необязательном четвертом этапе процедуры, показанном на на электроде 120d, на электроды может быть подан отталкивающий электрический потенциал для того, чтобы удалить несвязанные мешающие компоненты X ("мусор", например, нуклеотиды или праймеры) от электродов. Таким образом, помехи от реакций, которые не связаны с встраиванием нуклеотидов в представляющий интерес наношарик, могут быть уменьшены.
После этого подготовка биосенсора 100 завершена, и можно начинать фактические измерения, т.е. секвенирование представляющих интерес нуклеотидных последовательностей 1, 2, которые содержатся в множественных копиях у различных наношариков NB на электродах. Это показано на на электроде 120e.
Во время процедуры секвенирования реакционная камера 111 последовательно заполняется средами реагентов из резервуаров 141-144 с реагентами. Каждый из этих резервуаров содержит различный реагент, например, различный из мононуклеотидов A, T, G и С (альтернативно, могут быть использованы растворы олигонуклеотидов). Когда раствор с конкретным мононуклеотидом, скажем с аденозином A, заполняет реакционную камеру 111, любое изменение емкости, которое наблюдается на конкретном электроде, можно однозначно отнести к встраиванию этого мононуклеотида A в нить, которая копируется в соответствующий наношарик NB на электроде.
Прежде чем ввести новый раствор реагента в реакционную камеру 111, на электроды может быть подан отталкивающий потенциал (как показано выше на четвертом этапе), чтобы оттолкнуть свободные нуклеотиды, которые не были встроены во время реакции секвенирования.
Добавление одного-единственного нуклеотида к отдельно взятой молекуле едва ли даст обнаруживаемое изменение емкости на электроде. Для надежности, чтобы получить обнаруживаемый сигнал на каждый встроенный нуклеотид, необходимы клоны идентичных молекул, ко всем из которых добавлен тот же самый нуклеотид. Эти клоны обеспечиваются в описываемом подходе наношариками, полученными, например, с помощью амплификации по типу катящегося кольца. RCA дает большую свободу биохимического конструирования, например, для проведения реакции амплификации в растворе в отдельной пробирке. Впоследствии эти наношарики ДНК могут быть осаждены на поверхность биосенсора и удерживаться прикрепленными с помощью специфичных или неспецифичных взаимодействий с поверхностью. В качестве альтернативы, первый праймер может быть непосредственно прикреплен к поверхности, а затем может быть выполнена амплификация.
Кольцевая ДНК, которая служит шаблоном для амплификации по типу катящегося кольца, может быть создана различными способами. В одном примере концы случайных фрагментов ДНК лигируют (сшивают) вместе с образованием кольца. Использование амплификации по типу катящегося кольца (RCA) дополнительно обеспечивает возможность применений с целенаправленным секвенированием. RCA может быть основана на специфичных праймерах (технология отбора), так что амплифицируются только определенные последовательности. Или же полногеномные RCA-клоны могут быть гибридизированы со специфичными к последовательности зондами на магнитных бусинках для изоляции или непосредственно на поверхности биосенсора, так что секвенируются только определенные клоны. Кроме того, множественные фрагменты могут быть сшиты (лигированы) вместе с образованием одного кольца. В другом примере в качестве шаблона можно непосредственно использовать кольцевые вирусные геномы. RCA-молекулы могут быть специфично модифицированы во время или после амплификации для того, чтобы создать центры связывания для связывания с поверхностью сенсора.
Поскольку все клоновые копии, произведенные с помощью RCA, находятся в одной молекуле, то клонами можно манипулировать. Что касается биосенсора, то можно привлечь или оттолкнуть наношарики, подавая положительное или отрицательное напряжение на электроды. Поскольку наношариков могут быть «подстроены» имеющими аналогичный с электродами размер (как правило, 100-300 нм), то может быть получено очень эффективное заполнение поверхности, с заполнением практически всех электродов, но никакой из них не может иметь более чем один наношарик из-за их размера. Это является большим усовершенствованием по сравнению с ранее описанными способами, когда в среднем лишь примерно 1/3 электродов находится в использовании. При описанном способе может быть получена 25-кратная плотность потенциалов, нежели чем возможно для оптического секвенирования, что является важным для числа последовательностей, которые могут быть считаны параллельно в один проход. Дополнительно, наношарики могут быть притянуты в более плоскую конформацию на поверхности, вписываясь в активную высоту, в которой возможно измерение емкости. Вычисления показывают, что электрическая транслокация наношариков на достаточной скорости возможна при напряжениях, которые не вызывают электролиза на открытой электродной поверхности (до 1 В). В частности, для наношарика с типичным размером (200 нм) и зарядом (105 нт, соответствующим 105 зарядов электрона), при приложении 1 В и -1 В к электродам, достигается скорость транслокации примерно 0,2 м/с, которая достаточна для высот камеры порядка 50 мкм.
Подавая напряжение на конкретные электроды или ряды электродов, можно направить наношарики в конкретные места. По сути, можно, например, создавать пространственное ранжирование на сенсоре, которое позволяет сохранять априорную информацию и использовать ее в анализе секвенирования. Например, можно иметь определенные положения последовательностей контроля, измерять различные образцы параллельно или держать определенные электроды пустыми, чтобы обеспечить контрольный сигнал. Используя отталкивающие напряжения, можно помочь отталкиванию свободных нуклеотидов, которые не были встроены в реакции секвенирования, и таким образом улучшить промывку.
В описанных процедурах текучие среды с реагентами вынуждают протекать последовательно по всей поверхности сенсора, например, в режиме идеального вытеснения (т.е. когда отдельные реагенты подают последовательно в непрерывном потоке, сохраняя раздельными по их химическим свойствам или по структуре и размеру микрожидкостной системы). Придавая различным текучим средам различимые характеристики (например, диэлектрические свойства), можно следить при считывании за всеми этапами процесса секвенирования и точно определить профиль сигнала присоединения одного нуклеотида.
В заключение, был описан вариант осуществления изобретения, который относится к способу и аппарату для обработки нуклеотидных последовательностей. Такой аппарат содержит массив электродов, причем по меньшей мере один наношарик, содержащий повторения представляющей интерес нуклеотидной последовательности, прикрепляется к тому электроду, к которому может быть прикреплен только один наношарик такого размера в одно и то же время. Таким образом, может быть достигнута уникальная ассоциация электродов с представляющими интерес нуклеотидными последовательностями. Наношарики предпочтительно получают путем амплификации по типу катящегося кольца. Приложение притягивающих и/или отталкивающих электрических потенциалов к электродам может использоваться для управления прикреплением наношариков. Измерение изменений в емкости электродов может быть использовано для обнаружения и контроля встраивания мононуклеотидов, поставляемых последовательно с помощью различных растворов, в нити, которые копируются в наношарик на электроде. Изобретение может, например, применяться для обнаружения мутаций нуклеиновых кислот при диагностике, например, в области здравоохранения, онкологии и патологии.
Хотя изобретение было иллюстрировано на чертежах и подробно описано в предшествующем описании, такие иллюстрацию и описание нужно считать иллюстративными или примерными, а не ограничительными; изобретение не ограничено раскрытыми вариантами осуществления. Другие вариации в раскрытых вариантах осуществления могут быть поняты и выполнены специалистами в данной области техники при практическом осуществлении заявленного изобретения, исходя из изучения чертежей, описания изобретения и прилагаемой формулы изобретения. В формуле изобретения слова «включающий» и «содержащий» не исключают других элементов или этапов, а формы единственного числа не исключают множества. Отдельный процессор или другой блок могут выполнять функции нескольких элементов, указанных в формуле изобретения. Тот факт, что некоторые меры приведены во взаимно различных зависимых пунктах формулы изобретения, не указывает на то, что не может быть с выгодой использована комбинация этих мер. Компьютерная программа может быть сохранена/распространена на подходящем носителе, таком как оптический носитель данных или твердотельный носитель, поставляемый вместе с или как часть других аппаратных средств, но также может распространяться в других формах, таких как через Интернет или другие проводные или беспроводные телекоммуникационные системы. Любые ссылочные обозначения в формуле изобретения не должны быть истолкованы как ограничивающие объем изобретения.
1. Аппарат (100) для обработки нуклеотидных последовательностей, включающий в себя:
- массив электродов (120a, 120b, ...) и
- по меньшей мере один наношарик (NB), содержащий представляющую интерес одноцепочечную повторяющуюся нуклеотидную последовательность (1, 2), причем упомянутый наношарик (NB) прикреплен к электроду, к которому прикрепляется не более чем один наношарик (NB) такого размера,
при этом к электродам массива электродов (120a, 120b, ...) избирательно приложимы электрические потенциалы для привлечения и/или отталкивания наношариков (NB) и/или несвязанных мешающих компонен