Медные комплексы пиридинилметиленамино-бензо-15-крауны-5 и способ их получения
Иллюстрации
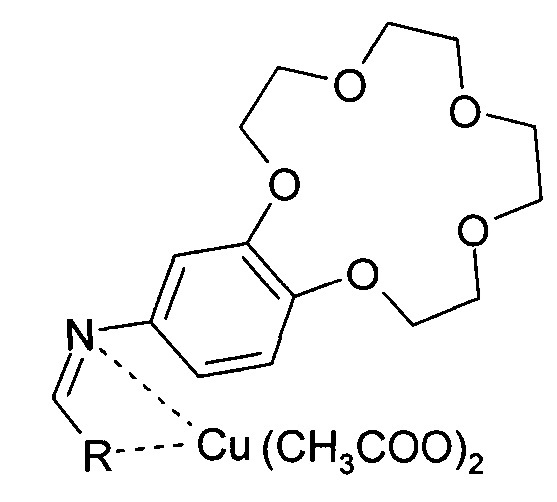
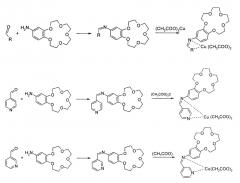
Показать всеИзобретение относится к медным комплексам пиридинилметиленамино-бензо-15-краун-5, общей структурной формулы:
где R - пиридинил-4-ил, пиридинил-3-ил. Также предложен способ их получения. Предлагаемые медные комплексы могут применяться в медицине, в частности при лечении онкологических заболеваний. 2 н. и 1 з.п. ф-лы, 1 табл., 4 пр.
Реферат
Предлагаемые новые соединения относятся к группе азометинов (оснований Шиффа) и непосредственно - к группе краунсодержащих иминов, а именно к медным комплексам пиридинилметиленаминобензо-15-краун-5-эфиров, которые, благодаря наличию высокочувствительной селективной сенсорной способности на катионы металлов, могут применяться в медицине, в частности при лечении онкологических заболеваний, а также в сельском хозяйстве и в ряде других областей.
Известно, что большое внимание в медицине уделяется изучению возможности широкого применения производных краун-эфиров в онкологии, в частности использованию их в качестве активных действующих соединений для химиотерапии, носителей лекарственных средств к раковой клетке, фитосенсибилизаторов [R. Muzzalupo, F.P. Nicoletta, S. Trombino et al., Coll. and Surf. B: Biointerfaces, 58, 197-202, (2007)]. Активно ведется поиск противоопухолевых соединений для химиотерапии как среди производных краун-эфиров, так и среди их комплексов с ионами металлов [J. Yoo, Y.S. Sohn and Y. Do, J. Inorg. Biochem. 73, 187-193, (1999)]. Доказано, что комплексы металлов меди, кобальта, никеля, палладия, рутения с органическими лигандами вызывают апоптоз раковых клеток [I. Iakovidis, I. Delimaris and S. M. Piperakis, Mol. Bio. Int., 1-13, (2011); C. Marzano, M. Pellei and F. Tisato, Med. Chem., 9, 185-211, (2009); M. Plotek, K. Dudek and A. Kyziol, Chemik, 67, 12, 1181-1190, (2013)].
Как сказано выше, рассматриваемые иминные производные краун-эфиров относятся к группе азометинов, что и определяет схему их синтеза. Известно, что основным способом получения азометинов (иминов, оснований Шиффа) является конденсация альдегидов или кетонов с первичными аминами. Азометиновые производные краун-эфиров, в частности бензо-15-краун-5, описаны ранее в ряде работ. Исходными соединениями в известных работах являлись: 4-амино-бензо-15-краун-5 и 2-гидрокси-4-метоксибензальдегид и 2-гидрокси-5-метоксибензальдегид [GulerH et all, Polyhedron, 2012 vol. 31, p. 688], 4-амино-бензо-15-краун-5 и 2,3,4-триметоксибензальдегид [Carlo Juiz et all, Organometallic 2009, vol 28, p. 6657; Sadovskay N.Yu. et all, Synthesis and properties of Macroheterocyclic Azomethines Based on 4-aminobenzo-15-crown-5, Russian Journal of General Chemistry, 2015, v/85, no 12, h. 2771-2777]. Процесс конденсации при синтезе описанных соединений предлагается проводить в среде метанола или безводного хлороформа при кипении.
Несмотря на довольно широкий ассортимент имеющихся противораковых средств, ведется поиск более эффективных и менее токсичных средств.
С целью расширения ассортимента таких противоопухолевых препаратов предлагаются новые соединения - медные комплексы пиридинилметиленамино-бензо-15-краун-5, общей структурной формулы:
где R - пиридин-4-ил или пиридинил-3-ил.
Медные комплексы пиридинилметиленамино-бензо-15-краун-5, имеющие указанную общую структурную формулу, получают добавлением к пиридин-4-илметиленамино-бензо-15-краун-5 или пиридин-3-илметиленамино-бензо-15-краун-5 эквимолярного количества ацетата меди в виде его метанольного раствора, выдерживанием реакционной массы при температуре 40-50°С, фильтрационным отделением выпавшего осадка и сушкой его на воздухе при комнатной температуре.
В качестве исходных соединений используют соответствующие пиридинилметиленамино-бензо-15-краун-5, предварительно синтезируемые из 3-пиридинкарбоксальдегида или 4-пиридинкарбоксальдегида и этанольного раствора 4-аминобензо-15-краун-5, взятыми в количествах, соответствующих мольному соотношению выбранного альдегида к краун-эфиру, равному 0,012:0,01.
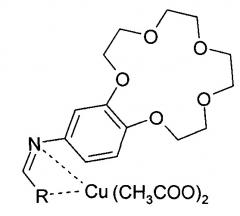
Новыми синтезированными заявленными медными комплексами являются: Медный комплекс N-(пиридин-4-илметиленамино)-бензо-15-краун-5)
и Медный комплекс N-(пиридин-3-илметиленамино)-бензо-15-краун-5
Заявляемые способы получения данных новых соединений характеризуется определенными технологическими условиями их осуществления, в котором существенную роль играют температурные режимы процесса, весовое соотношение исходных ингредиентов и выбор растворителя. Синтез осуществляется при эквимолярном соотношении исходных ингредиентов, а именно пиридинилметиленамино-бензо-15-краун-5 и ацетата меди. Выбор именно ацетата меди в качестве исходного продукта объясняется тем. что ацетат меди имеет хорошую растворимость в метаноле и, кроме того, он мало токсичен.
В качестве исходных выбраны N-(пиридин-3-илметиленамино)-бензо-15-краун-5 и N-(пиридин-4-илметиленамино)-бензо-15-краун-5, предварительно синтезируемые из 3-пиридинкарбоксальдегида или 4-пиридинкарбоксальдегида и этанольного раствора 4-аминобензо-15-краун-5, взятыми в количествах, соответствующих мольному соотношению выбранного альдегида к краун-эфиру, равному 0,012: 0,01. Синтез протекает по указанной ниже схеме:
Ниже изобретение иллюстрируется следующими примерами осуществления процесса синтеза, а также результатами исследований эффективности перечисленных соединений как противоопухолевых препаратов в сравнении с другими соединениями (Таблица 1):
Пример 1
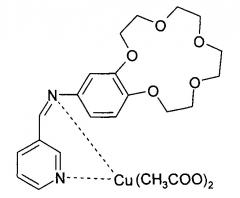
N-(пиридин-3-илметиленамино)-бензо-15-краун-5
К раствору 0,01 моль 4-аминобензо-15-краун-5 в 10 мл этанола прибавляют по каплям 0,012 моль 3-пиридинкарбоксальдегида. Выдерживают при температуре 40°С в течение 3 ч, раствор упаривают, выпавший осадок отфильтровывают, сушат на воздухе при комнатной температуре.
Получают N-(пиридин-3-илметиленамино)-бензо-15-краун-5 - порошок светло-зеленого цвета. Выход 88%. Т.пл. 87.3-88.0°С.
Спектр ЯМР 1Н (ДМСО-d6, 300 МГц): 3.63 (уш.с, 8Н), 3.75-3.82 (м, 4Н, С(14)Н2+С(19)Н2), 4.04-4.15 (м, 4Н, С(13)Н2+С(20)Н2), 6.91 (дд, 1Н, С(12)Н, J=8.4, J=2.3), 7.00 (д, 1Н, C(11)Н, J=8.4), 7.04 (д, 1Н, С(8), J=2.3), 7.54 (дд, 1H, С(4)Н, J=7.9, J=4.8), 8.28 (дт, 1Н, С(3)Н, J=7.9, J=1.7), 8.68 (дд, 1Н, С(5)Н, J=4.8, J=1.7), 8.75 (с, 1Н, С(6)Н), 9.03 (д, 1Н, С(1)Н, J=1.7). ИК-спектр (v, см-1): 623 сл., 705 ср., 811 сл., 844 сл., 918 сл., 939 сл., 991 сл., 1050 ср., 1091 ср., 1129 с., С-О-С, 1142 с., 1237 ср., 1262 с., 1331 сл., 1373 сл., 1421 сл., 1449 сл., 1510 с., 1568 сл., 1586 сл., 1625 сл., C=N, ~2873-~2930 с., уш., С-Н, ~3030-~3060 сл., уш., =С-Н. Для C20H24N2O5 вычислено, %: С 64.50; Н 6.53, N 7.52. Найдено, %: С 64.69.
Пример 2
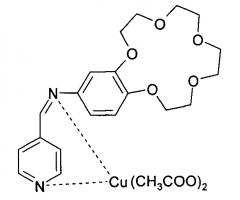
N-(пиридин-4-илметиленамино)-бензо-15-краун-5
К раствору 0,01 моль 4-аминобензо-15-краун-5 в 10 мл этанола прибавляют по каплям 0,012 моль 4-пиридинкарбоксальдегида. Выдерживают при температуре 40°С в течение 3 ч, раствор упаривают, выпавший осадок отфильтровывают, сушат на воздухе при комнатной температуре. Получают N-(пиридин-4-илметиленамино)-бензо-15-краун-5 (Р2) - порошок светло-зеленого цвета. Выход 86%. Т.пл 75.1-76.0°С. Спектр ЯМР 1Н (ДМСО-d6, 300 МГц): 3.63 (уш.с, 8Н), 3.72-3.85 (м, 4Н), 4.03-4.17 (м, 4Н), 6.96 (дд, 1H), 7.01 (д, 1Н), 7.08 (д, 1Н), 7.79-7.84 (м, 2Н), 7.70-7.76 (м, 3Н). Спектр ЯМР 13С (ДМСО-d6, 75 МГц): 68.46, 68.64, 68.76, 68.81, 69.73, 70.48, 106.89, 113.75, 114.73, 121.94, 142.79, 143.49, 148.13, 148.98, 150.39, 156.63. ИК-спектр (v, см-1): 627 сл., 814 сл., 851 сл., 934 сл., 989 сл., 1050 ср., 1091 ср., 1131 с., С-О-С, 1230 с., 1266 с., 1316 ср., 1363 сл., 1414 сл., 1453 ср., 1513 с., 1555 сл., 1588 ср., 1598 ср., 1626 сл., C=N, ~2868-~2922 с., уш., С-Н, ~3030-~3060 сл., br, =С-Н. Для C20H24N2O5 вычислено, %: С 64.50; Н 6.53, N 7.52. Найдено, %: С 64.69; Н 6.57 N 7.58.
Пример 3
Медный комплекс N-(пиридин-4-илметиленамино)-бензо-15-краун-5
К раствору 0,001 моль ацетата меди(II) в 15 мл метанола прибавляют раствор 0,001 моль в 10 мл метанола N-(пиридин-4-илметиленамино)-бензо-15-краун-5. Затем, выдерживают при температуре 45°С в течение 4 часов, выпавший осадок отфильтровывают, сушат на воздухе при комнатной температуре.
Порошок зеленого цвета. Выход 94%. Тпл. 203,2-203,8 (с разложением). ИК-спектр (KBr, v, см-1): 187 ср, уш., 266 с., уш., ar С-Н, 357 с., уш., 399 сл., 439 сл., 521 с., 538 с., 552 с., 617 с., 628 с., 680 с., 792 сл., 831 сл., 890 с., 942 ср., 974 сл., 1012 сл., 1026 ср., 1053 ср., 1084 сл., 1120 с., С-О-С, 1142 с., 1202 сл., 1276 ср., arС-Н, 1301 ср., 1350 сл., 1418 с., 1432 с., 1508 с., 1608 с., СООСu, 1628 с., C=N, ~2869-~2930 ср., уш., С-Н. Для C24H30O9N2Cu вычислено, %: С 64.52; Н 5.96, N 4.73. Найдено, %: С 64.60, Н 6.01, N 4.57.
Пример 4
Медный комплекс N-(пиридин-3-илметиленамино)-бензо-15-краун-5
К раствору 0,001 моль ацетата меди(II) в 15 мл метанола прибавляют раствор 0,001 моль в 10 мл метанола N-(пиридин-3-илметиленамино)-бензо-15-краун-5. Затем, выдерживают при температуре 45°С в течение 4 ч, выпавший осадок отфильтровывают, сушат на воздухе при комнатной температуре.
Получают порошок зеленого цвета. Выход 91%. Т.пл.=208,9-210,0 с разложением.
ИК-спектр (v, см-1): 188 ср., 263 с., уш., arС-Н, 356 с., уш., 394 сл., 413 сл., 443 ср., 472 сл., 483 ср., 509 ср., 537 ср., 563 ср., 628 с., 641 с., 682 с., 713 ср., 803 ср., 822 ср., 841 ср., 887 сл., 929 сл., 980 ср., 1031 сл., 1052 ср., 1080 ср., 1137 с., С-О-С, 1191 сл., 1237 ср., 1262 ср., 1316 сл., 1428 с., 1513 с, 1610 с., СООСu, 1629 с., C=N, ~2870-~2950 сл., уш., С-Н. Для C24H30O9N2Cu вычислено, %: С 64.52; Н 5.96, N 4.73. Найдено, %: С 64.62, Н 6.05, N 4.57.
Для оценки влияния краун-кольца на противоопухолевую активность соединений дополнительно по аналогичной схеме были синтезированы комплексы N-(пиридинилметиленамино)-бензо-18-краун-6, а также производные пиридинилметиленамино-анилина, не содержащие в своей структуре краун-кольца, и их медные комплексы, а именно: N-(пиридин-4-илметиленамино)-анилин - белый порошок с желтоватым оттенком Т.пл. 67.8-69.2°С.
Спектр ЯМР 1Н (ДМСО-d6, 75 МГц): 7.29-7.37 (м, 3Н, СН), 7.41-7.50 (м, 2Н, СН), 7.83-7.88 (м, 2Н, СН), 8.69 (с, 1Н, HC=N), 8.76 (д, 1Н, СН, J=3.4). ИК-спектр (v, см-1): 649 ср., 690 с., 734 ср., 764 с., 819 с., 881 сл., 913 ср., 961 сл., 977 сл., 987 сл., 1022 сл., 1059 сл., 1074 сл., 1165 сл., 1186 сл., 1209 сл., 1226 сл., 1236 сл., 1284 сл., 1325 ср., 1364 сл., 1411 с. (пиридин), 1449 сл., 1482 ср. (пиридин), 1554 сл., 1579 сл. (пиридин), 1593 ср. (пиридин), 1620 ср. (C=N), 1671 сл., 1711 сл., 1799 сл., 1881 сл., 1953 сл., 2001 сл., 2884 сл. (С-Н), 2991 сл. (С-Н), 3025 сл. (С-Н аром), 3054 сл. (С-Н аром), 3072 сл. (С-Н аром). Для C12H10N2 вычислено, %: С 79.12; Н 5.49, N 15.38. Найдено, %: С 78.99; Н 5.57 N 15.58.
N-(пиридин-3-илметиленамино)-анилин
Масло желтого цвета.
Спектр ЯМР 1Н: 7.26-7.33 (м, 3Н, СН), 7.39-7.48 (м, 2Н, СН), 7.54 (дд, 1Н, СН, J=7.9, J=4.6), 8.31 (дт, 1H, СН, J=7.9, J=1.9), 8.67-8.73 (м, 2Н, HC=N+CH), 9.06 (д, 1Н, СН, J=1.9). Спектр ЯМР 13С (ДМСО-d6, 75 МГц): 121.02, 123.99, 126.36, 129.20, 131.48, 134.92, 150.40, 151.04, 151.91, 158.53. ИК-спектр (v, см-1): 620 сл., 667 сл., 693 с, 760 с, 804 ср., 830 сл., 874 ср., 910 сл., 977 сл., 1023 сл., 1074 сл., 1092 оч. сл., 1114 оч. сл., 1186 сл., 1204 ср., 1236 сл., 1324 ср., 1365 сл., 1386 оч. сл., 1418 ср. (пиридин), 1450 сл., 1485 ср. (пиридин), 1570 ср. (пиридин), 1587 ср. (пиридин), 1626 ср. (C=N), 1703 ср., 1943 comb, 2857 сл. (С-Н), 2886 сл. (С-Н), 3001 сл. (С-Н аром), 3031 сл. (С-Н аром), 3054 сл. (С-Н аром), 3080 сл. (С-Н аром). Для C12H10N2 вычислено, %: С 79.12; Н 5.49, N 15.38. Найдено, %: С 78.99; Н 5.57 N 15.58.
Медный комплекс N-(пиридин-4-илметиленамино)-анилина
Порошок зеленого цвета. Тпл. 236,2-236,8 (с разложением).
ИК-спектр (KBr, v, см-1): 631 ср., 660 ср., 683 с., 735 сл., 768 ср., 824 ср., 883 сл., 913 сл., 961 сл, 976 сл., 1013 сл., 1033 сл., 1056 сл., 1185 сл., 1211 сл., 1244 сл., 1320 сл., 1350 сл., 1418 с., 1433 с., 1484 сл., 1559 сл., 1607 с., 1624 с., 2885 сл., 3000 сл., 3061 сл. Для C16H16O4N2C11 вычислено, %: С 52.82; Н 4.40, N 7.70. Найдено, %: С 52.61, Н 4.51, N 7.57.
Медный комплекс N-(пиридин-3-илметиленамино)-анилина
Порошок зеленого цвета. Тпл. 239,1-240,0 (с разложением).
ИК-спектр (v, см-1): 627 сл., 643 сл., 681 с., 699 ср., 761 сл., 800 сл., 892 сл., 988 сл., 1029 сл., 1049 сл., 1074 оч. сл., 1100 оч. сл., 1124 оч. сл., 1186 сл., 1197 сл., 1244 сл., 1327 сл., 1384 сл., 1374 сл., 1417 с., 1427 с., 1471 сл., 1488 сл., 1578 ср., 1617 с., 2930 сл., 3007 сл., 3071 сл. Для C16H16O4N2 Сu вычислено, %: С 52.82; Н 4.40, N 7.70. Найдено, %: С 52.61; Н 4.51, N 7.57.
N-(пиридин-4-илметиленамино)-бензо-18-краун-6
Порошок светло-зеленого цвета. Выход 89%. Т.пл. 63.9-64.7°С.
Спектр ЯМР 1Н (ДМСО-d6, 300 МГц): 3.52 (с, 4Н, СН2), 3.55-3.64 (м, 8Н, СН2), 3.73-3.80 (м, 4Н, СН2), 4.07-4.18 (м, 4Н, СН2), 6.95 (дд, 1H, СН, J=8.5, J=2.0), 7.01 (д, 1Н, СН, J=8.5), 7.08 (д, 1Н, СН, J=2.0), 7.82 (д, 2Н, СН, J=5.8), 8.68-8.77 (м, 3Н, CH+HC=N). Спектр ЯМР 13С (ДМСО-d6, 75 МГц): 69.30, 68.86, 69.77, 69.80, 69.90, 106.35, 113.07, 114.52, 121.96, 142.83, 143.28, 147.80, 148.60, 150.39, 156.55. ИК-спектр (v, см-1): 629 сл., 713 ср., 802 ср., 829 ср., 849 ср., 899 сл., 933 ср., 949 ср., 984 ср., 1032 ср., 1056 ср., 1116 с.(С-О-С), 1189 сл., 1222 ср., 1258 ср. (С-Н), 1319 сл., 1359 сл., 1414 сл., 1457 сл. (пиридин), 1482 сл. (пиридин), 1509 с.(СН2), 1587 сл. (пиридин), 1624 сл. (C=N), 2855 шир., 2925 сл. (С-Н), 2932 сл. (С-Н), 3030 сл. (С-Н аром), 3055 сл. (С-Н аром). Для C22H28O6N2 вычислено, %: С 52.22; Н 5.69, N 4.69. Найдено, %: С 52.41; Н 5.57, N 4.58.
N-(пиридин-3-илметиленамино)-бензо-18-краун-6
Порошок светло-зеленого цвета. Выход 89%. Т.пл. 73.9-74.2°С.
Спектр ЯМР 1Н (ДМСО-d6, 300 МГц): 3.53 (уш.с, 4Н, СН2), 3.55-3.61 (м, 8Н, СН2), 3.74-3.80 (м, 4Н, СН2), 4.07-4.18 (м, 4Н, СН2), 6.91 (дд, 1H, СН, J=8.5, J=2.3), 7.00 (д, 1Н, СН, J=8.5), 7.04 (д, 1Н, СН, J=2.4), 7.53 (дд, 1Н, СН, J=7.9, J=4.7), 8.28 (дт, 1Н, СН, J=7.9, J=1.9), 8.68 (дд, 1Н, СН, J=4.7, J=1.4), 8.75 (с, 1Н, HC=N), 9.03 (д, 1Н, СН, J=1.0). Спектр ЯМР 13С (ДМСО-d6, 75 МГц): 68.13, 68.31, 68.68, 69.77, 69.87, 106.38, 113.19, 113.89, 123.99, 131.79, 134.61, 143.94, 147.30, 148.57, 150.13, 151.52, 156.08. ИК-спектр (v, см-1): 629 сл., 713 ср., 802 ср., 829 ср., 849 ср., 899 сл., 933 ср., 949 ср., 984 ср., 1032 ср., 1056 ср., 1116 с.(С-О-С), 1189 сл., 1222 ср., 1258 ср. (С-Н), 1319 сл., 1359 сл., 1414 сл., 1457 сл. (пиридин), 1482 сл. (пиридин), 1509 с.(СН2), 1587 сл. (пиридин), 1624 сл. (ON), 2855 шир, 2925 сл. (С-Н), 2932 сл. (С-Н), 3030 сл. (С-Н аром), 3055 сл. (С-Н аром). Для C22H28O6N2 вычислено, %: С 52.22; Н 5.69, N 4.69. Найдено, %: С 52.31; Н 5.51, N 4.57.
Медный комплекс N-(пиридин-3-илметиленамино)-бензо-18-краун-6
Порошок зеленого цвета. Выход 88%. Тпл.=223,2-223,9 с разложением.
ИК-спектр (v, см-1): 627 сл., 793 ср., 819 ср., 839 сл., 862 сл., 879 сл., 945 ср., 987 ср., 1049 ср., 1107 с., 1127 с.(С-О-С), 1225 с., 1245 ср., 1265 с., 1315 сл., 1326 сл., 1354 сл., 1412 сл., 1427 сл., 1449 сл. (пиридин), 1463 сл. (пиридин), 1511 с.(СН2), 1552 оч. сл., 1582 ср. (пиридин), 1598 ср. (C=N), 2868 ср. (С-Н), 2923 сл. (С-Н), 3030 сл. (С-Н аром), 3056 сл. (С-Н аром) Для C26H34O10N2Cu вычислено, %: С52.22; Н 5.69, N 4.69. Найдено, %: С 52.30, Н 5.81, N 4.57.
Медный комплекс N-(пиридин-3-илметиленамино)-бензо-18-краун-6
Порошок зеленого цвета. Выход 88%. Тпл. 230,1-230,9 с разложением.
ИК-спектр (KBr, v, см-1): 628 сл., 642 сл., 680 с., 702 ср., 811 ср., 855 сл., 948 ср., 993 ср., 1031 ср., 1052 ср., 1120 с., 1223 ср., 1257 ср., 1297 сл., 1333 сл., 1354 сл., 1371 сл., 1426 с., 1443 sh, 1510 ср., 1587 сл., 1616 с., 2866 шир., 2923 шир., 3032 сл., 3050 сл. Для C26H34O10N2Cu вычислено, %: С52.22; Н 5.69, N 4.69. Найдено, %: С 52.33, Н 5.61, N 4.57.
Экспериментальная биологическая часть
Исследование проводилось на 5 клеточных линиях опухолей человека: карцинома толстой кишки НСТ-116; карцинома простаты РС-3; карцинома легкого А549; аденокарцинома молочной железы MCF-7; Т-клеточный лимфобластный лейкоз Jurkat, полученных из Банка клеточных линий ФГБУ «РОНЦ им. Н.Н. Блохина» Минздрава России.
Клеточные линии культивировали в среде RPMI-1640, содержащей 10% телячьей эмбриональной сыворотки, 10 мМ HEPES (Sigma, США), 2 мМ L-глутамина (Sigma, США), 40 нг/мл гентамицина (ICN, США), аминокислоты, пируват натрия и раствор витаминов (ПанЭко, Россия), при 37°С в атмосфере 5% СО2. Клетки поддерживали в логарифмической фазе роста постоянным пересевом культуры через 3-4 дня. Для открепления адгезионных культур с пластика использовали раствор Версена.
Для оценки противоопухолевой активности полученных соединений использовались МТТ-тест [16]. МТТ - 3-(4,5-диметилтиазолил-2)-2,5-дифенилтетразолий бромид - желтый водорастворимый тетразолиевый краситель, который в митохондриях жизнеспособных и гликолитически активных клеток восстанавливается действием НАД- или НАДФ-зависимых дегидрогеназ в нерастворимый фиолетовый формазан. Количество получившегося в результате реакции формазана зависит от числа и жизнеспособности клеток. После завершения реакции оставшиеся жизнеспособные клетки погибают, кристаллы формазана растворяют диметилсульфоксидом и измеряют оптическую плотность, которая отражает количество клеток в конце оцениваемого периода.
Для постановки МТТ-теста клетки раскапывали в 96-луночные плоскодонные планшеты (Costar, USA). Через сутки в каждую лунку добавляли исследуемые соединения в концентрации 100 мкМ, и инкубировали с клетками в течение 72 ч в 5% СО2 при 37°С. Каждое соединение исследовали в триплете. Соединения растворяли в диметилсульфоксиде так, чтобы концентрация диметилсульфоксида в лунке не превышала 1%. В качестве контроля использовали лунки с клетками с 1% диметилсульфоксидом в полной ростовой среде. Через 72 ч в каждую лунку вносили по 20 мкл раствора МТТ (конечная концентрация 1 мг/мл), и инкубировали 4 ч при 37°С в 5% СО2.
После образования формазана надосадочную жидкость удаляли, осадок растворяли в 150 мкл диметисульфоксида. Далее планшеты помещали на 10 минут в термостат при температуре 37°С и затем встряхивали на шейкере для равномерного растворения кристаллов формазана, после чего интенсивность окрашивания среды измеряли на фотометрическом анализаторе иммуноферментных реакций «АИФР-01 Униплан» (ЗАО «Пикон») при λ=540 нм. Величина поглощения прямо пропорциональна числу живых клеток.
Определяли процент ингибирования роста клеток (И, %) по формуле:
И=(1-(Оо/Ок))*100%, где Ок - оптическая плотность в контрольных лунках, Oo - оптическая плотность в опытных лунках.
Соединение считали цитостатически активным, если оно вызывало подавление роста клеток более 50%.
Обсуждение результатов.
В Таблице 1 приводятся данные по процентам ингибирования роста клеток, определяющие цитотоксичную активность синтезированных соединений. С целью сокращения словесного обозначения данных соединений они записаны под следующими кодами: Р2 - N-(пиридин-4-илметиленамино)-бензо-15-краун-5;
L2 - N-(пиридин-3-илметиленамино)-бензо-15-краун-5;
L3 - N-(пиридин-3-илметиленамино)-бензо-18-краун-6;
P3 - N-(пиридин-4-илметиленамино)-бензо-18-краун-6;
L1 - N-(пиридин-3-илметиленамино)-анилин;
Р1 - N-(пиридин-4-илметиленамино)-анилин;
(Р2)Сu(СН3СОО) - Медный комплекс N-(пиридин-4-илметиленамино)-бензо-15-краун-5;
L2Сu(СН3СОО)2 - Медный комплекс N-(пиридин-3-илметиленамино)-бензо-15-краун-5;
Р1Сu(СН3СОО)2 - Медный комплекс N-(пиридин-4-илметиленамино)-анилина;
L1Cu(CH3COO)2 - Медный комплекс N-(пиридин-4-илметиленамино)-анилина;
L3Сu(СН3СОО)2 - Медный комплекс N-(пиридин-3-илметиленамино)-бензо-18-краун-6;
Р3Сu(СН3СОО)2 - Медный комплекс N-(пиридин-4-илметиленамино)-)-бензо-18-краун-6.
Из 12 исследованных соединений 8 проявили цитотоксическую активность: P1, Р3, P1Cu(CH3COO)2, P2Cu(CH3COO)2, Р3Сu(СН3СОО)2, L1Cu(CH3COO)2, L2Cu(CH3COO)2, L3Cu(CH3COO)2. Проценты ингибирования роста клеток систематизированы в Таблицу 1. Видно, что все медные комплексы синтезированных лигандов проявили цитотоксическую активность, чего нельзя сказать о самих лигандах, пиридинсодержащих азометиновых производных краун-эфиров, которые не активны в отношении клеточных линий. Исключение составляет лиганд Р3, содержащий в своей структуре 18-членный краун-эфирный цикл. Соединение Р3 активно в отношении Т-клеточного лимфобластного лейкоза Jurkat и ингибирует рост раковых клеток на 58%. Исследования производных анилина, не содержащих в своей структуре краун-кольца, позволяют оценить влияние этого структурного элемента на противоопухолевую активность соединений в целом.
К изобретению
«Медные комплексы пиридинилметиленамино-бензо-15-крауны-5 и способ их получения»
Р2 - N-(пиридин-4-илметиленамино)-бензо-15-краун-5;
L2 - N-(пиридин-3-илметиленамино)-бензо-15-краун-5;
L3 - N-(пиридин-3-илметиленамино)-бензо-18-краун-6;
Р3 - N-(пиридин-4-илметиленамино)-бензо-18-краун-6;
L1 - N-(пиридин-3-илметиленамино)-анилин;
Р1 - N-(пиридин-4-илметиленамино)-анилин;
(Р2)Сu(СН3СОО) - Медный комплекс N-(пиридин-4-илметиленамино)-бензо-15-краун-5;
L2Сu(СН3СОО)2 - Медный комплекс N-(пиридин-3-илметиленамино)-бензо-15-краун-5;
Р1Сu(СН3СОО)2 - Медный комплекс N-(пиридин-4-илметиленамино)-анилина;
L1Сu(СН3СОО)2 - Медный комплекс N-(пиридин-4-илметиленамино)-анилина;
L3Сu(СН3СОО)2 - Медный комплекс N-(пиридин-3-илметиленамино)-бензо-18-краун-6;
Р3Сu(СН3СОО)2 - Медный комплекс N-(пиридин-4-илметиленамино)-)-бензо-18-краун-6.
1. Медные комплексы пиридинилметиленамино-бензо-15-краун-5 общей структурной формулы:
где R - пиридинил-4-ил, пиридинил-3-ил.
2. Способ получения медных комплексов пиридинилметиленамино-бензо-15-краун-5, имеющих общую структурную формулу:
где R - пиридинил-4-ил, пиридинил-3-ил, осуществляемый добавлением к предварительно полученным пиридин-4-илметиленамино-бензо-15-краун-5 или пиридин-3-илметиленамино-бензо-15-краун-5 эквимолярного количества ацетата меди в виде его метанольного раствора, выдерживанием реакционной массы при температуре 40-50°С, фильтрационным отделением выпавшего осадка и сушкой его на воздухе при комнатной температуре.
3. Способ получения медных комплексов пиридинилметиленамино-бензо-15-краун-5 по п. 2, характеризующийся тем, что в качестве исходных соединений используют соответствующие пиридинилметиленамино-бензо-15-краун-5, предварительно синтезируемые из 3-пиридинкарбоксальдегида или
4-пиридинкарбоксальдегида и этанольного раствора 4-аминобензо-15-краун-5, взятые в количествах, соответствующих мольному соотношению выбранного альдегида к краун-эфиру, равному 0,012:0,01.