Способ спектральной идентификации плодов шиповника и витаминного сбора
Иллюстрации
Показать всеИзобретение относится к химико-фармацевтической промышленности и касается способа идентификации лекарственных растительных субстанций - плодов шиповника и витаминного сбора №1 путем анализа спектральных характеристик спиртового извлечения. Способ идентификации плодов шиповника и витаминного сбора №1 включает получение спиртового извлечения с использованием этанола концентрацией 95%, аликвоту которого, равную 5-8 мл, помещают в мерную колбу вместимостью 25 мл, добавляют 5-8 мл кислоты уксусной 30%, 8 мл спиртового 2% раствора алюминия хлорида, доводят 95% этанолом до метки (рН раствора 1,6±0,4) и снимают спектр на фоне раствора сравнения, состоящего из 5-8 мл спиртового извлечения и 8 мл кислоты уксусной 30%, доведенных до метки 95% этанолом; при этом на спектре поглощения обнаруживаются одновременно три максимума поглощения, соответствующие: фенолкарбоновым кислотам при 311 нм для витаминного сбора №1 и 323 нм для плодов шиповника; флавоноидам при 411 нм для витаминного сбора №1 и 404 нм для плодов шиповника; антоцианам при 540 нм для витаминного сбора №1 и 526 нм для плодов шиповника. 2 ил., 3 пр.
Реферат
Изобретение относится к химико-фармацевтической промышленности и касается способа идентификации лекарственных растительных субстанций - плодов шиповника и витаминного сбора №1 путем анализа спектральных характеристик спиртового извлечения.
В литературе описан способ идентификации флавоноидов [Федосеева Г.М. и др. Фитохимический анализ растительного сырья, содержащего флавоноиды. - Учебн. пособие. - Иркутск. - 2009. - 67 с.], включающий получение УФ-спектра спиртового извлечения из лекарственного растительного сырья, на котором для флавоноидов характерны две интенсивные полосы поглощения в длинноволновой области 320-380 нм (1 полоса) и в коротковолновой 240-270 нм (2 полоса), а для флавонолов эти полосы идентифицируются по поглощению в диапазонах 350-390 нм и 250-270 нм соответственно, при этом возможен дополнительный максимум при 300 нм. Расстояние между основными максимумами поглощения постоянно и для флавонолов составляет 93-125 нм. Недостатком данного метода является то, что он подходит лишь для идентификации индивидуальных соединений флавоноидов и не может быть пригоден в оценке подлинности лекарственного растительного сырья, содержащего комплекс соединений, поглощающих при тех же длинах волн.
В работе [Харлампович Т.А. Фитохимическое изучение и стандартизация донника лекарственного травы, произрастающего на территории алтайского края. Автореф. на соиск. канд. фарм. н. - Пермь. - 2014. - 24 с.] описан способ идентификации индивидуальных фармацевтически активных соединений по спектрам их поглощения, например кемпферол может быть идентифицирован по двум максимумам поглощения при 265,4 и 364 нм. Недостатком этого способа является необходимость предварительного хроматографического разделения компонентов лекарственного растительного сырья с помощью высокоэффективной жидкостной хроматографии.
В литературе описана работа авторов Боков Д.О., Самылина И.А., Попов Д.М. Спектрофотометрия в анализе двух видов подснежника (Galanthus L.) Доступ: butlerov.com/files/reports/2005/…/Боков%20ДО.%20БН-2015_25_03_2015_37.doc.
В данном исследовании получены «спектрофотометрические профили» поглощения настоек матричных гомеопатических на основе лекарственного растительного сырья двух видов подснежника Воронова и белоснежного. Показано, что данный метод может применяться при доказательстве подлинности настоек. Однако, предложенные методы справедливы только для сырья и лекарственных форм, содержащих алкалоиды. Второй - экстракционно-спектрофотометрический метод, предлагаемый авторами, требует специальной пробоподготовки.
Наиболее близким аналогом является способ идентификации лекарственного растительного сырья [О.В. Чечета, Е.Ф. Сафонова, А.И. Сливкин, С.В. Снопов. Определение флавоноидов в плодах шиповника (rosa sp.) - Вестник ВГУ, серия: химия, биология. Фармация, 2011, №1. - С. 205-209.], включающий количественное определение суммы флавоноидов в водных и водно-спиртовых извлечениях из плодов шиповника методом УФ-спектрофотометрии. Недостатком этого метода является то, что он не дает возможности установить подлинность плодов шиповника, т.к. аналогичные максимумы поглощения присущи многим растениям, например чабрец, зверобой, ромашка и т.д.
Техническим результатом настоящего изобретения является определение подлинности плодов шиповника и витаминного сбора №1 по трем группам веществ в сумме - фенолкарбоновым кислотам, флавоноидам и антоцианам.
Предлагаемый нами метод объединяет сразу две задачи - возможность одновременного количественного определения флавоноидов в плодах шиповника и в сборе витаминном №1 и доказательства подлинности этих лекарственных субстанций по присутствию сразу трех групп биологически активных соединений в сумме.
Технический результат достигается за счет того, что 95% этанольное извлечение из лекарственного растительного сырья подвергают реакции комплексообразования с алюминия хлоридом в кислой среде (рН=1,6±0,4) и снимают спектр поглощения продуктов реакции комплексообразования одновременно по трем длинам волн 311 нм, 411 нм, 540 нм для витаминного сбора №1 и/или 323 нм, 404 нм и 526 нм для плодов шиповника. Это возможно только при указанном интервале рН, при рН больше (меньше кислоты или ацетатный буфер), максимумы при 311 нм и 411 нм не разделяются. В случае, когда рН меньше 1,6±0,4, требуется добавление минеральных кислот (серная, соляная), однако это приводит к разрушению определяемых соединений.
Четкое разделение максимумов поглощения комплексов флавоноидов с алюминия хлоридом, фенолкарбоновых кислот и антоцианов возможно при значении рН=1,6±0,4. Наличие трех максимумов поглощения в сумме позволяет четко идентифицировать плоды шиповника и витаминный сбор №1.
Заявленный способ спектральной идентификации лекарственного растительного сырья может быть проиллюстрирован следующими примерами.
Пример 1.
Около 2 г сырья (точная навеска) помещают в термостойкую колбу со шлифом, заливают 50 мл спирта этилового концентрацией 95%, присоединяют к обратному холодильнику и кипятят на плитке с закрытой спиралью в течение 30 мин (раствор А). Аликвоту раствора А, равную 8 мл, помещают в мерную колбу вместимостью 25 мл, добавляют 8 мл уксусной кислоты с концентрацией 30%, 8 мл спиртового раствора алюминия хлорида с концентрацией 2% и доводят объем до метки 95% спиртом этиловым (раствор Б). Снимают спектр поглощения в диапазоне длин волн 250-650 нм на фоне раствора сравнения в течение 10-50 мин от начала реакции.
Приготовление раствора сравнения: в мерную колбу вместимостью 25 мл помещают 8 мл раствора А, добавляют 8 мл уксусной кислоты с концентрацией 30% и доводят объем до метки 95% спиртом этиловым.
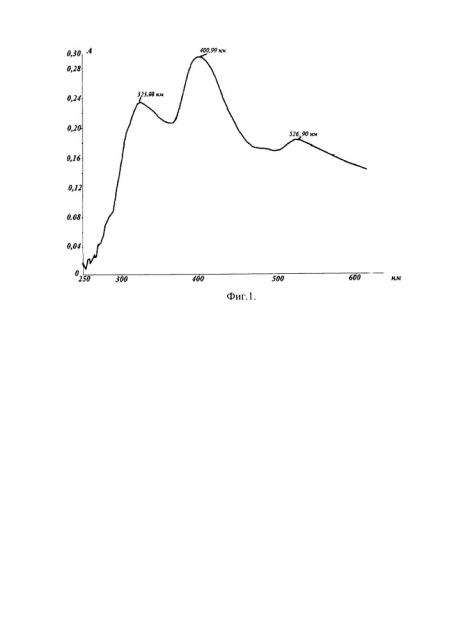
На спектре поглощения раствора Б для плодов шиповника на фоне раствора сравнения обнаруживаются 3 максимума поглощения, соответствующие: фенолкарбоновым кислотам при 323 нм; флавоноидам при 404 нм; антоцианам при 526 нм. На спектре поглощения раствора Б для витаминного сбора на фоне раствора сравнения обнаруживаются 3 максимума поглощения, соответствующие: фенолкарбоновым кислотам при 311 нм; флавоноидам при 411 нм; антоцианам при 540 нм.
Пример 2.
Навеску плодов шиповника массой 2,0021 г помещают в термостойкую колбу со шлифом, заливают 50 мл спирта этилового концентрацией 95%, присоединяют к обратному холодильнику и кипятят на плитке с закрытой спиралью в течение 30 мин (раствор А). Аликвоту раствора А, равную 8 мл, помещают в мерную колбу вместимостью 25 мл, добавляют 8 мл уксусной кислоты с концентрацией 30%, 8 мл спиртового раствора алюминия хлорида с концентрацией 2% и доводят объем до метки 95% спиртом этиловым (раствор Б). Снимают спектр поглощения в диапазоне длин волн 250-650 нм на фоне раствора сравнения.
Приготовление раствора сравнения: в мерную колбу вместимостью 25 мл помещают 8 мл раствора А, добавляют 8 мл уксусной кислоты с концентрацией 30% и доводят объем до метки 95% спиртом этиловым. На полученном спектре обнаруживаются 3 максимума поглощения, соответствующие: фенолкарбоновым кислотам при 323 нм; флавоноидам 404 нм; антоцианам при 526 нм. Абсорбционный дифференциальный спектр поглощения плодов шиповника представлен на фиг. 1.
Пример 3.
Навеску витаминного сбора №1 массой 2,0249 г помещают в термостойкую колбу со шлифом, заливают 50 мл спирта этилового концентрацией 95%, присоединяют к обратному холодильнику и кипятят на плитке с закрытой спиралью в течение 30 мин (раствор А). Аликвоту раствора А, равную 8 мл, помещают в мерную колбу вместимостью 25 мл, добавляют 8 мл уксусной кислоты с концентрацией 30%, 8 мл спиртового раствора алюминия хлорида с концентрацией 2% и доводят объем до метки 95% спиртом этиловым (раствор Б). Снимают спектр поглощения в диапазоне длин волн 250-650 нм на фоне раствора сравнения.
Приготовление раствора сравнения: в мерную колбу вместимостью 25 мл помещают 8 мл раствора А, добавляют 8 мл уксусной кислоты с концентрацией 30% и доводят объем до метки 95% спиртом этиловым. На полученном спектре обнаруживаются 3 максимума поглощения, соответствующие: фенолкарбоновым кислотам при 311 нм; флавоноидам 411 нм; антоцианам при 540 нм. Абсорбционный дифференциальный спектр поглощения витаминного сбора №1 представлен на фиг .2.
Способ идентификации плодов шиповника и витаминного сбора №1 путем получения спиртового извлечения с использованием этанола концентрацией 95%, аликвоту которого, равную 5-8 мл, помещают в мерную колбу вместимостью 25 мл, добавляют 5-8 мл кислоты уксусной 30%, 8 мл спиртового 2% раствора алюминия хлорида, доводят 95% этанолом до метки (рН раствора 1,6±0,4) и снимают спектр на фоне раствора сравнения, состоящего из 8 мл спиртового извлечения и 5-8 мл кислоты уксусной 30%, доведенных до метки 95% этанолом; при этом на спектре поглощения обнаруживаются одновременно три максимума поглощения, соответствующие: фенолкарбоновым кислотам при 311 нм для витаминного сбора №1 и 323 нм для плодов шиповника; флавоноидам при 411 нм для витаминного сбора №1 и 404 нм для плодов шиповника; антоцианам при 540 нм для витаминного сбора №1 и 526 нм для плодов шиповника.