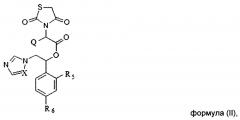Гибридные эфиры на основе производных тиазолидин-2,4-диона и азолов (1н-1,3-имидазола и 1н-1,3,4-триазола) и их применение
Иллюстрации
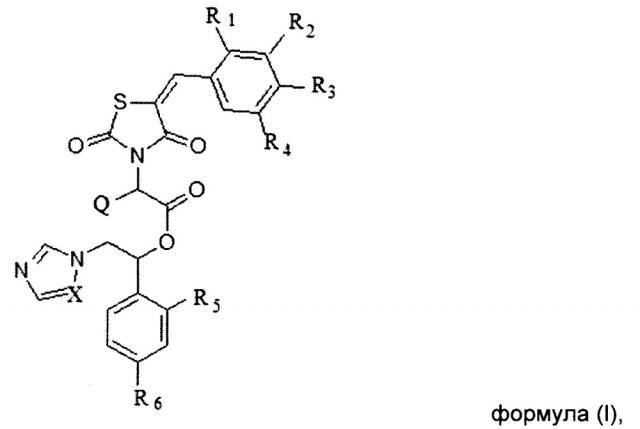
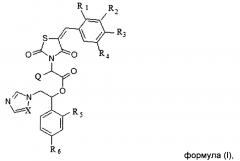
Показать всеИзобретение относится к соединениям, общей формулы (I) или (II), или его стереоизомеру или энантиомеру, фармацевтически приемлемой соли, где X выбирается независимо и представляет собой СН или N; Q выбирается независимо и представляет собой Н, -C1-6-алкил, фенил, галогенированный фенил, нафтил или галогенированный нафтил; R1, R2, R3, R4 выбираются независимо и представляют собой Н, -C1-6-алкил, -ОН, галоген, -O-бензил, фенил, причем фенил или бензил может быть необязательно замещен, по меньшей мере, одним заместителем, выбранным из галогена, -CN, -ОН, -O-C1-6-алкила, -СООН, -COOC1-6-алкил, причем R1 и R2 совместно с циклом, к которому они присоединены, могут образовывать бициклический фрагмент нафтил; R5, R6 выбираются независимо и представляют собой галоген. Соединения по изобретению предназначены для лечения и/или предотвращения инфекционного заболевания микробной этиологии у субъекта, которое вызвано грибковой инфекцией. 4 н. и 19 з.п. ф-лы, 8 табл., 5 пр.
Реферат
Область техники
Изобретение относится к химии органических соединений, фармакологии и медицине и касается новых химических соединений, характеризующихся высокой противогрибковой активностью, которые, в частности, могут использоваться для профилактики и лечения инфекционных заболеваний у субъекта, в частности заболеваний, вызванных кандидозными и филоментозными патогенами.
Уровень техники
Недостаточная эффективность современной противомикробной терапии обусловлена в значительной степени развитием резистентности у возбудителей к имеющимся лекарственным препаратам. Именно поэтому во всем мире проводится интенсивный поиск и разработка новых эффективных лекарственных соединений. Несмотря на все усилия, современный арсенал медицинских средств недостаточен и не позволяет проводить эффективное лечение многих заболеваний, в том числе грибковых инфекций. Имеющиеся в настоящее время противогрибковые препараты - полиены и азолы, влияющие на главный компонент мембраны грибов - эргостерол, не обеспечивают должной избирательности действия. Они весьма токсичны, более того, многие штаммы возбудителей приобретают резистентность к препаратам группы азолов.
Из уровня техники известны соединения, имеющие тиазолидиндионовый фрагмент и характеризующиеся противогрибковой активностью US 7105554, WO 2002022612, Thiazolidine and benzylidene thiazolidinedione inhibitors of mannosyltransferease as antifungal agents // Expert Opinion Ther. pat., Patent evaluation, 2002, 12,8, 1285-7. В данных документах описаны замещенные производные 5-бензилиден-2,4-тиазолидин-3 уксусной кислоты в качестве антимикотических средств, активных в отношении многих патогенных грибов. Из уровня техники известны также производные азола, характеризующиеся противогрибковой активностью WO 2005006860, Помимо этого описаны способы получения и противогрибковая активность ацильных производных азолов - широко известной группы противогрибковых средств, и, в частности, соединений, полученных путем ацилирования азольных гетероциклов по атому кислорода спиртовой части молекулы (Y. Wahbi et al. Aliphatic ethers and esters of 1-(2,4-dichlorophenyl)-2-(IH-imidazolyl)ethanol: study of antifungal activity against yeasts and hydrophobic character// Eur. J. Med. Chem, 1994, 29, 701-6.; D. De Vita et al. Synthesis and antifungal activity of a new series of 2-(1H-imidazol-1-yl)-1-phenylethanol derivatives // Eur. J. Med. Chem., 2012, 49, 334-342). Однако, как уже упоминалось выше, основном недостатком препаратов, на основе производных азолов, является растущая резистентность, что может свести на нет все прилагаемые усилия по лечению. Проблема еще усугубляется тем, что развивается перекрестная устойчивость ко всем используемым препаратам азольной группы (J.E. Parker. Resistance to antifungals that target CYP51 // J. Chem. Biol, 2014.).
Поэтому сохраняется высокая необходимость в разработке новых эффективных противогрибковых средств для терапии широкого спектра заболеваний, вызванных грибковыми инфекциями.
Раскрытие изобретения
Задачей настоящего изобретения является разработка и создание новых эффективных противогрибковых средств, перспективных для применения в клинической практике для терапии и/или профилактики инфекционных заболеваний.
Техническим результатом изобретения является разработка и получение новых химических соединений, обладающих высокой противогрибковой активностью, пониженной токсичностью и перспективных для применения в терапии инфекционных заболеваний у субъекта, в частности заболеваний, вызванных кандидозными и филоментозными патогенами, в частности для лечения дерматофитии, поверхностного микоза, кандидоза кожи и ногтей, вагинального кандидоза, кандидозного стоматита, эндокардита и других заболеваний человека и животных. Соединения по изобретению также снижают риск развития серьезных кандидозных инфекций у людей с ослабленным иммунитетом в результате терапии (например, химиотерапии), трансплантации органов или у людей с инфекционными заболеваниями, вызванными другими патогенами (в частности, ВИЧ).
Указанный технический результат достигается посредством разработки и создания соединений общей формулы (I) или общей формулы (II):
или их стереоизомеров или энантиомеров, фармацевтически приемлемых солей, сольватов или гидратов, где:
X выбирается независимо и представляет собой СН или N;
Q выбирается независимо и представляет собой Н, -C1-6-алкил, фенил, галогенированный фенил, нафтил или галогенированный нафтил;
R1, R2, R3, R4 выбираются независимо и представляют собой Н, -С1-6-алкил, - ОН, галоген, -О-бензил, фенил, причем фенил или бензил может быть необязательно замещен, по меньшей мере, одним заместителем, выбранным из галогена, -CN, -ОН, -О-С1-6-алкила, -СООН, -СООС1-6-алкил, причем R1 и R2 совместно с циклом, к которому они присоединены, могут образовывать бициклический фрагмент нафтил;
R5, R6 выбираются независимо и представляют собой галоген.
Отдельный подкласс соединений, представляющих интерес, включает соединения формулы (I), в которых:
X представляет собой СН;
Q выбирается независимо и представляет собой Н, -C1-6-алкил, фенил, галогенированный фенил, нафтил или галогенированный нафтил;
R1, R2, R3, R4 выбираются независимо и представляют собой Н, - ОН, галоген, -О-бензил, фенил, причем фенил или бензил может быть необязательно замещен, по меньшей мере, одним заместителем, выбранным из галогена, -CN, -ОН, -O-C1-6-алкила, -СООН, -СООС1-6-алкил;
R5, R6 представляют собой Cl.
Другой подкласс соединений, представляющих интерес, включает соединения формулы (I), в которых:
X представляет собой N;
Q выбирается независимо и представляет собой Н, -С1-6-алкил, фенил, галогенированный фенил, нафтил;
R1, R2, R3, R4 выбираются независимо и представляют собой Н, - ОН, галоген, -О-бензил, фенил, причем фенил или бензил может быть необязательно замещен, по меньшей мере, одним заместителем, выбранным из галогена, -CN, -ОН, -O-С1-6-алкила, -СООН, -СООС1-6-алкил;
R5, R6 представляют собой F.
Отдельный подкласс соединений, представляющих интерес, включает соединения формулы (I), в которых:
X выбирается независимо и представляет собой СН или N;
Q представляет собой -2-Cl-фенил, -4-Cl-фенил, -4-F-фенил, -2,4-Cl2-фенил;
R1, R2, R3, R4 выбираются независимо и представляют собой Н, - ОН, галоген, -О-бензил, фенил, причем фенил или бензил может быть необязательно замещен, по меньшей мере, одним заместителем, выбранным из галогена, -CN, -ОН, -О-С1-6-алкила, -СООН, -СООС1-6-алкил;
R5, R6 выбираются независимо и представляют собой галоген.
Другой подкласс соединений, представляющих интерес, включает соединения формулы (I), в которых:
X выбирается независимо и представляет собой СН или N;
Q выбирается независимо и представляет собой Н, -С1-6-алкил, фенил, галогенированный фенил, нафтил;
R1, R2, R4 представляют собой Н;
R3 представляет собой F;
R5, R6 выбираются независимо и представляют собой галоген.
Отдельный подкласс соединений, представляющих интерес, включает соединения формулы (I), в которых:
X выбирается независимо и представляет собой СН или N;
Q выбирается независимо и представляет собой Н, -С1-6-алкил, фенил, галогенированный фенил, нафтил;
R1, R2, R4 представляют собой Н;
R3 представляет собой Cl;
R5, R6 выбираются независимо и представляют собой галоген.
Другой подкласс соединений, представляющих интерес, включает соединения формулы (I), в которых:
X выбирается независимо и представляет собой СН или N;
Q выбирается независимо и представляет собой Н, -C1-6-алкил фенил, галогенированный фенил, нафтил;
R1 представляет собой -ОН;
R2, R3, R4 представляют собой Н;
R5, R6 выбираются независимо и представляют собой галоген.
Отдельный подкласс соединений, представляющих интерес, включает соединения формулы (I), в которых:
X выбирается независимо и представляет собой СН или N;
Q выбирается независимо и представляет собой Н, -C1-6-алкил, фенил, галогенированный фенил, нафтил;
R1, R4 представляют собой Н;
R2, R3 представляют собой -О-бензил;
R5, R6 выбираются независимо и представляют собой галоген.
Другой подкласс соединений, представляющих интерес, включает соединения формулы (I), в которых:
X выбирается независимо и представляет собой СН или N;
Q выбирается независимо и представляет собой Н, -C1-6-алкил, фенил, галогенированный фенил, нафтил;
R1 представляет собой -O-CH2-4-F-C6H4;
R2, R3, R4 представляют собой Н;
R5, R6 выбираются независимо и представляют собой галоген.
Отдельный подкласс соединений, представляющих интерес, включает соединения формулы (I), в которых:
X выбирается независимо и представляет собой СН или N;
Q выбирается независимо и представляет собой Н, -C1-6-алкил, фенил, галогенированный фенил, нафтил;
R1 представляет собой -ОН;
R2, R3 представляют собой Н;
R4 представляет собой Cl;
R5, R6 выбираются независимо и представляют собой галоген.
Другой подкласс соединений, представляющих интерес, включает соединения формулы (I), в которых:
X выбирается независимо и представляет собой СН или N;
Q выбирается независимо и представляет собой Н, -C1-6-алкил, фенил, галогенированный фенил, нафтил;
R1 представляет собой -O-СН2-4-СООСН3-С6Н4;
R2, R4 представляют собой Cl;
R3 представляет собой Н, галоген, -О-бензил;
R5, R6 выбираются независимо и представляют собой галоген.
Отдельный подкласс соединений, представляющих интерес, включает соединения формулы (I), в которых:
X выбирается независимо и представляет собой СН или N;
Q выбирается независимо и представляет собой Н, -C1-6-алкил, фенил, галогенированный фенил, нафтил;
R1 представляет собой -O-СН2-р-С(СН3)3-С6Н4;
R2, R4 представляют собой Cl;
R3 представляет собой Н, галоген, -О-бензил;
R5, R6 выбираются независимо и представляют собой галоген.
Другой подкласс соединений, представляющих интерес, включает соединения формулы (I), в которых:
X выбирается независимо и представляет собой СН или N;
Q выбирается независимо и представляет собой Н, -C1-6-алкил, фенил, галогенированный фенил, нафтил
R1 представляет собой -O-СН2-4-СООН-С6Н4;
R2, R4 представляют собой Cl;
R3 представляет собой Н, галоген, -О-бензил;
R5, R6 выбираются независимо и представляют собой галоген.
В частных вариантах воплощения изобретения соединения, представляющие интерес, могут быть выбраны из следующих соединений общей формулы (I) и общей формулы (II):
1-(2,4-дихлорфенил)-2-(1Н-1,3-имидазол-1-ил)этил-2-(тиазолидин-2,4-дион-3-ил)-ацетат;
(Z)-1-(2,4-дихлорфенил)-2-(1Н-1,3-имидазол-1-ил)этил-2-[5-(2-гидрокси,5-хлорбензилиден)-тиазолидин-2,4-дион-3-ил] ацетат;
(Z)-1-(2,4-дихлорфенил)-2-(1Н-1,3-имидазол-1-ил)этил-2-[(5-(2-гидроксибензилиден)-тиазолидин-2,4-дион-3-ил] ацетат;
(Z)-1-(2,4-дихлорфенил)-2-(1Н-1,3-имидазол-1-ил)этил-2-[(5-(2-(4-фторбензил)-оксибензилиден)-тиазолидин-2,4-дион-3-ил] ацетат;
(Z)-1-(2,4-дихлорфенил)-2-(1Н-1,3-имидазол-1-ил)этил-2-[5-(2-(4-фторбензил)-окси, 5-хлорбензилиден)-тиазолидин-2,4-дион-3-ил] ацетат;
(Z)-1-(2,4-дихлорфенил)-2-(1Н-1,3-имидазол-1-ил)этил-2-[(5-(4-фторбензилиден)-тиазолидин-2,4-дион-3-ил] ацетат;
(Z)-1-(2,4-дихлорфенил)-2-(1Н-1,3-имидазол-1-ил)этил-2-[(5-(4-хлорбензилиден)-тиазолидин-2,4-дион-3-ил] ацетат;
(Z)-1-(2,4-дихлорфенил)-2-(1Н-1,3-имидазол-1-ил)этил-2-[(5-(2,4-дихлорбензилиден)-тиазолидин-2,4-дион-3-ил] ацетат
(Z)-1-(2,4-дихлорфенил)-2-(1Н-1,3-имидазол-1-ил)этил-2-[(5-(2-гидрокси,3,5-дихлорбензилиден)-тиазолидин-2,4-дион-3-ил] ацетат;
(Z)-1-(2,4-дихлорфенил)-2-(1Н-1,3-имидазол-1-ил)этил-2-[(5-(3,4-бис(бензилокси)бензилиден)-тиазолидин-2,4-дион-3-ил] ацетат;
(Z)-3-(2-(1-((2,4-дихлорфенил)-2-(1Н-1,3-имидазол-1-ил)этокси)ацетил)-5(нафтилен-1-илметилен) тиазолидин-2,4-дион;
1-(2,4-дифторфенил)-2-(1Н-1,2,4-триазол-1-ил)этил-2-тиазолидин-2,4-дион-3-ил) ацетат;
(Z)-1-(2,4-дифторфенил)-2-(1Н-1,2,4-триазол-1-ил)этил-2-[5-(4-хлорбензилиден)]-2,4-тиазолидиндион-3-ил ацетата;
(Z)-1-(2,4-дифторфенил)-2-(1Н-1,2,4-триазол-1-ил)этил-2-[5-(2,4-дихлорбензилиден)]-2,4-тиазолидиндион-3-ил ацетат;
1-(1-(2,4-дихлорфенил)-2-(1Н-1,3-имидазол-1-ил)этил 2-(тиазолидин-2,4-дион-3-ил)пропионат;
(Z)-1-(2,4-дихлорфенил)-2-(1Н-1,3-имидазол-1-ил)этил-2-[5-(4-хлорбензилиден) тиазолидин-2,4-дион-3-ил] пропионат;
(Z)-1-(2,4-дихлорфенил)-2-(1Н-1,3-имидазол-1-ил)этил-2-[5-(4-фторбензилиден) тиазолидин-2,4-дион-3-ил] пропионат;
1-(2,4-дихлорфенил)-2-(1Н-1,3-имидазол-1-ил)этил-2-(тиазолидин-2,4-дион-3-ил)-(2-хлорфенил)ацетат;
1-(2,4-дихлорфенил)-2-(1Н-1,3-имидазол-1-ил)этил-2-(тиазолидин-2,4-дион-3-ил)-(4-хлорфенил) ацетат;
1-(2,4-дихлорфенил)-2-(1Н-1,3-имидазол-1-ил)этил-2-(тиазолидин-2,4-дион-3-ил)-(4-фторфенил) ацетат;
1-(2,4-дихлорфенил)-2-(1Н-1,3-имидазол-1-ил)этил-2-(тиазолидин-2,4-дион-3-ил)-(2,4-дихлорфенил) ацетат;
1-(2,4-дихлорфенил)-2-(1Н-1,3-имидазол-1-ил)этил-2-(тиазолидин-2,4-дион-3-ил)-(нафтил-1) ацетат;
(Z)-1-(2,4-дихлорфенил)-2-(1Н-1,3-имидазол-1-ил)этил-2-[5-(2-гидрокси бензилидентиазолидин-2,4-дион-3-ил)-(2-хлорфенил)ацетат;
(Z)-1-(2,4-дихлорфенил)-2-(1Н-1,3-имидазол-1-ил)этил-2-[5-(4-хлорбензилиден)-2,4-тиазолидиндион-3-ил]-(4-фторфенил) ацетат;
(Z)-1-(2,4-дихлорфенил)-2-(1Н-1,3-имидазол-1-ил)этил-2-[5-(2-гидрокси-,5-хлорбензилиден)тиазолидин-2,4-дион-3-ил)-(4-фторфенил) ацетат;
(Z)-1-(2,4-дихлорфенил)-2-(1Н-1,3-имидазол-1-ил)этил-2-[5-(4-хлорбензилиден) тиазолидин-2,4-дион-3-ил)-(2,4-дихлорфенил) ацетат;
(Z)-1-(2,4-дихлорфенил)-2-(1Н-1,3-имидазол-1-ил)этил-2-[5-(4-фторбензилидеи) тиазолидин-2,4-дион-3-ил)-(2,4-дихлорфенил) ацетат;
(Z)-1-(2,4-дихлорфенил)-2-(1Н-1,3-имидазол-1-ил)этил-2-[5-(2-гидрокси-,3,5-дихлорбензилиден)тиазолидин-2,4-дион-3-ил)-(2,4-дихлорфенил) ацетат;
(Z)-1-(2,4-дихлорфенил)-2-(1Н-1,3-имидазол-1-ил)этил-2-[5-(4-хлорбензилиден) тиазолидин-2,4-дион-3-ил)-(нафтил-1) ацетат.
(Z)-1-(2,4-дихлорфенил)-2-(1Н-1,3-имидазол-1-ил)этил-2-[5-(2-гидрокси-,5-хлорбензилиден)тиазолидин-2,4-дион-3-ил)-(нафтил-1) ацетат.
Настоящее изобретение относится к применению соединений, являющихся предметом изобретения, в качестве противогрибкового лекарственного средства.
Данное изобретение также относится к применению соединений, являющихся предметом изобретения, для лечения и/или предотвращения инфекционных заболеваний, в частности вызванных грибковой инфекцией у субъекта. В частных вариантах воплощения изобретения субъект представляет собой человека или животных.
Соединения по изобретению проявляют высокую противогрибковую активность, в частности, в отношении грибов рода Candida spp, Aspergillus, Microsporum, Trichophyton и Epidermophyton. Соединения по изобретению проявляют высокую противогрибковую активность, в частности, в отношении грибов видов Aspergillus fumigatus, Aspergillus niger, Microsporum canis, Trichophyton rubrum и/или Epidermophyton floccosum.
Изобретение также относится к применению соединений по изобретению для получения фармацевтической композиции для лечения и/или профилактики инфекционных заболеваний микробной этиологии. В частных вариантах воплощения изобретения инфекционное заболевание микробной этиологии вызвано грибковой инфекцией. В частных вариантах воплощения изобретения инфекционное заболевание представляет собой заболевание кожи, ногтей или внутренних органов, в частности таких как дерматофития, поверхностный микоз, кандидоз кожи и ногтей, вагинальный кандидоз, кандидозный стоматит, эндокардит и других заболеваний человека или животных.
Кроме того, изобретением предусматриваются фармацевтические композиции для лечения и/или предотвращения инфекционных заболеваний микробной этиологии, включающие терапевтически эффективное количество, по меньшей мере, одного соединения, являющегося предметом изобретения, и, по меньшей мере, одно фармацевтически приемлемое вспомогательное вещество.
В некоторых вариантах воплощения изобретения вспомогательное вещество может представлять собой носитель, наполнитель и/или растворитель.
В некоторых вариантах воплощения изобретения инфекционное заболевание микробной этиологии вызвано грибковой инфекцией.
В частных вариантах воплощения изобретения фармацевтическая композиция предназначена для лечения инфекционных заболеваний, вызванных грибом рода Candida spp, Aspergillus, Microsporum, Trichophyton и/или Epidermophyton. В частных вариантах воплощения изобретения фармацевтическая композиция предназначена для лечения инфекционных заболеваний, вызванных грибом вида Aspergillus fumigatus, Aspergillus niger, Microsporum canis, Trichophyton rubrum или Epidermophyton floccosum.
В частных вариантах воплощения изобретения фармацевтическая композиция предназначена для лечения и/или предотвращения заболевания, которое представляет собой заболевание кожи, ногтей или внутренних органов, в частности дерматофития, поверхностный микоз, кандидоз кожи и ногтей, вагинальный кандидоз, кандидозный стоматит, эндокардит и других заболеваний человека или животных.
Настоящее изобретение также относится к способу лечения и/или профилактики инфекционных заболеваний, включающему введение (в качестве монотерапии или в комбинации с одним или несколькими агентами) терапевтически эффективного количества соединения, являющегося предметом изобретения, в организм человека или животного, нуждающегося в лечении и/или профилактики таких заболеваний. Термин «введение» в организм соединения настоящего изобретения включает доставку к реципиенту соединения, описанного в настоящем изобретении, пролекарства, или другого фармакологически приемлемого производного такого соединения, используя любые допустимые препараты или пути введения в организм, хорошо известные специалистам.
Изобретение также включает получение соединений общей формулы (I) и общей формулы (II).
Подробное раскрытие изобретения
Определения (термины)
Следующие определения применяются в данном документе, если иное не указано явно. Кроме того, если не указано иное, все вхождения функциональных групп выбираются независимо, два вхождения могут быть как одинаковыми, так и разными.
Термин «алкил» сам по себе или как часть другого заместителя, относится к насыщенным углеводородным группам с прямой или разветвленной цепью, включая углеводородные группы, имеющие указанное число атомов углерода (то есть, C1-6 подразумевает от одного до шести атомов углерода). Примеры алкилов включают метил, этил, н-пропил, изо-пропил.
Термин «галоген» сам по себе или в части другого термина относится к атому фтора, хлора, брома или йода.
Термин «бензил», если иное не оговорено, обозначает углеводородный остаток -СН2-С6Н5;
Данное изобретение содержит только такие комбинации заместителей и производных, которые образуют стабильное или химически возможное соединение. Стабильным или химически возможным соединением называется такое соединение, стабильности которого достаточно для его синтеза и аналитического детектирования. Предпочтительные соединения данного изобретения являются достаточно стабильными и не разлагаются при температуре до 40°С в отсутствие химически активных условий, в течение, по крайней мере, одной недели.
Если не указано иначе, приведенные в материалах заявки структуры соединений также подразумевают и все стереоизомеры, то есть R- и S- изомеры для каждого ассиметричного центра. Кроме того, отдельные стереохимические изомеры, равно как и энантиомеры и диастереомерные смеси настоящих соединений, также являются предметом данного изобретения. Таким образом, данное изобретение охватывает каждый диастереомер или энантиомер, свободный в значительной степени от других изомеров (>90%; более предпочтительно, >95% мольной чистоты), так же как и смесь таких изомеров.
Конкретный оптический изомер может быть получен разделением рацемической смеси в соответствии со стандартной процедурой, например путем получения диастереоизомерных солей путем обработки оптически активной кислотой или основанием с последующим разделением смеси диастереомеров кристаллизацией с последующим выделением оптически активных оснований из этих солей. Примерами соответствующих кислот являются винная, диацетилвинная, дибензоилвинная, дитолуолвинная и камфорсульфоновая кислота. Другая методика разделения оптических изомеров заключается в использовании хиральной хроматографической колонки. Кроме того, другой метод разделения включает синтез ковалентных диастереомерных молекул путем реакции соединений изобретения с оптически чистой кислотой в активированной форме или оптически чистым изоцианатом. Полученные диастереомеры можно разделить обычными способами, например, хроматографией, дистилляцией, кристаллизаций или сублимацией, а затем гидролизовать для получения энантиомерно чистого соединения.
Оптически активные соединения данного изобретения могут быть получены с использованием оптически активных исходных материалов. Такие изомеры могут находиться в форме свободной кислоты, свободного основания, эфира или соли.
Термин «сольват» относится к ассоциации или комплексу из одной или нескольких молекул растворителя и соединения по изобретению. Примеры растворителей, образующих сольваты, включают, но ими не ограничиваются, воду, изопропанол, этанол, метанол, ДМСО, этилацетат, уксусную кислоту и этаноламин.
Термин «гидрат» относится к комплексу, где молекулами растворителя является вода.
Соединения настоящего изобретения могут существовать в свободной форме или, если требуется, в виде фармацевтически приемлемой соли или другого производного. Используемый здесь термин «фармацевтически приемлемая соль» относится к таким солям, которые, в рамках проведенного медицинского заключения, пригодны для использования в контакте с тканями человека и животных без излишней токсичности, раздражения, аллергической реакции и т.д., и отвечают разумному соотношению пользы и риска. Фармацевтически приемлемые соли аминов, карбоновых кислот, фосфонатов и другие типы соединений хорошо известны в медицине. Соли могут быть получены in situ в процессе выделения или очистки соединений изобретения, а также могут быть получены отдельно, путем взаимодействия свободной кислоты или свободного основания соединения изобретения с подходящим основанием или кислотой, соответственно. Примером фармацевтически приемлемых, нетоксичных солей кислот могут служить соли аминогруппы, образованные неорганическими кислотами, такими как соляная, бромоводородная, фосфорная, серная и хлорная кислоты, или органическими кислотами, такими как уксусная, щавелевая, малеиновая, винная, янтарная или малоновая кислоты, или полученные другими методами, используемыми в данной области, например, с помощью ионного обмена. К другим фармацевтически приемлемым солям относятся адипинат, альгинат, аскорбат, аспартат, бензолсульфонат, бензоат, бисульфат, борат, бутират, камфорат, камфорсульфонат, цитрат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, формиат, фумарат, глюкогептонат, глицерофосфат, глюконат, гемисульфат, гептанат, гексанат, гидройодид, 2-гидрокси-этансульфонат, лактобионат, лактат, лаурат, лаурил сульфат, малат, малеат, малонат, метансульфонат, 2-нафталинсульфонат, никотинат, нитрат, олеат, оксалат, пальмитат, памоат, пектинат, персульфат, 3-фенилпропионат, фосфат, пикрат, пивалат, пропионат, стеарат, сукцинат, сульфат, тартрат, тиоцианат, п-толуолсульфонат, ундеканат, валериат и подобные. Типичные соли щелочных и щелочноземельных металлов содержат натрий, литий, калий, кальций, магний и другие. Кроме того, фармацевтически приемлемые соли могут содержать, если требуется, нетоксичные катионы аммония, четвертичного аммония и амина, полученные с использованием таких противоионов, как галогениды, гидроксиды, карбоксилаты, сульфаты, фосфаты, нитраты, низшие алкил сульфонаты и арил сульфонаты.
Настоящее изобретение включает все фармацевтически приемлемые изотопно меченые соединения по настоящему изобретению, в которых один или несколько атомов замещен атомами, имеющими такой же атомный номер, но атомную массу или массовое число, отличные от атомной массы или массового числа, обычно встречающихся в природе.
Примеры изотопов, подходящих для включения в соединения по изобретению, включают изотопы водорода, такие как 2Н и 3Н, углерода, такие как 11С, 13С и 14С, хлора, такие как 36Cl, фтора, такие как 18F, йода, такие как 123I и 125I, азота, такие как 13N и 15N, кислорода, такие как 15O, 17O и 18O, фософора, такие как 32Р, и серы, такие как 35S.
Некоторые изотопно меченые соединения формулы (I) или соединения формулы (II), например, те, которые включают радиоактивный изотоп, используют в исследованиях распределения лекарственного препарата и/или субстрата в тканях. В частности, с этой целью используют радиоактивные изотопы, такие как тритий, то есть 3Н, и углерод-14, то есть 14С, ввиду легкости их введения и доступности средств их обнаружения.
Замещение более тяжелыми изотопами, такими как дейтерий, то есть 2Н, может обеспечить определенные терапевтические эффекты, обусловленные метаболической стабильностью, например, увеличением периода полувыведения in vivo или снижением норм дозирования, и, следовательно, может быть предпочтительным в некоторых случаях.
Изотопно меченые соединения по изобретению могут быть получены обычными способами, известными специалисту в данной области или способами, аналогичными описанным в прилагаемых примерах способов синтеза, при использовании соответствующих изотопно меченых реагентов вместо немеченого ранее применяемого реагента.
Фармацевтически приемлемые сольваты в соответствии с изобретением включают сольваты, где растворитель кристаллизации может быть изотопно замещен, например, D2O, d6-ацетон, d6-ДМСО.
Осуществление изобретения
Обзор методов получения соединений изобретения
Соединения, являющиеся предметом настоящего изобретения, могут быть получены с использованием описанных ниже синтетических методов. Перечисленные методы не являются исчерпывающими и допускают введение разумных модификаций. Указанные реакции должны проводиться с использованием подходящих растворителей и материалов. При реализации данных общих методик для синтеза конкретных веществ необходимо учитывать присутствующие в веществах функциональные группы и их влияние на протекание реакции. Для получения некоторых веществ необходимо изменить порядок стадий либо отдать предпочтение одной из нескольких альтернативных схем синтеза. Следует понимать, что эти и все приведенные в материалах заявки примеры не являются ограничивающими и приведены только для иллюстрации настоящего изобретения.
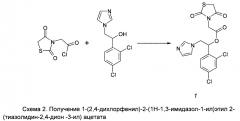
Пример 1. Получение (Z)-1-(2,4-дихлорфенил)-2-(1Н-1,3-имидазол-1-ил)этил 2-[5-(2-гидрокси-5-хлорбензилиден)-тиазолидин-2,4-дион-3-ил] ацетата (2)
Получение 1-(2,4-дихлорфенил)-2-(1Н-1,3-имидазол-1-ил)этил 2-(тиазолидин-2,4-дион-3-ил) ацетата (1)
Хлорангидрид тиазолидин-2,4-дион 3-уксусной кислоты (1,1 экв.), полученный после кипячения тиазолидин-2,4-дион 3 уксусной кислоты в избытке хлористого тионила в течение 1 часа и удаления избытка хлористого тионила отгонкой на роторном испарителе, добавляют по каплям при охлаждении на ледяной бане к раствору вторичного спирта 1-(2,4-дихлорфенил)-2-(1Н-имидазол-1-ил)этанола (1 экв.), совместно с триэтиламином (ТЭА, 2 экв.) и диметиламинопиридином (ДМАП, 0.1 экв.) в 100 мл безводного (воды<0.01%) хлористом метилене. Контроль по ТСХ на пластинах Силуфол УФ 254 нм (система: 10% метанола в бензоле). Через 12 часов реакционная масса промывалась водой, раствором лимонной кислоты и органический слой отделяют и высушивают над Na2SO4, затем упаривают на роторном испарителе досуха. Остаток растворяют в бензоле и очищают колоночной хроматографией на силикагеле (элюент: 5 % метанола в бензоле). Собранные фракции упаривают с получением сухой пены бежевого или желтоватого цвета. Продукт получают в виде смеси диастереомеров. Выход соединения (Z)-1-(2,4-дихлорфенил)-2-(1Н-1,3-имидазол-1-ил)этил 2-(тиазолидин-2,4-дион-3-ил] ацетата - 65%.
1Н-ЯМР (500 MHz, DMSO-d6) δ 7.84 (s, 1Н), 7.47-7.22 (m, 13Н), 5.23 (s, 2H), 5.21 (s, 2H), 4.18 (bs, 2H), 3.33 (s, 1H).
C16H13Cl2N3O4S. LCMS [M+H]+ 414.
Получение (Z)-1-(2,4-дихлорфенил)-2-(1Н-1,3-имидазол-1-ил)этил 2-[5-(2-гидрокси-5-хлорбензилиден)-тиазолидин-2,4-дион-3-ил] ацетата (2)
К раствору 1-(2,4-дихлорфенил)-2-(1Н-1,3-имидазол-1-ил)этил-2-(тиазолидин-2,4-дион-3-ил) ацетата (1 экв.) в безводном этаноле прибавляют рассчитанное количество 2-гидрокси,-5-хлорбензальдегида (1,1 экв.) и каплю пиперидина (0,01 экв.). Реакционную массу кипятят 8 часов, затем этанол упаривают и остаток очищают хроматографией на колонке с силикагелем в системе 3%-ный раствор метанола в хлористом метилене. Выход соединения (Z)-1-(2,4-дихлорфенил)-2-(1Н-1,3-имидазол-1-ил)этил-2-[5-(2-гидрокси-5-хлорбензилиден)-тиазолидин-2,4-дион-3-ил] ацетата - 10%.
1Н-ЯМР (500 MHz, CDCl3): 8.16 (s, 1H), 7.50-6.57 (m, 10Н), 4.46 (m, 2H), 4.26-4.22 (m, 2H), 1.56 (bs, 1H).
C23H16Cl3N3O5S. LCMS [M+H]+ 554.
Следующие примеры соединений по изобретению, представленные в таблице 1, получены в соответствии с методикой синтеза, описанной для соединения 2, используя подходящие исходные вещества: 1-(2,4-дихлорфенил)-2-(1Н-1,3-имидазол-1-ил)этил-2-(тиазолидин-2,4-дион-3-ил] ацетат и ароматические альдегиды.
Пример 2. Получение (Z)-1-(2,4-дифторфенил)-2-(1Н-1,2,4-триазол-1-ил)этил-2-[5-(4-хлорбензилиден)]-2,4-тиазолидиндион-3-ил ацетата (13)
Получение соединения (Z)-1-(2,4-дифторфенил)-2-(1Н-1,2,4-триазол-1-ил)этил-2-тиазолидин-2,4-дион-3-ил ацетата (12)
К раствору 1-(1Н-1,2,4-триазол-1-ил)этанола (1 экв.) в безводном хлористом метилене (2 мл) прибавляют рассчитанное количество триэтиламина (3 экв,). Реакционную массу охлаждают до 0°С и прикапывают раствор хлорангидрида тиазолидин-2,4-дион-3-уксусной кислоты (1,2 экв,) в безводном хлористом метилене (10 мл). Реакционную массу перемешивают в течение 8 часов при комнатной температуре. Затем при перемешивании добавляют 2 мл насыщенного раствора лимонной кислоты, отделяют органический слой и еще раз промывают его лимонной кислотой до кислой реакции. Затем метиленовый слой высушивают над сульфатом натрия и упаривают хлористый метилен на роторном испарителе. Полученный остаток очищают хроматографией на колонке с силикагелем (система для элюирования: 4%-ный раствор метанола в хлористом метилене). Выход соединения (Z)-1-(2,4-дифторфенил)-2-[(1Н-1,2,4-триазол-1-ил)этил-2-тиазолидин-2,4-дион-3-ил] ацетата - 23%.
1Н-ЯМР (500 MHz, DMSO-d6): 8.46 (s, 1Н), 7.95 (s, 1Н), 7.41 (t, 1Н, J=8.44 Hz), 7.32 (d, 1H, J=8.44 Hz), 7.14 (m, 1H), 6.24 (m, 1H), 4.80-4.75 (m, 1H), 4.66-4.62 (m, 1H), 4.40-4.32 (m, 4H).
C15H12F2N4O4S. LCMS [M+H]+ 383.
Получение (Z)-1-(2,4-дифторфенил)-2-(1Н-1,2,4-триазол-1-ил)этил-2-[5-(4-хлорбензилиден)]-2,4-тиазолидиндион-3-ил ацетата (13)
К раствору 1-(2,4-дифторфенил)-2-(1Н-1,2,4-триазол-1-ил)этил-2-тиазолидин-2,4-дион-3-ил ацетата (1 экв.) в безводном этаноле (15 мл) добавляют рассчитанное количество 4-хлорбензальдегида (1,1 экв,) и пиперидина (0,01 экв). Реакционную массу кипятят 8 часов в этаноле, затем отгоняют растворитель на роторном испарителе. Остаток растворяют в хлористом метилене и очищают хроматографией на колонке с силикагелем (система для элюирования 1%-ный раствор метанола в хлористом метилене). Выход соединения (Z)-1-(2,4-дифторфенил)-2-(1Н-1,2,4-триазол-1-ил)этил-2-[5-(4-хлорбензилиден)]-2,4-тиазолидиндион-3-ил ацетата - 34%.
1Н-ЯМР (500 MHz, CDCl3): 8.17 (bs, 1Н), 7.96-7.92 (m, 2Н), 7.49 (m, 4Н), 7.19 (m, 1Н), 6.90-6.87 (m, 2Н), 6.41 (m, 1Н), 4.65 (m, 2Н), 4.54 (m, 2Н).
C22H15CIF2N4O4S. LCMS [М+Н]+ 506.
Следующее соединение по изобретению, представленное в таблице 2, было получено в соответствии с методикой синтеза для соединения 13, при использовании подходящих исходных веществ - 1-(2,4-дифторфенил)-2-[(1Н-1,2,4-триазол-1-ил)этил-2-тиазолидин-2,4-дион-3-ил] ацетата и 2,4-дихлорбензальдегида.
Пример 3. Получение (Z)-1-(2,4-дихлорфенил)-2-(1Н-имидазол-1-ил)этил-2-[5-(4-хлорбензилиден)тиазолидин-2,4-дион-3-ил] пропионата (16)
Получение 1-(2,4-дихлорфенил)-2-(1Н-имидазол-1-ил)этил-2-(тиазолидин-2,4-дион-3-ил) пропионата (15)
Хлорангидрид тиазолидин-2,4-дион-3-пропионовой кислоты (1,1 экв.), полученный после кипячения тиазолидин-2,4-дион-3-пропионовой кислоты в избытке хлористого тионила в течение 1 часа и удаления избытка хлористого тионила отгонкой на роторном испарителе, добавляют по каплям при охлаждении на ледяной бане к раствору вторичного спирта 1-(2,4-дихлорфенил)-2-(1Н-имидазол-1-ил)этанола (1 экв.), совместно с триэтиламином (2 экв.) и диметиламинопиридином (ДМАП, 0.1 экв.) в 100 мл безводного (воды<0.01%) хлористого метилена. Контроль по ТСХ на пластинах Силуфол УФ 254 нм (система для ТСХ: 10% метанола в бензоле). Через 24 часа реакционную масса промывают водой, раствором лимонной кислоты, и органический слой отделяют и высушивают над Na2SO4, затем упаривают на роторном испарителе досуха. Остаток растворяют в бензоле и очищают с помощью колоночной хроматографии на силикагеле (элюент: 5% метанола в бензоле). Собранные фракции упаривают с получением сухой пены желтого цвета. Продукт получен в виде смеси диастереомеров. Выход соединения в виде смеси диастереомеров 1-(2,4-дихлорфенил)-2-(1Н-имидазол-1-ил)этил-2-тиазолидин-2,4-дион-3-ил] пропионата - 11%.
1Н-ЯМР (500 MHz, CDCl3): δ 7.68-7.62 (m, 1Н), 7.40 (m, 1Н), 7.22-7.18 (m, 2Н), 7.07-7.98 (m, 1Н), 6.85-6.72 (m, 1Н), 6.31-6.24 (m, 1Н), 4.97-4.85 (m, 1Н), 4.45-4.32 (m, 2Н), 4.07-3.91 (m, 2Н), 1.57-1.52 (m, 3Н).
C17H15Cl2N3O4S. LCMS [М+Н]+ 429.
Получение (2)-1-(2,4-дихлорфенил)-2-(1Н-имидазол-1-ил)этил-2-[5-(4-хлорбензилиден)тиазолидин-2,4-дион-3-ил] пропионата (16)
К раствору эфира 1-(2,4-дихлорфенил)-2-(1Н-имидазол-1-ил)этил-2-(тиазолидин-2,4-дион-3-ил) уксусной кислоты (1 экв.) в безводном этаноле прибавляют рассчитанное количество 4-хлорбензальдегида (1,1 экв.) и каплю пиперидина (0,01 экв). Реакционную массу кипятят 8 часов, затем этанол упаривают, и остаток очищают хроматографией на колонке с силикагелем в системе 3%-ный раствор метанола в хлористом метилене. Продукт получают в виде двух диастериоизомеров. Выход соединения в виде смеси диастереомеров (Z)-1-(2,4-дихлорфенил)-2-(1Н-имидазол-1-ил)этил-2-[5-(4-хлорбензилиден)-тиазолидин-2,4-дион-3-ил] пропионата - 38%.
1Н-ЯМР (500 MHz, CDCl3): δ ppm 1.70 (br d, J=7.09 Hz, 3Н) 4.23-4.50 (m, 1Н) 4.26-4.41 (m, 1Н) 4.41-4.50 (m, 1Н) 5.06-5.21 (m, 1Н) 5.31 (s, 1Н) 6.26-6.43 (m, 1Н) 6.34 (br s, 1Н) 6.39 (br s, 1Н) 6.68-6.81 (m, 1Н) 6.73 (s, 1Н) 6.78 (s, 1Н) 6.85 (br d, J=8.10 Hz, 1Н) 6.82-7.05 (m, 1Н) 6.91-7.03 (m, 1Н) 7.13-7.26 (m, 1Н) 7.26-7.52 (m, 1Н) 7.29-7.35 (m, 1Н) 7.44 (br s, 1H) 7.49 (s, 3H) 7.57 (br s, 1H) 7.74 (s, 1H) 7.89 (s, 1H).
C24H18Cl3N3O4S. LCMS [M+H]+ 551.
Следующее соединение по изобретению, представленное в таблице 3, было получено в соответствии с методикой синтеза для соединения 16, с использованием подходящих исходных веществ - 4-фторбензальдегида и 1-(2,4-дихлорфенил)-2-(1Н-имидазол-1-ил)этил-2-тиазолидин-2,4-дион-3-ил]пропионата.
Пример 4. Получение 1-(2,4-дихлорфенил)-2-(1Н-имидазол-1-ил)-этил-2-(тиазолидин-2,4-дион-3-ил)-(2-хлорфенил) ацетата (18)
Хлорангидрид (1 экв.), полученный после кипячения тиазолидин-2,4-дион-3-(2-хлорфенил)уксусной кислоты в избытке хлористого тионила в течение 1 часа и удаления избытка хлористого тионила отгонкой на роторном испарителе, добавляют по каплям при охлаждении на ледяной бане к раствору вторичного спирта 1-(2,4-дихлорфенил)-2-(1Н-имидазол-1-ил)этанола (1 экв.), совместно с триэтиламином (2 экв.) и диметиламинопиридином (ДМАП, 0.1 экв.) в 100 мл безводного (воды <0.01%) хлористого метилена. Контроль по