Средство с панкрео- и гепатопротекторной активностью для парентерального введения
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к созданию лекарственного средства, обладающего панкрео- и гепатопротекторной активностью, в частности для лечения острого панкреатита и острого гепатита. В качестве средства с панкрео- и гепатопротекторной активностью применяют известное соединение 2-этил-6-метил-3-оксипиридиния L-аспарагинат (6-метил-2-этилпиридин-3-ол соль (2S)-2-аминобутандиовой кислоты). Также описана парентеральная лекарственная форма на основе 2-этил-6-метил-3-оксипиридиния L-аспарагината, выполненная в виде раствора для инъекций/инфузий. У животных (по летальности и данным биохимических и морфологических исследований) указанное соединение и лекарственная форма на его основе превосходят ближайший аналог заявляемого средства мексидол (в значительно большей дозе) и другие препараты сравнения. 2 н.п. ф-лы, 7 табл., 3 пр.
Реферат
Изобретение относится к медицине, а именно к созданию лекарственного средства, обладающего панкрео- и гепатопротекторной активностью, в частности для лечения острого панкреатита и острого гепатита.
В современной медицине проблема лечения острого панкреатита (ОП) продолжает оставаться одной из наиболее сложных и актуальных. В последние годы в российских стационарах ОП занимает 3-е место среди острых хирургических заболеваний брюшной полости и составляет 12,5% всей острой хирургической абдоминальной патологии, а в США и ряде других стран - 1-е место [10, 31]. При этом в структуре смертности от острой хирургической патологии органов брюшной полости он занимает 1-е место, опережая острый холецистит, ущемленную грыжу, острый аппендицит, кишечную непроходимость и прободную гастродуоденальную язву. Несмотря на постоянное расширение арсенала методов и средств лечения, летальность при ОП колеблется от 6,5% до 86% (например, в Москве в последние годы она остается в пределах 33-34%), достигая 98-100% при молниеносной форме [1, 3, 14].
В исследованиях последнего времени под эгидой Всемирной организации здравоохранения отмечено постоянное увеличение ежегодной заболеваемости ОП, которая колеблется от 4,9 до 73,4 случаев на 100000 населения. В России заболеваемость ОП составляет 20-80 человек на 100000 населения. Также неуклонно возрастает количество пациентов, у которых развиваются инфицированный панкреонекроз, поздняя полиорганная недостаточность и другие тяжелые гнойно-деструктивные осложнения острого панкреатита - аррозивное кровотечение, дуоденальный свищ, тонко- и толстокишечные свищи, панкреатический свищ [2, 7, 19, 29]. Если в 2000 году панкреонекроз диагностировался у 15-20% больных, то к 2008-2009 гг. этот показатель составил 25-30%). Более того, по результатам выполненных в США и странах западной Европы исследований опубликованы следующие данные: в конце 1990-х годов деструктивные формы выявлялись в 2,1 случае на 100000 населения, в конце 2000-х годов указанный показатель - 15-38 случаев на 100000 населения. В РФ частота панкреонекроза составляет, в среднем, 18,9 на 100000 населения (от 11,5 до 31). Развитие деструктивных форм имеет место в 17,7% случаев острого панкреатита. У 33% больных с деструктивным панкреатитом отмечается инфицированный некроз (вариабельность 16-47%) [23]. При этом в РФ на лечение пациентов с таким грозным осложнением ОП как инфицированный панкреонекроз в отделениях реанимации и интенсивной терапии в течение одного месяца затрачивается не менее 2 млн руб. [6].
Таким образом, вне зависимости от причины и формы ОП его последствия для пациента могут будут весьма тяжелыми, а лечение и последующая реабилитация - крайне затратными.
В связи с изложенным выше проблема успешного лечения ОП - приоритетное направление научных изысканий во многих областях современной медицины.
Оптимальный вид лечения ОП в IA фазе - интенсивная консервативная терапия (категория доказательности А по критериям доказательной медицины), а хирургическое вмешательство в виде лапаротомии показано лишь при развитии осложнений хирургического профиля, которые невозможно устранить миниинвазивными технологиями [11].
Как известно, для фармакотерапии ОП используют различные лекарственные средства, в том числе октреотид, даларгин и мексидол. Однако все эти средства имеют существенные недостатки: они либо недостаточно эффективны, либо дают выраженные побочные эффекты.
Долгие годы для лечения ОП использовали октреотид - синтетический октапептид, являющийся аналогом соматостатина и обладающий панкреопротекторными свойствами как у человека, так и у животных. Однако сегодня, согласно Государственному реестру лекарственных средств (от 11.08.2017 г.), у этого лекарственного препарата нет такого показания к применению, как ОП, а его используют только для профилактики осложнений после операции на поджелудочной железе. Кроме того, октреотид имеет ряд существенных побочных эффектов: так, было установлено, что препарат вызывает ряд нежелательных явлений со стороны желудочно-кишечного тракта (анорексия, тошнота, рвота, спастическая боль в животе, избыточное газообразование, диарея, нарушение коллоидной стабильности желчи за счет образования микрокристаллов холестерина и др.), сердечно-сосудистой (аритмия, брадикардия), дыхательной (одышка и др.), центральной нервной (головная боль, головокружение и др.) систем, а также нарушение метаболизма, функции щитовидной железы и др. Также известны случаи, когда препарат при подкожном введении вызывал в первые часы или сутки развитие ОП. Серьезным побочным эффектом октреотида считают стойкий спазм сфинктера Одди, что подтверждается при гастродуоденоскопии, а также прогрессирование секвестрации ткани поджелудочной железы, выявляемое во время динамических лапароскопий [14]. Необходимо также подчеркнуть, что на сегодняшний день однозначно позиционируется отказ от ингибирования секреции поджелудочной железы, в частности октреотидом, что подтверждается многочисленными литературными данными [20, 34, 35], а в Российских клинических рекомендациях по лечению ОП [11] она имеет всего лишь категорию доказательности D по критериям доказательной медицины.
Другой лекарственный препарат, широко используемый для лечения ОП, - гексапептид даларгин - известен уже более 30 лет; это первый в мире синтетический агонист опиоидных рецепторов, созданный на основе эндогенного лейцин-энкефалина [5]. Однако и он не лишен существенных недостатков. Так, например, даларгин вызывает развитие артериальной гипотензии, а также он противопоказан при острых инфекционных процессах, что, безусловно, ограничивает его применение при инфицированном панкреонекрозе [9].
Учитывая тот факт, что при ОП происходит некомпенсированное усиление ПОЛ, приводящее к нарушению мембранных структур, причем отмечается корреляция между интенсивностью ПОЛ и тяжестью деструктивного процесса, было предложено использовать для фармакотерапии данной патологии препарат с антиокидантным механизмом действия - этилметилгидроксипиридина сукцинат (мексидол) [13, 14].
В настоящее время в мире растет число заболеваний печени, обусловливающих высокую смертность людей, а количество больных с гепатобилиарной патологией превышает 3 миллиарда человек. Что касается России, то более 50% россиян страдают различными нарушениями работы печени [21, 33].
Сегодня фармакотерапия является основным методом лечения заболеваний печени. Гепатопротекторы с успехом применяют для патогенетической терапии острых и хронических гепатитов, цирроза печени и жирового гепатоза токсической, лекарственной и алкогольной этиологии. При этом гепатопротекторы менее эффективны при вирусном гепатите [8, 27].
В связи с изложенным разработка новых эффективных методов лекарственного лечения и профилактики заболеваний печени - важная проблема современной медицины, а поиск новых гепатопротекторов весьма актуален.
Широко известен такой гепатопротектор, как адеметионин (гептрал), обладающий антиоксидантными, холеретическими и холекинетическими свойствами, являющийся донатором метальных групп и обеспечивающий окислительно-восстановительный механизм клеточной детоксикации. Его широко применяют при лечении различных заболеваний печени (токсические поражения печени, алкогольный стеатоз, хронический гепатит, цирроз печени и др.) [27, 30].
Однако адеметионин имеет ряд существенных недостатков, ограничивающих его применение. Так, например, он способен вызывать головокружение, головную боль, парестезии, тревогу, спутанность сознания, бессонницу, различные сердечно-сосудистые нарушения, тошноту, боль в животе, диарею, желудочно-кишечные кровотечения, отек гортани, астению, озноб, лихорадку, аллергические реакции вплоть до отека Квинке, реакцию в месте введения (очень редко с некрозом кожи) и др. Кроме того, адеметионин должен применяться с осторожностью при биполярных расстройствах, а также одновременно с селективными ингибиторами обратного захвата серотонина, трициклическими антидепрессантами, препаратами, содержащими триптофан и др. [27].
Исходя из изложенного, возникает необходимость изыскания новых лекарственных средств, обладающих панкрео- и гепатопротекторной активностью.
Поэтому задачей настоящего изобретения является создание нового лекарственного средства, обладающего панкрео- и гепатопротекторной активностью.
Поставленная цель достигается применением в качестве средства с панкрео- и гепатопротекторной активностью известного вещества 2-этил-6-метил-3-оксипиридиния L-аспарагината (OA) [28] в эффективных количествах и созданием на его основе готового лекарственного средства в виде раствора для внутривенного и внутримышечного введения.
Изобретение иллюстрируется следующими ниже примерами. При этом примеры 2-3 иллюстрируют эффективность OA в качестве панкрео- и гепатопротекторного средства в сравнении с ближайшим аналогом мексидолом (пример 2), а также другими препаратами сравнения.
Пример 1. Готовое лекарственное средство (ГЛС) 2-этил-6-метил-3-оксипиридиния L-аспарагината (OA; согласно IUPAC - 6-метил-2-этилпиридин-3-ол соль (2S)-2-аминобутандиовой кислоты) в виде раствора для внутривенного и внутримышечного введения
Предлагаемая лекарственная форма OA в виде раствора для внутривенного и внутримышечного введения на 1 мл содержит:
Действующее вещество:
| 6-метил-2-этилпиридин-3-ол соль | |
| (2S)-2-аминобутандиовой кислоты | 50,0 мг |
Вспомогательные вещества:
| Натрия метабисульфит | 1,0 мг |
| Вода для инъекций | до 1,0 мл |
Данное ГЛС представляет собой бесцветную или с желтым оттенком прозрачную жидкость.
При выполнении экспериментальной части работы (опыты на животных - примеры 2-3) в соответствии с Российскими национальными правилами исследований (Приказ Министерства здравоохранения и социального развития РФ от 23 августа 2010 г. №708н «Об утверждении Правил лабораторной практики» и др.) и международными требованиями в основном были использованы модели и методы, рекомендованные для проведения подобных исследований, утвержденные Министерством здравоохранения РФ и соответствующие рекомендациям ВОЗ, касающимся правил надлежащей лабораторной практики (GLP - "Good Laboratory Practice") [22]. Животных получали из Филиала «Столбовая» ФГБУН «Научный центр биомедицинских технологий Федерального медико-биологического агентства» (Московская область). Содержание животных соответствовало правилам GLP и осуществлялось в соответствии с нормативным документом «Санитарные правила по устройству, оборудованию и содержанию вивариев», утвержденным Главным государственным санитарным врачом 06.04.1973 г. №1045-73, и приказом МЗ CP РФ №708н от 23.08.2010 г.
Пример 2. Панкреопротекторное действие активной фармацевтической субстанции (АФС) и готового лекарственного средства (ГЛС) 2-этил-6-метил-3-оксипиридиния L-аспарагината (OA) у крыс при лечении острого панкреатита (ОП) (табл. 1-3)
Холодовую (ишемическую) модель ОП воспроизводили у белых нелинейных крыс-самцов массой 250-300 г с помощью охлаждения хлорэтилом поджелудочной железы /ПЖ/ (по методике П.С. Симаворяна /1973/) [24]. Для этого у крыс под общей анестезией диэтиловым эфиром в асептических условиях вскрывали брюшную полость, в рану выводили желудок, двенадцатиперстную кишку (ДПК) и селезенку с находящейся под ними ПЖ. В течение 1 минуты обе поверхности ПЖ охлаждали струей хлорэтила до появления налета инея. Температура этого сегмента железы понижалась до -30°C. Измерение температуры проводили в предварительных опытах с помощью специального термометра, который вводили в толщу ПЖ до замораживания. После последующего быстрого оттаивания ПЖ вместе с желудком, ДПК и селезенкой погружали в брюшную полость и рану брюшной стенки зашивали через все слои отдельными узловыми капроновыми швами наглухо. Асептической повязки не накладывали.
Эта модель относится к ишемическим моделям экспериментального ОП и является весьма удобной именно для изучения действия новых фармакологических веществ [14]. Моделировали ОП тяжелой степени тяжести. Животных после операции наблюдали в течение 2 недель.
Для оценки лечебного эффекта испытанных веществ было поставлено 6 серий экспериментов у крыс: I группа - интактная; II группа - контрольная (ОП без лечения - животные, получающие только изотонический раствор натрия хлорида); III группа - ОП (лечение АФС OA в дозе 30 мг/кг/сутки); IV группа - ОП (лечение ГЛС OA в дозе 30 мг/кг/сутки); V группа - ОП (лечение препаратом сравнения мексидолом /этилметилгидроксипиридина сукцинат/ в дозе 100 мг/кг/сутки); VI группа - ОП (лечение препаратом сравнения даларгином в дозе 1 мг/кг/сутки).
Дозы препаратов сравнения были выбраны, исходя из результатов ранее проведенных исследований [4, 12]. Все вещества вводили внутрибрюшинно (в/б) 1 раз/сутки (сут) в течение 5 сут. Поскольку максимальная выраженность заболевания развивается через 24 часа (ч) от начала опытов, то вещества начинали вводить через 1 сут после воспроизведения ОП, т.е. на высоте патологического процесса.
Критериями оценки эффективности лечения служили: увеличение выживаемости крыс, макроскопические изменения в брюшной полости, морфологические изменения ткани ПЖ, биохимические показатели (активность ферментов ПЖ и содержание продуктов перекисного окисления липидов /ПОЛ/ в крови).
Биохимическое исследование крови проводили через 2, 3 и 10 сут после воспроизведения ОП.
В гепаринизированной плазме крови крыс определяли (с учетом рекомендаций В.В. Меньшикова /ред./, 1987 [18]) с помощью стандартных коммерческих наборов реагентов фирмы "DiaSys" (Германия) следующие показатели: активность α-амилазы, липазы панкреатической, трипсина, аспартатаминотрансферазы (ACT), аланинаминотрансферазы (АЛТ), щелочной фосфатазы (ЩФ) и γ-глутамил-транспептидазы (ГГТП). Измерения проводили на биохимическом анализаторе "Targa ВТ 3000" (Biotecnica Instruments, Италия).
Об интенсивности ПОЛ судили, определяя в плазме крови содержание продуктов ПОЛ, реагирующих с 2-тиобарбитуровой кислотой (ТБК-активные продукты, естественно, в первую очередь малонового диальдегида, - одного из наиболее важных конечных продуктов ПОЛ), и диеновых коньюгатов (ДК), появляющихся на начальных этапах ПОЛ [25, 26]. Для оценки состояния системы эндогенной антиоксидантной защиты определяли активность таких антиоксидантных ферментов, как каталаза и супероксиддисмутаза /СОД/ [16, 17]. Кроме того, оценивали антиоксидантную активность сыворотки крови [15].
Для морфологического исследования через 2, 3 и 10 сут после воспроизведения ОП забирали ПЖ. Для светооптического исследования кусочки ПЖ фиксировали 10% нейтральным формалином. Приготовленные гистологические срезы окрашивали гематоксилином и эозином и проводили микроскопическое исследование. Исследование проводили на микроскопе Leica DM2500 с цифровой фотокамерой для объективной оценки динамики морфологических изменений.
Статистическую обработку результатов исследований проводили параметрическими (критерий Стьюдента) и непараметрическими (точный метод Фишера) методами с использованием программы BioStat 2009 Professional.
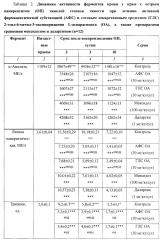
Было установлено, что в контрольной группе (ОП без лечения) гибель составила 47% (14 крыс из 30) животных (табл.1).
АФС OA в дозе 30 мг/кг/сут значимо (p<0,05) снижала летальность крыс до 0%. Аналогичным образом действовала и ГЛС OA (30 мг/кг/сут), значимо (p<0,05) снижая летальность животных до 0%.
Препарат сравнения мексидол в дозе 100 мг/кг/сут значимо (p<0,05) уменьшал летальность крыс до 19% (6 животных из 32).
Другой препарат сравнения - даларгин в дозе 1 мг/кг/сут - значимо (p<0,05) снижал летальность животных до 23% (7 крыс из 31).
По выраженности действия в отношении летальности и АФС, и ГЛС OA значимо (p<0,05) превосходили мексидол и даларгин на 19% и 23% соответственно.
Итак, АФС и ГЛС OA в дозе 30 мг/кг/сут оказывают выраженное лечебное действие, значимо превосходя по влиянию на летальность препараты сравнения мексидол (100 мг/кг/сут) и даларгин (1 мг/кг/сут).
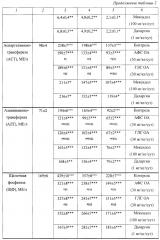
Установлено, что у животных контрольной группы (ОП без лечения) через 2 сут после воспроизведения ОП развивалась выраженная панкреатогенная энзимная токсемия. Так, например, активность α-амилазы в плазме крови значимо (p<0,001) увеличивалась в 5,3 раза по сравнению с группой интактных крыс, а через 3 и 10 сут превышала исходный уровень (здесь и далее имеется ввиду уровень у интактных животных) в 4,0 и 1,3 раза соответственно (p<0,001) (табл. 2).
АФС OA в дозе 30 мг/кг/сут значимо (p<0,001) уменьшала активность α-амилазы через 2 сут после воспроизведения ОП в 1,7 раза, через 3 сут - в 2,1 раза, а через 10 сут - в 1.4 раза (даже несколько ниже исходного уровня). Аналогичным образом действовала и ГЛС OA (30 мг/кг/сут), значимо (p<0,001) уменьшая данный показатель через 2 сут в 1,6 раза, через 3 сут - в 2,1 раза, а через 10 сут - в 1,4 раза (также несколько ниже исходного уровня).
Препарат сравнения мексидол в дозе 100 мг/кг/сут значимо (p<0,001) уменьшал активность α-амилазы через 2, 3 и 10 сут после воспроизведения ОП в 1,4, 1,4 и 1,3 раза (до исходного уровня) соответственно. Препарат сравнения даларгин в дозе 1 мг/кг/сут значимо (p<0,001) уменьшал данный показатель в указанные сроки наблюдения в 1,4, 1,4 и 1,2 раза соответственно.
По выраженности действия в отношении активности α-амилазы плазмы крови крыс АФС OA через 2, 3 и 10 сут после воспроизведения ОП значимо (p<0,001) превосходила мексидол в 1,1, 1,5 и 1,1 раза соответственно и даларгин - в 1,2, 1,5 и 1,2 раза соответственно. ГЛС OA в указанные сроки наблюдения также значимо превосходила мексидол в 1,1 (p<0,001), 1,5 (p<0,001) и 1,05 (p<0,01) раза соответственно, а даларгин - в 1,2, 1,5 и 1,2 раза (p<0,001) соответственно.
Выявлено, что через 2 сут после воспроизведения ОП активность липазы панкреатической в плазме крови контрольных крыс значимо (p<0,001) увеличивалась в 3,8 раза по сравнению с группой интактных крыс, а через 3 и 10 сут превышала исходный уровень в 2,8 и 2,0 раза соответственно (p<0,001) (табл. 2).
АФС и ГЛС OA в дозе 30 мг/кг/сут значимо (p<0,001) уменьшали активность липазы панкреатической через 2 сут в 1,8 раза, через 3 сут - в 2,0 раза, а через 10 сут - в 2,1 раза (даже несколько ниже исходного уровня).
Мексидол в дозе 100 мг/кг/сут значимо (p<0,001) уменьшал данный показатель через 2, 3 и 10 сут в 1,4, 1,5 и 1,8 раза соответственно, а даларгин в дозе 1 мг/кг/сут - в 1,3, 1,4 и 1,7 раза (p<0,001) соответственно.
По выраженности действия в отношении активности липазы панкреатической плазмы крови крыс АФС и ГЛС OA в указанные сроки наблюдения значимо (p<0,001) превосходили мексидол в 1,3, 1,4 и 1,2 раза соответственно и даларгин - в 1,4, 1,4-1,5 и 1,2 раза соответственно.
Обнаружено, что через 2 сут активность трипсина в плазме крови контрольных крыс значимо (p<0,001) увеличивалась в 4,6 раза по сравнению с группой интактных крыс, а через 3 и 10 сут превышала исходный уровень в 2,9 (p<0,001) и 1,3 раза (p<0,05) соответственно (табл. 2).
АФС и ГЛС OA (30 мг/кг/сут) значимо (p<0,001) уменьшали активность трипсина через 2 сут в 1,7 раза, через 3 сут - в 1,5 раза и через 10 сут - также в 1,5 раза (даже несколько ниже исходного уровня).
Мексидол (100 мг/кг/сут) значимо уменьшал данный показатель через 2, 3 и 10 сут в 1,4 (p<0,01), 1,2 (p<0,01) и 1,2 раза (до исходного уровня; p<0,05) соответственно, а даларгин (1 мг/кг/сут) - в 1,4 (p<0,01), 1,2 (p<0,01) и 1,1 раза (до исходного уровня; p<0,05) соответственно.
По выраженности действия в отношении активности трипсина плазмы крови крыс АФС и ГЛС OA в указанные сроки наблюдения значимо (p<0,05) превосходили мексидол в 1,2 раза и даларгин - в 1,3 (p<0,001), 1,2-1,3 (p<0,001) и 1,3 раза (p<0,01) соответственно.
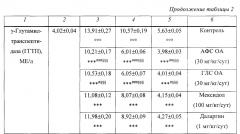
Было также установлено, что через 2 сут развивался синдром цитолиза гепатоцитов - активность ACT в плазме крови контрольных крыс значимо (p<0,001) увеличивалась в 2,4 раза по сравнению с группой интактных крыс, а через 3 и 10 сут превышала исходный уровень в 2,0 и 1,4 раза соответственно (p<0,001) (табл. 2).
АФС и ГЛС OA (30 мг/кг/сут) значимо (p<0,001) уменьшали активность ACT через 2 сут в 1,3 раза, через 3 сут - в 1,5 раза и через 10 сут - также в 1,5 раза (до исходного уровня).
Мексидол (100 мг/кг/сут) значимо уменьшал данный показатель через 2, 3 и 10 сут в 1,1 (p<0,05), 1,3 (p<0,001) и 1,3 раза (p<0,001) соответственно, а даларгин (1 мг/кг/сут) - в 1,1 (p<0,05), 1,3 (p<0,001) и 1,2 раза (p<0,05) соответственно.
По выраженности действия в отношении активности ACT плазмы крови крыс АФС и ГЛС OA в указанные сроки наблюдения значимо (p<0,05) превосходили мексидол в 1,1, 1,1 и 1,2 раза соответственно и даларгин - в 1,1 (p<0,05), 1,1-1,2 (p<0,01) и 1,3 раза (p<0,001) соответственно.
Было обнаружено, что через 2 сут активность другого показателя синдрома цитолиза гепатоцитов - АЛТ - в плазме крови контрольных крыс значимо (p<0,001) увеличивалась в 2,7 раза по сравнению с группой интактных крыс, а через 3 и 10 сут превышала исходный уровень в 2,3 и 1,3 раза соответственно (p<0,001) (табл.2).
АФС и ГЛС OA (30 мг/кг/сут) значимо (p<0,001) уменьшали активность АЛТ через 2 сут в 1,6 и 1,5 раза соответственно, через 3 сут - в 1,6 раза, а через 10 сут - в 1,4 раза (до исходного уровня).
Мексидол (100 мг/кг/сут) и даларгин (1 мг/кг/сут) значимо (p<0,001) уменьшали данный показатель в 1,2 раза во все сроки наблюдения.
По выраженности действия в отношении активности АЛТ плазмы крови крыс АФС и ГЛС OA значимо превосходили мексидол через 2 и 3 сут в 1,3 раза (p<0,001), а через 10 сут - в 1,2 (p<0,001) и 1,1 раза (p<0,01) соответственно; даларгин через 2 и 3 сут - в 1,3-1,4 раза (p<0,001), а через 10 сут-в 1,2 раза (p<0,001).
Было также выявлено, что через 2 сут после воспроизведения ОП развивался синдром холестаза. Так, например, активность ЩФ (основной показатель синдрома холестаза) в плазме крови контрольных крыс значимо (p<0,001) увеличивалась в 2,6 раза по сравнению с группой интактных крыс, а через 3 и 10 сут превышала исходный уровень в 2,1 и 1,3 раза соответственно (p<0,001) (табл. 2).
АФС и ГЛС OA (30 мг/кг/сут) значимо (p<0,001) уменьшали активность ЩФ через 2 сут в 1,4 и 1,3 раза соответственно, через 3 сут - в 1,5 раза и через 10 сут - также в 1,5 раза (даже несколько ниже исходного уровня).
Мексидол (100 мг/кг/сут) значимо (p<0,001) уменьшал данный показатель через 2, 3 и 10 сут в 1,2, 1,3 и 1,3 раза соответственно, а даларгин (1 мг/кг/сут) - в 1,2, 1,3 и 1,2 раза соответственно.
По выраженности действия в отношении активности ЩФ плазмы крови крыс АФС и ГЛС OA значимо превосходили мексидол в указанные сроки наблюдения в 1,1 раза (p<0,05), а даларгин - в 1,1 (p<0,01), 1,2 (p<0,001) и 1,2 раза (p<0,001) соответственно.
Было также установлено, что через 2 сут активность другого показателя синдрома холестаза - ГГТП, являющегося также индикатором цитолиза, - в плазме крови контрольных крыс значимо (p<0,001) увеличивалась в 3,5 раза, а через 3 и 10 сут превышала исходный уровень в 2,6 и 1,4 раза соответственно (p<0,001) (табл. 2).
АФС и ГЛС OA (30 мг/кг/сут) значимо (p<0,001) уменьшали активность ГГТП через 2 сут в 1,4 и 1,3 раза соответственно, через 3 сут - в 1,8 и 1,7 раза соответственно, а через 10 сут - в 1,4 раза (до исходного уровня).
Мексидол (100 мг/кг/сут) значимо (p<0,001) уменьшал данный показатель через 2, 3 и 10 сут в 1,3, 1,3 и 1,4 раза соответственно, а даларгин (1 мг/кг/сут) - в 1,2, 1,2 и 1,3 раза соответственно.
По выраженности действия в отношении активности ГГТП плазмы крови крыс АФС и ГЛС OA значимо превосходили мексидол через 2 и 3 сут в 1,1 раза (p<0,05) и в 1,3 раза (p<0,001) соответственно, а через 10 сут - в 1,03-1,04 раза (p<0,05); даларгин - в 1,1-1,2, 1,5 и 1,1 раза (p<0,001) соответственно.
Итак, АФС и ГЛС OA в дозе 30 мг/кг/сут оказывают выраженное панкреопротекторное действие, снижая проявления панкреатогенной энзимной токсемии и синдромов поражения печени (цитолиза - ACT, АЛТ и ГГТП и холестаза - ЩФ и ГГТП) через 2 и 3 сут после воспроизведения ОП тяжелой степени тяжести, а через 10 сут уменьшая активность ферментов до исходных значений (или даже несколько ниже их). При этом по выраженности действия они превосходят препараты сравнения мексидол и даларгин.
Данные о динамике показателей ПОЛ и отражающие состояние системы эндогенной антиоксидантной защиты по изучению таких антиоксидантных ферментов, как каталаза и СОД, а также антиоксидантной активности сыворотки представлены в табл. 3.
Из нее видно, что в плазме крови крыс контрольной группы (ОП без лечения) через 2 сут отмечалось значительное повышение содержания ДК, появляющихся на начальных этапах ПОЛ. Так, концентрация ДК в плазме значимо (p<0,001) увеличивалась в 7,7 раза по сравнению с группой интактных крыс, а через 3 и 10 сут превышала исходный уровень в 5,3 и 2,3 раза соответственно (p<0,001) (табл. 3).
АФС и ГЛС OA (30 мг/кг/сут) значимо (p<0,001) уменьшали уровень ДК через 2 сут в 1,8 раза, через 3 сут - в 2,0 раза, а через 10 сут - в 2,7 и 2,6 раза (до исходного уровня) соответственно.
Мексидол (100 мг/кг/сут) значимо (p<0,001) уменьшал данный показатель через 2, 3 и 10 сут в 1,6, 1,4 и 2,2 раза (до исходного уровня) соответственно, а даларгин (1 мг/кг/сут) - в 1,2 (p<0,001), 1,2 (p<0,01) и 1,9 раза (p<0,001) соответственно.
По выраженности действия в отношении снижения уровня ДК плазмы крови АФС и ГЛС OA значимо превосходили мексидол через 2 и 3 сут в 1,2 раза (p<0,05) и в 1,4 раза (p<0,001) соответственно, а через 10 сут - в 1,2-1,3 раза (p<0,05); даларгин - в 1,5, 1,7 и 1,4-1,5 раза (p<0,001) соответственно.
Установлено, что у животных контрольной группы через 2 сут резко повышалась концентрация ТБК-активных продуктов. Так, их концентрация в плазме крови значимо (p<0,001) увеличивалась в 8,0 раза по сравнению с группой интактных крыс, а через 3 и 10 сут превышала исходный уровень в 5,4 и 2,0 раза соответственно (p<0,001) (табл. 3).
АФС и ГЛС OA (30 мг/кг/сут) значимо (p<0,001) уменьшали концентрацию ТБК-активных продуктов через 2 сут в 1,8 раза, через 3 сут - в 2,0 раза, а через 10 сут - в 2,4 и 2,6 раза соответственно (даже несколько ниже исходного уровня).
Мексидол (100 мг/кг/сут) значимо (p<0,001) уменьшал данный показатель через 2, 3 и 10 сут в 1,5, 1,5 и 2,0 раза (до исходного уровня) соответственно, а даларгин (1 мг/кг/сут) - в 1,3, 1,3 и 1,6 раза (p<0,001) соответственно.
По выраженности действия в отношении уменьшения концентрации ТБК-активных продуктов крови АФС и ГЛС OA значимо превосходили мексидол через 2 сут в 1,2 раза (p<0,01), через 3 сут - в 1,3 раза (p<0,001), а через 10 сут - в 1,2 и 1,3 раза (p<0,01) соответственно; даларгин через 2 сут - в 1,3 и 1,4 раза соответственно, через 3 сут - 1,5 раза, а через 10 сут - в 1,5 и 1,6 раза (p<0,001) соответственно.
Выявлено, что у животных контрольной группы через 2 сут резко повышалась активность каталазы - в 3,6 раза (p<0,001) по сравнению с группой интактных крыс, а через 3 и 10 сут превышала исходный уровень в 2,1 и 1,3 раза соответственно (p<0,001) (табл. 3).
АФС и ГЛС OA (30 мг/кг/сут) значимо (p<0,001) уменьшали активность каталазы через 2 сут в 2,1 раза, через 3 сут - в 1,8 раза, а через 10 сут - в 1,4 раза (до исходного уровня).
Мексидол (100 мг/кг/сут) значимо (p<0,001) уменьшал данный показатель через 2, 3 и 10 сут в 1,9, 1,6 и 1,2 раза (до исходного уровня) соответственно, а даларгин (1 мг/кг/сут) - в 1,7 (p<0,001), 1,4 (p<0,001) и 1,2 раза (p<0,01) соответственно.
По выраженности действия в отношении уменьшения активности каталазы АФС и ГЛС OA значимо превосходили мексидол в указанные сроки наблюдения в 1,1 раза (p<0,05), а даларгин - в 1,2-1,3 раза (p<0,01).
Показано, что у животных контрольной группы через 2 сут исследования наблюдается значимое (p<0,001) снижение активности СОД в крови (эритроцитах) - в 1,8 раза по сравнению с группой интактных крыс, а через 3 и 10 сут - в 1,4 (p<0,001) и 1,1 раза (p<0,05) соответственно (табл. 3).
АФС и ГЛС OA (30 мг/кг/сут) значимо повышали активность СОД через 2 сут в 1,5 раза (p<0,001), через 3 сут - в 1,3 раза (p<0,001), а через 10 сут - в 1,1 раза (p<0,05; до исходного уровня).
Мексидол (100 мг/кг/сут) значимо увеличивал данный показатель через 2 и 3 сут в 1,3 (p<0,001) и 1,1 раза (p<0,05) соответственно, а через 10 сут активность СОД статистически достоверно не отличалась от контрольной. Даларгин (1 мг/кг/сут) значимо повышал активность указанного фермента также только через 2 и 3 сут - в 1,2 (p<0,001) и 1,1 раза (p<0,05) соответственно.
По выраженности действия в отношении повышения активности СОД АФС и ГЛС OA значимо превосходили мексидол через 2, 3 и 10 сут в 1,1 (p<0,01), 1,2 (p<0,001) и 1,1 раза (p<0,05) соответственно, а даларгин - в 1,2 раза (p<0,001).
Обнаружено, что у животных контрольной группы через 2 сут резко снижалась антиоксидантная активность сыворотки - в 2,6 раза (p<0,001) по сравнению с группой интактных крыс, а через 3 и 10 сут она была ниже исходного уровня в 1,7 и 1,2 раза соответственно (p<0,001) (табл. 3).
АФС и ГЛС OA (30 мг/кг/сут) значимо (p<0,001) повышали антиоксидантную активность сыворотки через 2 сут в 1,8 раза, через 3 сут - в 1,5 раза, а через 10 сут - в 1,3 раза (даже несколько выше исходного уровня).
Мексидол (100 мг/кг/сут) значимо (p<0,001) увеличивал данный показатель через 2 сут в 1,5 раза, через 3 сут - в 1,3 раза, а через 10 сут - в 1,2 раза (близко к исходному уровню). Даларгин (1 мг/кг/сут) значимо повышал антиоксидантную активность сыворотки через 2 сут в 1,3 раза (p<0,001), через 3 сут - в 1,2 (p<0,01), а через 10 сут - в 1,1 раза (p<0,05) соответственно.
По выраженности действия в отношении повышения антиоксидантной активности сыворотки АФС и ГЛС OA значимо превосходили мексидол через 2 и 3 сут в 1,2 раза (p<0,001), а через 10 сут - в 1,1 раза (p<0,01); даларгин через 2 суток - в 1,3 и 1,4 раза (p<0,001) соответственно, через 3 сут - в 1,3 раза (p<0,001), а через 10 сут - в 1,2 раза (p<0,001).
Итак, АФС и ГЛС OA в дозе 30 мг/кг/сут через 2 и 3 сут после воспроизведения ОП тяжелой степени тяжести уменьшают показатели ПОЛ (содержание ДК и ТБК-активных продуктов) и активность каталазы, повышают активность такого антиоксидантного фермента, как СОД, и антиоксидантную активность сыворотки, а через 10 сут полностью нормализуют данные показатели до исходных значений (или даже превосходя их). При этом по выраженности действия они превосходят препараты сравнения мексидол и даларгин.
Эффективность АФС и ГЛС OA в отношении лечения ОП тяжелой степени тяжести была полностью подтверждена также морфологическими исследованиями ПЖ.
Таким образом, можно заключить, что у крыс на модели ОП тяжелой степени тяжести и АФС, и ГЛС OA в дозе 30 мг/кг/сут (ежедневно в течение 5 суток) оказывают выраженное лечебное действие, уменьшая летальность животных с 47% (контроль) до 0% и общую интоксикацию. По выраженности действия в отношении летальности они существенно превосходят препараты сравнения мексидол (100 мг/кг/сут) и даларгин (1 мг/кг/сут) на 19% и 23% соответственно. АФС и ГЛС OA примерно в равной степени нормализуют все исследованные биохимические показатели, в том числе свидетельствующие об энзимной токсемии (панкреатические α-амилаза, липаза и трипсин) и отражающие синдромы поражения печени, а именно цитолиза гепатоцитов (ACT, АЛТ, ГГТП) и холестаза (ЩФ и ГГТП); также нормализуют показатели ПОЛ (содержание ДК и ТБК-активных продуктов) и состояние эндогенной антиоксидантной защитной системы (по активности таких антиоксидантных ферментов, как каталаза и СОД, а также антиоксидантной активности сыворотки). При этом по выраженности действия АФС и ГЛС OA существенно превосходят мексидол (в значительно большей дозе) и даларгин. Более того, эффективность АФС и ГЛС OA в отношении лечения ОП полностью подтверждена морфологическими исследованиями ПЖ.
Пример 3. Гепатопротекторное действие активной фармацевтической субстанции (АФС) и готового лекарственного средства (ГЛС) 2-этил-6-метил-3-оксипиридиния L-аспарагината (OA) у крыс при остром токсическом гепатите (табл. 4-7).
Исследования выполнены на белых нелинейных крысах-самцах массой 220-280 г с использованием модели и методов, рекомендованных «Руководством по проведению доклинических исследований лекарственных средств» (2012) [22].
У крыс моделировали острый токсический гепатит подкожным введением тетрахлорметана (ССl4, четыреххлористый углерод; по 4 мл/кг 50% масляного раствора) в течение 4 сут. Как известно, ССl4 - классический гепатотропный яд, который широко используют в эксперименте для моделирования острого токсического гепатита; он, в частности, вызывает интенсивное ПОЛ бислоя клеточных мембран гепатоцитов [8, 32].
В подопытных группах животным вводили в/б АФС и ГЛС OA в дозе 30 мг/кг, а также препарат сравнения гептрал (адеметионин, лиофилизат для приготовления раствора для внутривенного и внутримышечного введения; Hospira S.p.A., Италия) в дозе 50 мг/кг за 1 ч до введения ССl4 1 раз в сутки в течение 5 сут.
Выбор в качестве препарата сравнения известного гепатопротектора гептрала (адеметионина) был обусловлен тем, что он имеет ряд ценных фармакологических свойств: холеретические, холекинетические и антиоксидантные, а также является донатором метальных групп, обеспечивающим окислительно-восстановительный механизм клеточной детоксикации. Он широко применяется при лечении различных заболеваний печени (токсические поражения печени, алкогольный стеатоз, хронический гепатит, цирроз печени и др.) [27, 30].
В контрольной группе крысы получали в/б только изотонический раствор натрия хлорида в эквиобъемном количестве.
Забор печени для морфологического (светооптического) исследования и крови для биохимического анализа производили как до, так и на 5-е, 7-е и 10-е сутки исследования.
В гепаринизированной плазме крови крыс определяли активность ферментов (α-амилазы, ACT, АЛТ, ЩФ, ГГТП), концентрацию общего белка, альбуминов, общего холестерина, триглицеридов, общего и непрямого билирубина, мочевины и креатинина, а также показателей ПОЛ (ДК, основания Шиффа, ТБК-активные продукты) и антиоксидантных ферментов (каталаза и СОД) так, как описано в примере 2.
Осуществляли забор кусочков печени для морфологического исследования, которое проводили стандартными методами световой микроскопии. Для светооптического исследования кусочки печени фиксировали 10% нейтральным формалином, затем приготовленные гистологические срезы окрашивали гематоксилином и эозином и проводили микроскопическое исследование так, как описано в примере 2.
Статистическую обработку результатов исследований проводили параметрическими (критерий Стьюдента) и непараметрическими (точный метод Фишера) методами с использованием программы BioStat 2009 Professional.
Было установлено, что в контрольной группе гепатотоксин ССl4 (подкожное введение по 4 мл/кг в течение 4 сут) вызывал гибель 24% (8 крыс из 33) животных (табл. 4).
АФС OA в дозе 30 мг/кг/сут значимо (p<0,05) снижала летальность крыс до 0%. Аналогичным образом действовала и ГЛС OA (30 мг/кг/сут), - значимо (p<0,05) снижая летальность животных до 0%.
Препарат сравнения гепатопротектор гептрал в дозе 50 мг/кг/сут уменьшал летальность животных до 17%, но недостоверно (р>0,05).
По выраженности действия в отношении летальности АФС и ГЛС OA значимо превосходили гептрал на 17% (p<0,05).
Итак, АФС и ГЛС OA в дозе 30 мг/кг/сут оказывают выраженное гепатопротекторное действие, значительно превосходя по влиянию на летальность препарат сравнения гептрал (50 мг/кг/сут).
Установлено, что у животных контрольной группы ССl4 вызывал на 5-10-е сутки исследования развитие гиперферментемии. Так, на 5-е сутки активность α-амилазы в плазме крови значимо (p<0,001) увеличивалась в 2,5 раза по сравнению с группой интактных крыс. На 7-е сутки она значимо (p<0,001) превышала исходный уровень (здесь и далее имеется ввиду уровень у интактных животных) в 1,8 раза, а на 10-е - в 1,3 раза (табл. 5).
АФС и ГЛС OA в дозе 30 мг/кг/сут значимо (p<0,001) уменьшали активность α-амилазы на 5-е сутки в 1,8 раза, на 7-е - в 1,5 и 1,4 раза соответственно и на 10-е - в 1,4 раза (даже несколько ниже исходного уровня).
Препарат сравнения гептрал в дозе 50 мг/кг/сут значимо (p<0,001) уменьшал данный показатель на 5-е сутки в 1,4 раза, на 7-е - в 1,3 раза и на 10-е - также в 1,3 раза (практически полностью восстанавливая его до исходного уровня).
По выраженности действия в отношении активности α-амилазы АФС и ГЛС OA значимо (p<0,001) превосходили гептрал на 5-е сутки в 1,3 раза, а на 7-е и 10-е - в 1,1 раза.
Выявлено, что у животных контрольной группы ССl4 вызывал на 5-10-е сутки исследования развитие синдрома цитолиза. Так, на 5-е сутки активность в плазме крови аминотрансфераз - ACT и АЛТ - значительно увеличивалась в 6,6 и 5,7 раза (p<0,001) соответственно по сравнению с группой интактных крыс; причем на 7-е сутки она значимо (p<0,001) превышала исходный уровень в 5,8 и 4,7 раза соответственно, а на 10-е - в 3,0 и 2,0 раза соответственно (табл. 5).
АФС и ГЛС OA в дозе 30 мг/кг/сут значимо (p<0,001) уменьшали активность ACT и АЛТ на 5-е сутки в 1,8 и 1,9 раза соответственно,