Способы и композиции на основе желчных кислот и их солей для уменьшения количества жира
Иллюстрации
Показать всеИзобретение относится к области косметологии и представляет собой состав для нехирургического удаления локализованного жирового отложения у субъекта, при этом состав содержит концентрацию, при которой лизируется жир, одного или нескольких из холата и хенодезоксихолата и имеет значение рН менее 8, где один или несколько из холата и хенодезоксихолата используются в качестве активного ингредиента для лизиса жира. Изобретение обеспечивает уменьшение локализованных жировых накоплений, не требует хирургического вмешательства или продолжительного времени восстановления, имеет меньше неблагоприятных побочных эффектов. 3 н. и 18 з.п. ф-лы, 4 табл., 18 ил.
Реферат
ПРЕДПОСЫЛКИ К СОЗДАНИЮ ИЗОБРЕТЕНИЯ
Липосакция, также известная как липопластика, липоструктурная липэктомия, липэктомия или просто липо, является косметической хирургической операцией, при которой удаляют жир из многих различных участков на теле человека. Пораженные площади могут варьировать от живота, бедер и ягодиц до шеи, тыльной стороны рук и других мест.
Несколько факторов ограничивают количество жира, которое можно безопасно удалить за один сеанс. Существуют негативные аспекты удаления слишком большого количества жира. Непривычные уплотнения и/или следы на коже можно увидеть у пациентов, к которым применили "излишнее отсасывание жира". Чем больше жира удалено, тем выше хирургический риск.
Инъекционное расщепление жира представляет собой косметическую процедуру, при которой пациентам инъецируют смесь лекарственных средств с целью разрушения жировых клеток. Данная практика с использованием лекарственных средств, в целом основанная на фосфатидилхолине (РРС) и дезоксихолате (DCA), развилась из первоначального внутривенного применения этих составов лекарственных средств для лечения заболеваний крови.
РРС относится к классу фосфолипидов, которые содержат холин в виде концевой группы. Он является одним из основных компонентов биологических мембран, и его можно легко получить из различных доступных источников, таких как яичный желток или соевые бобы, из которого(которых) его выделяют механическим или химическим путем с использованием гексана. РРС предотвращает накопление жировой ткани, и его используют для лечения печеночной недостаточности, вызванной жировым перерождением печени, ишемии миокарда, заболеваний сосудов головного мозга и слабоумия. Он был также недавно представлен для расщепления жира при лечении ожирения в Соединенных Штатах, Европе и остальных странах мира.
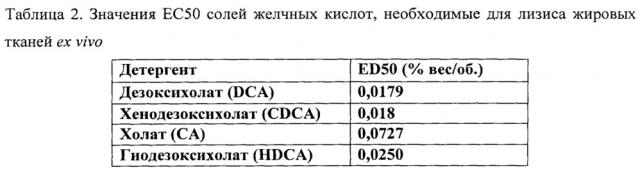
DCA представляет собой одну из солей вторичных желчных кислот, которые представляют собой продукты обмена веществ кишечных бактерий. DCA используют с момента его открытия в различных областях медицины человека и открыто используют при инъекциях по расщеплению жира, смешивая с РРС. DCA используют для улучшения растворимости РРС в воде и в последнее время лекарственных препаратов, таких как амфотерицин В, Taxol™ и диазепам. Высокоочищенный РРС может быть объединен с DCA, противомикробным средством, бензиловым спиртом и водой с образованием стабильного, смешанного мицеллярного препарата, который можно быстро стерилизовать и использовать для внутривенного введения.
В 1966 году исследователи отметили, что внутривенное введение РРС-содержащих растворов может устранить жировую эмболию. Позже состав лекарственного средства под названием Lipostabil®, содержащий 5% РРС и 4,75% DCA, был одобрен в Германии и применялся в лечении жировой эмболии, дислипидемии и цирроза печени, обусловленного алкоголизмом.
Среди детергентов соли желчных кислот являются особенно мощными солюбилизаторами липидных двухслойных мембран. Все биологические мембраны клеток состоят из той же структуры липидного бислоя, и поэтому они подвержены солюбилизации с помощью детергентов. Солюбилизация мембран клеток с помощью детергента включает в себя распределение детергента между липидными бислоями, дестабилизацию бислоя, дезинтеграцию и последующее формирование смешанных мицелл (состоящих из детергента и липида клеточной мембраны). Соли желчных кислот и другие детергенты уменьшают поверхностное натяжение на границе несмешиваемых материалов и позволяют разбивать крупные агрегаты на меньшие и меньшие частицы. В ткани эти средства растворяют мембраны клеток и вызывают лизис клеток. Воспалительная реакция генерируется лизисом клеток, в результате чего тело удаляет солюбилизированный детергентом материал.
Недавно Kythera Biopharmaceuticals, частная компания, расположенная в США, разработала инъекцию по расщеплению жира с применением версии РРС без DCA. На основании роли РРС в качестве эмульгатора в DCA и его применения в лечении гиперлипидемии РРС был предложен в качестве активного ингредиента при инъекции по расщеплению жира. Детергенты, такие как DCA, в этих композициях из предшествующего уровня техники были добавлены исключительно для дисперсии или растворения предполагаемого активного ингредиента, РРС. Однако было показано, что DCA был на самом деле активным средством для эмульгации локализованного жира.
Поскольку DCA является одним из сильных детергентов в семействе солей желчных кислот, лечение с помощью РРС и DCA или отдельно DCA может вызывать нежелательные побочные эффекты. Введение DCA вызывает разрушение окружающих тканей в местах инъекции. Использование DC А для удаления туловищного жира также связано со значительными побочными эффектами, включая боль, жжение, онемение, гематому, отек, опухание, пигментацию и отвердение. Кроме того, предыдущие исследователи предполагают повышение риска рака молочной железы или рака толстой кишки после воздействия DCA.
Наряду с определенным успехом предыдущих методик и композиций, имели место некоторые ограничения. Таким образом, было бы желательно иметь способ уменьшения локализованных жировых накоплений, который не требует хирургического вмешательства или продолжительного времени восстановления и имеет меньше неблагоприятных побочных эффектов, чем у доступных в настоящее время методов. Настоящее изобретение удовлетворяет эту потребность.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение предусматривает состав для нехирургического удаления локализованного жирового отложения у субъекта. Согласно одному варианту осуществления изобретения состав содержит концентрацию, при которой лизируется жир, одного или нескольких из холата и хенодезоксихолата в фармацевтически приемлемом составе со значением рН менее 9. Согласно одному варианту осуществления состав имеет уровень рН менее 8. Согласно другому варианту осуществления состав имеет уровень рН менее 7,5.
Согласно одному варианту осуществления изобретения состав содержит концентрацию, при которой лизируется жир, одного или нескольких из холата и хенодезоксихолата, при концентрации от приблизительно 0,5% до приблизительно 4,0%. Согласно другому варианту осуществления концентрация составляет от приблизительно 0,5% до приблизительно 2,0%.
Согласно одному варианту осуществления состав дополнительно содержит по меньшей мере один дополнительный активный ингредиент, выбранный из группы, состоящей из противовоспалительного средства, аналгетика, диспергирующего средства и вещества, способствующего проникновению.
Согласно одному варианту осуществления состав дополнительно содержит терапевтическое средство, выбранное из группы, состоящей из противомикробного средства, антитромботического средства, антикоагулянта, подавителя образования пены, противовоспалительного средства, анестетика, аналгетика, стероида, транквилизатора, антидиспергирующего средства и миорелаксанта.
Согласно одному варианту осуществления состав представлен в форме инъекционного состава. Согласно другому варианту осуществления состав представлен в виде состава для инъекции по расщеплению жира.
Настоящее изобретение предусматривает способ нехирургического удаления локализованных жировых отложений у субъекта, имеющего локализованные жировые накопления. Согласно одному варианту осуществления изобретения способ включает введение состава, содержащего концентрацию, при которой лизируется жир, одного или нескольких из холата и хенодезоксихолата в фармацевтически приемлемом составе со значением рН менее 9.
Согласно одному варианту осуществления стадия введения предусматривает подкожную инъекцию.
Согласно одному варианту осуществления локализованное жировое накопление выбрано из группы, состоящей из грыжи жировой клетчатки нижнего века, липом, липодистрофии и жировых отложений, связанных с целлюлитом.
Согласно одному варианту осуществления жировое отложение локализовано под глазом, под подбородком, под рукой, ягодицей, голенью, спиной, Зедром, лодыжкой или животом субъекта.
Настоящее изобретение также предусматривает набор, содержащий (а) первый контейнер, содержащий состав для нехирургического удаления локализованного жирового отложения у субъекта, который содержит концентрацию, при которой лизируется жир, одного или нескольких из холата и хенодезоксихолата в фармацевтически приемлемом составе со значением рН менее 9; и (b) письменные инструкции по применению состава для снижения жирового отложения у субъекта без применения хирургического вмешательства.
Согласно одному варианту осуществления первый контейнер
дополнительно содержит терапевтическое средство, выбранное из группы, состоящей из противомикробного средства, антитромботического средства, антикоагулянта, подавителя образования пены, противовоспалительного средства, анестетика, аналгетика, стероида, транквилизатора, антидиспергирующего средства и миорелаксанта.
Согласно одному варианту осуществления дополнительно содержится второй контейнер, при этом второй контейнер содержит второе терапевтическое средство, выбранное из группы, состоящей из противомикробного средства, антитромботического средства, антикоагулянта, подавителя образования пены, противовоспалительного средства, анестетика, аналгетика, стероида, транквилизатора, антидиспергирующего средства и миорелаксанта.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Следующее подробное описание предпочтительных вариантов осуществления настоящего изобретения будет лучше понятно при прочтении совместно с прилагаемыми графическими материалами. С целью иллюстрации настоящего изобретения, на графических материалах показаны варианты осуществления, которые в настоящее время являются предпочтительными. Однако следует понимать, что настоящее изобретение не ограничивается точными условиями и средствами вариантов осуществления, показанных на графических материалах.
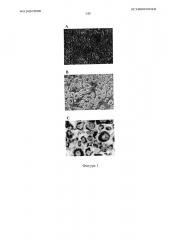
На фигуре 1, включающей фигуры 1А-1С, представлен ряд изображений, на которых показано дифференциацию преадипоцитов 3T3-L1. Преадипоциты 3T3-L1 (фигура 1А) обрабатывали средой для дифференциации (среда MDI) и дифференцированные адипоциты (фигура 1 В) промывали и фиксировали. После фильтрации с помощью 0,2% Тритона Х-100 клетки окрашивали масляным красным О (фигура 1С) и фотографировали при увеличении 200Х.
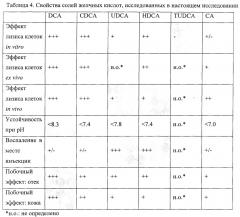
На фигуре 2, включающей фигуры 2А-2С, представлен ряд изображений, на которых показаны эффекты лизиса клеток детергентами в адипоцитах 3T3-L1. Дифференцированные адипоциты 3T3-L1 подвергали воздействию дезоксихолатом (DCA), хенодезоксихолатом (CDCA), тауроуросодезоксихолатом (TUDCA) и холатом (СА) (0~0,1%) (фигура 2 А) и TUDCA и СА (0~2%) (фигура 2В), и урсодезоксихолатом (UDCA), гиодезоксихолатом (HDCA) и СА (0~1%) (фигура 2С) в течение 1 часа и жизнеспособность клеток измеряли с помощью анализа с 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолийбромидом (МТТ). Все детергенты кроме TUDCA показывали дозозависимый эффект лизиса клеток. Эксперимент проводили в трех повторностях для каждой обработки. Результаты выражены в общей процентной доле жизнеспособных клеток по сравнению с необработанным контролем.
На фигуре 3, включающей фигуры 3А и 3В, представлен ряд диаграмм, на которых показано измерение лизиса жировой ткани после обработки с помощью DCA, CDCA, HDCA и СА. 95~100 мг жировых тканей вырезали у мышей с ожирением, вызванным рационом, и их подвергали воздействию различных концентраций DCA, CDCA и СА (фигура 3А), а также HDCA (фигура 3В). Жизнеспособность жировых тканей измеряли с помощью анализа МТТ и относительную поглощающую способность (OD570) измеряли с помощью спектрофотометра. Повышение концентрации детергентов вызывало более выраженный лизис жировой ткани. Эксперимент проводили в пяти повторностях для каждой обработки.
На фигуре 4 представлены графики, на которых показано среднее увеличение веса тела мышей, которых кормили рационом с высоким содержанием жиров. Вес тела отслеживали каждые две недели.
На фигуре 5, включающей фигуры 5А и 5В, представлен ряд диаграмм, на которых показан (фигура 5А) вес тела и (фигура 5В) вес паховых скоплений жировой ткани у мышей с ожирением, которым инъецировали 1% DCA, CDCA, СА и фосфатный буферный раствор (PBS). Растворы солей желчных кислот (DCA, CDCA и СА) инъецировали в паховые скопления жировой ткани мышей с правой стороны. Паховые скопления жировой ткани мышей с левой стороны получали такой же объемом PBS в качестве контроля. Инъекции повторяли еще 4 раза в течение 2 недель. Мышей умерщвляли через 4 дня после последней инъекции и иссекали паховые скопления жировой ткани и измеряли их вес.
Фигура 6 представляет собой изображение, описывающие гистологические изменения, наблюдаемые в скоплениях жировой ткани мышей, которым вводили соли желчных кислот. После инъекций солей желчных кислот и PBS, иссекали жировые ткани в участке инъекции. Иссеченные ткани фиксировали параформальдегидом, заключали в парафиновые блоки, разделяли по предметным стеклам. Наблюдали повреждение тканей и некроз при окрашивании Н & Е.
На фигуре 7 представлена процедура измерения площади некроза. Изображения скоплений жировой ткани, окрашенной 2,3,5-трифенилтетразолия хлоридом (ТТС), получали через 24 часа после инъекции. Нормальная ткань окрашивалась в красный цвет, а площадь некроза окрашивалась в белый цвет, и количественную оценку осуществляли с помощью системы анализа изображений. Площади некроза (белая, неокрашенная область) измеряли с помощью системы анализа изображений (ImageJ; National Institutes of Health, Бетесда, Мериленд, США).
На фигуре 8 представлена диаграмма, на которой показано количественное определение площади некроза in vivo. Скопления жировой ткани, в которые инъецировали различные концентрации солей желчных кислот (DCA, CDCA и СА) и PBS, иссекали и площади некроза определяли с помощью ТТС-окрашивания (n=8 в каждой группе). Повышение концентрации детергентов вызывало более выраженный лизис жировой ткани.
На фигуре 9 представлены изображения ТТС-окрашенного с помощью скопления жировой ткани после обработки различными (DCA, СА, CDCA) солями желчных кислот и носителем (PBS).
На фигуре 10, включающей фигуры 10А и 10В, представлен ряд диаграмм, изображающих жизнеспособность ткани по сравнению с нормальным PBS (фигура 10A) и относительную поглощающую способность (фигура 10В) после анализа МТТ. Паховые скопления жировой ткани мышей подвергали воздействию различными концентрациями солей (0~200 ммоль хлорида натрия) в фосфатном буфере, который содержал CA, DCA и CDCA. 95~100 мг жировой ткани инкубировали с DCA, CDCA и СА при концентрации ЕС50 (концентрации, которые показывают снижение на 50% жизнеспособности ткани в нормальном PBS) в различных концентрациях солей. Эксперимент проводили в пяти повторностях для каждой обработки.
На фигуре 11, включающей фигуры 11A-11D, представлен ряд изображений, на которых показана жизнеспособность (фигуры 11А, 11С) и относительная поглощающая способность (фигуры 11В, 11D) пахового скопления жировой ткани мышей, которых подвергали воздействию DCA, CDCA, СА, HDCA и PBS при различных рН (рН 6,0, 6,5, 7,0, 7,5, 8,0, 8,5, 9,0). 95~100 мг жировой ткани инкубировали с DCA, CDCA, HDCA и СА при концентрации ЕС50 в различных условиях рН. Жизнеспособность жировых тканей измеряли с помощью анализа МТТ и поглощающую способность (OD570) измеряли с помощью спектрофотометра. Эксперимент проводили в пяти повторностях для каждой обработки.
На фигуре 12, включающей фигуры 12А-12С, представлен ряд графиков, на которых показана относительная площадь некроза. Скопления жировой ткани, в которые инъецировали различные концентрации DCA, CDCA и СА (фигура 12А), UDCA (фигура 12В), HDCA (фигура 12С), иссекали и площади некроза определяли с помощью ТТС-окрашивания (n=10 в каждой группе). Площади некроза (белая, неокрашенная область) измеряли с помощью системы анализа изображений. Инъекция более высокой концентрации детергентов вызывала более выраженный лизис жировой ткани.
На фигуре 13 представлен ряд изображений, на которых показаны гистологические изменения, которые наблюдали в скоплениях жировой ткани мышей после введения солей желчных кислот. Жировые ткани иссекали и фиксировали параформальдегидом, заключали в парафиновые блоки и разделяли по предметным стеклам после инъекции 1,5% СА, 1,5% HDCA и 1,5% раствора UDCA. Инфильтрацию полиморфно-ядерных (PMN) клеток в скоплении жировой ткани наблюдали в обработанных HDCA или UDCA тканях при окрашивании Н & Е.
На фигуре 14, включающей фигуры 14А-14С, представлен ряд диаграмм, на которых показаны эффекты лизиса клеток различными солями желчных кислот в адипоцитах 3T3-L1. Дифференцированные адипоциты 3T3-L1 подвергали воздействию таурохолатом (ТСА), гликохолатом (GCA), СА, тауродезоксихолатом (TDCA), гликодезоксихолатом (GDCA), DCA, таурохенодезоксихолатом (TCDCA) и CDCA (фигуры 14А-14С) в течение 1 часа и жизнеспособность клеток измеряли с помощью анализа МТТ. Все детергенты показывали дозозависимый эффект лизиса клеток. Соединенный с таурином глицин не влиял на активность лизиса клеток СА, DCA и CDCA. Эксперимент проводили в трех повторностях для каждой обработки. Результаты выражены в общей процентной доле жизнеспособных клеток по сравнению с необработанным контролем.
На фигуре 15, включающей фигуры 16А и 16В, представлен ряд изображений, на которых показана жизнеспособность ткани пахового скопления жировой ткани мышей, которую подвергали воздействию при различных условиях рН (рН 6,0, 6,5, 7,0, 8,0, 9,0) растворов СА, GCA, ТСА и носителя (PBS). 95~100 мг жировой ткани инкубировали с 0,1% GCA, ТСА и СА при различных условиях рН. Жизнеспособность жировой ткани отслеживали как поглощающую способность (фигура 16А) и относительную поглощающую способность (фигура 16В) с помощью анализа МТТ. Поглощающая способность (фигура 16А) и относительная поглощающая способность (фигура 16В). Эксперимент проводили в пяти повторностях для каждой обработки.
На фигуре 16 представлен ряд изображений, на которых показано гистологическое исследование хвостов мышей через 14 дней после инъекции DCA, СА и PBS. Окрашивание Н&Е показало некроз подкожного жира в обработанном хвосте. Также наблюдали тканевую структуру мышц и слоя кожи в обработанных хвостах.
На фигуре 17, включающей фигуры 17А-17Е, представлен ряд Изображений, на которых показаны внешний вид крысиных лап (фигура 17А, 17С) и толщина лап (фигуры 17В, 17D, Е) после инъекций в задние лапы 1% DCA, 1,5% СА, 0,8% CDCA, 1,5% UDCA, 1,5% HDCA и PBS.
На фигуре 18, включающей фигуры 18А и 18В, представлен ряд изображений, на которых показаны внешний вид мышиной кожи (фигура 18А) и тяжесть поражений кожи (фигура 18В) после подкожных инъекций различных концентраций (0,5-1,5%; в растворе с рН 7,4) DCA, СА и PBS.
ПОДРОБНОЕ ОПИСАНИЕ
Настоящее изобретение основано на неожиданном открытии эффекта лизиса жира холатом in vivo, которое не является предсказуемым, исходя из показателей активности холата, наблюдаемых in vitro и ex vivo. Таким образом, хотя холат проявлял относительно низкую активность лизиса по сравнению с дезоксихолатом и хенодезоксихолатом in vitro, холат проявлял превосходные результаты in vivo. Например, обработка холатом in vivo вызвала значительное снижение побочных эффектов в коже по сравнению с обработкой дезоксихолатом. Данный неожиданный эффект лизиса жира холатом, при котором уменьшались побочные эффекты in vivo, подкрепляет применение холата в качестве активного компонента при инъекции по расщеплению жира, в частности в концентрации, которую не предполагали из результатов in vitro и ex vivo.
Настоящее изобретение направлено на решение проблемы локализованных жировых накоплений у животных путем обеспечения нехирургического способа уменьшения жировых отложений. Согласно одному варианту осуществления настоящее изобретение предусматривает введение эффективного количества концентрации, при которой лизируется жир, одного или нескольких из холата и хенодезоксихолата в фармацевтически приемлемом составе.
Настоящее изобретение относится к применению желчной кислоты или ее соли для уменьшения количества жира в организме животного, предпочтительно млекопитающего, более предпочтительно человека. Согласно одному варианту осуществления желчная кислота или ее соль представляют собой один или несколько из холата и хенодезоксихолата.
Согласно одному варианту осуществления настоящее изобретение относится к применению одного или нескольких из холата и хенодезоксихолата для уменьшения подкожных жировых накоплений у млекопитающих путем введения фармацевтически приемлемого состава локально в целевой участок. Согласно одному варианту осуществления состав имеет форму для инъекции по расщеплению жира.
Настоящее изобретение относится к способу уменьшения жирового отложения у млекопитающих, включающему контакт жирового отложения с составом, содержащим один или несколько из холата и хенодезоксихолата.
Согласно другому варианту осуществления настоящее изобретение относится к способу обработки целлюлита и излишних жировых отложений с помощью одного или нескольких из холата и хенодезоксихолата для того, чтобы лизировать жировые клетки, связанные с целлюлитом и излишними жировыми отложениями.
Согласно другому варианту осуществления настоящее изобретение относится к способу удаления жира путем контроля уровня рН состава для улучшения активности одного или нескольких из холата и хенодезоксихолата. Согласно одному варианту осуществления состав, который содержит один или несколько из холата и хенодезоксихолата, можно составить для получения подходящего значения рН менее приблизительно 9.
Определения
Если не указано иное, все технические и научные термины, используемые в данном документе, имеют такое же значение, которое обычно понимается специалистом в области, к которой принадлежит настоящее изобретение. Хотя при практическом осуществлении или тестировании настоящего изобретения можно применять любые способы и материалы, сходные с описанными в данном документе или эквивалентные им, в данном документе описаны предпочтительные способы и материалы.
Используемый в данном документе, каждый из следующих терминов имеет значение, связанное с ним в этом разделе.
Форма единственного числа применяется в данном документе для обозначения одного или нескольких (т.е. по меньшей мере одного) грамматического объекта. В качестве примера, элемент" означает один элемент или несколько элементов.
"Приблизительно", как используется в данном документе, при ссылке на измеряемую величину, такую как количество, продолжительность времени и тому подобное, предназначено для охвата вариантов ±20%, ±10%, ±5%, ±1% или ±0,1% от указанного значения, так как такие вариации являются подходящими для осуществления описанных способов.
Заболевание или расстройство "облегчены", если тяжесть симптома заболевания или расстройства, частота, с которой такой симптом, который испытывает пациент, или и то, и другое, снижаются.
Термин "желчные кислоты", используемый в данном документе, включает стероидные кислоты (и/или их карбоксилатный анион) и их соли, найденные в желчи животного (например, человека), в том числе, в качестве неограничивающего примера, холевую кислоту, холат, дезоксихолевую кислоту, дезоксихолат, гиодезоксихолевую кислоту, гиодезоксихолат, гликохолевую кислоту, гликохолат, таурохолевую кислоту, таурохолат, хенодезоксихолевую кислоту, хенодезоксихолат, литохолевую кислоту, литохолат и т.п. (и их соли).
Термины "пациент", "субъект", "индивидуум", и т.п. используются в данном документе взаимозаменяемо и относятся к любому животному или его клетке, или in vitro, или in situ, которые доступны в способах, описанных в данном документе. Согласно определенным неограничивающим вариантам осуществления пациент, субъект или индивидуум является человеком.
Используемый в данном документе термин "композиция" или "фармацевтическая композиция" относится к смеси по меньшей мере одного соединения по настоящему изобретению с другими химическими компонентами, такими как носители, стабилизаторы, разбавители, диспергирующие средства, суспендирующие средства, загустители и/или вспомогательные средства. Фармацевтическая композиция облегчает введение соединения в организм.
Используемые в данном документе термины "эффективное количество", "фармацевтически эффективное количество" и "терапевтически эффективное количество" относятся к нетоксичному, но достаточному количеству средства для обеспечения желаемого биологического результата. Результатом может быть уменьшение и/или облегчение признаков, симптомов или причин болезни или любое другое желаемое изменение биологической системы. Соответствующее терапевтическое количество в каждом отдельном случае может быть определено одним из специалистов в данной области техники, с использованием рутинного экспериментирования.
Используемый в данном документе термин "эффективность" относится к максимальному эффекту (Emax), достигнутому в исследовании.
Используемый в данном документе "обучающий материал" включает публикацию, запись, диаграмму или любую другую среду выражения, которые можно использовать для сообщения пользы соединения, композиции, вектора или системы доставки в наборе по настоящему изобретению для обеспечения облегчения различных заболеваний или расстройств, приведенных в данном документе. Необязательно или с другой стороны в обучающем материале может описываться один или несколько способов облегчения заболеваний или расстройств в клетке или ткани млекопитающего. Обучающий материал набора по настоящему изобретению может, например, быть прикреплен к контейнеру, который содержит идентифицированное соединение, композицию, вектор или систему доставки по настоящему изобретению, или может поставляться вместе с контейнером, который содержит идентифицированное соединение, композицию, вектор или систему доставки. Альтернативно, обучающий материал может поставляться отдельно от контейнера с намерением, чтобы обучающий материал и соединение получатель использовал совместно.
"Локальное введение" означает введение пациенту несистемным путем фармацевтического средства или в непосредственной близости от мышцы, или в нее, или в подкожное место. Таким образом, локальное введение исключает системные пути введения, такие как внутривенное или пероральное введение.
"Периферическое введение" означает введение в место, отдаленное от места симптома, в отличие от локального введения.
"Фармацевтически приемлемый" относится к тем свойствам и/или веществам, которые являются приемлемыми для пациента с фармакологической/токсикологической точки зрения и для фармацевта химика-Технолога с физической/химической точки зрения относительно композиции, состава, стабильности, переносимости пациентом и биодоступности. "Фармацевтически приемлемый носитель" относится к среде, которая не препятствует эффективности биологической активности активного(активных) ингредиента(ингредиентов) и не является токсичной для хозяина, которому его вводят.
"Терапевтическое" лечение представляет собой лечение, которое назначают субъекту, который проявляет признаки или симптомы патологии, с целью уменьшения или устранения этих признаков или симптомов.
Используемый в настоящем описании термин "лечение" или "обеспечение лечения" определяется как применение или введение терапевтического средства, т.е. соединения по настоящему изобретению (отдельно или в комбинации с другим фармацевтическим средством), пациенту или применение или введение терапевтического средства в выделенную ткань или клеточную линию от пациента (например, для диагностики или применения ex vivo), который характеризуется рассматриваемым в данном документе состоянием, симптомом рассматриваемого в данном документе состояния или потенциалом для развития рассматриваемого в данном документе состояния, с целью вылечить, исцелить, облегчить, ослабить, обратить, устранить, улучшить, усовершенствовать или повлиять на рассматриваемое в данном документе состояние, симптомы рассматриваемого в данном документе состояния или потенциал для развития рассматриваемого в данном документе состояния. Такие способы лечения могут быть специально разработаны или модифицированы на основе знаний, полученных из области фармакологии.
"Терапевтически эффективное количество" означает количество соединения по настоящему изобретению, которое при введении пациенту улучшает симптомы заболевания. Количество соединения по настоящему изобретению, которое представляет собой "терапевтически эффективное количество", будет варьировать в зависимости от соединения, состояния заболевания и его тяжести, возраста пациента, подлежащего лечению, и т.п. Терапевтически эффективное количество может быть определено рутинным способом специалистом в данной области с учетом его собственных знаний и данного раскрытия.
Диапазоны: в настоящем документе, различные аспекты настоящего изобретения могут быть представлены в формате диапазона. Следует понимать, что описание в формате диапазона предназначено лишь для удобства и краткости и не должно быть истолковано как негибкое ограничение объема настоящего изобретения. Соответственно, описание диапазона следует рассматривать как имеющее конкретно раскрытые все возможные поддиапазоны, а также отдельные числовые значения в пределах этого диапазона. Например, описание диапазона, например, от 1 до 6, следует рассматривать как имеющее специфические раскрытые поддиапазоны, такие как от 1 до 3, от 1 до 4, от 1 до 5, от 2 до 4, от 2 до 6, от 3 до 6 и т.д., а также отдельные числа в пределах этого диапазона, например, 1, 2, 2,7, 3, 4, 5, 5,3 и 6. Это применяется независимо от ширины диапазона.
Описание
Стабильность и активность солей желчных кислот в значительной степени зависит от условий их рН. Настоящее изобретение частично связано с наблюдением того, что безопасность инъекции соли желчных кислот улучшается путем регулирования условия рН.
Настоящее изобретение относится к открытию того, что комбинация соответствующего диапазона концентрации соли желчных кислот в соответствующем диапазоне рН характеризуется важным значением для достижения желаемого терапевтического результата за счет снижения побочных эффектов. Например, более низкую концентрацию солей желчных кислот можно применять в составе с более низким значением рН, поскольку условие с более низким значением рН усиливает активность лизиса клеток солью желчных кислот. Предпочтительно, применяемое низкое значение рН не увеличивает неблагоприятные эффекты состава соли желчных кислот. Соответственно, неблагоприятные эффекты можно отличить от активности лизиса клеток при соответствующем уровне рН. Таким образом, в некоторых случаях применение более низкой концентрации соли желчных кислот в составе с более низким значением рН может уменьшить неблагоприятные эффекты соли желчных кислот без снижения активности лизиса клеток.
В случае дезоксихолата наблюдали осаждение дезоксихолата в растворах с более низким значением рН. В результате, для дезоксихолата необходимы буферы с более высоким значением рН. Однако растворы с более высоким значением рН, чем физиологическое, проявляли побочные эффекты. Соответственно, настоящее изобретение предусматривает состав раствора одного или нескольких из холата и хенодезоксихолата с физиологическим значением рН и низкими концентрациями, что обеспечивает дополнительные преимущества, такие как снижение побочных эффектов по сравнению с составом дезоксихолата.
Настоящее изобретение основано на неожиданном эффекте лизиса жира холатом in vivo, при котором холат не проявлял неблагоприятные эффекты на реципиента при концентрации, в которой в противном случае дезоксихолат проявлял неблагоприятные эффекты. Соответственно, настоящее изобретение предусматривает состав холата, в котором концентрация холата может быть выше, чем концентрация дезоксихолата, который также проявляет снижение неблагоприятного эффекта у пациента. Согласно другому аспекту, настоящее изобретение предусматривает состав холата, при этом концентрация холата может быть аналогичной концентрации дезоксихолата, но приводит в результате к большему эффекту лизиса жира, также проявляет снижение неблагоприятного эффекта у пациентов. Таким образом, настоящее изобретение предусматривает безопасную инъекцию по расщеплению жира, предусматривающую холат с эффективной концентрацией, которая не проявляет неблагоприятные эффекты по сравнению с применением дезоксихолата.
Согласно одному варианту осуществления настоящее изобретение предусматривает композиции и способы применения одного или нескольких из холата и хенодезоксихолата в качестве активного компонента для уменьшения количества жира у млекопитающих. Согласно одному варианту осуществления настоящее изобретение предусматривает композиции и способы применения одного или нескольких из холата и хенодезоксихолата при инъекции по расщеплению жира.
Согласно одному варианту осуществления настоящее изобретение предусматривает композиции и способы, полезные при нехирургическом уменьшении локализованных жировых отложений у нуждающихся в этом пациентов, таким образом, способ предусматривает применение композиции, содержащей фармакологически активную желчную кислоту или ее соль, например, холат и хенодезоксихолат. Композиция по настоящему изобретению может дополнительно содержать другие средства, такие как противовоспалительные средства, аналгетики, диспергирующие средства и их фармацевтически приемлемые вспомогательные средства. Композиции по настоящему изобретению полезны для лечения локализованных жировых накоплений, включая жировые отложения под глазом, подбородком или рукой, а также ягодицей, голенью, спиной, бедром, лодыжкой или животом млекопитающего. Согласно другому варианту осуществления способы могут уменьшать определенные типы жировых отложений, таких как, например, образование грыжи жировой клетчатки века, липомы, липодистрофию, липодистрофию по типу "бычий горб" или жировые отложения, связанные с целлюлитом. Согласно одному варианту осуществления уменьшение количества жира не требует хирургических процедур, таких как липосакция.
Согласно одному варианту осуществления композиции по настоящему изобретению составлены так, чтобы они подходили для инъекции прямо в подвергаемый лечению участок нуждающегося в уменьшении количества жира пациента, без необходимости в хирургическом вмешательстве.
Согласно одному варианту осуществления нехирургический способ удаления жира не включает липосакцию, липопластику или липэктомию путем отсасывания жира.
Согласно одному варианту осуществления настоящее изобретение предусматривает композиции, способы и наборы для уменьшения подкожных жировых отложений, а также разглаживания дряблой кожи.
Композиция
Настоящее изобретение предусматривает композиции, полезные при нехирургическом уменьшении или удалении локализованных жировых отложений у нуждающихся в этом пациентов. Согласно одному варианту осуществления композиция содержит эффективное для лизиса жира количество одного или нескольких из холата и хенодезоксихолата. Согласно одному варианту осуществления композиции по настоящему изобретению полезны для лечения, среди прочего, локализованных жировых накоплений, включая образование грыжи жировой клетчатки, липодистрофию и жировые отложения, связанные с целлюлитом. Предпочтительно композиции по настоящему изобретению применяются таким образом, что не требуют хирургических процедур, таких как липосакция.
Согласно одному варианту осуществления настоящее изобретение предусматривает композицию биологически совместимых желчных кислот или их солей, включая одну или более фармакологически активную желчную кислоту и ее соль и фармацевтически приемлемые вспомогательные средства в водном носителе. В частности, в объеме настоящего изобретения существует вариант применения фармакологически активной желчной кислоты или ее соли для лизирования жира.
Несколько желчных кислот и их солей включены в настоящее изобретение. Например, желчные кислоты и их соли, охватываемые в настоящем изобретении, выбраны из холевой кислоты, хено