Способ получения 1-(1н-бензохромен-2-ил)-2,2,2-трифторэтанонов
Иллюстрации
Показать всеИзобретение относится к способу получения 1H-бензо[ƒ]хроменов из 1-[(диметиламино)метил]-2-нафтолов и 1,1,1-трифтор-4-морфолинобутен-3-она-2 в среде кипящей уксусной кислоты в мольном соотношении (1:1), которые являются перспективными исходными соединениями для синтеза фармакологически активных веществ. Технический результат - упрощение технологического процесса и удешевление производства, достигаемые за счет использования доступных 1,1,1-трифтор-4-морфолинобутен-3-она-2 и уксусной кислоты без необходимости использовать инертную атмосферу и катализаторы. 14 пр.
Реферат
Изобретение относится к способу получения 1H-бензо[ƒ]хроменов, содержащих во втором положении трифторацетильную группу. В настоящее время органические соединения фтора находят широкое применение в самых различных областях техники, сельском хозяйстве и медицине. Присутствие трифторметильной группы может существенно менять профиль биологической активности органических соединений, приводить к усилению терапевтического эффекта или появлению новых видов активности [1]. Большое прикладное значение фторорганических соединений диктует необходимость разработки новых доступных методов синтеза. Органические соединения, построенные на основе 4H-хроменов и содержащие атомы фтора, могут обладать рядом практически ценных свойств.
Данным изобретением решена задача разработки нового высокоэффективного способа получения замещенных 1H-бензо[ƒ]хроменов, содержащих трифторацетильную группу в положении 2.
Формула изобретения - способ получения 1-(1H-бензо[ƒ]хромен-2-ил)-2,2,2-трифторэтанонов конденсацией 1-[(диметиламино)метил]-2-нафтолов и 1,1,1-трифтор-4-морфолинбутен-3-она-2 в мольном соотношении 1:1 в среде кипящей уксусной кислоты.
В литературе представлено ограниченное число способов получения хроменил- и бензохроменил(арил)кетонов: сочетание бензиловых спиртов с дитиоацеталями кетенов [2], циклоприсоединение енаминов к предшественникам о-метиленхинонов [3, 4], присоединение С-нуклеофилов по Михаэлю к тозилалкилфенолам с последующей циклизацией [5], реакции 2-галогенбензилбромидов или 2-[гидрокси(фенил)метил]фенолов с 1,3-дикарбонильными соединениями [6-9], взаимодействие фенольных и нафтольных оснований Манниха с арил(этинил)кетонами [10], трехкомпонентная конденсация 1,3-дикетонов, 2-нафтола и ароматических альдегидов [11, 12], а также ацилирование мостиковых бензопиранов в присутствии трифлата алюминия(III) [13]. 4-Замещенные 3-ацетилхромены были получены из салициловых альдегидов или салицил-N-тозилиминов и кетонов ацетиленового ряда в присутствии DABCO [14, 15]. Следует отметить, что большинство из указанных методов не имеют общего характера, а синтез исходных соединений в ряде случаев представляет самостоятельную синтетическую задачу. Полученные ацилхромены, как правило, содержат заместители во 2-м и/или 4-м положении, что ограничивает круг возможных дальнейших превращений с их участием. В то же время среди ацилхроменов обнаружен ряд соединений, обладающих противораковой [14] и антибактериальной активностью [11], что свидетельствует об актуальности поиска новых методов их получения.
Наиболее близким по конечному результату к заявляемому способу является способ получения (2H-хромен-3-ил)(фенил)метанонов, основанный на катализируемом FeCl3 внутримолекулярном метатезисе алкиниловых эфиров салициловых альдегидов в кипящем абсолютном ацетонитриле. Выходы 3-ароил-4H-хроменов составляют 45-89% [16].
Способ заключается в том, что смесь 0.5 ммоль пропаргилового эфира салицилового альдегида и 0.08 ммоль безводного хлорида железа(III) в 3 мл сухого ацетонитрила нагревают при кипении 4 ч в атмосфере аргона в темноте. Растворитель отгоняют в вакууме и остаток очищают колоночной хроматографией.
Указанный способ обладает целым рядом существенных недостатков:
1. В качестве растворителя используется токсичный ацетонитрил, а сам процесс проводят в безводной среде в атмосфере аргона, что приводит к удорожанию процесса.
2. Требование проводить реакцию в темноте затрудняет контроль за ее протеканием.
3. Процесс является достаточно длительным, а выделение продукта из реакционной смеси трудоемким. Необходима очистка колоночной хроматографией на силикагеле.
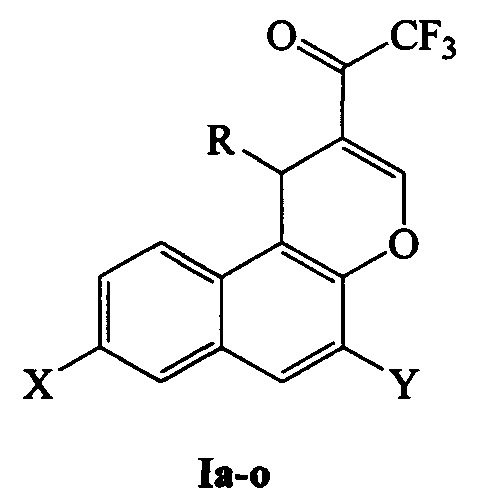
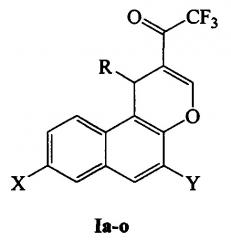
Полученный нами технический результат - более универсальный и менее трудоемкий способ синтеза 1-(1H-бензо[ƒ]хромен-2-ил)-2,2,2-трифторэтанонов, в том числе незамещенных по первому положению, общей формулы I:
где R, X, Y: Н, Н, Н (Ia); Ph, Н, Н (Iб); 2-тиенил, Н, Н (Iв); 3-NO2C6H4, Н, Н (Iг); 4-ClC6H4, Н, Н (Iд); 4-FC6H4, Н, Н (Ie); 3-ClC6H4, Н, Н (Iж); 3,4,5-СН3ОС6Н2, Н, Н (Iз); Н, Br, Н (Iи); Н, CN, Н (Iк); Н, (СН3)3С, Н (Iл); Н, 1-адамантил, Н (Iм); Н, Ph3C, Н (Iн); Н, (СН3)3С, (СН3)3С(Iо).
Технический результат достигается проведением реакции замещенных 1-[(диметиламино)метил]-2-нафтолов II:
где R, X, Y: H, H, Н (IIа); Ph, Н, Н (IIб); 2-тиенил, Н, Н (IIв); 3-NO2C6H4, Н, Н (IIг); 4-ClC6H4, Н, Н (IIд); 4-FC6H4, Н, Н (IIе); 3-ClC6H4, Н, Н (IIж); 3,4,5-СН3ОС6Н2, Н, Н (IIз); Н, Br, Н (IIи); Н, CN, Н (IIк); Н, (СН3)3С, Н (IIл); Н, 1-адамантил, Н (IIм); Н, Ph3C, Н (IIн); H,(CH3)3C, (CH3)3C (IIo).
с 1,1,1-трифтор-4-морфолинобутен-3-он-2 III:
Отличительные признаки:
1. Использование легко доступных оснований Манниха, содержащих как донорные, так и акцепторные группы в ароматическом заместителе и нафталиновом фрагменте.
2. Применение эквимолярных количеств реагентов и отсутствие какого-либо катализатора.
3. Использование в качестве растворителя уксусной кислоты.
4. Длительность протекания реакции обычно составляет 1-3 ч.
Заявляемое изобретение имеет следующие преимущества:
1. Распространение метода на синтез как незамещенных по метиленовому фрагменту 1-(1H-бензо[ƒ]хромен-2-ил)-2,2,2-трифторэтанонов, так и содержащих арильный заместитель в 1-ом положении.
2. Более высокие выходы конечных продуктов (в среднем 65%).
3. Для очистки конечного продукта обычно достаточно однократной перекристаллизации из этанола.
4. Синтез легко масштабируется.
5. Предлагаемый метод не предполагает использование инертной атмосферы, что существенно упрощает схему реактора, и не требует применения сложного и дорогостоящего оборудования.
Исходные основания Манниха нафталиновой серии IIа-о и 1,1,1-трифтор-4-морфолинобутен-3-он-2 III получены по описанным в литературе методикам [17, 18].
Примеры выполнения способа
ИК спектры записаны на спектрометре Shimadzu FTIR-8400S в таблетках KBr. Спектры ЯМР 1Н и 13С (400 и 100 МГц соответственно), а также DEPT зарегистрированы на спектрометре JEOL JNM-ECX400 в CDCl3. Измерения проводили без использования дополнительных эталонов с привязкой частоты к сигналу дейтерированного растворителя. Элементный анализ выполнен на автоматическом CHNS-анализаторе Euro Vector ЕА-3000. Температуры плавления определены капиллярным методом на приборе SRS OptiMelt МРА 100. Тонкослойная хроматография проведена на пластинах Silufol UV-254, проявление в УФ-свете и парах иода.
Пример 1.
1-(1H-Бензо[ƒ]хромен-2-ил)-2,2,2-трифторэтанон-1 (Iа). Смесь 0.29 г (1.43 ммоль) 1-[(диметиламино)метил]-2-нафтола (IIа) и 0.3 г (1.43 ммоль) 1,1,1-трифтор-4-морфолинобутен-3-она-2 (III) в 4 мл уксусной кислоты нагревали при кипении 2 ч. Смесь охлаждали до комнатной температуры. Выпавший осадок отфильтровывали и очищали перекристаллизацией из этанола. Выход 0.31 г (76%). Бесцветные кристаллы, т. пл. 112-114°C. ИК-спектр, ν, см-1: 3117, 2885, 1681, 1643, 1593, 1238, 1184, 1141, 921, 813, 748. Спектр ЯМР 1Н, δ, м. д. (J, Гц): 3.86 (2Н, с, СН2), 7.21 (1Н, д, J=8.9, Н-5), 7.52 (1Н, т, J=7.5) и 7.62 (1Н, т, J=7.3) (Н-8,9), 7.75 (1H, д, J=8.9, HAr), 7.85 (1Н, д, 7=8.9, HAr), 7.87 (1Н, д, J=8.9, HAr), 7.95 (1H, с, Н-3). Спектр ЯМР 13С, δ, м. д.: 19.6 (СН2), 110.4 (С), 112.2 (С), 116.6 (к, 1JC-F=288.9 Гц, CF3), 116.9 (СН), 122.9 (СН), 125.7 (СН), 127.5 (СН), 128.6 (СН), 129.0 (СН), 131.5 (С), 131.7 (С), 146.2 (С), 156.5 (к, 4JC-F=5.7 Гц, СН-3), 179.6 (к, 2JC-F=35.3 Гц, С=O). Вычислено для C15H9F3O2, %: С 64.75; Н 3.26. Найдено, %: С 64.88; Н 3.29.
Пример 2.
1-(1-Фенил-1H-бензо[ƒ]хромен-2-ил)-2,2,2-трифторэтанон-1 (Iб). Смесь 0.4 г (1.43 ммоль) 1-[(диметиламино)(фенил)метил]-2-нафтола (IIб) и 0.3 г (1.43 ммоль) 1,1,1-трифтор-4-морфолинобутен-3-она-2 (III) в 4 мл уксусной кислоты нагревали при кипении 1 ч. Смесь охлаждали до комнатной температуры. Выпавший осадок отфильтровывали и очищали перекристаллизацией из этанола. Выход 0.31 г (61%). Бесцветные кристаллы, т. пл. 139-141°С. ИК-спектр, ν, см-1: 3033, 2885, 1681, 1640, 1590, 1242, 1211, 1145, 824.
Спектр ЯМР 1Н, δ, м. д. (J, Гц): 5.71 (1Н, с, Н-1), 7.11 (1Н, т, J=7.3, HAr), 7.21 (2Н, т, J=7.6, HAr), 7.33-7.48 (5Н, м, HAr), 7.80 (2Н, д, J=8.6, HAr), 7.95 (1H, д, J=8.4, HAr), 8.02 (1H, с, Н-3). Спектр ЯМР 13С, δ, м. д.: 35.6 (СН-1), 116.3 (С), 116.5 (к, 1JC-F=288.9 Гц, CF3), 116.8 (СН), 123.6 (2СН), 125.5 (СН), 127.1 (СН), 127.5 (СН), 128.6 (2СН), 128.7 (2СН), 129.6 (СН), 131.0 (С), 132.1 (2С), 143.4 (С), 147.0 (С), 155.3 (к, 4JC-F=5.7 Гц, СН-3), 178.5 (к, 2JC-F=35.3 Гц, С=O). Вычислено для C21H13F3O2, %: С 71.19; Н 3.70. Найдено, %: С 71.03; Н 3.62.
Пример 3.
1-[1-(Тиофен-2-ил)-1H-бензо[ƒ]хромен-2-ил]-2,2,2-трифторэтанон-1 (Iв). Смесь 0.4 г (1.43 ммоль) 1-[(диметиламино)(2-тиенил)метил]-2-нафтола (IIв) и 0.3 г (1.43 ммоль) 1,1,1-трифтор-4-морфолинобутен-3-она-2 (III) нагревали в 4 мл уксусной кислоты при кипении 1 ч. Смесь охлаждали до комнатной температуры. Выпавший осадок отфильтровывали и очищали перекристаллизацией из этанола. Выход 0.43 г (83%). Бесцветные кристаллы, т. пл. 141-142°С. ИК-спектр, ν, см-1: 3062, 2916, 1685, 1643, 1589, 1238, 1211, 1138, 810. Спектр ЯМР 1Н, δ, м. д. (J, Гц): 6.06 (1H, с, Н-1), 6.80 (1H, т, J=4.1, Нтиофен), 6.87 (1Н, д, J=3.0, Нтиофен), 7.06 (1Н, д, J=5.0, Нтиофен), 7.36 (1H, д, J=8.9, HAr), 7.44-7.54 (2Н, м, HAr), 7.83 (2Н, д, J=5.0, HAr), 8.00-8.04 (2Н, м, HAr, Н-3). Спектр ЯМР 13С, δ, м. д.: 30.1 (СН-1), 115.9 (С), 116.6 (к, 1JC-F=288.9 Гц, CF3), 116.9 (СН), 123.3 (СН), 125.0 (СН), 125.8 (СН), 126.0 (СН), 126.7 (СН), 127.7 (СН), 128.8 (СН), 129.9 (СН), 131.0 (С), 132.0 (С), 146.9 (С), 155.8 (к, 4JC-F=5.7 Гц, СН-3), 178.7 (к, 2JC-F=35.3 Гц, С=O). Вычислено для C19H11F3O2S, %: С 63.33; Н 3.08; S 8.90. Найдено, %: С 63.40; Н 3.05; S 8.78.
Пример 4.
1-[1-(3-Нитрофенил)-1H-бензо[ƒ]хромен-2-ил]-2,2,2-трифторэтанон-1 (Iг). Смесь 0.46 г (1.43 ммоль) 1-[(диметиламино)(3-нитрофенил)метил]-2-нафтола (IIг) и 0.3 г (1.43 ммоль) 1,1,1-трифтор-4-морфолинобутен-3-она-2 (III) в 4 мл уксусной кислоты нагревали при кипении 3 ч. Смесь охлаждали до комнатной температуры. Выпавший осадок отфильтровывали и очищали перекристаллизацией из этанола. Выход 0.29 г (50%). Светло-желтые кристаллы, т. пл. 150-152°С. ИК-спектр, ν, см-1: 3086, 2924, 1693, 1639, 1589, 1531 (NO2), 1354 (NO2), 1242, 1207, 1138, 821. Спектр ЯМР 1Н, δ, м. д. (J, Гц): 5.82 (1Н, с, Н-1), 7.39-7.51 (4Н, м, HAr), 7.77 (1Н, д, J=7.8, HAr), 7.82-7.88 (3Н, м, HAr), 7.99 (1H, ддд, J=8.2, J=2.3, J=0.9, HAr), 8.08 (1Н, с, Н-3), 8.13 (1H, т, J=1.8, HAr). Спектр ЯМР 13С, δ, м. д.: 35.5 (СН-1), 114.6 (С), 114.8 (С), 116.4 (к, lJC-F=288.9 Гц, CF3), 117.0 (СН), 122.4 (СН), 123.0 (СН), 123.5 (СН), 125.9 (СН), 127.9 (СН), 129.0 (СН), 129.5 (СН), 130.48 (С), 130.55 (СН), 132.2 (С), 134.8 (СН), 145.3 (С), 147.0 (С), 148.6 (С), 156.0 (к, 4JC-F=5.7 Гц, СН-3), 178.7 (к, 2JC-F=35.3 Гц, С=O). Вычислено для C21H12F3NO4, %: С 63.16; Н 3.03; N 3.51. Найдено, %: С 63.27; Н 2.96; N 3.42.
Пример 5.
1-[1-(4-Хлорфенил)-1H-бензо[ƒ]хромен-2-ил]-2,2,2-трифторэтанон-1 (Iд). Смесь 0.44 г (1.43 ммоль) 1-[(диметиламино)(4-хлорфенил)метил]-2-нафтола (IIд) и 0.3 г (1.43 ммоль) 1,1,1-трифтор-4-морфолинобутен-3-она-2 (III) в 4 мл уксусной кислоты нагревали при кипении 3 ч. Смесь охлаждали до комнатной температуры. Выпавший осадок отфильтровывали и очищали перекристаллизацией из этанола. Выход 0.34 г (61%). Бесцветные кристаллы, т. пл. 144-146°С. ИК-спектр, ν, см-1: 3025, 2883, 1683, 1640, 1592, 1241, 1211, 1145, 819. Спектр ЯМР 1Н, δ, м. д. (J, Гц): 5.68 (1Н, с, Н-1), 7.18 (2Н, д, J=8.5, HAr), 7.28 (2Н, д, J=8.5, HAr), 7.37 (1Н, д, J=8.9, HAr), 7.41-7.49 (2Н, м, HAr), 7.81 (2Н, д, J=8.8, HAr), 7.87 (1H, д, J=8.5, HAr), 8.03 (1Н, с, Н-3). Спектр ЯМР 13С, δ, м. д.: 35.1 (СН-1), 115.3 (С), 115.7 (С), 116.5 (к, 1JC-F=288.9 Гц, CF3), 116.8 (СН), 123.4 (СН), 125.7 (СН), 127.6 (СН), 128.8 (2СН), 129.9 (СН), 130.0 (2СН), 130.8 (С), 132.1 (С), 132.9 (С), 141.9 (С), 146.9 (С), 155.5 (к, 4JC-F=5.7 Гц, СН-3), 178.7 (к, 2JC-F=35.3 Гц, С=O). Вычислено для C21H12ClF3O2, %: С 64.88; Н 3.11. Найдено, %: С 64.95; Н 3.13.
Пример 6.
1-[1-(4-Фторфенил)-1H-бензо[ƒ]хромен-2-ил]-2,2,2-трифторэтанон-1 (Iе). Смесь 0.42 г (1.43 ммоль) 1-[(диметиламино)(4-фторфенил)метил]-2-нафтола (IIе) и 0.3 г (1.43 ммоль) 1,1,1-трифтор-4-морфолинобутен-3-она-2 (III) в 4 мл уксусной кислоты нагревали при кипении 3 ч. Смесь охлаждали до комнатной температуры. Выпавший осадок отфильтровывали и очищали перекристаллизацией из изопропанола. Выход 0.35 г (65%). Бесцветные кристаллы, т. пл. 198-200°С. ИК-спектр, ν, см-1: 3059, 1685, 1641, 1589, 1504, 1244, 1213, 1157,1132, 927, 813, 742, 725. Спектр ЯМР 1Н, δ, м. д. (J, Гц): 5.69 (1Н, с, Н-1), 6.89 (2Н, т, J=8.7, HAr), 7.28-7.33 (2Н, м, HAr), 7.37 (2Н, д, J=9.2, HAr), 7.40-7.49 (2Н, м, HAr), 7.81 (2Н, д, J=8.5, HAr), 7.89 (2Н, д, J=8.2, HAr), 8.01 (1H, с, Н-3). Спектр ЯМР 13С, δ, м. д.: 34.9 (СН-1), 115.5 (д, 2JC-F=21.0 Гц, 2СН), 115.6 (С), 116.0 (С), 116.5 (к, lJC-F=289.8 Гц, CF3), 116.8 (СН), 123.4 (СН), 125.7 (СН), 127.6 (СН), 128.8 (СН), 129.8 (СН), 130.2 (д, 3JC-F=7.6 Гц, 2СН), 130.8 (С), 132.1 (C), 139.2 (С), 146.9 (С), 155.4 (к, 4JC-F=5.7 Гц, СН-3), 161.7 (д, 1JC-F=244.1 Гц, CF), 178.7 (к, 2JC-F=35.3 Гц, С=O). Вычислено для C21H12F4O2, %: С 67.75; Н 3.25. Найдено, %: С 67.80; Н 3.20.
Пример 7.
1-(1-[(3-Хлорфенил)-1H-бензо[ƒ]хромен-2-ил]-2,2,2-трифторэтанон-1 (Iж). Смесь 0.44 г (1.43 ммоль) 1-[(диметиламино)(3-хлорфенил)метил]-2-нафтола (IIж) и 0.3 г (1.43 ммоль) 1,1,1-трифтор-4-морфолинобутен-3-она-2 (III) в 4 мл уксусной кислоты нагревали при кипении 3 ч. Смесь охлаждали до комнатной температуры. Выпавший осадок отфильтровывали и очищали перекристаллизацией из изопропанола. Выход 0.3 г (54%). Бесцветные кристаллы, т. пл. 143-145°С. ИК-спектр, ν, см-1: 3067, 2924, 1686, 1639,1589, 1466, 1242, 1207, 1165, 1142, 934, 848, 814. Спектр ЯМР 1H, δ, м. д. (J, Гц): 5.68 (1Н, с, Н-1), 7.09 (1H, д, J=8.0, HAr), 7.16 (1Н, тд, J=7.3, J=2.0, HAr), 7.25-7.29 (2Н, м, HAr), 7.38 (1H, дд, J=8.9, J=2.0, HAr), 7.42-7.51 (2Н, м, HAr), 7.82 (2Н, д, J=8.7 Гц, HAr), 7.88 (1H, д, J=8.0, HAr), 8.03 (1Н, с, Н-3). Спектр ЯМР 13С, δ, м. д.: 35.3 (СН-1), 115.1 (С), 115.5 (С), 116.5 (к, 1JC-F=288.9 Гц, CF3), 116.9 (СН), 123.3 (СН), 125.7 (СН), 127.0 (СН), 127.5 (СН), 127.7 (СН), 128.7 (СН), 128.8 (СН), 129.8 (СН), 130.0 (СН), 130.8 (С), 132.1 (С), 134.6 (С), 145.2 (С), 147.0 (С), 155.6 (к, 4JC-F=5.7 Гц, СН-3), 178.6 (к, 2JC-F=35.3 Гц, С=O). Вычислено для C21H12ClF3O2, %: С 64.88; Н 3.11. Найдено, %: С 64.74; Н 3.03.
Пример 8.
1-[1-(3,4,5-Триметоксифенил)-1H-бензо[ƒ]хромен-2-ил]-2,2,2-трифторэтанон-1 (Iз). Смесь 0.53 г (1.43 ммоль) 1-[(диметиламино)(3,4,5-триметоксифенил)метил]-2-нафтола (IIз) и 0.3 г (1.43 ммоль) 1,1,1-трифтор-4-морфолинобутен-3-она-2 (III) в 4 мл уксусной кислоты нагревали при кипении 1 ч. Смесь охлаждали до комнатной температуры. Выпавший осадок отфильтровывали и очищали перекристаллизацией из изопропанола. Выход 0.36 г (56%). Бесцветные кристаллы, т. пл. 157-159°С. ИК-спектр, ν, см-1: 3064, 2997, 2938, 2837, 1692, 1644, 1616, 1591, 1504, 1464, 1240, 1201, 1169, 1126, 999, 929, 819. Спектр ЯМР 1Н, δ, м. д. (J, Гц): 3.74 (9Н, с, 3CH3O), 5.65 (1Н, с, Н-1), 6.51 (2Н, с, HAr), 7.37 (1Н, д, J=8.9, HAr), 7.42-7.51 (2Н, м, HAr), 7.79-7.85 (2Н, м, HAr), 7.96 (1H, д, J=8.2, HAr), 8.00 (1Н, с, Н-3). Спектр ЯМР 13С, δ, м. д.: 35.6 (СН-1), 56.2 (2OCH3), 60.8 (ОСН3), 105.8 (2СН), 115.6 (С), 116.1 (С), 116.5 (к, 1JC-F=289.4 Гц, CF3), 116.7 (СН), 123.6 (СН), 125.7 (СН), 127.5 (СН), 128.7 (СН), 129.7 (СН), 131.1 (С), 132.1 (С), 137.0 (С), 139.0 (С), 147.0 (С), 153.2 (2С), 155.4 (к, 4JC-F=5.7 Гц, СН-3), 178.8 (к, 2JC-F=35.3 Гц, С=O). Вычислено для C24H19F3O5, %: С 64.86; Н 4.31. Найдено, %: С 64.99; Н 4.22.
Пример 9.
1-(8-Бром-1H-бензо[ƒ]хромен-2-ил)-2,2,2-трифторэтанон-1 (Iи). Смесь 0.4 г (1.43 ммоль) 6-бром-1-[(диметиламино)метил]-2-нафтола (IIи) и 0.3 г (1.43 ммоль) 1,1,1-трифтор-4-морфолинобутен-3-она-2 (III) в 4 мл уксусной кислоты нагревали при кипении 1 ч. Смесь охлаждали до комнатной температуры. Выпавший осадок отфильтровывали и очищали перекристаллизацией из этанола. Выход 0.37 г (71%). Светло-желтые кристаллы, т. пл. 173-174°С. ИК-спектр, ν, см-1: 3117, 3082, 2905, 1690, 1647, 1612, 1585, 1501, 1354, 1238, 1203, 1172, 1130, 1076, 968, 922, 864, 806, 729. Спектр ЯМР 1Н, δ, м. д. (J, Гц): 3.77 (2Н, с, СН2), 7.21 (1Н, д, J=8.9, HAr), 7.63 (1H, д, J=8.7, HAr), 7.65-7.70 (2Н, м, HAr), 7.92 (1Н, с, HAr), 7.97 (1H, с, Н-3). Спектр ЯМР 13С, δ, м. д.: 19.5 (СН2), 110.3(C), 112.5 (С), 116.6 (к, 1JC-F=288.9 Гц, CF3), 118.1 (СН), 119.8 (С), 124.6 (СН), 128.1 (СН), 130.2 (С), 130.5 (СН), 130.8 (СН), 132.4 (С), 146.3 (С), 156.2 (к, 4JC-F=5.7 Гц, СН-3), 179.5 (к, 2JC-F=35.6 Гц, С=O). Вычислено для C15H8BrF3O2, %: С 50.45; Н 2.26. Найдено, %: С 50.30; Н 2.16.
Пример 10.
2-(2,2,2-Трифторацетил)-1H-бензо[ƒ]хромен-8-карбонитрил (Iк). Смесь 0.32 г (1.43 ммоль) 5-[(диметиламино)метил]-6-гидроксинафталин-2-карбонитрила (IIк) и 0.3 г (1.43 ммоль) 1,1,1-трифтор-4-морфолинобутен-3-она-2 (III) в 3 мл уксусной кислоты нагревали при кипении 1 ч. Смесь охлаждали до комнатной температуры. Выпавший осадок отфильтровывали и очищали перекристаллизацией из изопропанола. Выход 0.2 г (45%). Бесцветные кристаллы, т. пл. 210-213°С. ИК-спектр, ν, см-1: 3113, 2224, 1684, 1641, 1595, 1585, 1468, 1394, 1240, 1209, 1190, 1132, 891, 814, 735. Спектр ЯМР 1Н, δ, м. д. (J, Гц): 3.87 (2Н, с, СН2), 7.34 (1Н, д, J=8.9, HAr), 7.76 (1Н, д, J=8.7, HAr), 7.83 (1Н, д, J=8.7, HAr), 7.95 (1Н, с, HAr), 7.96 (1H, д, J=8.9, HAr), 8.22 (1H, с, Н-3). Спектр ЯМР 13С, δ, м. д.: 19.6 (СН2), 109.4 (С), 110.5 (С), 112.76 (С), 112.8 (С), 116.8 (к, lJC-F=288.9 Гц, CF3), 118.9 (С), 119.0 (СН), 124.2 (СН), 128.2 (СН), 129.6 (СН), 130.4 (С), 133.4 (С), 134.3 (СН), 148.4 (С), 155.9 (к, 4JC-F=5.7 Гц, СН-3), 179.4 (к, 2JC-F=35.6 Гц, С=O). Вычислено для C16H8F3NO2, %: С 63.37; Н 2.66; N 4.62. Найдено, %: С 63.49; Н 2.60; N 4.51.
Пример 11.
1-(8-трет-Бутил-1H-бензо[ƒ]хромен-2-ил)-2,2,2-трифторэтанон-1 (Iл). Смесь 0.51 г (1.43 ммоль) 6-трет-бутил-1-[(диметиламино)метил]-2-нафтола (IIл) и 0.3 г (1.43 ммоль) 1,1,1-трифтор-4-морфолинобутен-3-она-2 (III) в 4 мл уксусной кислоты нагревали при кипении 1 ч. Смесь охлаждали до комнатной температуры. Выпавший осадок отфильтровывали и очищали перекристаллизацией из этанола. Выход 0.36 г (75%). Бесцветные кристаллы, т. пл. 120-121°С. ИК-спектр, ν, см-1: 3078, 2963, 2874, 1689, 1647, 1601, 1585, 1470, 1396, 1308, 1269, 1219, 1200, 1169, 1134, 906, 733. Спектр ЯМР 1H, δ, м. д. (J, Гц): 1.43 (9Н, с, 3СН3), 3.83 (2Н, с, СН2), 7.18 (1Н, д, J=8.9, Н-5), 7.70-7.73 (2Н, м, HAr), 7.78 (1Н, с, HAr), 7.81 (1H, д, J=8.9, HAr), 7.95 (1Н, с, Н-3). Спектр ЯМР 13С, δ, м. д.: 19.5 (СН2), 31.3 (3СН3), 34.9 (С), 110.4 (С), 111.9 (С), 116.7 (к, 1JC-F=288.9 Гц, CF3), 116.7 (СН), 122.7 (СН), 123.7 (СН), 126.3 (СН), 128.9 (СН), 129.7 (С), 131.4 (С), 145.8 (С), 148.6 (С), 156.5 (к, 4VC-F=5.7 Гц, СН-3), 179.6 (к, 2JC-F=35.3 Гц, С=O). Вычислено для C19H17F3O2, %: С 68.26; Н 5.13. Найдено, %: С 68.31; Н 5.06.
Пример 12.
1-[8-(1-Адамантил)-1H-бензо[ƒ]хромен-2-ил]-2,2,2-трифторэтанон-1 (Iм). Смесь 0.48 г (1.43 ммоль) 6-(1-адамантал)-1-[(диметиламино)метил]-2-нафтола (IIм) и 0.3 г (1.43 ммоль) 1,1,1-трифтор-4-морфолинобутен-3-она-2 (III) в 8 мл уксусной кислоты нагревали при кипении 1 ч. Смесь охлаждали до комнатной температуры. Выпавший осадок отфильтровывали и очищали перекристаллизацией из изопропанола. Выход 0.5 г (84%). Бесцветные кристаллы, т. пл. 150-152°С. ИК-спектр, ν, см-1: 3059, 2904 (CAd-H), 2851 (CAd-Н), 1686, 1647, 1593, 1219, 1173, 1138, 906, 802. Спектр ЯМР 1Н, δ, м. д. (J, Гц): 1.78-1.85 (6Н, м, СН2 Ad), 1.98-2.02 (6Н, м, СН2 Ad), 2.15 (3Н, уш. с, CHAd), 3.84 (2Н, с, Н-1), 7.18 (1Н, д, J=8.9, HAr), 7.69-7.73 (3Н, м, HAr), 7.82 (1Н, д, J=8.7, HAr), 7.95 (с, Н-3). Спектр ЯМР 13С, δ, м. д.: 19.6 (СН2), 29.0 (3CHAd), 36.4 (CAd), 36.9 (3СН2 Ad), 43.2 (3СН2 Ad), 110.4 (С), 111.9 (С), 116.7 (СН), 116.8 (к, 1JC-F=290.0 Гц, CF3), 122.7 (СН), 123.7 (СН), 125.8 (СН), 129.1 (СН), 129.9 (С), 131.5 (С), 145.8 (С), 148.9 (С), 156.7 (к, 4JC-F=5.7 Гц, СН-3), 179.7 (к, 2JC-F=35.0 Гц, С=O). Вычислено для C25H23F3O2, %: С 72.80; Н 5.62. Найдено, %: С 72.67; Н 5.57.
Пример 13.
1-(8-Тритил-1H-бензо[ƒ]хромен-2-ил)-2,2,2-трифторэтанон-1 (Iн). Смесь 0.63 г (1.43 ммоль) 6-тритил-1-[(диметиламино)метил]-2-нафтола (IIн) и 0.3 г (1.43 ммоль) 1,1,1-трифтор-4-морфолинобутен-3-она-2 (III) в 4 мл уксусной кислоты нагревали при кипении 1 ч. Смесь охлаждали до комнатной температуры. Выпавший осадок отфильтровывали и очищали перекристаллизацией из изопропанола. Выход 0.5 г (67%). Бесцветные кристаллы, т. пл. 119-121°С. ИК-спектр, ν, см-1: 3028, 1688, 1645, 1595, 1585, 1491, 1240, 1190, 1171, 1138, 922, 847, 824, 752, 741, 700. Спектр ЯМР 1Н, δ, м. д. (J, Гц): 3.81 (2Н, с, СН2), 7.16 (1H, д, J=8.7, HAr), 7.20-7.31 (15Н, м, HAr), 7.39 (1H, дд, J=8.9, J=2.0, HAr), 7.61 (1Н, д, J=9.0, HAr), 7.68 (1Н, д, J=9.0, HAr), 7.77 (1Н, д, J=1.8, HAr), 7.95 (1H, с, Н-3). Спектр ЯМР 13С, δ, м. д.: 19.5 (СН2), 65.0 (CPh3), 110.4 (С), 112.1 (С), 116.7 (к, 1JC-F=289.9 Гц, CF3), 116.8 (СН), 121.8 (СН), 126.2 (3CHPh), 127.8 (6CHPh), 128.9 (СН), 129.4 (СН), 129.9 (С), 130.9 (С), 131.3 (6CHPh), 132.4 (СН), 144.5 (С), 146.4 (4С), 156.5 (к, 4JC-F=5.7 Гц, СН-3), 179.5 (к, 2JC-F=35.0 Гц, С=O). Вычислено для C34H23F3O2, %: С 78.45; Н 4.45. Найдено, %: С 78.33; Н 4.36.
Пример 14.
1-(5,8-ди-трет-Бутил-1H-бензо[ƒ]хромен-2-ил)-2,2,2-трифторэтанон-1 (Io). Смесь 0.45 г (1.43 ммоль) 3,6-ди-трет-бутил-1-[(диметиламино)метил]-2-нафтола (IIо) и 0.3 г (1.43 ммоль) 1,1,1-трифтор-4-морфолинобутен-3-она-2 (III) в 5 мл уксусной кислоты нагревали при кипении 1 ч. Смесь охлаждали до комнатной температуры. Выпавший осадок отфильтровывали и очищали перекристаллизацией из этанола. Выход 0.33 г (58%). Бесцветные кристаллы, т. пл. 144-146°С. ИК-спектр, ν, см-1: 2957, 2912, 2872, 1708, 1659, 1584, 1572, 1558, 1258, 1200, 1175, 1148, 1138, 916, 735. Спектр ЯМР 1Н, δ, м. д. (J, Гц): 1.42 (9Н, с, 3СН3), 1.50 (9Н, с, 3СН3), 3.87 (2Н, с, СН2), 7.66 (1H, д, J=9.0, HAr), 7.69 (1H, с, HAr), 7.76 (1Н, с, HAr), 7.78 (1Н, д, 7=9.2, HAr), 8.03 (1Н, с, Н-3). Спектр ЯМР 13С, δ, м. д.: 19.7 (СН2), 30.3 (СН3), 31.3 (3СН3), 34.9 (Ct-Bu), 35.3 (Ct-Bu), 110.2 (С), 112.5 (С), 116.7 (к, 1JC-F=288.9 Гц, CF3), 122.3 (СН), 123.7 (СН), 125.5 (СН), 125.6 (СН), 128.5 (С), 130.9 (С), 137.7 (С), 145.6 (С), 148.6 (С), 155.5 (к, 4JC-F=5.7 Гц, СН-3), 179.5 (к, 2JC-F=35.3 Гц, С=O). Вычислено для C23H25F3O2, %: С 70.75; Н 6.45. Найдено, %: С 70.70; Н 6.48.
Литература
[1] Bassetto М., Ferla S., Pertusati F. Polyfluorinated groups in medicinal chemistry // Future Med. Chem., 2015, V. 7, pp. 527-546.
[2] Liang D., Wang M., Bekturhun В., Xiong В., Liu Q. One-pot synthesis of polyfunctionalized 4H-chromene and dihydrocoumarins based on copper(II) bromide-catalyzed C-C coupling of benzylic alcohols with ketene dithioacetals // Adv. Synth. Catal., 2010, V. 352, pp. 1593-1599.
[3] L. A new general approach to the synthesis of functionalized 4H-chromenes // Synthesis, 1989, pp. 69-70.
[4] Jones R.M., Selenski C., Pettus T.R.R. Rapid syntheses of benzopyrans from o-OBOC salicylaldehydes and salicyl alcohols: a three-component reaction // J. Org. Chem., 2002, V. 67, pp. 6911-6915.
[5] Wu В., Gao X., Yan Z., Huang W.-X., Zhou Y.-G. Enantioselective synthesis of functionalized 2-amino-4H-chromenes via the o-quinone methides generated from 2-(1-tosylalkyl)phenols // Tetrahedron Lett., 2015, V. 56, pp. 4334-4338.
[6] Zhang X.Y., Fang L.L., Liu N., Wu H.Y., Fan X.S. Copper-catalyzed tandem reaction of 2-bromobenzyl bromides with 1,3-dicarbonyl compounds leading to 4H-chromenes // Chin. Chem. Lett., 2012, V. 23, pp. 1129-1132.
[7] Funabiki K., Komeda Т., Kubota Y., Matsui M. acid ionic liquid-catalyzed direct benzylation, allylation and propargylation of 1,3-dicarbonyl compounds with alcohols as well as one-pot synthesis of 4H-chromenes // Tetrahedron, 2009, V. 65, pp. 7457-7463.
[8] Bunce R.A., Rogers D., Nago Т., Bryant S.А. 4H-1-Benzopyrans by a tandem SN2-SNAr reaction // J. Heterocyclic Chem., 2008, V. 45, pp. 547-550.
[9] Aoyama Т., Yamamoto Т., Miyota S., Hayakawa M., Takido Т., Kodomari M. One-pot synthesis of 4H-chromenes by tandem benzylation and cyclization in the presence of sodium bisulfate on silica gel // Synlett, 2014, V. 25, pp. 1571-1576.
[10] Balasubramanian K.K., Selvaraj S. Studies in phenolic Mannich bases - reaction with acetylenes // Tetrahedron Lett., 1980, V. 21, pp. 851-852.
[11] Akondi A.M., Kantam M.L., Trivedi R., Sreedhar В., Buddana S.K., Prakasham R.S., Bhargava S. Formation of benzoxanthenones and benzochromenones via cerium-impregnated-MCM-41 catalyzed, solvent-free, three-component reaction and their biological evaluation as anti-microbial agents // J. Mol. Catal. A: Chem., 2014, V. 386, pp. 49-60.
[12] Sandaroos R., Damavandi S. Ultrasound-assisted one-pot synthesis of disubstituted and trisubstituted 1H-benzo[ƒ]chromene derivatives catalyzed by 4-nitro-2,6-diacetylpyridinebis(2,4,6-trimethylaniline)FeCl2 // Res. Chem. Intermed., 2013, V. 39, pp. 4167-4174.
[13] Simelane S.В., Kinfe H.H., Muller A., Williams D.B.G. Aluminum triflate catalyzed tandem reactions of D-galactal: toward chiral benzopyrans, chromenes, and chromans // Org. Lett., 2014, V. 16, pp. 4543-4545.
[14] Singh S.N., Bopanni R., Jayaprakash S., Reddy K.V., Ashfaq M.A., Kumar K.S., Pal M. Reactions of salicylaldehydes with activated terminal alkynes in aqueous media: synthesis of 3-substituted 4-hydroxy chromenes as potential cytotoxic agents // RSC Adv., 2014, V. 4, pp. 24870-24873.
[15] Shi Y.-L., Shi M. Synthesis of substituted chromenes through the DABCO-catalyzed reaction of but-3-yn-2-one and methyl propiolate with salicyl N-tosylimines (DABCO = 1,4-diazabicyclo[2.2.2]octane) // Chem. Eur. J., 2006, V. 12, pp. 3374-3378.
[16] Rhee J.U., Krische M.J. Alkynes as synthetic equivalents to stabilized Wittig reagents: intra- and intermolecular carbonyl olefinations catalyzed by Ag(I), BF3, and HBF4 // Org. Lett., 2005, V. 7, pp. 2493-2495.
[17] Vdovenko I.S., Gerus I.I., Gorbunova M.G. Kinetics of reaction of β-alkoxyvinyltrifluoromethyl ketones with nucleophiles containing amino groups // J. Fluorine Chem., 1997, V. 82, pp. 167-169.
[18] Осипов Д.В., Осянин В.А., Климочкин Ю.Н. Новый метод синтеза 3-амино-1H-бензо[ƒ]хромен-2-карбонитрилов // Журн. органич. химии, 2013, т. 49, с. 412-415.
Способ получения 1-(1H-бензохромен-2-ил)-2,2,2-трифторэтанонов реакцией замещенных 1-[(диметиламино)метил]-2-нафтолов с 1,1,1-трифтор-4-морфолинобутен-3-оном-2 в среде кипящей уксусной кислоты в мольном соотношении (1:1).