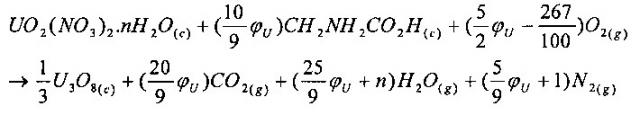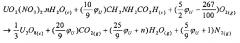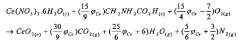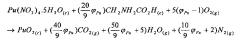Способ получения порошка, включающего твердый раствор диоксида урана и диоксида по меньшей мере одного другого актинида и/или лантанида
Иллюстрации
Показать всеИзобретение относится к способу получения порошка, включающего твердый раствор диоксида урана и диоксида по меньшей мере одного другого актинида и/или лантанида, который подходит для использования в изготовлении ядерного топлива. Способ включает стадию сжигания раствора, включающего нитрат уранила, по меньшей мере один нитрат другого актинида и/или лантанида, и азотсодержащее топливо, которым является глицин, с получением твердого раствора, причем топливо используют в предопределенном сверхстехиометрическом количестве по отношению к нитрату уранила, в результате осуществления следующих операций: a) операция определения уравнения сгорания нитрата уранила, в котором стехиометрическому коэффициенту азотсодержащего топлива приписывают фактор ϕU; b) операция определения сверхстехиометрического количества азотсодержащего топлива (так называемое QU) путем умножения известного количества нитрата уранила на стехиометрический коэффициент азотсодержащего топлива и на фактор ϕU, где фактор имеет значение выше 1, предпочтительно от 1,5 до 1,7; c) операция определения уравнения сгорания нитрата другого актинида и/или лантанида, в котором стехиометрическому коэффициенту азотсодержащего топлива приписывают фактор ϕAn/Ln; d) операция определения количества азотсодержащего топлива (так называемое QAn/Ln) путем умножения известного количества нитрата другого элемента на стехиометрический коэффициент азотсодержащего топлива и на фактор ϕAn/Ln, причем фактор имеет значение ниже 2; и e) операция сложения по меньшей мере количеств азотсодержащего топлива, определенных в операциях b) и d) (а именно, QU и QAn/Ln). Изобретение обеспечивает эффективное получение смешанных оксидов в одну стадию. 8 з.п. ф-лы, 3 ил., 3 пр.
Реферат
Область техники, к которой относится изобретения
Изобретение относится к новому способу получения порошка, включающего твердый раствор диоксида урана и диоксида по меньшей мере одного другого элемента актиноидного и/или лантаноидного ряда, из раствора нитратов, причем вышеупомянутый порошок подходит для использования в изготовлении ядерного топлива, такого как топливо СОЯТ (смешанное оксидное ядерное топливо, англ. «Mixed OXide Fuel» или МОХ).
Из-за использования растворов нитратов данный способ может быть включен в более общий процесс рециркуляции использованного топлива, предполагающий использование стадии растворения топлива в азотной кислоте для получения нитратов.
Более конкретно, описываемый способ может быть включен в способ рециркуляции плутония, и даже минорных актинидов, из использованного топлива на основе урана.
Уровень техники
В странах, выбравших закрытый цикл, плутоний, происходящий из использованного топлива на основе урана, рециркулируют в промышленном масштабе, чтобы изготавливать топливо на основе смешанных оксидов урана и плутония, называемое СОЯТ, и предназначенное для легководных реакторов (известных под сокращением РЛВ, англ. «light water reactors» или LWR).
Базовыми материалами для изготовления ядерных топлив являются порошки оксидов, предназначенные для прессования, последующего спекания и, в случае необходимости, шлифования, чтобы получить гранулы ядерного топлива.
Таким образом, для изготовления топлива использованные порошки должны отвечать специфическим характеристикам. Они должны иметь особенно хорошую сыпучесть, хорошие характеристики сжимаемости и способность к уплотнению при обжиге. Кроме того, важным критерием качества окончательных свойств гранул является однородность распределения различных химических элементов (в данном случае, урана и плутония в СОЯТ) в порошке, использованном для изготовления гранул, так чтобы эта же однородность имела место в гранулах топлива. Действительно, высокая однородность в распределении элементов внутри гранул является, с одной стороны, весьма благоприятной характеристикой топлива (особенно, когда идет речь о СОЯТ) в реакторе, особенно в перспективе роста скорости сжигания, а с другой стороны облегчает полное растворение материала в начале операций обработки использованного топлива или в ходе рециркуляции отходов изготовления, при условии, что эту рециркуляцию осуществляют мокрым способом.
В случае смешанного топлива на основе оксида плутония, например топлива типа СОЯТ, составление этого топлива механическим смешиванием порошков простых оксидов (для СОЯТ, порошка UO2 и порошка PuO2) требует усиленных мер защиты для контроля проблем распространения, особенно выраженных в случае использования простого оксида плутония. Кроме того, основываясь на механической смеси порошков простых оксидов, оказывается затруднено получение однородной смеси порошков с учетом распределения этих элементов.
Для обхода этих неудобств ставится вопрос о прямом получении стартового материала в форме смешанных оксидов, например (U, Pu)O2, особенно когда получают смеси химических элементов до изготовления указанных оксидов, что имеет место, когда эти смешанные оксиды получают способами соконверсии (называемыми также способами осаждения-прокаливания).
Среди уже применяемых способов соконверсии можно указать оксалатный способ соосаждения, карбонатный способ соосаждения или еще аммиачный способ соосаждения.
Для оксалатного способа соосаждения, как описано в патенте FR 0451058, уран U(VI) и плутоний Pu(IV) предварительно восстанавливают в U(IV) и Pu(III). К возникающей в результате смеси добавляют щавелевую кислоту, что дает осадок оксалата U(IV)/Pu(III), однородный с точки зрения распределения химических элементов. Осадок после разделения прокаливают в инертной атмосфере, что приводит к образованию полностью однородного смешанного оксида, который может иметь вид твердого раствора.
В случае карбонатного способа соосаждения, как описано в Transactions of the American Nuclear Society, 40 (1982), 50-52, способ состоит из конверсии в смешанный оксид смеси ионов уранила и плутония, присутствующих в растворе азотной кислоты, включающий соосаждение ионов уранила и плутония в форме осадка карбоната урана и плутония и прокаливание указанного осадка. Более конкретно, первоначальная стадия заключается в нагреве нитратного раствора уранила и плутония (IV) для того, чтобы превратить плутоний Pu(IV) в плутоний (VI). Концентрацию в азотной кислоте этого раствора затем доводят до приблизительно 1М сухой дистилляцией с последующим повторным растворением остатка в 1М азотной кислоте. Возникающий в результате раствор затем доводят до температуры 60°С и вводят диоксид углерода и аммиак, чтобы получить осадок в форме карбоната в интервале рН от 7 до 9. Осадок после разделения, наконец, прокаливают в контролируемой атмосфере (N2-3%Н2), посредством чего получают смешанный оксид в форме твердого раствора.
Для аммиачного способа соосаждения аммиак добавляют к первоначальному раствору урана и плутония, предварительно приведенного к температуре 50°С, посредством чего раствор образует соосадок. После разделения и сушки осадок прокаливают в восстановительной атмосфере, что приводит к образованию относительно однородного смешанного оксида урана и плутония.
Таким образом, в качестве резюме, можно отметить, что вышеупомянутые способы соконверсии включают, как минимум, три стадии:
- стадию образования смешанного осадка из раствора, включающего соли урана;
- стадию отделения указанного осадка от раствора; и
- стадию прокаливания отделенного осадка в контролируемой атмосфере.
Среди уже используемых способов соконверсии можно упомянуть также способы термического соденитрования. Для этих способов первоначальный раствор нитрата уранила и плутония испаряют, затем термически денитруют, чтобы получить смесь оксидов (UO3+PuO2 или U3O8+PuO2) в форме порошка. Этот порошок затем подвергают новой термической обработке в восстановительной атмосфере, чтобы получить смешанный оксид урана и плутония в форме диоксидов UO2+PuO2.
Таким образом, эти вышеупомянутые способы термического соденитрования включают, как минимум, две стадии:
- стадию образования смеси оксидных фаз, где фаза урана не является фазой диоксида;
- дополнительную стадию обработки при высокой температуре в восстановительной атмосфере, чтобы получить вышеупомянутый смешанный оксид урана и плутония.
Были исследованы и другие пути синтеза порошков смешанных оксидов, включая, в особенности, синтез смешанных оксидов сжиганием раствора, который также известен под именем синтеза самораспространяющимся сжиганием.
Обычно, синтез смешанных оксидов сжиганием раствора предполагает использование смеси нитратов металлических элементов, которые одновременно служат окислителем топлива и источником металла (причем металлическим элементом является элемент, предназначенный для вхождения в состав смешанного оксида) и топлива, когда все их смешивают в растворе. Вышеупомянутую смесь сначала подвергают нагреву до низкой температуры (например, до температуры от 80 до 600°C) с использованием внешнего источника (например, печи, нагревательной плиты), чтобы инициировать реакцию сжигания, затем выполняют реакцию сжигания между топливом и кислородными соединениями, образующимися при разложении нитратов (таких как HNO3), что позволяет быстро достигнуть высоких температур (так называемые температуры факела могут быть от 600 до 1300°С), что позволяет распространение и поддержание реакции сжигания до тех пор, пока присутствуют топливо и окислитель топлива (отсюда характер самораспространения реакции сжигания).
Этот метод уже был применен для получения смешанных оксидов, включающих уран, особенно для получения смешанных оксидов (U, Ce)O2 или (U, Th)O2.
Для (U, Ce)O2, как описано в Journal of Nuclear Materials, 345, 2005, 245-253, предложен способ получения раствора нитрата U(VI) и нитрата Се(III) с мольным отношением Ce/(U+Ce)=0,28, к которому добавляют лимонную кислоту (компонент топлива) согласно мольному отношению (лимонная кислота/нитраты), равному 1. Полученную смесь нагревают микроволнами, затем на нагревающей плите, для завершения сжигания. Возникающий в результате порошок затем прокаливают при 800°C на воздухе. Анализ методом дифракции рентгеновских лучей показывает, что в результате прокаливания получают порошок, состоящий из смеси фаз (UO3+U3O8+СеО2+(U, Ce)O2+x). Чтобы получить твердый раствор (U, Ce)O2, необходимо спрессовать порошок и спечь агрегат при 1600°С в атмосфере Ar/Н2.
Для (U, Th)O2, как описано в Journal of Nuclear Materials, 278, 2000, 346-347, раствор нитрата урана U(VI) и тория Th(IV), к которому добавлена лимонная кислота, нагревают микроволнами или на нагревательной плите до тех пор, пока весь раствор не превратится в порошок, который затем обжигают на воздухе при 700°C в течение 5 часов, чтобы удалить остаточный углерод (от 0,2 до 0,4%), после чего порошок формуют до обжига при температурах от 1200 до 1500°С в течение 5 часов в атмосфере аргона-водорода (2% Н2). Были протестированы различные отношения (лимонная кислота/нитраты) и (U/U+Th), что позволило сделать следующие заключения:
- для отношений (U/U+Th)>0,5 в результате сжигания получают двухфазную смесь, включающую смешанный оксид урана и тория и U3O8; и
- для отношений (U/U+Th)<0,5 и только для этих количеств в результате сжигания получают твердый раствор оксида урана и тория.
Таким образом, в известных способах получения смешанных оксидов, включающих уран, методом сжигания раствора, кроме особого случая упомянутого ограничения состава, образование твердого раствора оксида урана и другого элемента актинида требует две стадии: первая стадия образования смеси фаз (UO3 и/или U3O8+AnO2) (An означает актиноид) и вторая стадия образования твердого раствора (U, An)O2 или смеси оксидов (UO2+AnO2) дополнительной термической обработкой смеси фаз в результате сжигания как такового.
Ввиду сказанного выше, существует все еще не удовлетворенная потребность в способе, позволяющем получить, в одну стадию обработки раствора сжиганием, смешанных оксидов урана и по меньшей мере одного другого актинида и/или лантанида, в форме твердых растворов из раствора, включающего уран и по меньшей мере один другой актинид и/или лантанид, при каком бы то ни было отношении урана и другого элемента.
Обсуждение изобретения
Авторы изобретения неожиданно обнаружили, что, используя определенное топливо в предопределенном количестве, вышеупомянутые смешанные оксиды можно получить в одну стадию.
Таким образом, изобретение относится к способу получения порошка твердого раствора диоксида урана и по меньшей мере одного другого актинида и/или лантанида, включающему стадию сжигания раствора, включающего нитрат уранила и по меньшей мере один нитрат другого актинида и/или лантанида, и азотсодержащее топливо, причем вышеупомянутое азотсодержащее топливо используют в предопределенном количестве, чтобы получить в результате этой стадии вышеупомянутый твердый раствор, причем указанное предопределенное количество предпочтительно является сверхстехиометрическим количеством азотсодержащего топлива по отношению к нитрату уранила, где указанное предопределенное количество предпочтительно получают путем осуществления следующих операций:
a) операция определения уравнения сгорания нитрата уранила, в котором стехиометрическому коэффициенту азотсодержащего топлива приписывается фактор ϕU;
b) операция определения сверхстехиометрического количества азотсодержащего топлива (так называемое QU) умножением известного количества нитрата уранила на стехиометрический коэффициент азотсодержащего топлива и на фактор ϕU, причем указанный фактор имеет значение выше 1, предпочтительно от 1,5 до 1,7;
c) операция определения уравнения сгорания нитрата другого актинида и/или лантанида, в котором стехиометрическому коэффициенту азотсодержащего топлива приписывают фактор ϕAn/Ln;
d) операция определения количества азотсодержащего топлива (так называемое QAn/Ln) умножением известного количества нитрата другого элемента на стехиометрический коэффициент азотсодержащего топлива и на фактор ϕΑn/Ln, причем указанный фактор имеет значение ниже 2;
е) операция получения вышеупомянутого предопределенного количества сложением по меньшей мере количеств азотсодержащего топлива, определенных в операциях b) и d) (а именно, QU и QAn/Ln).
Прежде чем далее углубляться в настоящее обсуждение, мы уточним следующие определения.
Под твердым раствором понимают смесь урана и по меньшей мере одного другого актинида и/или лантанида с получением твердой однородной монофазы типа диоксида.
Под диоксидом урана и по меньшей мере одного актинида и/или лантанида понимают, например, соединение общей формулы (U, An/Ln)O2±x, где An и Ln представляют собой, соответственно, актинид и лантанид, причем уран, актинид и/или лантанид могут присутствовать в различных пропорциях, и x имеет значение от 0 до 0,25.
Под предопределенным количеством понимают то количество, которое предварительно выбрано так, чтобы получить вышеуказанный раствор.
Под сверхстехиометрическим количеством азотсодержащего топлива по отношению к нитрату уранила понимают, что азотсодержащее топливо изначально (то есть прежде, чем начинается реакция сгорания) присутствует в избытке по отношению к нитрату уранила.
Таким образом, предопределенное количество азотсодержащего топлива, которое надо добавить к вышеупомянутому раствору нитратов, предпочтительно соответствует, как упомянуто выше, по меньшей мере сумме (QU+QAn/Ln), причем это предопределенное количество соответствует сверхстехиометрическому количеству азотсодержащего топлива по отношению к нитрату уранила (это сверхстехиометрическое количество, очевидно, выше количества, определенного на стадии b) вследствие добавления количества QAn/Ln).
Как указано выше, сверхстехиометрическое количество на стадии b) предпочтительно определяют по отношению к уравнению сгорания нитрата уранила в присутствии топлива, где продуктами реакции являются диоксид урана, диоксид углерода, вода (в форме пара) и диазот и, необязательно, один или несколько других газов рекомбинации.
Для этого достаточно в уравнении сгорания нитрата уранила стехиометрическому коэффициенту азотсодержащего топлива приписать фактор ϕU, превышающий 1, предпочтительно от 1,5 до 1,7, причем этот фактор ϕU может быть описан как «обогащенность смеси», свойственную нитрату уранила.
Например, при использовании глицина, уравнение сгорания нитрата уранила может быть записано следующим образом:
или
n означает число молей гидратной воды нитрата уранила.
К этому сверхстехиометрическому количеству, полученному на стадии b), добавляют, по меньшей мере, количество азотсодержащего топлива по отношению к нитрату другого актинида и/или лантанида, чтобы получить, в конечном счете, предопределенное количество азотсодержащего топлива. Чтобы получить это количество азотсодержащего топлива по отношению к нитрату другого актинида и/или лантанида достаточно в уравнении сгорания нитрата другого элемента, актинида и/или лантанида, приписать стехиометрическому коэффициенту топлива фактор ϕAn/Ln ниже 2.
Не связывая себя какой-либо теорией, авторы полагают, что использование избытка азотсодержащего топлива по отношению к нитрату уранила приводит к образованию в достаточном количестве газа восстановителя in situ и к восстановлению урана (VI) в уран (IV), даже в присутствии воздуха, причем этот последний оказывается включенным в твердый раствор диоксида, и уран, таким образом, больше не обнаруживается в форме U3O8, как это происходит в способе сжигания из уровня техники.
Азотсодержащее топливо, использованное в рамках способа по изобретению, может быть выбрано из мочевины, глицина, ацетата аммония, гексаметилентетрамина (известного под сокращением ГМТА), гидразидов и их смесей и, предпочтительно, может быть глицином.
Нитратом уранила является нитрат урана (VI), а именно, нитрат формулы UO2(NO3)2⋅xH2O, где x имеет значение число молей гидратной воды нитрата уранила, где x составляет от 0 до 6.
Нитратом другого актинида и/или лантанида может быть:
* если это нитрат актинида:
- нитрат плутония и, более конкретно, нитрат плутония (IV) (который является степенью окисления плутония, наиболее устойчивой в азотнокислой среде);
- нитрат минорного актинида и, более конкретно, нитрат америция (III) (который является наиболее устойчивой степенью окисления америция в азотнокислой среде), нитрат кюрия (III) (который является наиболее устойчивой степенью окисления кюрия в азотнокислой среде) или нитрат нептуния (IV), (V) или (VI) (которые являются наиболее устойчивыми степенями окисления нептуния в азотнокислой среде); и/или
- нитрат тория (IV); и
* если это нитрат лантанида: нитрат лантанида (III) или (IV), такой как нитрат церия (III) или (IV).
Следует отметить, что способ по изобретению особенно пригоден для нитратов актинидов и/или лантанидов в их степенях окисления, более устойчивых в азотнокислой среде.
Стадия сжигания в способе по изобретению может состоять из операции постепенного нагревания раствора до температуры воспламенения (а именно, до температуры запуска реакции сгорания), причем эта температура воспламенения может быть от 50 до 1000°С.
Стадия сжигания в способе по изобретению может быть предпочтительно осуществлена в присутствии воздуха.
Способ по изобретению может, кроме этого, включать, до стадии сжигания, стадию получения раствора, включающего нитрат уранила и по меньшей мере один нитрат другого актинида и/или лантанида и азотсодержащее топливо, причем этот этап может заключаться в добавлении к первому раствору, включающему только нитрат уранила и по меньшей мере один нитрат другого актинида и/или лантанида, предопределенного количества азотсодержащего топлива, причем это количество предопределено, например, методом, описанным выше.
Способ по изобретению позволяет получать порошки твердого раствора диоксида урана и по меньшей мере одного другого актинида и/или лантанида, причем эти порошки могут быть использованы для получения гранул ядерного топлива.
Для этого полученные порошки могут подвергаться спеканию, чтобы получить вышеупомянутые гранулы.
Другие характеристики будут более понятны при ознакомлении с приведенным ниже дополнительным описанием, которое относится к примерам изготовления порошков по изобретению.
Разумеется, нижеследующие примеры приведены только в качестве иллюстрации сути изобретения и не являются каким бы то ни было ограничением этой сути.
Краткое описание чертежей
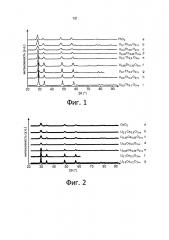
Фиг. 1 представляет собой порошковые дифрактограммы рентгеновских лучей, полученные в опытах от а) до h) примера 1.
Фиг. 2 представляет собой порошковые дифрактограммы рентгеновских лучей, полученные в опытах от а) до f) примера 2.
Фиг. 3 представляет собой порошковые дифрактограммы рентгеновских лучей, полученные в опытах а) и с) примера 3.
Подробное описание варианта осуществления изобретения
Пример 1
Этот пример показывает различные опыты по получению твердых растворов диоксида урана и тория (UyTh1-y)O2±x, где у имеет значение от 0,1 до 0,9 и x от 0 до 0,25, из различных растворов нитрата уранила и нитрата тория и определенного азотсодержащего топлива: глицина.
Были протестированы следующие различные растворы:
- раствор нитрата уранила и нитрата тория, в котором мольное отношение (U/U+Th) было равно 0,1 (опыт а);
- раствор нитрата уранила и нитрата тория, в котором мольное отношение (U/U+Th) было равно 0,2 (опыт b);
- раствор нитрата уранила и нитрата тория, в котором мольное отношение (U/U+Th) было равно 0,35 (опыт с);
- раствор нитрата уранила и нитрата тория, в котором мольное отношение (U/U+Th) было равно 0,5 (опыт d);
- раствор нитрата уранила и нитрата тория, в котором мольное отношение (U/U+Th) было равно 0,65 (опыт е);
- раствор нитрата уранила и нитрата тория, в котором мольное отношение (U/U+Th) было равно 0,7 (опыт f);
- раствор нитрата уранила и нитрата тория, в котором мольное отношение (U/U+Th) было равно 0,8 (опыт g);
- раствор нитрата уранила и нитрата тория, в котором мольное отношение (U/U+Th) было равно 0,9 (опыт h).
Перед осуществлением этих опытов был выполнен предварительный опыт только с раствором нитрата уранила, чтобы определить содержание глицина, при котором образуется только диоксид урана UO2. Это содержание глицина определяют, как находящееся в интервале от 1,5 до 1,7 стехиометрического количества (т.е. ϕU составил от 1,5 до 1,7), исходя из следующего уравнения сжигания:
1) Опыт а
В этом опыте используют раствор нитрата уранила и нитрата тория, в котором мольное отношение (U/U+Th) было равно 0,1, причем вышеупомянутое мольное отношение может быть получено смешиванием 1 мл материнского раствора, содержащего 1 моль ⋅ л-1 урана, и 9 мл материнского раствора, содержащего 1 моль ⋅ л-1 тория.
Уравнения сгорания нитрата уранила и нитрата тория, использованные в рамках этого примера, являются следующими:
* для нитрата уранила:
* для нитрата тория:
Исходя из упомянутых выше уравнений сгорания, фиксируя параметр ϕU=1,7 (что соответствует избытку топлива по отношению к урану) и ϕTh=0,54 для тория, определяют количество глицина QGly, которое надо добавить к вышеупомянутому раствору, по следующему уравнению:
QGly=QU+QTh
где:
* QU=y*[(10/9)*1,7], где у, соответствующий мольному содержанию урана, в этом опыте был равен 0,1, и коэффициент (10/9)*1,7, определенный из уравнения сгорания, соответствовал числу молей глицина, которое надо добавить к раствору по отношению к количеству молей урана; и
* QTh=(1-y) [(20/9)*0,54], где у соответствует тому же самому определению, что и выше, и коэффициент (20/9)*0,54, определенный из уравнения сгорания, соответствует числу молей глицина, которое надо добавить к раствору по отношению к количеству молей тория,
QGly соответствует предопределенному количеству, упомянутому в описании выше.
Предопределенное количество QGly добавляют к раствору, включающему нитрат уранила и нитрат тория.
Возникающий в результате раствор постепенно нагревают на нагревательной плите на воздухе, таким образом, чтобы его испарить (т.е. 1 час при 80°С) до образования геля, и инициируют его зажигание (температура воспламенения порядка 200°С).
После инициирования реакции сгорания нагревание прекращают, так как реакция сгорания является самораспространяющейся реакцией.
Продуктом сгорания является порошок, который был проанализирован методом дифракции рентгеновских лучей, показавшим, что этот порошок является твердым раствором формулы (U0,1Th0,9)O2+x, где x имеет значение от 0 до 0,25 (см. кривую b) фиг. 1).
Дифрактограмма ThO2 содержит характерные линии гранецентрированной кубической структуры. Такие же линии обнаруживают вновь со сдвигом к более высоким углам, что характеризует включение в структуру урана.
2) Опыт b
В этом опыте используют раствор нитрата уранила и нитрата тория, в котором мольное отношение (U/U+Th) было равно 0,2. Этот раствор получают, исходя из материнского раствора нитрата уранила и материнского раствора нитрата тория известных концентраций. Необходимый объем каждого материнского раствора отбирают таким образом, чтобы достичь желаемого мольного отношения (U/U+Th).
Раствор обрабатывают в тех же условиях, что и в опыте а), с тем же коэффициентом ϕU по отношению к урану, и тем же коэффициентом ϕTh, по отношению к торию, причем количество глицина, которое надо добавить для этого опыта, составляет, таким образом, 0,2*[(10/9)*1,7]+0,8*[(20/9)*0,54].
Продуктом сгорания является порошок. Анализ методом дифракции рентгеновских лучей показал, что этим порошком является твердый раствор формулы (U0,2Th0,8)O2+x, где x имеет значение от 0 до 0,25 (см. кривую с) фиг. 1).
Остаточные количества азота и углерода были измерены и составили:
-0,42±0,04% углерода;
-1,93±0,16% азота.
3) Опыт с
В этом опыте используют раствор нитрата уранила и нитрата тория, в котором мольное отношение (U/U+Th) было равно 0,35.
Этот раствор получают, исходя из материнского раствора нитрата уранила и материнского раствора нитрата тория известных концентраций. Необходимый объем каждого материнского раствора отбирают таким образом, чтобы достичь желаемого мольного отношения (U/U+Th).
Раствор обрабатывают в тех же условиях, что и условия опыта а), с тем же коэффициентом ϕU по отношению к урану и тем же коэффициентом ϕTh по отношению к торию, причем количество глицина, которое надо добавить для этого опыта, составляет 0,35*[(10/9)*1,7]+0,65*[(20/9)*0,54].
Продуктом сгорания является порошок, который был проанализирован методом дифракции рентгеновских лучей, показавшим, что порошок является твердым раствором формулы (U0,35Th0,65)O2+x, причем x имеет значения от 0 до 0,25 (см. кривую d) фиг. 1).
4) Опыт d
В этом опыте используют раствор нитрата уранила и нитрата тория, в котором мольное отношение (U/U+Th) было равно 0,5.
Этот раствор получают, исходя из материнского раствора нитрата уранила и материнского раствора нитрата тория известных концентраций. Необходимый объем каждого материнского раствора отбирают таким образом, чтобы достичь желаемого мольного отношения (U/U+Th).
Раствор обрабатывают в тех же условиях, что и условия опыта а), с тем же коэффициентом ϕU по отношению к урану и тем же коэффициентом ϕTh по отношению к торию, причем количество глицина, которое надо добавить для этого опыта, составляет 0,5*[(10/9)*1,7]+0,5*[(20/9)*0,54].
Продуктом сгорания является порошок, который был проанализирован методом дифракции рентгеновских лучей, показавшим, что порошок является твердым раствором формулы (U0,5Th0,5)O2+x, причем x имеет значения от 0 до 0,25 (см. кривую е) фиг. 1).
Остаточные количества азота и углерода были измерены и составили:
-0,34±0,01% углерода;
-1,16±0,11% азота.
5) Опыт е
В этом опыте используют раствор нитрата уранила и нитрата тория, в котором мольное отношение (U/U+Th) было равно 0,65.
Этот раствор получают, исходя из материнского раствора нитрата уранила и материнского раствора нитрата тория известных концентраций. Необходимый объем каждого материнского раствора отбирают таким образом, чтобы достичь желаемого мольного отношения (U/U+Th).
Раствор обрабатывают в тех же условиях, что и условия опыта а), с тем же коэффициентом ϕU по отношению к урану и тем же коэффициентом ϕTh по отношению к торию, причем количество глицина, которое надо добавить для этого опыта, составляет 0,65*[(10/9)*1,7]+0,35*[(20/9)*0,54].
Продуктом сгорания является порошок, который был проанализирован методом дифракции рентгеновских лучей, показавшим, что порошок является твердым раствором формулы (U0,65Th0,35)O2+x, причем x имеет значения от 0 до 0,25 (см. кривую f) фиг. 1).
6) Опыт f
В этом опыте используют раствор нитрата уранила и нитрата тория, в котором мольное отношение (U/U+Th) было равно 0,7.
Этот раствор получают, исходя из материнского раствора нитрата уранила и материнского раствора нитрата тория известных концентраций. Необходимый объем каждого материнского раствора отбирают таким образом, чтобы достичь желаемого мольного отношения (U/U+Th).
Раствор обрабатывают в тех же условиях, что и условия опыта а), с тем же коэффициентом ϕU по отношению к урану и тем же коэффициентом ϕTh по отношению к торию, причем количество глицина, которое надо добавить для этого опыта, составляет 0,7*[(10/9)*1,7]+0,3*[(20/9)*0,54].
Продуктом сгорания является порошок, который был проанализирован методом дифракции рентгеновских лучей, показавшим, что порошок является твердым раствором формулы (U0,7Th0,3)O2+x, причем x имеет значения от 0 до 0,25 (см. кривую g) фиг. 1).
7) Опыт g
В этом опыте используют раствор нитрата уранила и нитрата тория, в котором мольное отношение (U/U+Th) было равно 0,8.
Этот раствор получают, исходя из материнского раствора нитрата уранила и материнского раствора нитрата тория известных концентраций. Необходимый объем каждого материнского раствора отбирают таким образом, чтобы достичь желаемого мольного отношения (U/U+Th).
Раствор обрабатывают в тех же условиях, что и условия опыта а), с тем же коэффициентом ϕU по отношению к урану и тем же коэффициентом ϕTh, по отношению к торию, причем количество глицина, которое надо добавить для этого опыта, составляет 0,8*[(10/9)*1,7]+0,2*[(20/9)*0,54].
Продуктом сгорания является порошок, который был проанализирован методом дифракции рентгеновских лучей, показавшим, что порошок является твердым раствором формулы (U0,8Th0,2)O2+x, причем x имеет значения от 0 до 0,25 (см. кривую h) фиг. 1).
Остаточные количества азота и углерода были измерены и составили:
-0,50±0,04% углерода;
-0,98±0,06% азота.
8) Опыт h
В этом опыте используют раствор нитрата уранила и нитрата тория, в котором мольное отношение (U/U+Th) было равно 0,9.
Этот раствор получают, исходя из материнского раствора нитрата уранила и материнского раствора нитрата тория известных концентраций. Необходимый объем каждого материнского раствора отбирают, таким образом, чтобы достичь желаемого мольного отношения (U/U+Th).
Раствор обрабатывают в тех же условиях, что и условия опыта а), с тем же коэффициентом ϕU по отношению к урану и тем же коэффициентом ϕTh по отношению к торию, причем количество глицина, которое надо добавить для этого опыта, составляет 0,9*[(10/9)*1,7]+0,1*[(20/9)*0,54].
Продуктом сгорания является порошок, который был проанализирован методом дифракции рентгеновских лучей, показавшим, что порошок является твердым раствором формулы (U0,9Th0,1)O2+x, причем x имеет значения от 0 до 0,25 (см. кривую i) фиг. 1).
Из этих опытов следует, что с избытком топлива по отношению к урану получают твердый раствор диоксида урана и тория с содержанием урана от 10 до 90%.
Пример 2
Этот пример иллюстрирует различные опыты по получению твердого раствора диоксида урана и церия (UyCe1-y)O2±x, где y имеет значения от 0,2 до 0,8 и x от 0 до 0,25, исходя из различных растворов нитрата уранила и нитрата церия и определенного азотсодержащего топлива: глицина.
Были протестированы следующие различные растворы:
- раствор нитрата урана (VI) и нитрата церия (III), в котором мольное отношение (U/U+Ce) было равно 0,2 (Опыт а);
- раствор нитрата урана (VI) и нитрата церия (III), в котором мольное отношение (U/U+Ce) было равно 0,35 (Опыт b);
- раствор нитрата урана (VI) и нитрата церия (III), в котором мольное отношение (U/U+Ce) было равно 0,5 (Опыт с);
- раствор нитрата урана (VI) и нитрата церия (III), в котором мольное отношение (U/U+Ce) было равно 0,65 (Опыт d);
- раствор нитрата урана (VI) и нитрата церия (III), в котором мольное отношение (U/U+Ce) было равно 0,7 (Опыт е); и
- раствор нитрата урана (VI) и нитрата церия (III), в котором мольное отношение (U/U+Ce) было равно 0,8 (Опыт f).
Следующие уравнения сгорания нитрата уранила и нитрата церия были использованы в рамках этого примера:
* для нитрата уранила:
* для нитрата церия:
Исходя из упомянутых выше уравнений сгорания, и фиксируя параметр ϕU=1,7 (что соответствует избытку топлива по отношению к урану) и ϕCe - 0,54 для церия, количество глицина QGly, которое надо добавить к вышеупомянутому раствору, определяется следующим уравнением:
QGly=QU+QCe где:
* -QU=у*[(10/9)*1,7], где у соответствует мольному содержанию урана, и коэффициент (10/9)*1,7, определенный из уравнения сжигания, соответствует числу молей глицина, которое надо добавить к раствору по отношению к количеству молей урана; и
*QCe=(1-у)[(15/9)*0,54], где у соответствует тому же самому определению, что и определение выше, и коэффициент (15/9)*0,54, определенный из уравнения сжигания, соответствует числу молей глицина, которое надо добавить к раствору по отношению к количеству молей церия,
QGly соответствует предопределенному количеству, упомянутому в описании выше.
1) Опыт а
В этом опыте используют раствор нитрата уранила и нитрата тория, в котором мольное отношение (U/U+Ce) было равно 0,2. Этот раствор получают, исходя из материнского раствора нитрата уранила и материнского раствора нитрата церия известных концентраций. Необходимый объем каждого материнского раствора отбирают таким образом, чтобы достичь желаемого мольного отношения (U/U+Ce).
В соответствии со вступительным абзацем примера 2, количество глицина, которое надо добавить для этого опыта, было равно 0,2*[(10/9)* 1,7]+0,8*[(15/9)*0,54].
Определенное количество глицина добавляют к вышеупомянутому раствору.
Получаемый в результате раствор испаряют на нагревательной плите на воздухе (1 час при 80°С) до получения геля, затем температуру плиты увеличивают до инициирования сжигания (температура воспламенения была порядка 200°С). Тот же результат получают прямым и постепенным нагреванием раствора до температуры воспламенения.
После инициирования реакции сгорания нагревание останавливают, так как реакция сгорания является самораспространяющейся реакцией.
Продуктом сгорания является порошок, который был проанализирован методом дифракции рентгеновских лучей, показавшим, что порошок является твердым раствором формулы (U0,2Ce0,8)O2+x, причем x имеет значения от 0 до 0,25 (см. кривую b) фиг. 2).
Дифрактограмма СеО2 содержит характерные линии кубической гранецентрированной структуры. Такие же линии обнаруживают вновь со сдвигом к более высоким углам, что характеризует включение в структуру урана.
Остаточные количества азота и углерода были измерены и составляют:
-0,37±0,03% углерода;
-1,76±0,14% азота.
2) Опыт b
В этом опыте используют раствор нитрата урана(VI) и нитрата церия(III), в котором мольное отношение (U/U+Ce) было равно 0,35.
Этот раствор получают, исходя из материнского раствора нитрата уранила и материнского раствора нитрата церия известных концентраций. Необходимый объем каждого материнского раствора отбирают таким образом, чтобы достичь желаемого мольного отношения (U/U+Ce).
Раствор обрабатывают в тех же условиях, что и условия опыта а), с тем же коэффициентом ϕU по отношению к урану и тем же коэффициентом ϕCe по отношению к церию, причем количество глицина, которое надо добавить для этого опыта, составляет 0,35*[(10/9)*1,7]+0,65*[(15/9)*0,54].
Продуктом сгорания является порошок, который был проанализирован методом дифракции рентгеновских лучей, показавшим, что порошок является твердым раствором формулы (U0,35Ce0,65)O2+x, причем x имеет значения от 0 до 0,25 (см. кривую с) фиг. 2).
3) Опыт c
В этом опыте используют раствор нитрата урана(VI) и нитрата церия(III), в котором мольное отношение (U/U+Ce) было равно 0,5.
Этот раствор получают, исходя из материнского раствора нитрата уранила и материнского раствора нитрата церия известных концентраций. Необходимый объем каждого материнского раствора отбирают, таким образом, чтобы достичь желаемого мольного отношения (U/U+Ce).
Раствор обрабатывают в тех же условиях, что и условия опыта а), с тем же коэффициентом ϕU по отношению к урану и тем же коэффициентом ϕCe по отношению к церию, причем количество глицина, которое надо добавить для этого опыта, составляет 0,5*[(10/9)* 1,7]+0,5*[(15/9)*0,54].
Продуктом сгорания является порошок, который был проанализирован методом дифракции рентгеновских лучей, показавшим, что порошок является твердым раствором формулы (U0,5Ce0,5)O2+x, причем x имеет значения от 0 до 0,25 (см. кривую d) фиг. 2).
Остаточные количества азота и углерода были измерены и составили: