Способ подготовки материала для создания биоинженерной конструкции пищевода
Иллюстрации
Показать всеИзобретение относится к области регенеративной медицины. Предложен способ подготовки матрикса для создания биоинженерной конструкции пищевода в эксперименте. Осуществляют выделение и очищение пищевода экспериментальных животных от окружающей соединительной ткани, канюлирование краниальной и каудальной частей пищевода, децеллюляризацию детергентами и энзимами и отмывание пищевода от децеллюляризирующих растворов. Качество децеллюляризации подтверждают путем иммуногистохимического анализа по наличию коллагенов I и IV типов, ламинина, эластина, фибронектина и отсутствию гладкомышечного актина, тропомиозина, компонентов дыхательной цепи митохондрий, а также по отсутствию выраженной клеточной воспалительной реакции на пробу подкожной имплантации подготовленного матрикса in vivo. Изобретение обеспечивает повышение качества получаемого матрикса. 1 табл., 1 пр.
Реферат
Предлагаемое изобретение относится к медицине, а именно к регенеративной медицине, и может быть использовано в клеточной биологии, молекулярной биологии, торакальной хирургии для создания технологии получения и использования в практических целях биоинженерного органа в качестве трансплантата.
Во всем мире ежегодно более чем у 500000 человек диагностируют рак пищевода [Wheeler J.В. et al., 2012] и по современному прогнозу эта цифра увеличится до 850000 человек к 2030 году [Bloom D. et al., 2012]. Рак пищевода среди злокачественных заболеваний является одним из наиболее агрессивных по течению и неблагоприятных по прогнозу для жизни пациентов. В структуре всех злокачественных заболеваний рак пищевода составляет 3% и занимает 6-е место среди опухолей желудочно-кишечного тракта, 3-е место после рака желудка и прямой кишки. Пик заболеваемости приходится на возраст 50-60 лет [Янкин А.В., 2003]. Около 30% пациентов с раком пищевода, а также пациенты с травматическими и врожденными нарушениями (частота встречаемости от 1:2500 до 1:4500 новорожденных) нуждаются в резекции пищевода. Существуют разнообразные тактики по восстановлению пассажа пищи, в том числе с формированием неопищевода из участка желудка [Poghosyan Т. et al., 2011], толстого и тонкого отделов кишечника [Cowles R.A. et al., 2010]. Однако данные реконструктивные операции очень сложны, связаны со значительным количеством послеоперационных осложнений [Smithers В. et al., 2007], а также высокой летальностью [Stein Н.J. et al., 2005]. В течение двух лет после подобных операций многие пациенты страдают от дисфагии в результате образования стриктур и, как правило, нуждаются в повторных эндоскопических вмешательствах для бужирования пищевода [Teoh A.Y.В. et al., 2011].
Тканевая инженерия позволяет создавать биологические конструкции в лабораторных условиях для замены поврежденного или удаленного органа. Она включает в себя разработку и модификацию биологических (природных) или искусственных каркасов (носителей), а также оценку и поддержание жизнеспособности клеток или тканей, взаимодействующих с ними и в связи с этим обладает огромным потенциалом для создания новых способов лечения и улучшения качества жизни таких больных, которым требуется пересадка пищевода. Кроме того, пациенты, которые сегодня считаются неоперабельными из-за плохого клинического статуса, могут получить шанс на выздоровление. С учетом высокой смертности от рака пищевода весьма актуальной является разработка способа подготовки материала для создания биоинженерной конструкции пищевода.
В частности, известен способ децеллюляризации сердца крысы [Патент РФ на изобретение №2550286/ 03.06.14. Бюл. №13. Маккиарини П., Губарева Е.А., Сотниченко А.С., Гилевич И.В., Юнгеблут Ф. Способ моделирования биоинженерного каркаса сердца в эксперименте на крысе.]. Протокол включает в себя канюлирование сердца крысы выше места отхождения основных ветвей дуги аорты с последующей перфузией через аорту очищенной водой, фосфатно-буферным солевым раствором, детергентами и ферментами: растворами, содержащими 4% раствор дезоксихолата натрия в комбинации с 0,002М Na2-ЭДТА, свиную панкреатическую ДНКазу-I 2000 ЕД/200 мл фосфатного буфера с кальцием и магнием и отмывку каркаса фосфатным буфером с добавлением 1% пенициллина-стрептомицина с общей продолжительностью 28 часов, причем жизнеспособность клеток на полученном каркасе определяют по наличию дифференциального окрашивания живых и мертвых клеток, по способности дегидрогеназ живых клеток восстанавливать неокрашенные формы 3-4,5-диметилтиазол-2-ил-2,5-дифенилтераразола до голубого кристаллического фармазана, растворимого в диметилсульфоксиде.
Основным недостатком данного способа является то, что по данному протоколу децеллюляризацию проводят на модели сердца крысы, и это, в связи с физиологическими отличиями животных, не может транслироваться на модель пищевода низшего примата без изменений и дополнений.
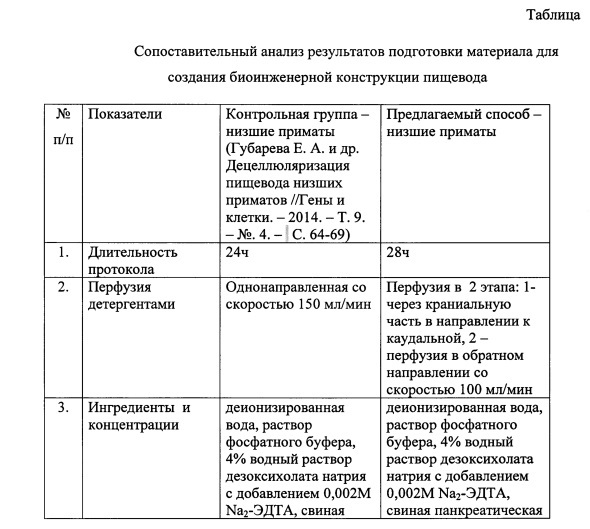
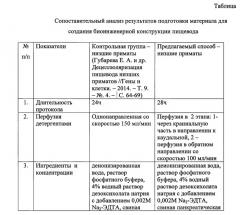
За ближайший аналог принят способ проведения децеллюляризации пищевода низшего примата [Губарева Е.А., Сьоквист С., Сотниченко А.С. и др. Децеллюляризация пищевода низших приматов. Гены и клетки. 2014; 9 (4): 64-69], заключающийся в выделении пищевода низшего примата, очищении его от окружающей соединительной ткани, канюлировании краниальной и каудальной части пищевода пластиковыми катетерами, децеллюляризации пищевода детергент-энзиматическим методом в 2 цикла перфузии пищевода со скоростью 150 мл/мин детергентами и энзимами (деионизированная вода - 1 ч; дезоксихолат натрия 4% + 2 mM раствор ЭДТА 1 час; PBS -/- 10 мин; свиная панкреатическая ДНКаза-I 2000 ЕД/200 мл PBS+/+ - 1 ч), отмывании от децеллюляризирующих растворов фосфатным солевым буферным раствором -/- 200 мл - с общей продолжительностью процедур ~ 24 ч. Контроль качества децеллюляризации проводился путем гистологического исследования, анализа морфологической структуры, количественного определения уровня ДНК и механических свойств полученного каркаса.
Основными недостатками данного способа являются однонаправленная перфузия пищевода децеллюляризирующими растворами, приводящая к неравномерному обесклечиванию органа на протяжении, отсутствие обеззараживания матрикса, создающее угрозу бактериальной контаминации и, как следствие, нарушения его структуры, высокая скорость перфузии, приводящая к изменению механических характеристик, не полный контроль качества децеллюляризации.
Задачи: максимальное сохранение гистологической структуры внеклеточного матрикса пищевода, обеспечение щадящего режима обработки биологического материала, снижение вероятности бактериальной контаминации получаемого каркаса, полноценный морфологический и молекулярно-биологический анализ матрикса, т.е. повышение качества получаемого биоинженерного материала и обеспечение контроля его качества.
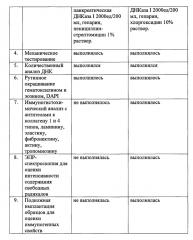
Сущностью предлагаемого способа подготовки матрикса для создания биоинженерной конструкции пищевода в эксперименте является то, что после выделения пищевода низшего примата и очищения его от окружающей соединительной ткани канюлируют краниальную и каудальную части органа, перфузию для децеллюляризации осуществляют в течение 28 часов со скоростью потока реагентов 100 мл/минуту, при этом перфузию осуществляют в 2 этапа: после перфузии через краниальный конец пищевода в направлении к каудальному направление перфузии изменяют на противоположное - от каудального к краниальному, каждый из двух этапов перфузии включает обработку деионизированной водой в течение 1,5 часов, затем используют 4% раствор дезоксихолата натрия в комбинации с 0,002М Na2-ЭДТА в течение 70 минут, фосфатный буфер - в течение 15 минут, свиную панкреатическую ДНКазу-I 2000 ЕД/200 мл фосфатного буфера с кальцием и магнием - 70 минут, завершают децеллюляризацию промывкой от децеллюляризирующих растворов и дезинфекцией матрикса в 10% растворе хлоргексидина биглюконата в фосфатном буфере со сменой раствора и направления перфузии каждые 5 часов, причем качество децеллюляризации подтверждают путем гистологического окрашивания, определения количественного содержания ДНК, механического тестирования иммуногистохимического анализа по наличию коллагенов I и IV типов, ламинина, эластина, фибронектина и отсутствию гладкомышечного актина, тропомиозина, компонентов дыхательной цепи митохондрий - с помощью ЭПР-спектроскопии; а также по отсутствию выраженной клеточной воспалительной реакции на пробу подкожной имплантации подготовленного матрикса in vivo.
Техническим результатом способа является повышение качества получаемого матрикса. Ранее использовавшиеся протоколы и способы повреждали матрикс пищевода и несли высокий риск развития бактериальной контаминации, что крайне неблагоприятно сказывалось на качестве полученного матрикса пищевода и возможности последующего создания биоинженерного органа. Чередование направления перфузии, снижение ее скорости, применение хлоргексидина биглюконата для дезинфекции матрикса полностью нивелирует негативные эффекты известных способов того же назначения. Кроме того, способ предусматривает качественную оценку состава матрикса, контроль количества остаточных компонентов дыхательной цепи митохондрий и биосовместимости матрикса.
Способ подготовки матрикса для создания биоинженерной конструкции пищевода в эксперименте осуществляют следующим образом: для децеллюляризации используют пищевод низших приматов. Орган очищают от окружающей соединительной ткани. Канюлируют краниальную и каудальную части пищевода пластиковыми катетерами соответствующего диаметра. Для проведения децеллюляризации пищевод помещают в специализированный биореактор ORCA (Harvard Apparatus, США) и начинают ретроградную перфузию жидкости через орган в течение 28 часов при скорости потока реагентов 100 мл/мин. Децеллюляризацию проводят в 2 этапа: на первом растворы перфузируют через краниальный конец пищевода в направлении каудального, на втором этапе направление перфузии меняют на противоположное. Каждый из этапов включает перфузию деионизированной водой - 1,5 часа, дезоксихолатом натрия 4% в комбинации с 0,002М Na2-ЭДТА - 70 минут, фосфатным буфером - 15 минут, свиной панкреатической ДНКазой-I 2000 ЕД/200 мл фосфатного буфера с кальцием и магнием - 70 минут, затем завершают децеллюляризацию отмывкой от децеллюляризирующих растворов и дезинфекцией матрикса в 10% растворе хлоргексидина биглюконата в фосфатном буфере со сменой раствора и направления перфузии каждые 5 часов.
Контроль качества полученного биоинженерного каркаса осуществляют методами гистологического исследования (окрашивание гематоксилином и эозином, флуорофором DAPI) для подтверждения сохранности архитектоники внеклеточного матрикса пищевода и отсутствия клеточных элементов на сердечном каркасе, количественного определения уровня оставшейся ДНК [Badylak S.F. et al., 2011], а также путем определения предельных биомеханических параметров на растяжение каркаса на универсальных испытательных машинах фирмы Инстрон модель 5965 (датчик 50 Н) и на Lloyd LRX (100 N load cell) [Witzenburg С. et al., 2012]. Сохранность белков внеклеточного матрикса - коллагенов I и IV типов, ламинина, эластина, фибронектина и отсутствие внутриклеточных сократительных белков - гладкомышечного актина, тропомиозина определяют при помощи иммуногистохимического исследования [Ott Н.С. et al., 2008]. Проводят ЭПР-спектроскопию образцов матрикса пищевода для содержания определения компонентов дыхательной цепи митохондрий [Е.А. Губарева и др., 2016]. Для определения уровня клеточной воспалительной реакции организма лабораторного животного на получаемый матрикс пищевода ацеллюлярные образцы размером до 5 мм в диаметре имплантируют подкожно лабораторным крысам на срок до 14 дней с последующей гистологической оценкой воспалительного ответа.
Способ апробирован в течение 1,5 лет на биологическом материале (пищевод) экспериментальных животных (низшие примата - Масаса Mulatta). Результаты полностью подтвердили решаемые задачи. Получены естественные каркасы органов, с сохранным внеклеточным матриксом и отсутствием клеточных структур.
Данный способ подготовки материала для создания биоинженерной конструкции пищевода использован в эксперименте на низших приматах - Масаса Mulatta. Выполнен забор и фиксация в биореакторе пищевода с последующей децеллюляризацией по предлагаемому способу.
Пример: произвели забор пищевода с соблюдением правил проведения работ с использованием экспериментальных животных (протокол локального этического комитета №30/1). Орган очистили от окружающей соединительной ткани, канулировали краниальный и каудальный концы пищевода и фиксировали в биореакторе. Начали децеллюляризацию пищевода путем перфузии со скоростью 100 мл/мин через краниальный конец децеллюляризирующими растворами: деионизированной водой - 1,5 часа, дезоксихолатом натрия 4% в комбинации с 0,002М Na2-ЭДТА - 70 минут, фосфатным буфером - 15 минут, свиной панкреатической ДНКазой-I 2000 ЕД/200 мл фосфатного буфера с кальцием и магнием - 70 минут, затем сменили направление перфузии жидкости на обратное - от каудального конца к краниальному и повторили цикл перфузии децеллюляризирующими растворами. Децеллюляризацию пищевода завершили отмывкой от децеллюляризирующих растворов и дезинфекцией матрикса в 10% растворе хлоргексидина биглюконата в фосфатном буфере со сменой раствора и направления перфузии каждые 5 часов.
Контроль качества полученного биоинженерного каркаса осуществили методами гистологического исследования (окрашиванием гематоксилином и эозином, флуорофором DAPI) для подтверждения сохранности архитектоники внеклеточного матрикса пищевода и отсутствия клеточных элементов на сердечном каркасе, количественного определения уровня оставшейся ДНК, установили предельные биомеханические параметры на растяжение каркаса на универсальных испытательных машинах фирмы Инстрон модель 5965 (датчик 50 Н) и на Lloyd LRX (100 N load cell).
Сохранность белков внеклеточного матрикса (коллагена I и IV типов, ламинина, эластина, фибронектина) и отсутствие внутриклеточных сократительных белков (гладкомышечного актина, тропомиозина) определили при помощи иммуногистохимического исследования, по наличию либо отсутствию специфичной реакции с антителами против данных белков. Провели ЭПР-спектроскопию образцов матрикса пищевода, определив содержание компонентов дыхательной цепи митохондрий. Выполнили подкожную имплантацию образцов размером до 5 мм в диаметре лабораторным крысам на срок до 14 дней, после чего гистологически оценили выраженность воспалительного ответа.
В результате экспериментов по децеллюляризации получен каркас пищевода с сохранением гистологической архитектоники и белков внеклеточного матрикса. Проведено всестороннее изучение свойств ацеллюлярного матрикса.
Способ подготовки матрикса для создания биоинженерной конструкции пищевода в эксперименте, включающий выделение и очищение пищевода экспериментальных животных от окружающей соединительной ткани, канюлирование краниальной и каудальной частей пищевода, децеллюляризацию детергентами и энзимами и отмывание пищевода от децеллюляризирующих растворов, контроль качества матрикса: гистологическое окрашивание, определение количественного содержания ДНК, механическое тестирование, отличающийся тем, что перфузию в течение 28 ч со скоростью 100 мл/мин при канюлировании осуществляют в 2 этапа: после перфузии через краниальный конец пищевода в направлении к каудальному направление перфузии изменяют на противоположное - от каудального к краниальному, каждый из двух этапов перфузии включает обработку деионизированной водой в течение 1,5 ч, затем используют 4% раствор дезоксихолата натрия в комбинации с 0,002 М Na2-ЭДТА в течение 70 мин, фосфатный буфер - в течение 15 мин, свиную панкреатическую ДНКазу-I 2000 ЕД/200 мл фосфатного буфера с кальцием и магнием - 70 мин, завершают децеллюляризацию промывкой от децеллюляризирующих растворов и дезинфекцией матрикса в 10% растворе хлоргексидина биглюконата в фосфатном буфере со сменой раствора и направления перфузии каждые 5 ч, дополнительно качество децеллюляризации подтверждают путем иммуногистохимического анализа по наличию коллагенов I и IV типов, ламинина, эластина, фибронектина и отсутствию гладкомышечного актина, тропомиозина, компонентов дыхательной цепи митохондрий - с помощью ЭПР-спектроскопии, а также по отсутствию выраженной клеточной воспалительной реакции на пробу подкожной имплантации подготовленного матрикса in vivo.