Новый ингибитор глутаминилциклаз и его применение для лечения заболеваний легких и дыхательных путей
Иллюстрации
Показать всеГруппа изобретений относится к химико-фармацевтической промышленности и включает в себя фармацевтические композиции и их применение для модулирования активности глутаминилциклазы, для лечения расстройства, связанного с активностью глутаминилциклазы, а также для предупреждения и/или лечения расстройства, связанного с аберрантной активностью клеток иммунной системы, содержащие терапевтически эффективное количество соединения формулы:
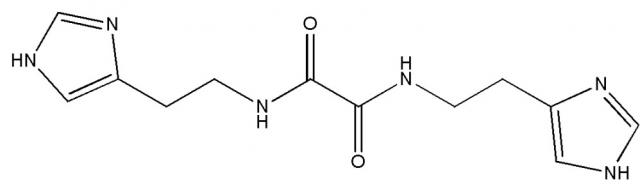
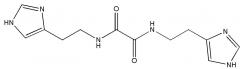
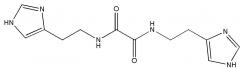
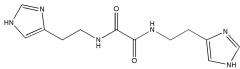
или его фармацевтически приемлемой соли, гидрата или сольвата и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество. Группа изобретений позволяет получить эффективный модулятор глутаминилциклазы, характеризующийся высокой ингибирующей активностью и эффективностью в терапии заболеваний, связанных с аберрантной активностью клеток иммунной системы. 7 н. и 20 з.п. ф-лы, 1 ил., 10 табл., 2 пр.
Реферат
Область техники
Данное изобретение относится к химии органических соединений, фармакологии и медицине и касается терапии заболеваний, связанных с аберрантной активностью клеток иммунной системы, предпочтительно терапии заболеваний легких и дыхательных путей, в частности терапии бронхиальной астмы, острого и хронического бронхита, фарингита, эмфиземы легкого, ринита, риносинусита и хронической обструктивной болезни легких посредством применения соединения, обладающего эффективностью в ингибировании фермента глутаминилциклазы, вовлеченной, в частности, в процессы пост-трансляционной модификации хемокинов и хемотаксиса клеток иммунной системы.
Уровень техники
Хемотаксис или направленное движение клеток иммунной системы по градиенту концентрации некоторых эндогенных и экзогенных веществ (хемоаттрактантов) является одной из важнейших составных частей функционирования клеток иммунной системы. Избыточный приток клеток иммунной системы как правило вызывает избыточную активность клеток иммунной системы и повреждению окружающих органов и тканей. Понимание участников и процессов, связанных с процессом хемотаксиса, на молекулярном уровне может привести к новым эффективным подходам в лечении и профилактике целого ряда заболеваний, связанных с аберрантной активностью клеток иммунной системы.
Хемокины семейства CCL (CCL2, CCL7, CCL8, CCL13), являющиеся лигандами рецептора ССR2, являются наиболее мощными факторами хемотаксиса моноцитов и макрофагов в организме млекопитающих (Biochem. J. 2012 Mar 1; 442(2):403-12). Хемокины семейства CCL составляют важный класс цитокинов, необходимых для активации нейтрофилов и моноцитов и привлечения этих клеток в очаг воспаления. Однако высокие концентрации хемокинов как привило вызывают избыточный приток клеток иммунной системы. Аберрантная активность клеток иммунной системы может привести к серьезным повреждением окружающих органов и тканей. Например, в ряде случаев продукты окисления липидов могут активировать клетки эндотелия сосудов (интиму), что приводит к выделению CCL2, привлечению макрофагов которые, в свою очередь выделяют маркеры воспаления, провоцирующие повреждение артериальной стенки и развитие атеросклероза (Mol Cell. 1998 Aug;2(2):275-81; Nature. 1998 Aug 27;394(6696):894-7). Известна роль хемокинов семейства CCL в патофизиологии целого ряда аутоиммунных и аллергических состояний, опосредованных аберрантной активностью моноцитов CCR2+, CD14+ и CD16lo (ревматоидный артрит, рассеянный склероз). Кроме того, хемокины семейства CCL (в частности CCL2) вовлечены в патогенез метаболического синдрома, хронической боли, фиброза и некоторых форм рака.
Подавление аберрантной активности клеток иммунной системы, за счет ингибирования CCL-опосредованного хемотаксиса, может быть крайне востребовано для терапии целого круга заболеваний дыхательной системы, таких как бронхиальная астма, бронхит, хроническая обструктивная болезнь легких и т.д. Например воздействие бактериальных липополисахаридов, липотейхоевой кислоты или других раздражителей на слизистую оболочку органов дыхательной системы приводит к увеличению секреции CCL2 клетками гладкой мускулатуры бронхов (Am. J. Physiol. Lung Cell Mol. Physiol. 2012 Apr 15;302(8):L785-92) и росту концентрации CCL2 в бронхоальвеолярном лаваже (Mol. Immunol. 2011 Jul;48(12-13):1468-76). Увеличение концентрации CCL2 в свою очередь вызывает миграцию эозинофилов, моноцитов и базофилов и развитие аберрантного ответа ассоциированного с выделением большего количества хемокинов (TNFα, IL-1, IL-6, IL-4) и активных форм кислорода, повреждающих окружающие клетки бронхов и органов дыхания (Immunobiology. 2016 Feb;221(2):182-7; Int. J. Biol Sci. 2012; 8(9):1281-90; Mol. Immunol. 2013 Nov; 56(1-2):57-63). Повреждение бронхов приводит к развитию и сохранению аберрантной активности клеток иммунной системы и дальнейшему разрушению тканей органов дыхания. В in vivo моделях аллергической астмы блокада взаимодействия CCL2/CCR2 низкомолекулярными антагонистами показала значительную эффективность (Int Arch Allergy Immunol. 2015;166(1):52-62).
Члены семейства CCL (CCL2, CCL7, CCL8, CCL13), а также ряда других гормонов и секретируемых белков, содержат остаток пироглутаминовой кислоты (pE), роль которого заключается в защите от деградации аминопептидазами (Chem. Immunol. 1999;72:42-56; Biochemistry, 1999 Oct 5; 38(40):13013-25). Пироглутаминирование N-концевого остатка глутамина является пост-трансляционной модификацией белка, и катализируется ферментами глутаминилциклазой (QPCT или QC) (J. Biol. Chem. 2003 Dec 12; 278(50):49773-9) и изо-глутаминилциклазой (QPCTL или isoQC) (J. Mol. Biol. 2008 Jun 20;379(5):966-80). Обе изоформы фермента представляют собой близкие по структуре и субстратной специфичности белки с различной локализацией: глутаминилциклаза является секретируемым белком, в то время как изоглутаминилциклаза находится внутри клетки и закреплена в аппарате Гольджи (J. Mol. Biol. 2008 Jun 20;379(5):966-80).
В ходе экспериментальных исследований было показано, что ингибирование глутаминилциклаз приводит к резкому снижению хемоаттракторной активности непироглутаминированных форм хемокинов CCL2, CCL7, CCL8 и CCL13 (Biochem. J. (2012) 442, 403-412). Таким образом, пироглутаминирование хемокинов семейства CCL, является необходимым этапом CCL-опосредованного хемотаксиса моноцитов, а стратегия направленная на ингибирование глутаминилциклазы является возможной стратегией модулирования аберрантной активности клеток иммунной системы.
К настоящему времени известны ингибиторы глутаминилциклазы, включающие сульфолипиды (WO 2017/046256), производные флаваноидов (Bioorg. Med Chem. 2016 May 15;24(10):2280-6), производные пиридина (US 2015/0291632) и некоторые небольшие молекулы, описанные в работах последнего времени (J Med Chem. 2017 Mar 23;60(6):2573-2590; WO 2014/193974, US 2015/0291557). Наиболее близкие аналоги, соединения, являющегося предметом настоящего изобретения приведены в публикациях компании Probiodrug Aktiengesellschaft (J Biol Chem. 2003 Dec 12;278(50):49773-9). В данной работе описаны ингибиторы глутаминилциклазы на основе производных имидазола. Однако, в структурах соединений опубликованных компанией Probiodrug Aktiengesellschaft имидозол содержит алифатический заместитель по одному из атомов азота. Введение алифатического заместителя снижает метаболическую стабильность соединений. Кроме того, введение алифатического заместителя увеличивает гидрофобность соединений и облегчает проникновение соединения через гемато-энцефалический барьер, что явно излишне для подавления аберрантной активности клеток иммунной системы и потенциально может привести к возникновению побочных эффектов.
На сегодняшний день нет ни одного препарата, действующего как ингибитор глутаминилциклазы, который бы применяли в терапии заболеваний, связанных с аберрантной активностью клеток иммунной системы, поэтому сохраняется потребность в создании и внедрении в клинику новых эффективных лекарственных средств на основе ингибиторов глутаминилциклазы.
Данное изобретение касается применения соединения, обладающего эффективностью в ингибировании глутаминилциклазы, в терапии заболеваний, связанных с аберрантной активностью клеток иммунной системы, предпочтительно терапии заболеваний легких и дыхательных путей, в частности терапии бронхиальной астмы, острого и хронического бронхита, фарингита, эмфиземы легкого, ринита, риносинусита и хронической обструктивной болезни легких, а так же других заболеваний органов дыхания, связанных с аберрантной активностью клеток иммунной системы.
Краткое описание чертежей.
Фиг.1 - Приток клеток воспаления в бронхоальвеолярное пространство при изучении специфической фармакологической активности Соединения 1 на модели острой астмы у морских свинок (M±m, n=10).
Раскрытие изобретения
Задачей настоящего изобретения является разработка нового средства - ингибитора внутриклеточной и секретируемой изоформ глутаминилциклазы, эффективного для лечения заболеваний, связанных с аберрантной активностью клеток иммунной системы, в особенности заболеваний легких и дыхательных путей, таких как бронхиальная астма, острый и хронический бронхит, фарингит, эмфизема легкого, ринит, риносинусит и хроническая обструктивная болезнь легких, а так же прочих заболеваний, связанных с аберрантной активности клеток иммунной системы.
Техническим результатом данного изобретения является разработка и получение эффективного модулятора глутаминилциклазы, и в частности, эффективного ингибитора глутаминилциклазы характеризующегося высокой ингибирующей активностью и фармакокинетическими характеристиками (в частности, существенным превышением экспозиции ингибитора в органах мишенях (легкие, носогубный треугольник) по сравнению с плазмой крови), позволяющих использовать данный ингибитор для лечения заболеваний, связанных с аберрантной активностью клеток иммунной системы, в особенности заболеваний легких и дыхательных путей, таких как бронхиальная астма, острый и хронический бронхит, фарингит, ринит (в частности aллергический ринит), риносинусит, хроническая обструктивная болезнь легких и ее проявления (в частности эмфизема легкого, бронхиальная обструкция), а так же прочих заболеваний, связанных с аберрантной активностью клеток иммунной системы, в частности с аберрантным хемотаксисом клеток иммунной системы.
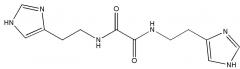
Указанный технический результат достигается путем применения соединения N,N'-бис[2-(1H-имидазол-4-ил)этил]оксаламида
или его соли, гидрата, сольвата в качестве ингибитора внутриклеточной и секретируемой изоформ глутаминилциклазы.
Указанный технический результат достигается также посредством применения соединения N,N'-бис[2-(1H-имидазол-4-ил)этил]оксаламида или его соли, гидрата, сольвата для получения фармацевтической композиции для предупреждения и/или лечения расстройства, связанного с активностью глутаминилциклазы.
Указанный технический результат достигается также посредством применения соединения N,N'-бис[2-(1H-имидазол-4-ил)этил]оксаламида или его соли, гидрата, сольвата для получения фармацевтической композиции для предупреждения и/или лечения расстройства, связанного с аберрантной активностью клеток иммунной системы, в частности с аберрантным хемотаксисом клеток иммунной системы.
Кроме того, изобретение предусматривает фармацевтические композиции и лекарственные средства для предупреждения и/или лечения расстройства, связанного с активностью глутаминилциклазы и/или с аберрантной активностью клеток иммунной системы, в частности с аберрантным хемотаксисом клеток иммунной системы, и характеризующиеся тем, что они содержит эффективное количество соединения по изобретению и, по меньшей мере, одно фармацевтически приемлемое вспомогательное вещество. В некоторых вариантах воплощениях изобретения вспомогательное вещество представляет собой фармацевтически приемлемый носитель и/или эксципиент.
Изобретение также включает способ предупреждения и/или лечения расстройства, связанного с активностью глутаминилциклазы в организме, включающий введение в указанный организм фармацевтической композиции по изобретению. Такое расстройство, связанное с активностью глутаминилциклазы, представляет собой заболевание, связанное с аберрантной активностью клеток иммунной системы, в частности с аберрантным хемотаксисом клеток иммунной системы, в особенности заболевание легких и дыхательных путей. В некоторых неограничивающих вариантах воплощения изобретения заболевание легких и дыхательных путей представляет собой бронхиальную астму, острый и хронический бронхит, фарингит, эмфизему легкого, ринит, риносинусит или хроническую обструктивную болезнь легких. В частных случаях воплощения изобретения организм представляет собой человека или животного.
Соединение N,N'-бис[2-(1H-имидазол-4-ил)этил] оксаламида описано в заявке на изобретение RU 2013/116822.
Подробное раскрытие изобретения
Получение Соединения 1, медицинское применение которого является предметом настоящего изобретения, описано в заявке на изобретение RU 2013/116822. В указанной патентной заявки описаны производные бисамидов дикарбоновых кислот, обладающие способностью к комплексообразованию или хелатированию ионов металлов, а также их применение в качестве средства для профилактики и/или лечения вирусного гепатита, ВИЧ-инфекции, онкологических, нейродегенеративных, сердечнососудистых, воспалительных заболеваний, диабета, геронтологических заболеваний, заболеваний, вызываемых токсинами микроорганизмов, а также алкоголизма, алкогольного цирроза печени, анемии, поздней порфирии, отравлений солями переходных металлов.
В ходе исследований специфической фармакологической активности Соединения 1 в моделях различных заболеваний было установлено, что применение Соединения 1 достоверно снижает приток клеток иммунной системы. Таким образом, показано, что Соединение 1 влияет на хемотаксис клеток иммунной системы. Снижение притока клеток иммунной системы может применяться в терапии целого ряда заболеваний связанных с аберрантной активностью клеток иммунной системы, в частности заболеваний легких и дыхательных путей, таких как бронхиальная астма, острый и хронический бронхит, фарингит, эмфизема легкого, ринит, риносинусит и хроническая обструктивная болезнь легких. Поскольку влияние на хемотаксис не может быть предсказано или объяснено способностью соединения к комплексообразованию или хелатированию ионов металлов, была предпринята попытка поиска возможных терапевтических мишени Соединения 1.
Поиск возможных терапевтических мишеней, с использованием методов вычислительной химии, молекулярного моделирования и in vitro испытаний на ферментном препарате позволил обнаружить, что наблюдаемый терапевтический эффект Соединения 1 связан со способностью данного соединения ингибировать активность глутаминилциклазы.
В ходе дальнейших исследований фармакокинетики соединения 1 неожиданно оказалось, что после перорального применения вещество распределяется по органам и тканям, причем высокие концентрации достигаются в органах дыхания, в частности, в легких и носовом треугольнике.
Таким образом, Соединение 1 является новым ингибитором глутаминилциклазы, который влияет на хемотаксис клеток иммунной системы и может применяться для терапии заболеваний, связанных с аберрантной активностью клеток иммунной системы, предпочтительно заболеваний легких и дыхательных путей, в частности бронхиальной астмы, острого и хронического бронхита, фарингита, эмфиземы легкого, ринита, риносинусита и хронической обструктивной болезни легких, а также других заболеваний легких и дыхательных путей, связанных с аберрантной активностью клеток иммунной системы.
Термины и определения
Термин «Соединение 1» относится к N,N'-бис[2-(1H-имидазол-4-ил)этил]оксаламиду, также представленному структурной формулой:
.
Термин «С», когда он используется со ссылкой на температуру, означает температурную шкалу Цельсия.
Термин «IC50» означает концентрацию тестируемого соединения, при которой достигается полумаксимальное ингибирование фермента.
Термин «фармацевтически приемлемые соли» или «соли» включает соли активных соединений, которые получены с помощью относительно нетоксичных кислот. Примерами фармацевтически приемлемых нетоксичных солей могут служить соли, образованные неорганическими кислотами, такими как соляная, бромоводородная, фосфорная, серная и хлорная кислоты, или органическими кислотами, такими как уксусная, щавелевая, малеиновая, винная, янтарная, лимонная или малоновая кислоты, или полученные другими методами, используемыми в данной области, например, с помощью ионного обмена. К другим фармацевтически приемлемым солям относятся адипинат, альгинат, аскорбат, аспартат, бензолсульфонат, бензоат, бисульфат, борат, бутират, камфорат, камфорсульфонат, цитрат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, формиат, фумарат, глюкогептонат, глицерофосфат, глюконат, гемисульфат, гептанат, гексанат, гидройодид, 2-гидрокси-этансульфонат, лактобионат, лактат, лаурат, лаурил сульфат, малат, малеат, малонат, метансульфонат (мезилат), 2-нафталинсульфонат, никотинат, нитрат, олеат, оксалат, пальмитат, памоат, пектинат, персульфат, 3-фенилпропионат, фосфат, пикрат, пивалат, пропионат, полуфумарат, стеарат, сукцинат, сульфат, тартрат, тиоцианат, п-толуолсульфонат (тозилат), ундеканат, валериат и подобные.
Термин «сольват» используется для описания молекулярного комплекса, содержащего соединение по изобретению и одну или более молекул фармацевтически приемлемого растворителя, например этанола. Термин «гидрат» используется, когда указанным растворителем является вода.
Термин «аберрантная активность» клеток иммунной системы в настоящем документе означает активность, существенно отличающуюся от базового уровня активности клеток иммунной системы в организме при отсутствии патологии. Аберрантная активность может быть вызвана избыточным притоком клеток иммунной системы к органу или ткани, нарушением процессов, приводящих к активации клеток иммунной системы, дерегулированием процессов связанных с гибелью клеток иммунной системы, а также другими факторами.
Термин «вспомогательное вещество» означает любое фармацевтически приемлемое вещество неорганического или органического происхождения, входящее в состав лекарственного препарата или используемое в процессе производства, изготовления лекарственного препарата для придания ему необходимых физико-химических свойств.
Термин «AUC» (area under the curve) означает фармакокинетический параметр, характеризующий суммарную концентрацию лекарственного препарата в плазме крови в течение всего времени наблюдения. Математически определяется как интеграл от 0 до ∞ функции концентрации препарата (фармакокинетической кривой) в плазме крови от времени и равен площади фигуры, ограниченной фармакокинетической кривой и осями координат.
Термин «среда RPMI» (англ. Roswell Park Memorial Institute medium) означает среду для культур клеток и тканей. RPMI традиционно используется для выращивания лимфоидных клеток человека. Среда содержит значительное количество фосфата и имеет состав для выращивания в атмосфере с содержанием углекислого газа 5%.
Термин «глутаминилциклаза» означает фермент аминоацилтрансферазу участвующую в преобразовании N-концевой глутамина в пироглутамин в различных пептидных субстратах. Образование N-концевого пироглутамата защищает биологически активные пептиды, гормоны и хемокины (например, тиреотропин-высвобождающий гормон, β-хемокиновый лиганд-2) от деградации экзопептидазами и в некоторых случаях может увеличивать аффинность лигандов к их рецепторам.
Термин «секретируемая глутаминилциклаза» означает одну из изоформ фермента глутаминилциклазы, содержащая секреторный N-концевой домен и преимущественно секретируемая клетками человека. Секретируемая глутаминилциклаза преимущественно экспрессируются в клетках нервной и иммунной систем.
Термин «внутриклеточная глутаминилциклаза» означает одну из изоформ фермента глутаминилциклазы, содержащая якорный N-концевой домен и преимущественно связанная с аппаратом Гольджи. Внутриклеточная глутаминилциклаза распространена повсеместно в клетках млекопитающих и человека
Термин «хемотаксис» означает направленное движение клеток в ответ на химический раздражитель. В основе хемотаксиса лежит способность клетки отвечать на градиент концентрации хемотаксического медиатора. Хемотаксис является тем процессом, благодаря которому клетки иммунной системы покидают сосудистое русло и мигрируют в поврежденную ткань. Ведущую роль в хемотаксисе играют хемотаксические вещества (хемоатрактанты). Одним из наиболее мощных хемоатрактантов для моноцитов и макрофагов является хемокин CCL2.
Термины «лечение», «терапия» охватывают лечение патологических состояний у млекопитающих, предпочтительно у человека, и включают: а) снижение, б) блокирование (приостановку) течения заболевания, в) облегчение тяжести заболевания, т.е. индукцию регрессии заболевания, г) реверсирование заболевания или состояния, к которому данный термин применяется, или одного или более симптомов данного заболевания или состояния.
Термин «профилактика», «предотвращение» охватывает устранение факторов риска, а также профилактическое лечение субклинических стадий заболевания у млекопитающих, предпочтительно у человека, направленное на уменьшение вероятности возникновения клинических стадий заболевания. Пациенты для профилактической терапии отбираются на основе факторов, которые, на основании известных данных, влекут увеличение риска возникновения клинических стадий заболевания по сравнению с общим населением. К профилактической терапии относится а) первичная профилактика и б) вторичная профилактика. Первичная профилактика определяется как профилактическое лечение у пациентов, клиническая стадия заболевания у которых еще не наступила. Вторичная профилактика - это предотвращение повторного наступления того же или близкого клинического состояния заболевания.
Соединение 1, перспективно для лечения заболеваний, связанных с аберрантной активностью клеток иммунной системы, в особенности заболеваний связанных с аберрантным хемотаксисом клеток иммунной системы, предпочтительно терапии заболеваний легких и дыхательных путей, таких как бронхиальная астма, острый и хронический бронхит, фарингит, эмфизема легкого, ринит, риносинусит и хроническая обструктивная болезнь легких, имеющих как системный, так и локальный характер, в том числе, обусловленных первичными патологическими изменениями в тканях легких и дыхательных путей, или связанных с различными заболеваниями или длительным приемом некоторых лекарственных препаратов. В некоторых частных вариантах соединения по изобретению могут быть использованы для лечения других заболеваний легких и дыхательных путей, связанных с аберрантной активностью клеток иммунной системы.
Способ терапевтического применения соединений
Предмет данного изобретения также включает введение субъекту, нуждающемуся в соответствующем лечении, терапевтически эффективного количества соединения по изобретению. Под терапевтически эффективным количеством подразумевается такое количество соединения, вводимого или доставляемого пациенту, при котором у пациента с наибольшей вероятностью проявится желаемая реакция на лечение (профилактику). Точное требуемое количество может меняться от субъекта к субъекту в зависимости от возраста, массы тела и общего состояния пациента, тяжести заболевания, методики введения препарата, комбинированного лечения с другими препаратами и т.п.
Соединение по изобретению или фармацевтическая композиция, содержащая соединение, может быть введено в организм пациента в любом количестве (предпочтительно, суточная доза действующего вещества составляет до 0,5 г на пациента в сутки, наиболее предпочтительно, суточная доза составляет 5-50 мг/сутки) и любым путем введения (предпочтительно, пероральный путь введения), эффективным для лечения или профилактики заболевания.
После смешения лекарственного препарата с конкретным подходящим фармацевтически допустимым носителем в желаемой дозировке, композиции, составляющие суть изобретения, могут быть введены в организм человека или других животных перорально, парентерально, местно и т.п.
Введение может осуществляться как разово, так и несколько раз в день, неделю (или любой другой временной интервал), или время от времени. Кроме того, соединение может вводиться в организм пациента ежедневно в течение определенного периода дней (например, 2-10 дней), а затем следует период без приема вещества (например, 1-30 дней).
В том случае, когда соединение по изобретению используется как часть режима комбинированной терапии, доза каждого из компонентов комбинированной терапии вводится в течение требуемого периода лечения. Соединения, составляющие комбинированную терапию, могут вводиться в организм пациента как единовременно, в виде дозировки, содержащей все компоненты, так и в виде индивидуальных дозировок компонентов.
Фармацевтические композиции
Изобретение также относится к фармацевтическим композициям, которые содержат соединение 1 по изобретению (или пролекарственную форму или другое фармацевтически приемлемое производное) и один или несколько фармацевтически приемлемых носителей, адъювантов, растворителей и/или наполнителей, таких, которые могут быть введены в организм пациента совместно с соединением, составляющем суть данного изобретения, и которые не влияют на фармакологическую активность этого соединения, и являются нетоксичными при введении в дозах, достаточных для доставки терапевтического количества соединения.
Фармацевтические композиции, заявляемые в данном изобретении, содержат соединение 1 совместно с фармацевтически приемлемыми носителями, которые могут включать в себя любые растворители, разбавители, дисперсии или суспензии, поверхностно-активные вещества, изотонические агенты, загустители и эмульгаторы, консерванты, вяжущие вещества, скользящие материалы и т.д., подходящие для конкретной формы дозирования. Материалы, которые могут служить фармацевтически приемлемыми носителями, включают, но не ограничиваются, моно- и олигосахаридами, а также их производными; желатин; тальк; эксципиенты, такие как какао-масло и воск для суппозиториев; масла, такие как арахисовое, хлопковое, сафроловое, кунжутное, оливковое, кукурузное и соевое масло; гликоли, такие как пропиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар; буферные вещества, такие как гидроксид магния и гидроксид алюминия; альгиновая кислота; апирогенная вода; изотонический раствор, раствор Рингера; этиловый спирт и фосфатные буферные растворы. Также в составе композиции могут быть другие нетоксичные совместимые скользящие вещества, такие как лаурилсульфат натрия и стеарат магния, а также красители, пленкообразователи, подсластители, вкусовые добавки и ароматизаторы, консерванты и антиоксиданты.
Предметом данного изобретения являются также лекарственные -средства, под которыми подразумевают фармацевтические композиции, состав которых оптимизирован для определенного пути введения в организм в терапевтически эффективной дозе, например, для введения в организм орально, местно, ингаляционно, например, в виде ингаляционного спрея, или внутрисосудистым способом, интраназально, подкожно, внутримышечно, а также инфузионным способом, в рекомендованных дозировках.
Лекарственные средства данного изобретения могут содержать составы, полученные методами использования липосом, методами микрокапсулирования, методами приготовления наноформ препарата, или другими методами, известными в фармацевтике.
При получении композиции, например в форме таблетки, активное начало смешивают с одним или несколькими фармацевтическими эксципиентами, такими как желатин, крахмал, лактоза, стеарат магния, тальк, кремнезем, аравийская камедь, маннит, микрокристаллическая целлюлоза, гипромеллоза или аналогичные соединения.
Таблетки можно покрыть сахарозой, целлюлозным производным или другими веществами, подходящими для нанесения оболочки. Таблетки могут быть получены различными способами, такими как непосредственное сжатие, сухое или влажное гранулирование или горячее сплавление в горячем состоянии.
Фармацевтическую композицию в форме желатиновой капсулы можно получить, смешивая активное начало с другими веществами и заполняя полученной смесью мягкие или твердые капсулы.
Для введения парентеральным путем используются водные суспензии, изотонические солевые растворы или стерильные растворы для инъекций, которые содержат фармакологически совместимые агенты, например пропиленгликоль или бутиленгликоль.
Примеры фармацевтических композиций
Вещество, описанные в данном изобретении, может быть использовано для профилактики и/или лечения болезней человека, или животных в виде следующих составов (под «Веществом» понимается активный ингредиент):
Таблетка I мг/таблетка
Вещество 2.0
Микрокристаллическая целлюлоза 73,2
Карбоксиметилкрахмал натрия 4.0
Магния стеарат 0,8
Таблетка II мг/таблетка
Вещество 10.0
Микрокристаллическая целлюлоза 366
Карбоксиметилкрахмал натрия 20
Магния стеарат 4.0
Таблетка III мг/таблетка
Вещество 20
Микрокристаллическая целлюлоза 732
Карбоксиметилкрахмал натрия 40
Магния стеарат 8.0
Таблетка IV мг/таблетка
Вещество 50
Лактоза Ph. Eur 223.75
Кроскармеллоза натрия 6.0
Кукурузный крахмал 15
Поливинилпироллидон (5% w/v паста) 2.25
Стеарат магния 3.0
Таблетка V мг/таблетка
Вещество 200
Лактоза Ph. Eur 182.75
Кроскармеллоза натрия 12.0
Кукурузный крахмал (5% w/v паста) 2.25
Стеарат магния 3.0
Капсула мг/капсула
Вещество 10
Лактоза Ph. Eur 488.5
Магнезия 1.5
Данные составы могут быть приготовлены в соответствии со стандартными фармацевтическими методиками. Таблетки (I)-(II) могут быть покрыты кишечнорастворимой оболочкой с использованием, например, фталата ацетата целлюлозы.
Применение Соединения 1 в комбинированной терапии
Несмотря на то, что Соединение 1 по данному изобретению может вводиться в качестве индивидуального активного фармацевтического средства, его также можно использовать в сочетании с одним или несколькими другими агентами, в частности, другой агент может представлять собой антибиотик, НПВС или другое противовоспалительное средство, антигипертензивные средство, α-блокатор, цитостатический препарат и т.д. При совместном приеме внутрь терапевтические агенты могут представлять собой разные лекарственные формы, которые вводятся одновременно или последовательно в разное время, либо терапевтические агенты могут быть объединены в одну лекарственную форму.
Фраза «комбинированная терапия» в отношении соединения данного изобретения в сочетании с другими фармацевтическими агентами, означает одновременный или последовательный прием всех агентов, который так или иначе обеспечит благоприятное воздействие сочетания лекарств. Совместное введение подразумевает, в частности, совместную доставку, например, в одной таблетке, капсуле, инъекции или в другой форме, имеющий фиксированное соотношение активных веществ, также как и одновременную доставку в нескольких, отдельных лекарственных формах для каждого соединения соответственно.
Таким образом, введение соединений данного изобретения может быть осуществлено в сочетании с дополнительными методами лечения, известными специалистам в области профилактики и лечения соответствующих заболеваний, включающими применение антибактериальных, цитостатических и цитотоксических препаратов, препаратов для подавления симптомов или побочных эффектов одного из лекарств.
Если лекарственная форма представляет собой фиксированную дозу, такая комбинация использует соединения данного изобретения в приемлемом дозовом диапазоне. Соединение 1 по данному изобретению также может быть введено в организм пациента последовательно с другими агентами, в том случае, когда комбинация этих препаратов невозможна. Изобретение не ограничено последовательностью введения; соединение данного изобретения может быть введено в организм пациента совместно, до или после введения другого препарата.
Примеры
1) Получение соединения 1
Получение Соединения 1 описано в заявке на изобретение RU 2013/116822. В той же заявке описана способность Соединения 1 к комплексообразованию или хелатированию ионов металлов.
2) Характеристика биологической активности соединения по изобретению
Биологическая активность Соединения 1, являющегося предметом настоящего изобретения, была изучена в различных in vitro и in vivo экспериментах. В частности, при изучении активности Соединения 1 в различных in vitro и in vivo моделях было показано ингибирующее действие Соединения 1 на хемотаксис моноцитов, макрофагов и других клеток иммунной системы. Данное биологическое действие Соединения 1 не может быть предсказано или объяснено на основе предшествующих знаний о способности Соединения 1 к хелатированию ионов металлов.
Исследования биологической активности Соединения 1 in vitro, позволили установить, что Соединение 1 является ингибитором фермента глутаминилциклазы и, таким образом, действие Соединения 1 на хемотаксис клеток иммунной системы может быть опосредованно ингибированием активности глутаминилциклазы.
2.1) Исследование влияния Соединения 1 на ферментативную активность внутриклеточной глутаминилциклазы человека in vitro.
В ходе исследований влияния Соединения 1, являющегося предметом настоящего изобретения, на ферментативную активность внутриклеточной глутаминилциклазы in vitro впервые было обнаружено прямое ингибирующее действие Соединения 1 на рекомбинантную внутриклеточную глутаминилциклазу человека.
Активность глутаминилциклазы при различных концентрациях Соединения 1 изучалась при 25°C с использованием флуоресцентного субстрата L-глутаминил 2-нафтиламида (Gln-bNA) (Anal. Biochem. 2002 Apr 1;303(1):49-56). Реакционная смесь объемом 100 мкл содержала 50микромоль флуорогенного субстрата; ~0,2 единицы пироглутаминиламинопептидазы человека (1 единица определяется как количество, гидролизующее 1 микромоль pGlu-bNA в минуту), и аликвоту рекомбинантной внутриклеточной глутаминилциклазы человека (gQC) в 50 милимоль трисаминометан-HCl и 5% глицерине, pH 8,0. Реакцию инициировали добавлением к реакционной смеси аликвоты глутаминилциклазы, инкубированной с Соединением 1 в течение 5 минут. Дальнейшее протекание реакции отслеживали спектрофотометрически (длина волны возбуждения и эмиссии составляли 320 и 410 нм). Ферментативную активность определяли по количеству выделившегося 2-нафтиламида (bNA), рассчитанному по калибровочной кривой. Значения IC50 рассчитывали с помощью нелинейной регрессии кривой ʺконцентрация ингибитораʺ-ʺферментативная активностьʺ. В качестве вещества сравнения использовали известный ингибитор глутаминилциклаз -- соединение PBD150 (J. Med. Chem. 2006 Jan 26;49(2):664-77).
В результате эксперимента было установлено, что Соединение 1 ингибирует активность внутриклеточной глутаминилциклазы с IC50=2,7 мкМ.
2.2) Исследование влияния Соединения 1 на ферментативную активность секретируемой глутаминилциклазы человека in vitro.
В лунки 96-луночного ПЦР планшета (Bio-Rad) добавляли по 25 мкл раствора Соединения 1. В каждую лунку, содержащую Соединение 1, помещали 25 мкл 320 мкМ раствора (2S)-2-амино-N-(4-метил-2-оксо-хромен-7-ил)пентандиамида (Q-AMC) в 25 мМ HEPES, pH 7.0 и перемешивали. В каждую лунку (кроме контролей холостого гидролиза) помещали 50 мкл раствора секретируемой глутаминилциклазы (QPCT) с концентрацией 0,2 мкг/мл в буфере (25 мМ HEPES, pH 7.0), либо аналогичный буферный раствор (контроль холостого гидролиза). Планшет инкубировали при комнатной температуре в течение 20 минут, затем помещали в термостат, нагревали при 100°C в течение 5 минут и затем охлаждали во льду в течение 3 минут. В каждую лунку добавляли 100 мкл раствора пироглутаминилпептилазы (PGPEP) с концентрацией 1 мкг/мл в буфере (0.1 мМ трисаминометан, 5 мМ дитиотреитол, pH 9.0) и инкубировали при комнатной температуре в течение 10 минут. Из каждой лунки отбирали 2 раза по 90 мкл раствора, помещали в 3 лунки планшета для флуориметрии Greiner Bio и определяли флуоресценцию (возбуждение - 355 нм, испускание - 460 нм). Полученную кривую ингибирования (зависимости I от концентрации вещества) аппроксимировали дозозависимой кривой (Dose-response curve) c нижней асимптотой=0 и верхней асимптотой =1 с помощью программного обеспечения Origin Pro 8.0, что позволяло получить значение IC50.
В результате эксперимента было установлено, что Соединение 1 ингибирует активность секретируемой глутаминилциклазы с IC50=1,4 мкМ.
2.3) Исследование вли